2. 中药资源教育部工程研究中心, 北京 100193
2. Engineering Research Center of Chinese Medicine Resource, Ministry of Education, Beijing 100193, China
锁阳(Cynomorium songaricum)是药食两用的多年生全寄生种子沙生植物。具有补肾助阳、润肠通便和延缓衰老等传统功效[1]。现代药理学研究表明, 锁阳具有抗病毒、抗阿尔茨海默症、抗糖尿病、抗胃溃疡、抗肿瘤和抗骨质疏松等作用[2, 3]。多糖、熊果酸、儿茶素和鞣质是锁阳重要的有效成分[1]。锁阳主要分布在中国、蒙古、地中海盆地国家、吉尔吉斯斯坦和俄罗斯等地[4]。
中药品质生态是研究中药品质及与生态环境关系及机制的关键[5]。生态型是道地药材形成的生物学实质, 其中生态气候因子通过影响药材生长的环境, 进而影响药材的化学成分含量及遗传物质基础[6]。课题组前期利用中药材产地适宜性分析系统(Geographic Information System for Traditional Chinese, TCMGIS), 发现中国锁阳的适宜性生态区主要有新疆、内蒙古、青海、甘肃和陕西等地[7]。进一步发现不同产区因生态气候环境不同, 其化学品质分型呈现有差异。关键化学标志物原儿茶酸将中国产锁阳分为长城内型与长城外型两大化学生态型。长城外型锁阳品质(内蒙古产)好于其他产地锁阳。课题组还发现年日照时数是影响锁阳生长的主要生态因子[7]。目前已有对不同产区锁阳的代谢组与其内生真菌组的相关性进行研究[8], 但关于不同产区锁阳的根际土壤细菌群落的研究尚且空白。因此急需探索不同产区锁阳品质差异的生态机制, 研究其土壤微生物群落组成特征。
环境通过影响土壤微生物组的组成和功能间接影响植物品质。植物依靠根与微生物的有益互作获取营养, 促进生长并抵抗外部压力[9]。锁阳是全寄生植物, 通过haustoria与寄主相连, 使锁阳能够从寄主中获取水分和营养[10]。研究表明即使寄生植物很少通过根与土壤系统直接接触, 但其仍然影响土壤微生物[11]。寄生植物可改变土壤化学循环, 将固有不变的成分转化为可利用的养分, 并改变土壤生物群落的结构和功能, 从而显著影响地下生物群落[12]。研究表明, 丛枝菌根(Arbuscular mycorrhiza, AM)真菌和外生菌根(Ectomycorrhiza, EM)真菌可能对寄生植物及其寄主产生直接或间接影响[13]。同时, 土壤微生物组可以分解土壤中的有机物质、促进土壤养分释放、推动能量顺利转移, 并且控制着生物地球化学循环, 包括宏(微)量元素及营养元素等[9]。因此了解土壤微生物群落组成特征对于研究植物生长品质至关重要[14], 探索环境因素对锁阳土壤微生物群落组成的影响, 有助于更深层地探索锁阳品质变异的生态机制。
本研究通过对内蒙古和甘肃两个产地锁阳的根际土壤进行16s扩增子测序, 分析比较两个产地锁阳土壤微生物群落的组成和功能差异, 并结合产地附近的生态气候数据, 通过对微生物组-生态的相关性分析探讨影响不同产地锁阳土壤微生物群落组成的潜在生态机制, 为道地药材品质生态学理论研究提供科学依据。
材料与方法材料 本实验材料锁阳根际土壤(表 1, 图 1a)于2017年5月采集自内蒙古自治区阿拉善吉兰泰(NM1、NM4、NM5、NM6)、内蒙古阿拉善通古淖尔(NM2)、内蒙古阿拉善扎海布鲁格(NM3)、甘肃省酒泉市金塔县大庄子乡(GS1)、甘肃省酒泉市玉门市小金湾东乡族乡(GS2)和甘肃省酒泉市玉门市花海镇(GS3、GS4、GS5、GS6)。用直径5 cm的不锈钢圆柱钻机取20 cm深的核心土壤, 并在干冰中冻存。运到实验室, 将土壤样品过2 mm筛, 除去植物组织、根和石块等, 存放于-20 ℃的冰箱中。使用R中ggplot2、ggmap及maps包绘制采样点地图。
| Table 1 Soil sample information and operational taxonomic units (OUT) results |

|
Figure 1 Information on soil sampling sites in two origins of Cynomorium songaricum. (a) Soil sampling points map and close-up photos of plants C. songaricum in Inner Mongolia (NM) and Gansu (GS). (b) Based on unweighted unifrac distance diversity clustering tree |
DNA提取及16s扩增子测序 使用DNA Kit (Omega Bio-tek, Norcross, GA, U.S.)对收集到的12组样品提取DNA, 获得的DNA用1%琼脂糖凝胶电泳检测和分光光度法(260 nm/280 nm光密度比)质量检测。再将样品于-20 ℃保存以备后续实验使用。两个产地锁阳土壤微生物多样性检测选取细菌16S rDNA V3-V4区, DNA样本送至北京奥维森基因科技有限公司, 利用Illumina Miseq PE300高通量测序平台测序。细菌16S rDNA V3-V4扩增引物为338F (5′-ACTCC TACGGGAGGCAGCAG-3′)和806R (5′-GGACTAC NNGGGTATCTAAT-3′)。PCR反应体系(总体系为25 μL): 12.5 μL KAPA 2G Robust Hot Start Ready Mix、1 μL Forward Primer (5 μmol·L-1)、1 μL Reverse Primer (5 μmol·L-1)、5 μL DNA (加入的DNA总量为30 ng), 最后加5.5 μL dd H2O补足至25 μL。反应参数: 95 ℃预变性5 min; 95 ℃变性45 s, 55 ℃退火50 s, 72 ℃延伸45 s, 28个循环; 72 ℃延伸10 min。测序原始序列上传至NCBI的SRA数据库。
数据统计分析 通过Illumina MiSeq平台进行Paired-end测序, 下机数据经QIIME (v1.8.0)软件过滤、拼接、去除嵌合体, 去除打分低于20、碱基模糊、引物错配或测序长度小于150 bp的序列。根据barcodes归类各处理组序列信息, 聚类为用于物种分类的OTU (operational taxonomic units), OTU相似性设置为97%。通过RDP Classifier (http://rdp.cme.msu.edu/classifier/classifier.jsp)算法基于细菌数据库(Silva 128)对OTU代表序列进行比对分析, 并在界(Domain)、门(Phylum)、纲(Class)、目(Order)、科(Family)、属(Genus)水平注释群落的物种信息。使用R中ggplot2包绘制物种在门水平和属水平上的丰度直方图及饼图。再利用Mothur软件(version 1.31.2)进行α多样分析(包括Shannon、Simpson、observed species和Chao1等4个指数)。基于Unweighted Unifrace距离, 使用R (v3.1.1)软件包的pheatmap进行聚类分析。经过UniFrac算法利用系统进化的信息比较样品间物种群落差异, 并进行Beta多样性(beta diversity)分析。
通过在线分析网站Microbiome Analyst (http://www.microbiomeanalyst.ca/)获得核心微生物组(core microbiome), 结合LDA Effect Size (LEfSe)[15]及随机森林(random forest)分析预测生物标记biomarker。使用R中pheatmap包绘制核心微生物组及biomarker的丰度热图。使用R中的Tax4Fun包[16] (http://tax4fun.gobics.de/)预测土壤样品中微生物群落的基因功能及KEGG代谢特征。使用R中的doBy包对获得的KEGG代谢通路注释信息进行组间差异检验。并使用R中的pheatmap和ggplot2包绘制热图及直方图
相关性分析 从中国气象数据网(http://data.cma.cn/)收集整理两个产地锁阳根际土壤采样点附近的12个气象站([53336]乌拉特中旗、[53529]鄂托克旗、[53192]阿巴嘎旗、[53352]达茂旗气象局、[54027]巴林左旗、[54102]锡林浩特、[52533]酒泉、[52681]民勤、[52787]乌鞘岭、[53915]崆峒、[56080]合作和[56096]武都) 1971~2000年间12个生态数据, 作为生态因子数据用于后续相关性分析。
结合两个产地锁阳11个土壤微生物关键微生物群落(5个核心微生物组和6个biomarker)的丰度与两产地12个生态气候因子数据进行相关性分析, 应用SPSS 19.0统计分析软件进行Pearson相关性分析。使用R中pheatmap包绘制相关性热图, 使用Cytoscape 3.7.0软件绘制两个产地各自的相关性网络图。通过Canoco 5软件对其进行降趋势对应分析(discriminant component analysis, DCA)和冗余分析(redundancy analysis, RDA)。
结果与分析 1 两个产地锁阳土壤微生物群落组成特征对两个产地(图 1a)锁阳根际土壤共12个样品的细菌16S DNA的V3和V4区域进行高通量测序, 经数据前处理质控后, 分析得到25 860~41 432条clean reads。聚类分析后, 12个样品共得到11 735个OTUs (表 1), 其中内蒙产地OTU介于977~1 492, 甘肃产地OTU介于373~1 051。非加权unifrac距离聚类结果(图 1b)显示两个产地土壤样品的微生物群落被聚为两支, 说明12个土壤样本的组间差异大于组内差异。
两个产地锁阳的根际土壤中, 细菌类群主要涉及18门、40纲、76目、132科及167个属。内蒙古锁阳根际土壤中的优势菌门(图 2a)为变形菌门Proteobacteria (47.1%)、放线菌门Actinobacteria (27.71%)和拟杆菌门Bacteroidetes (7.6%)。属水平上的优势菌属(图 2b, 2d)为噬甲基菌属Methylophaga (7.22%)、嗜盐单胞菌属Halomonas (6.52%)和节杆菌属Arthrobacter (3.26%)。甘肃锁阳根际土壤中的优势菌门(图 2a)为变形菌门Proteobacteria (35.15%)、放线菌门Actinobacteria (35.15%)和厚壁菌门Firmicutes (21.33%)。属水平上的优势菌属(图 2b, 2d)为芽孢杆菌属Bacillus (16.49%)、嗜盐单胞菌属Halomonas (12.27%)和链霉菌属Streptomyces (10.25%)。图 2c显示了门水平上细菌类群的系统进化关系, 图形大小显示了细菌群落的丰度。图 2d和2e分别展示了内蒙古和甘肃丰度前十的菌属及其对应的门类别。由此可看出, 两个产地土壤微生物的优势菌群类别在门和属水平上总体相似, 但其丰度存在差异。
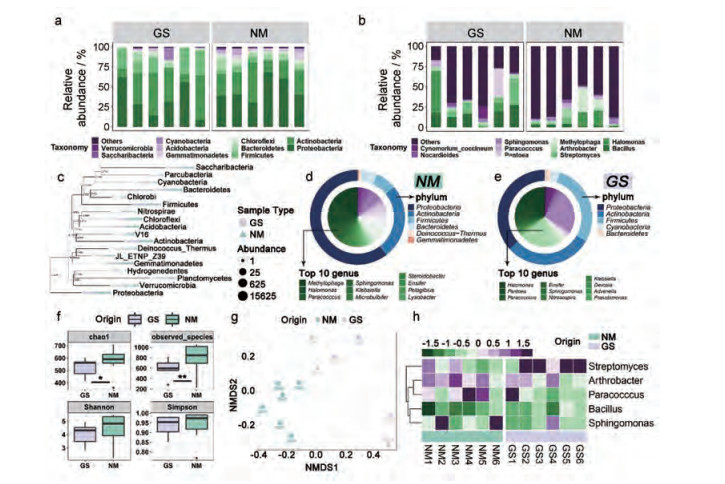
|
Figure 2 Classification of the microbial community composition across the two ecotypes of Cynomorium songaricum. (a) Histograms of phyla abundances. (b) Histograms of genus abundances. (c) Phylogenetic tree at phylum level. (d) Pie chart of the top 10 microbial genera and their phylum-level species in saline-alkali land. (e) Pie chart of the top 10 microbial genera and their phylum-level species in desert-steppe. (f) Within-sample diversity (α-diversity). ACE, which is used as an indicator of species richness in ecology. The higher the value, the richer the community species. Chao1 index, which indicates the bacterial community richness (expressed as the projected total number of OTU in each sample). Fisher, in which along with the number (richness), the abundance of organisms (evenness) is also measured to describe the actual diversity of a community. Observed species. *P < 0.05; **P < 0.01. (g) PCoA plot based on the unweighted UniFrac distance matrix of the 16S rRNA gene amplicons. (h) Heatmap of core microbial abundance of two ecotypes of Cynomorium songaricum. NM: Inner Mongolia province; GS: Gansu province |
样本内多样性(α-diversity)分析结果(图 2f)显示内蒙古锁阳土壤微生物多样性高于甘肃。Chao1、observed species、Shannon和Simpson四个多样性指数的结果一致, 其中chao1和observed species指数显示有显著性(Pchao1 < 0.05, Pobserved species < 0.01)。基于非加权unifrac距离的非度量多维尺度分析(non-metric multidimensional scaling, NMDS)结果(图 2g)显示, 两个产地的土壤微生物群落明显区分, 但内蒙古样本中NM4和NM5、甘肃样本中的GS1和GS5这4个重复相对分散。
根据OTU的样本最小百分比及相对丰度获得的两个产地锁阳土壤的核心微生物组(属水平)为节杆菌属Arthrobacter、链霉菌属Streptomyces、芽孢杆菌属Bacillus、副球菌属Paracocccus和鞘氨醇单胞菌属Sphingomonas。核心微生物组丰度热图(图 2h)显示, 两个产地锁阳土壤中链霉菌属Streptomyces和节杆菌属Arthrobacter的丰度均较高。
属水平土壤微生物群落的丰度分层聚类热图(图 3)展示了两个产地锁阳土壤微生物的丰度差异, 从聚类结果来看内蒙古土壤样本中GS1和GS5被聚为一支且与其余4个样本距离较远, 甘肃土壤样本中NM4和NM5被聚为一支且与其余4个样本距离较远, 该结果与NMDS (图 2g)结果一致。

|
Figure 3 Hierarchical clustering heatmap of soil microbial community abundance in two origins of Cynomorium songaricum (Distance measure using correlation and clustering algorithm using ward. D at Genus level) |
分子方差分析(analysis of molecular variance, AMOVA)得到P-value = 0.014 014 (P < 0.05), 表明内蒙古与甘肃土壤微生物群落组间差异显著(表 2), 同时印证了非加权unifrac距离聚类的结果(图 1b)。曼哈顿图(图 2a)展示了两个产地的差异OUT所在的属, 与甘肃相比, 内蒙古产锁阳土壤中Adhaeribacter属密集上调, 诺卡氏菌属Nocardia、芽孢杆菌属Bacillus和博德特菌属Bordetella密集下调。LEfSe分析可以实现分组比较的内部进行亚组比较分析, 从而找到组间在丰度上有显著差异的biomarker。图 4b列举了LDA score大于2的前15个微生物标记物(biomarker)。采用随机森林方法(number of trees to grow = 5 000)鉴定了两个产地锁阳土壤中差异的属。图 4c展示了按贡献度由大到小排序的前15个biomarkers。图 4e表明随机森林方法在使用5 000个树时, 整体的错误率最低(Error = 0.2)。综合两种方法共获得了6个能区别两个产地土壤样本的biomarkers。其中在内蒙古样本中得分较高的为微球茎属Microbulbifer、Methyloceanibacter和土微菌属Pedomicrobium、Rufibacter。在甘肃样本中得分较高的为Cynomorium_coccineum和博德特菌属Bordetella。6个biomarkers的丰度热图显示Cynomorium_coccineum和博德特菌属Bordetella在甘肃样本中丰度较高, Microbulbifer和Methyloceanibacter等在内蒙古样本丰度较高, 这与得分值结果相呼应。
| Table 2 AMOVA results |

|
Figure 4 Differential microbial profiles of two origins of Cynomorium songaricum. (a) Manhattan plots showing enriched and depleted OTUs in saline-alkali land vs. desert-steppe at phylum level. The dashed line corresponds to the false discovery rate-corrected P value threshold of significance (α = 0.05). The size of the point represents the relative abundance of the OTUs. The point identifies the type of changes, the shape of the solid triangle represents increased enrichment, hollow triangles represent the cut depleted and solid dots indicate no significant difference. (b) Graphical summary at genus level in group sample type of the top 15 biomarkers by LEfSe. (c) Significant features identified by Random Forest. The features are ranked by the mean decrease in classification accuracy when they are permuted. (d) Heatmap of biomarker microbiome abundance of two origins of C. songaricum. (e) Cumulative error rates obtained through RF classification. The overall error rate is represented by the black line, whilst the error rates for each class are represented by the red and green lines. NM: Inner Mongolia province; GS: Gansu province |
使用Tax4Fun对两个产地锁阳土壤微生物群落进行代谢功能预测。Tax4Fun首先基于SILVA数据库获得分类结果, 再通过BLASTN分析建立关联矩阵; 最后通过构建SILVA分类结果与KEGG数据库中原核分类的线性关系, 实现对微生物群落功能的预测。结果共被注释到6条KEGG一级代谢通路, 包括新陈代谢(metabolism)、遗传信息处理(genetic information processing)、环境信息处理(environmental information processing)、细胞过程(cellular processes)和人类疾病(人类疾病和药物发展)等。注释到的42条KEGG二级代谢通路, 对各类型的代谢通路执行Wilcoxon秩和检验, 计算两个产地土壤样本之间的相对丰度的组间差异, 根据组间差异分析结果展示在图 5中。从图 5可看到两个产地土壤微生物样本注释到新陈代谢通路中碳水化合物代谢(carbohydrate metabolism, ko09101)和氨基酸代谢(amino acid metabolism, ko09105)等的相对丰度均较高, 均超过10%。此外, 两个产地土壤微生物样本注释到环境信息处理通路中膜运输(membrane transport, ko09131)和信号转导(signal transduction, ko09132)的相对丰度也较高, 均超过5%。
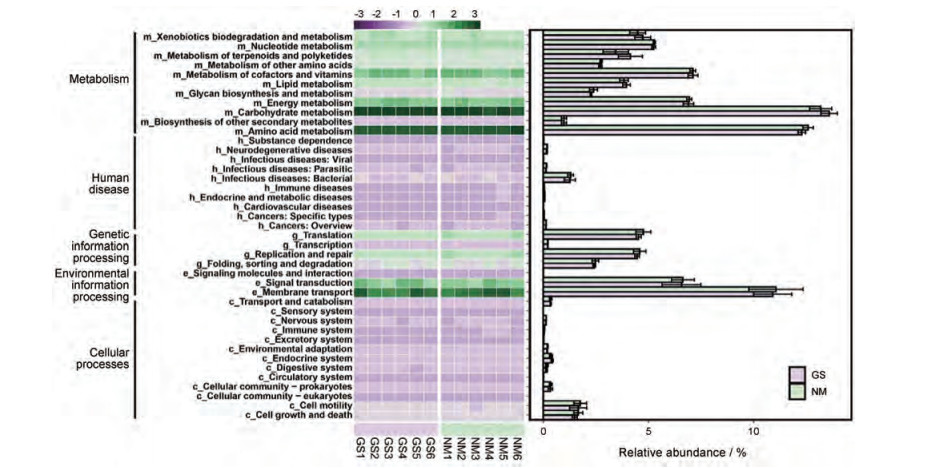
|
Figure 5 The heatmap of normalized relative abundance of imputed functional profiles of KOs assigned to KEGG pathways within C. songaricum soil in two origins bacterial microbiome using Tax4Fun grouped into level-3 functional categories |
从中国气象数据网(http://data.cma.cn/)下载内蒙古与甘肃两产地锁阳样品采集地附近的共12个气象站数据, 收集1971~2000年间12个气候因子的数据(表 3), 包括累年-年平均本站气压(EF1)、累年-年平均气温(EF2)、累年-年平均最高气温(EF3)、累年-年平均最低气温(EF4)、累年-年平均相对湿度(EF5)、累年-年降水量(EF6)、累年-年蒸发量(小型) (EF7)、累年-年平均风速(EF8)、累年-年平均地温(EF9)、累年-年极端最高地温(EF10)、累年-年极端最低地温(EF11)和累年-年日照时数(EF12)。数据下载后, 去掉未检测数据及超出正常范围的数值, 并把生态因子数值进行log转化, 减少生态因子之间数值大小造成的影响。整理以备后续相关性分析用。
| Table 3 Ecological factors in two origins of Cynomorium songaricum. Note: 12 meteorological stations near the rhizosphere soil sampling sites in the two places of Cynomorium songaricum. Inner Mongolia: [53336] Wulatzhong Banner, [53529] Etouk Banner, [53192] Abaga Banner, [53352] Damao Banner Meteorological Bureau, [54027] Bairin Left Banner, [54102] Xilinhot; Gansu: [52533] Jiuquan, [52681] Minqin, [52787] Wushaoling, [53915] Kongtong, [56080] cooperation and [56096] Wudu |
基于微生物群落-生态相关性分析的研究新体系, 对两个产地锁阳11个土壤微生物关键微生物群落(5个核心微生物组和6个biomarkers)的丰度与两产地12个生态气候因子数据进行相关性分析, 以分析不同产地锁阳土壤微生物群落组成特征差异的生态机制。首先根据DCA (species-sample)分析结果筛选RDA和CCA的模型。DCA分析结果中Lengths of gradient的第一轴的大小为2.36 (小于4), 故本研究选用RDA模型进行分析。RDA结果计算得出典型特征值为0.602 278, 即解释变量为60.2%, 其中RDA前两个排序轴的特征值分别为0.505 3和0.093 8, 分别解释了50.53%和9.38%的细菌群落变化。为了挖掘影响两个产地锁阳土壤微生物群落结构的主导生态因素, 根据Effects值进行重分析, 调整后的方差解释度为45.3%。结果(表 4, 图 6a)表明只有累年-年日照时数(EF12, P = 0.008, F = 8)对两个产地锁阳土壤微生物群落的组成有极显著性影响(P < 0.01), 解释率为44.5%。Pearson相关性分析结果(图 6b)与RDA结果相呼应, 累年-年日照时数(EF12)与链霉菌属Streptomyces和芽孢杆菌属Bacillus呈极显著负相关。结果还发现累年-年极端最低地温(EF11)与链霉菌属Streptomyces和芽孢杆菌属Bacillus呈显著负相关。图 6c和图 6d分别展示了内蒙古产和甘肃产地锁阳土壤微生物群落与生态因子的关联网络, 内蒙古锁阳土壤样本中Cynomorium coccineum与累年-年平均本站气压(EF1)和累年-年降水量(EF6)呈显著正相关, 博德特菌属Bordetella与累年-年平均风速(EF8)显著正相关。甘肃锁阳土壤样本中土微菌属Pedomicrobium与累年-年平均风速(EF8)呈极显著正相关, 累年-年平均风速(EF8)同时也与Microbulbifer和Methyloceanibacter显著正相关。节杆菌属Arthrobacter与累年-年平均本站气压(EF1)、累年-年平均气温(EF2)和累年-年极端最高地温(EF10)显著正相关。两个网络关联图显示生态因子对于甘肃锁阳土壤微生物群落组成的影响更大。
| Table 4 Redundancy analysis of bacterial communities |
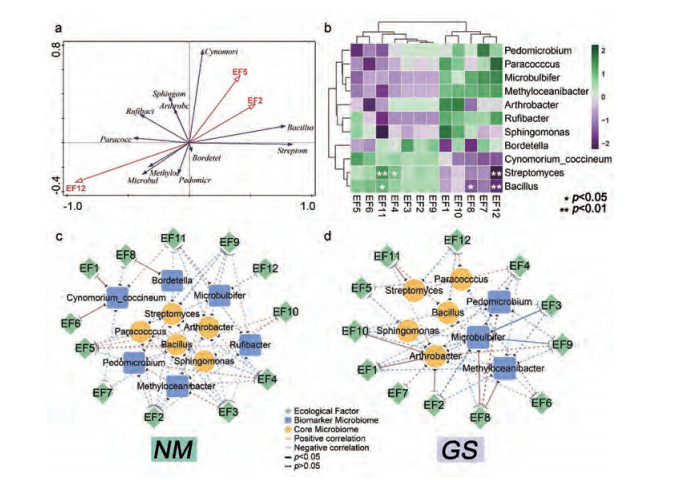
|
Figure 6 Correlation analysis based on key microbiomes (six biomarker microbiome and five core microbiome) and 12 ecological factors. (a) RDA plot of overall key microbiomes, and ecological factors by Canoco 5. (b) Heatmap for correlation analysis of the key microbiomes, ecological factors and active components of C. songaricum soil in the two origins. (c, d) Key microbiomes abundance networks of soil in the two origins of C. songaricum reveal that OTU modules are related to ecological factors |
本研究对内蒙古和甘肃两个产地锁阳的根际土壤进行微生物组-生态的综合相关性分析, 对两个产地共有核心微生物组和特异微生物组比较, 结合两个产地11个关键微生物群落丰度及12个气候生态因子数据进行相关性和冗余分析, 挖掘影响不同产地锁阳土壤微生物群落组成和功能的生态因子, 为阐明锁阳道地性的形成机制提供参考。
土壤样本的采样点均属于温带大陆性气候, 处于寒冷干旱的戈壁沙漠地带, 气温日较差、年较差均较大。较低的年降水量导致其气候干燥, 云量小, 太阳辐射能强[17]。戈壁沙漠位于海拔910~1520米的高原上, 其气温低。冬季和夏季的温差大[18]。综上, 本研究采样点的生态环境较恶劣, 干旱胁迫严重, 并且土壤贫瘠, 寒冷且温差较大, 极端气候频繁。本研究分析的两个产地锁阳土壤共有核心微生物组(属水平)为节杆菌属Arthrobacter、链霉菌属Streptomyces、芽孢杆菌属Bacillus、副球菌属Paracocccus和鞘氨醇单胞菌属Sphingomonas。节杆菌属Arthrobacter广泛分布在土壤中且具有代谢多种物质。研究表明耐旱作物小米(Setaria italica)根际细菌包含节杆菌属, 该属部分细菌属于促进植物生长的根际细菌(plant growth promoting rhizobacteria, PGPR), 有产生ACC脱氨酶的能力[19], 且增加植物乙烯含量减轻植物干旱胁迫影响[20]。链霉菌属Streptomyces存在于世界各地的土壤中, 链霉菌属的基因组大, 具有代谢多样性, 能够产生细胞外水解酶代谢糖、醇、氨基酸和芳香族等化合物。研究发现施用链霉菌菌肥对干旱胁迫下种植的玉米产量有显著影响[21], 将耐旱的链霉菌Streptomyces pactum Act12接种到Cd千穗谷(Amaranthus hypochondriacus), 显著增加株高、根长和茎生物量, 通过增加谷胱甘肽, 提高超氧化物歧化酶和过氧化氢酶活性以及减少叶片中的丙二醛含量增强植物对Cd的耐受性[22]。芽孢杆菌属Bacillus显示强大的生理能力和代谢多样性, 拥有许多极端的栖息环境, 如沙漠、温泉和北极土壤等[23]。该属部分细菌属于PGPR, 研究表明接种芽孢杆菌属的菌可增加干旱胁迫下玉米和辣椒产量, 减轻干旱胁迫带来的负面影响[24]。副球菌属Paracocccus主要生活在土壤中。该属下的部分菌有将氨代谢为氮的能力[25]。对干旱盐渍胁迫生长的小麦(Triticum aestivum)接种副球菌属M1K和M7菌株, 可提高小麦根际微生物群合成吲哚-3-乙酸(IAA)的能力, 促进小麦的生长。鞘氨醇单胞菌属Sphingomonas由于其具有利用多种有机化合物, 并可在低营养条件下生长和生存的能力使其在广阔的环境中分布[26]。研究发现对干旱胁迫下生长的大豆接种PGPR鞘氨醇单胞菌属菌种, 可改善渗透胁迫, 增加IAA的产量并促进植物生长[27]。综上, 两个产地锁阳的土壤共有核心微生物组大多为促进植物生长的根际细菌(PGPR), PGPR适应性强, 并保护植物免受环境胁迫, 大部分核心细菌组自生代谢多样性丰富, 在贫瘠的土壤条件下产生营养, 为植物的生长发育提供物质基础。
中药材品质变异是物种对不同生态环境长期适应与自然选择的结果, 环境因素是中药材品质变异的生态学实质[5]。本研究基于LEfSe方法和随机森林方法得到两个产地土壤微生物群落的6个差异biomarkers, 其中在内蒙古样本中得分较高的为微球茎属Microbulbifer、Methyloceanibacter和土微菌属Pedomicrobium、Rufibacter。在甘肃样本中得分较高的为Cynomorium_ coccineum和博德特菌属Bordetella。差异biomarkers不仅可鉴别不同产地锁阳的土壤微生物群落, 还是影响锁阳品质变异的潜在因子。本研究结合5个核心微生物组, 获得两个产地锁阳土壤的关键微生物组。将关键微生物组的丰度与生态因子的冗余分析和关联分析发现, 影响土壤微生物群落组成的主要生态因子是累年-年日照时数(EF12)。与课题组前期研究发现影响锁阳生长的主要生态因子是年日照时数吻合[7], 说明日照对于锁阳及其土壤微生物群落有显著影响。
本研究首次展现两个产地锁阳土壤微生物组的代谢功能谱。在新陈代谢途径中, 微生物组丰度较高的被注释在碳水化合物代谢(果糖和甘露糖代谢, ko00051;磷酸戊糖途径, ko00030)和氨基酸代谢(精氨酸和脯氨酸代谢, ko00330;甘氨酸、丝氨酸和苏氨酸代谢, ko00260)。碳水化合物代谢调控生物体内碳水化合物的代谢形成、分解和相互转化, 因此在整个生物化学过程起重要作用。碳水化合物通过植物光合作用产生并被其他生物消耗, 同时作为细胞呼吸的底物[28]。植物和微生物从环境中吸收铵盐、硝酸盐和其他无机氮, 合成蛋白质和含氮物质。部分微生物可以将空气中的N2转化为合成氨基酸[29]。土壤微生物群落的代谢功能在初级代谢中富集, 这种富集表明微生物群可能在贫瘠的沙漠环境下为植物提供营养并在干旱胁迫下促进植物生长。
在环境信息处理通路中, 被注释到膜转运(ABC转运蛋白, ko02010)和信号转导(双组分调节系统, ko02020)通路的微生物组相对丰度较高。干旱胁迫导致细胞累积大量的调节渗透压的物质, 会使细胞质的浓度增大, 渗透势降低。膜转运调节诸如离子和小分子等通过生物膜, 跨膜调控归因于膜的选择渗透性[30]。ATP结合盒式蛋白(ABC)是已知的最大蛋白家族之一, 广泛存在于细菌、古细菌和真核生物中。转运蛋白将ATP水解与各种底物(如离子、糖、脂质、固醇、肽、蛋白质和药物)主动转运结合。信号转导是化学或物理信号作为一系列分子事件通过细胞传递的过程, 最常见的是蛋白激酶催化的蛋白磷酸化。双组分调节系统在细菌中最常见, 通过组氨酸激酶(HK)磷酸化反应调节子(RR)完成信号转导。双组分系统调控细菌的许多特征信号通路, 如毒性、致病性、渗透压变化、营养吸收、次生代谢物产生等[31]。综上, 干旱胁迫促使土壤微生物组增强其膜转运功能和信号转导功能。
内蒙古产锁阳土壤微生物群落多样性显著高于甘肃产, 鉴定了6个生物标志物, 在内蒙古土壤中富集的微球茎属Microbulbifer、Methyloceanibacter和土微菌属Pedomicrobium、Rufibacter。在甘肃土壤中富集的Cynomorium_coccineum和博德特菌属Bordetella。同时得到两个产地的5个核心微生物组, 多为促进植物生长的根际细菌(PGPR), 具有在干旱环境下增强植物抵御干旱胁迫的能力。对土壤微生物群落的代谢功能预测表明两个产地锁阳土壤微生物组均在碳水化合物代谢、氨基酸代谢、膜转运和信号转导等通路富集, 这与干旱戈壁沙漠环境相关。基于11个关键微生物组的丰度与生态因子进行相关性分析, 表明日照时数是影响锁阳土壤微生物群落组成的主要限制因素。研究结果为科学合理阐释锁阳品质差异成因提供参考, 为后期寻找道地药材的细菌分子标记, 并利用该微生物资源抵御干旱胁迫, 促进锁阳生长、分子育种及品质提高研究奠定基础。
| [1] |
Li X, Sdiri M, Peng J, et al. Identification and characterization of chemical components in the bioactive fractions of Cynomorium coccineum that possess anticancer activity[J]. Int J Biol Sci, 2020, 16: 61-73. DOI:10.7150/ijbs.38475 |
| [2] |
Ma CM, Sato N, Li XY, et al. Flavan-3-ol contents, anti-oxidative and α-glucosidase inhibitory activities of Cynomorium songaricum[J]. Food Chem, 2010, 118: 116-119. DOI:10.1016/j.foodchem.2009.04.083 |
| [3] |
Zhang QH, Wang WB, Li J, et al. Simultaneous determination of catechin, epicatechin and epicatechin gallate in rat plasma by LC-ESI-MS/MS for pharmacokinetic studies after oral administration of Cynomorium songaricum extract[J]. J Chromatogr B, 2012, 880: 168-171. DOI:10.1016/j.jchromb.2011.11.021 |
| [4] |
Zhang X, Gu C, Ahmad B, et al. Optimization of extract method for Cynomorium songaricum Rupr. by response surface methodology[J]. J Anal Methods Chem, 2017, 2017: 1-7. |
| [5] |
Huang LF, Chen SL. Quality ecology of traditional Chinese medicine:an emerging interdisciplinary subject[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2017, 23: 1-11. |
| [6] |
Huang LF, Fu J, Chen SL. Academic discussion on ecological variation of Chinese medicinal materials[J]. Chin Tradit Herb Drugs (中草药), 2012, 43: 1249-1258. |
| [7] |
Huang L, Xie C, Chen S, et al. Regional suitability evaluation on desert herba Cynomorii[J]. Chin Bull Bot (植物学报), 2010, 45: 205-211. |
| [8] |
Cui JL, Gong Y, Vijayakumar V, et al. Correlation in chemical metabolome and endophytic mycobiome in Cynomorium songaricum from different desert locations in China[J]. J Agric Food Chem, 2019, 67: 3554-3564. DOI:10.1021/acs.jafc.9b00467 |
| [9] |
Jansson JK, Hofmockel KS. Soil microbiomes and climate change[J]. Nat Rev Microbiol, 2020, 8: 35-46. |
| [10] |
Brunel C, Beifen Y, Pouteau R, et al. Responses of Rhizospheric microbial communities of native and alien plant species to Cuscuta Parasitism[J]. Microbial Ecol, 2019. |
| [11] |
Press MC, Phoenix GK. Impacts of parasitic plants on natural communities[J]. New Phytol, 2005, 166: 737-751. DOI:10.1111/j.1469-8137.2005.01358.x |
| [12] |
Bardgett RD, Smith RS, Shiel RS, et al. Parasitic plants indirectly regulate below-ground properties in grassland ecosystems[J]. Nature, 2006, 439: 969-972. DOI:10.1038/nature04197 |
| [13] |
Salonen V, Setälä H, Puustinen S. The interplay between Pinus sylvestris, its root hemiparasite, Melampyrum pratense, and ectomycorrhizal fungi:influences on plant growth and reproduction[J]. Ecoscience, 2000, 7: 195-200. DOI:10.1080/11956860.2000.11682588 |
| [14] |
Drenovsky R, Vo D, Graham K, et al. Soil water content and organic carbon availability are major determinants of soil microbial community composition[J]. Microbial Ecol, 2004, 48: 424-430. DOI:10.1007/s00248-003-1063-2 |
| [15] |
Edgar RC. Search and clustering orders of magnitude faster than BLAST[J]. Bioinformatics, 2010, 26: 2460-2461. DOI:10.1093/bioinformatics/btq461 |
| [16] |
Asshauer KP, Wemheuer B, Daniel R, et al. Tax4Fun:predicting functional profiles from metagenomic 16S rRNA data[J]. Bioinformatics, 2015, 31: 2882-2884. DOI:10.1093/bioinformatics/btv287 |
| [17] |
Petuchowski SJ, Reid R, Schmalbeck L, et al. Gobi:tracking the desert[J]. Am Sci, 2000, 88: 358. |
| [18] |
Lattimore O. Return to China's northern frontier[J]. Geograph J, 1973, 139: 233-242. DOI:10.2307/1796091 |
| [19] |
Niu X, Song L, Xiao Y, et al. Drought-tolerant plant growth-promoting rhizobacteria associated with foxtail millet in a semi-arid agroecosystem and their potential in alleviating drought stress[J]. Front Microbiol, 2018, 8: 2580. DOI:10.3389/fmicb.2017.02580 |
| [20] |
Mayak S, Tirosh T, Glick BR. Plant growth-promoting bacteria that confer resistance to water stress in tomatoes and peppers[J]. Plant Sci, 2004, 166: 525-530. DOI:10.1016/j.plantsci.2003.10.025 |
| [21] |
Dias MP, Bastos MS, Xavier VB, et al. Plant growth and resistance promoted by Streptomyces spp. in tomato[J]. Plant Physiol Biochem, 2017, 118: 479-493. DOI:10.1016/j.plaphy.2017.07.017 |
| [22] |
Cao S, Wang W, Wang F, et al. Drought-tolerant Streptomyces pactum Act12 assist phytoremediation of cadmium-contaminated soil by Amaranthus hypochondriacus:great potential application in arid/semi-arid areas[J]. Environ Sci Pollut Res, 2016, 23: 14898-14907. DOI:10.1007/s11356-016-6636-y |
| [23] |
Kramer JM, Gilbert RJ. Bacillus cereus and other Bacillus species[M]//Foodborne Bacterial Pathog, 1989: 21-70.
|
| [24] |
Lim JH, Kim SD. Induction of drought stress resistance by multi-functional PGPR Bacillus licheniformis K11 in pepper[J]. Plant Pathol J, 2013, 29: 201. DOI:10.5423/PPJ.SI.02.2013.0021 |
| [25] |
Reimann J, Flock U, Lepp H, et al. A pathway for protons in nitric oxide reductase from Paracoccus denitrificans[J]. Biochim Biophys Acta, 2007, 1767: 362-373. DOI:10.1016/j.bbabio.2007.03.006 |
| [26] |
Khan AL, Waqas M, Kang SM, et al. Bacterial endophyte Sphingomonas sp. LK11 produces gibberellins and IAA and promotes tomato plant growth[J]. J Microbiol, 2014, 52: 689-695. DOI:10.1007/s12275-014-4002-7 |
| [27] |
Asaf S, Khan AL, Khan MA, et al. Osmoprotective functions conferred to soybean plants via inoculation with Sphingomonas sp. LK11 and exogenous trehalose[J]. Microbiol Res, 2017, 205: 135-145. DOI:10.1016/j.micres.2017.08.009 |
| [28] |
Gray GM. Carbohydrate digestion and absorption[J]. Gastroenterology, 2004, 58: 96-107. |
| [29] |
Coon MJ, Robinson WG. Amino acid metabolism[J]. Annu Rev Biochem, 1958, 27: 561-612. DOI:10.1146/annurev.bi.27.070158.003021 |
| [30] |
Bhattacharya S. Handbook of cell signaling[J]. J Anatomy, 2004, 205: 77. DOI:10.1111/j.0021-8782.2004.00308.x |
| [31] |
Kleerebezem M, Quadri LE, Kuipers OP, et al. Quorum sensing by peptide pheromones and two-component signal-transduction systems in Gram-positive bacteria[J]. Mol Microbiol, 2010, 24: 895-904. |
 2020, Vol. 55
2020, Vol. 55


