2. 军事科学院军事医学研究院辐射医学研究所, 北京 100850;
3. 河南大学药学院, 河南 开封 475004
2. Institute of Radiation Medicine, Academy of Military Medicine Sciences, Academy of Military Sciences, Beijing 100850, China;
3. Pharmaceutical College of Henan University, Kaifeng 475004, China
肺是进行气体交换的重要器官, 空气中颗粒、化学物质和病原体等进入肺中可引起肺部疾病以及全身疾病[1]。肺部疾病包括各种肺炎(细菌、真菌、病毒性或吸入性肺炎)、肺纤维化、哮喘和肺癌等。这些疾病往往会造成急性肺损伤(acute lung injury, ALI)[2], 表现为弥漫性肺泡、毛细血管膜损伤, 如不及时治疗会发展成急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS), 导致顽固性低氧血症, 造成高达35%~40%的死亡率[3]。目前临床上没有特效药治疗ALI, 常用雾化吸入激素类药物缓解ALI[4], 但长期使用会产生不良反应和耐受性。目前, 在全球暴发的新型冠状病毒肺炎(新冠肺炎, COVID-19)确认由新型冠状病毒(SARS-CoV-2019)经呼吸道吸入造成。该病毒可导致全身感染, 但主要表现为呼吸系统感染和损伤, 最后发展成严重致命的ARDS。早期研究发现, 新冠肺炎患者体内促炎细胞因子如肿瘤坏死因子α (tumor necrosis factor α, TNF-α)、白介素-6 (interleukin-6, IL-6)、IL-15和IL-17等浓度急剧升高, 形成炎症风暴, 导致严重ALI [5]。因为没有抗新型冠状病毒的特效药物, 临床治疗有建议严重新冠肺炎患者短时间内注射免疫球蛋白和甾体激素类药物如甲泼尼龙, 增强抗感染能力和消除炎症[6]。
莪术(Curcumae Rhizoma)为我国传统中药材, 药用部位为干燥根茎, 来源于姜科植物蓬莪术、广西莪术或温郁金。莪术主要成分为挥发油、姜黄素和多糖, 具有抗肿瘤、抗氧化和抗病毒等药理作用[7, 8]。莪术油是从莪术中提取的混合物, 主要成分包括莪术醇、莪术二酮、榄香烯、吉马酮及莪术酮。莪术油注射液和莪术油葡萄糖注射液作为抗病毒药物用于临床。近年来对莪术油及其有效成分的抗肿瘤、抗病毒、抗菌消炎和抗血栓等活性研究的较多[9-11], 开发出包括莪术油葡萄糖注射液、莪术油乳剂和莪术油栓[12-15]等剂型。莪术醇是莪术油中重要的化合物, 又名莪黄醇、姜黄环氧醇, 也显示抗肿瘤、抗病毒和抗炎等作用[16-18]。
肺中肺泡表面积巨大, 有丰富的毛细血管。肺吸入药物可在肺部集中分布, 避免首过效应, 迅速发挥药效, 被世界卫生组织推荐为呼吸道疾病的首选疗法, 尤其对急性肺部疾病可快速救治[19]。本实验室长期开展针对肺部疾病的肺吸入给药系统研究, 特别是治疗ALI的肺吸入制剂, 如将天然药物如姜黄素、冬凌草甲素制备成脂质体粉雾剂、包合物等治疗盐酸、脂多糖(lipopolysaccharide, LPS)或过氧化氢等导致的ALI[20, 21]; 将茶树油、穿心莲内酯等制备成大多孔微球、脂质体粉雾剂和包合物等治疗细菌性和真菌性肺炎[22, 23]。
莪术油注射液可以治疗病毒性肺炎, 也有将莪术油注射液雾化治疗病毒性上呼吸道感染的报道[24], 但还没有关于莪术油肺吸入制剂的报道。莪术醇的研究也较多, 但莪术油及莪术醇均为分别报道, 没有两者的比较研究。区分有效成分和有效化合物的治疗作用及其机制是中药和天然产物研究的重要内容。二者的安全性好[25], 可以作为治疗ALI的备选药物。本文基于莪术油和莪术醇的性质, 以及肺吸入给药特点, 制备了适合肺部给药的莪术油粉雾剂(zedoary turmeric oil dry powder inhalers, ZDPIs)和莪术醇粉雾剂(curcumol dry powder inhalers, CDPIs), 考察ZDPIs和CDPIs对LPS导致的ALI治疗效果, 包括肺组织病理改变, TNF-α、IL-6和总蛋白等炎症因子的水平, 为二者成为ALI治疗有效药物提供依据, 也为天然产物中有效成分和有效化合物的比较研究提供借鉴。
材料与方法药物与试剂 莪术油(批号: 20190714)、莪术醇(纯度: ≥96%, 批号: 20190416) (江西环球天然香料有限公司); 蛋黄卵磷脂PL-100M (注射用, 批号: EK16068, 艾伟拓医药科技有限公司); 乳糖(批号: 20190422, Meggle公司); 甘露醇(批号: 20170427, 国药集团化学试剂有限公司); 地塞米松磷酸钠注射液(规格: 5 mg/2 mL, 批号: 180602, 芮城天通动保药有限公司); 脂多糖(LPS, 批号: 057M4013V, Sigma公司); 大鼠TNF-α和IL-6 ELISA检测试剂盒(欣博盛生物科技有限公司); BCA蛋白浓度测定试剂盒(批号; PC0020, 北京索莱宝科技有限公司), 甲醇和乙腈为色谱级, 其他试剂为分析纯。
仪器 高速分散机(型号: D-1 Disperser, 德国Miccra公司); 纳米激光粒度仪(型号: Zetasizer Nano ZS, 英国马尔文仪器有限公司); 冷冻干燥机(型号: LGJ-30F, 北京松源华兴科技发展有限公司); 干法激光粒度仪(型号: BT-2001, 丹东百特仪器有限公司); 倒置荧光显微镜(型号: BDS200-FL, 重庆奥特光学仪器有限责任公司); 喉镜(型号: MJ, 江苏迈骏医疗科技有限公司); 扫描电镜(型号: S-4800, 日本HITACHI公司); 酶标仪(型号: ELX800, 美国伯滕仪器有限公司); 高效液相色谱仪(型号: Agilent 1260, 美国安捷伦公司); 高速组织研磨仪(型号: KI-Ⅱ, 武汉谷歌生物科技有限公司); 超低温冰箱(型号: DW-86L828, 青岛海尔特种电器有限公司); 纯水仪(型号: Heal Force Super NW, 上海康雷仪器有限公司)。
实验动物 SD大鼠, SPF级, 雄性, 体重200 ± 20 g, 许可证号: SCXK (京) 2016-0006, 北京维通利华实验动物科技有限公司。实验期间动物自由取食、饮水。所有动物实验经军事科学院军事医学研究院辐射医学研究所伦理委员会批准且实验均按照相关指导原则和规定进行。
含量测定 莪术油中主要活性成分为莪术醇、莪术二酮以及榄香烯等, 2005版《中国药典》以莪术醇的含量作为莪术油的质量控制指标[26]。本实验采用高效液相色谱法(HPLC)测定莪术醇的含量[27]。色谱条件为色谱柱: Agilent C18色谱柱(250 mm×4.6 mm, 5 μm); 流动相:乙腈-水= 80:20;流速: 1.0 mL·min-1; 进样量: 20 μL; 柱温: 35 ℃; 波长: 210 nm。
莪术油与莪术醇粉雾剂的制备 粉雾剂的制备分为两步:先制备乳剂, 再冻干形成粉末。以较大的电位、较小的粒径和较小的多分散系数为指标, 采用相转化法制备乳剂, 并对乳剂处方进行优化得到最优处方工艺:取蛋黄卵磷脂0.39 g, 溶于5.5 mL无水乙醇, 分别加入莪术油或莪术醇0.55 g搅拌溶解; 室温下用高速分散机(30 000 r·min-1)搅拌, 缓慢加入水73.5 mL, 开始形成稍有黏性类白色均匀乳剂, 随着水体积增加, 逐渐形成黏度较小的O/W类白色乳剂, 高速分散过程约2 min, 分别获得莪术油与莪术醇乳剂。
选择甘露醇为冻干保护剂, 按照冻干保护剂/乳剂(w/v)为5%, 加入莪术油与莪术醇乳剂中, 甘露醇完全溶解, 乳状液置于-35 ℃冷冻干燥机中, 预冻3 h, 然后梯度升温, 共冷冻干燥40 h, 分别制备得到ZDPIs和CDPIs。
莪术油与莪术醇乳剂包封率和载药量的测定 精密量取莪术油和莪术醇乳剂0.5 mL于超滤离心管, 10 000 ×g离心10 min, 将滤过液取出, 移至5 mL量瓶中, 用甲醇定容至刻度, HPLC法测得游离部分药物总量(W1); 精密量取莪术油和莪术醇乳剂0.5 mL, 加入甲醇2 mL, 充分摇匀破乳, 移至5 mL量瓶中, 用甲醇定容至刻度, HPLC法测得总药物量(W2)。通过公式计算莪术油和莪术醇乳剂包封率(encapsulation efficiency, EE)[28] (n = 3):
| $ \mathrm{EE}=\left(W_{2}-W_{1}\right) / W_{2} \times 100 \% $ | (1) |
根据EE与整个乳剂体系的体积(V), 计算药物载药量(loading efficiency, LE)[29] (n = 3):
| $ \mathrm{LE}=\left(W_{2}-W_{1}\right) / V $ | (2) |
莪术油和莪术醇粉雾剂形态学观察 将少量待测样品涂布在双面导电胶并固定在金属板上, 喷金后于扫描电镜(scanning electron microscope, SEM)观察ZDPIs和CDPIs粒子的形态。
莪术油和莪术醇粉雾剂粉体学考察 冻干后粉末过180目筛, 用激光粒度仪测定其几何粒径, 将过筛后粉末(约1 g)缓慢加入量筒(10 mL)中, 将量筒中粉末振实100次, 记录振实前后药物重量与体积, 计算粉末的松密度和振实密度(n = 3), 按照公式计算空气动力学粒径(aerodynamic diameter, Da)。
| $ D_{\mathrm{a}}=D_{\mathrm{e}} \sqrt{\frac{\rho_{\mathrm{p}}}{\rho_{0} \chi}} $ | (3) |
其中, De为中位几何粒径(median geometric diameter); ρp为有效颗粒密度, 其数值为振实密度的1.26倍; ρ0为参照密度, 等于1 g·cm3; χ为动态形态因子(球形时χ = 1, 本文采用1)[30]。Da是影响药物沉积部位的最主要的因素, 一般认为Da在1~5 μm内粒子可以到达肺深部。
急性肺损伤大鼠模型的建立及给药 将25只大鼠随机分为5组, 每组5只, 即正常组、模型组、阳性药地塞米松注射液(dexamethasone injection, DXM)组、ZDPIs和CDPIs组。除正常组大鼠气管喷入生理盐水0.2 mL, 其他组气管喷入5 mg·mL-1LPS溶液0.2 mL, 建立ALI模型[31]。造模1 h后, 分别给予CDPIs (含莪术醇0.5 mg)、ZDPIs (含莪术油0.5 mg)和DXM (5 mg/2 mL, 含DXM 0.5 mg)[32]。具体给药操作步骤:用喉镜撑开大鼠喉部, 暴露气管, 用细的软管进行气管插管, 尾端用三通阀连接至预充生理盐水或LPS溶液的1.0 mL注射器, 打开三通阀, 将溶液喷入肺部; 如果采用粉末给药, 则先将粉末放入三通阀内, 注射器先压缩空气, 打开三通阀后, 压缩空气将粉末喷入肺部。
肺部外观及病理检查 肺部外观与肺组织病理变化是最直接的治疗观察指标。给药10 h后, 用10%水合氯醛麻醉处死大鼠, 取肺右上叶组织后立即用生理盐水(4 ℃)洗净表面血迹及残留物, 用滤纸擦干后将其放入10%甲醛溶液中固定24 h, 石蜡包埋, 切片, 脱蜡、酒精梯度复水, 苏木精-伊红(hematoxylin and eosin, H & E)染色后在显微镜下观察组织病理形态[22]。
TNF-α、IL-6和总蛋白含量测定 取肺右中叶, 称重, 加入9倍量的生理盐水(4 ℃), 于高速组织研磨仪中进行组织研磨, 研磨条件为60 Hz, 4 min, 研磨后采用低温高速离心机4 ℃条件下, 10 000 r·min-1离心10 min, 取上清分装, 在-80 ℃冰箱保存。用ELISA试剂盒测定匀浆中TNF-α和IL-6;用BCA蛋白浓度测定试剂盒测定匀浆中总蛋白的量。
统计学分析 采用SPSS 18.0软件对数据进行统计学分析(单因素方差分析, one-way ANOVA), 实验数据以均数±标准差(x±s)表示, 比较组间差异, P < 0.05表示具有显著性差异, P < 0.01表示具有非常显著性差异。
结果 1 莪术油和莪术醇粉雾剂处方和制备工艺的优化实验中筛选了乳糖和甘露醇两种冻干保护剂, 在乳剂中分别占1%、5%和10% (w/v), 以冻干粉的松密度、振实密度、De和Da为指标, 筛选最优的冻干保护剂种类及其用量(表 1)。以Da在1~5 μm间适合肺部吸入为最终指标, 筛选出莪术油纳米乳冻干保护剂为5%甘露醇, 其最优处方Da为3.02 ± 0.17 μm; 而莪术醇纳米乳5%和10%甘露醇乳冻干保护剂的处方Da分别为2.67 ± 0.49 μm和4.16 ± 0.12 μm, 均符合肺部吸入的要求。为了减少辅料的吸入, 提高载药量, 最终选择5%甘露醇作为莪术醇纳米乳的冻干保护剂。
| Table 1 Effects of different kinds of lyophilized protective agents on the properties of lyophilized powders. De: Median geometric diameter; Da: Aerodynamic diameter. n = 3, x±s |
莪术油为黄褐色液体, 制备成乳剂后为O/W白色乳剂, 乳剂的粒径为205.9 ± 11.4 nm, 多分散指数(polydispersity index, PDI)为0.230 ± 0.018, zeta电位为-34.8 ± 0.3 mV, 莪术油纳米乳的包封率为(90.11 ± 9.61)%, 载药量为5.63 ± 0.77 g·L-1; 莪术醇为黄色晶体, 制备成乳剂后为O/W微黄色乳剂, 乳剂的粒径为275.8 ± 10.3 nm, PDI为0.495 ± 0.072, zeta电位为-38.0 ± 2.4 mV (图 1), 莪术醇纳米乳的包封率为(82.00 ± 1.91)%, 载药量为5.72 ± 0.15 g·L-1 (表 2)。高电位值表明莪术油和莪术醇乳剂都属于稳定体系。二者粒径相差不大, 但莪术油乳剂的PDI为0.230, 在0.1~0.3之间, 而莪术醇乳剂的PDI为0.495, 大于0.4, 说明莪术油乳剂中乳滴的分布较莪术醇乳剂均匀; 从包封率和载药量可见, 莪术油和莪术醇均能较好地包封于水中形成纳米乳, 且两个乳剂的载药量均较大。

|
Figure 1 Size distribution of zedoary turmeric oil nanoemulsions (A), zeta potential of zedoary turmeric oil nanoemulsions (B), size distribution of curcumol nanoemulsions (C), and zeta potential of curcumol nanoemulsions (D) |
| Table 2 Characteristics of zedoary turmeric oil nanoemulsions and curcumol nanoemulsions. PDI: Polydispersity index; EE: Encapsulation efficiency; LE: Loading efficiency. n = 3, x±s |
ZDPIs为白色疏松状粉末, 可以全部过180目筛, 松密度为0.12 ± 0.00 g·cm-3, 振实密度为0.22 ± 0.00 g·cm-3, Da为3.02 ± 0.17 μm; CDPIs也为白色疏松状粉末, 可以全部过180目筛, 松密度为0.14 ± 0.00 g·cm-3, 振实密度为0.22 ± 0.00 g·cm-3, Da为2.67 ± 0.49 μm (表 3)。二者的Da值均在1~5 μm之间, 均适合肺部吸入给药[31]。ZDPIs和CDPIs遇水后会迅速溶解, 复溶后粒径分别为180.2 ± 11.4 nm和220.7 ± 10.4 nm, 说明ZDPIs和CDPIs吸入后会迅速形成纳米乳发挥药效。扫描电镜观察ZDPIs和CDPIs粉末颗粒形态发现, ZDPIs和CDPIs主要由柱状甘露醇晶体构成, 莪术油和莪术醇乳可能吸附于或嵌入甘露醇晶体(图 2)。
| Table 3 Characteristics of zedoary turmeric oil dry powder inhalers (ZDPIs) and curcumol dry powder inhalers (CDPIs). n = 3, x±s |

|
Figure 2 Scanning electron microscopic (SEM) images of mannitol (A), ZDPIs (B), and CDPIs (C) |
正常组大鼠肺颜色粉红, 质地柔软, 无出血(图 3A); 模型组可见明显的出血(图 3B); DXM组(图 3C)、CDPIs组(图 3D)和ZDPIs组(图 3E)均未见明显出血。

|
Figure 3 Appearance of lung tissues and hematoxylin and eosin (H & E) (×100). A: Normal group; B: Acute lung injury (ALI) model group; C: Dexamethasone (DXM) group; D: CDPIs group; E: ZDPIs group. Arrows represent bleeding. The scale bars indicate 100 μm |
正常组大鼠肺组织结构清晰、排列整齐, 肺泡腔完整、肺泡腔内未见出血、肺泡间隔无明显增厚, 无炎性细胞浸润(图 3A); 模型组可见肺部弥漫性渗出、出血、肺泡上皮损伤明显, 肺泡间隔增宽, 有明显炎性细胞浸润(图 3B); 3个治疗组肺组织损伤减轻, 出血减少, 渗出减少, 但仍有少量炎性细胞浸润和肺泡结构损伤(图 3C~E)。
4 莪术油和莪术醇粉雾剂具有降低炎症反应的作用IL-6和TNF-α是典型炎症指标[33]。ALI产生时, 肺内IL-6具有促炎特性, 能使中性粒细胞募集、渗透, 产生中性粒细胞介导的组织损伤和导致肺水肿。TNF-α被认为是介导ALI的主要细胞因子, 同时, 肺巨噬细胞释放的TNF-α激活损伤粒细胞、内皮细胞和血小板等, 导致组织细胞的损伤[34]。ALI时肺泡上皮细胞被大量破坏, 使蛋白渗透进入肺泡。在本研究中LPS导致产生大鼠ALI, 使大鼠肺组织中TNF-α、IL-6和总蛋白的含量显著升高(均P < 0.01); ZDPIs和CDPIs组大鼠肺组织中TNF-α、IL-6和总蛋白含量比模型组降低, 且具有显著差异(P < 0.01); ZDPIs和CDPIs组大鼠肺组织中TNF-α、IL-6含量与正常组大鼠比较无显著差异(P > 0.05)。说明莪术油和莪术醇均能通过抑制炎性因子TNF-α和IL-6, 减轻对ALI大鼠肺组织的损伤, 且莪术油和莪术醇均可降低肺组织中总蛋白的含量, 推测二者具有保护肺泡上皮细胞的作用。DXM组可显著降低ALI模型大鼠肺组织中TNF-α、IL-6和总蛋白的含量(P < 0.01, 图 4)。
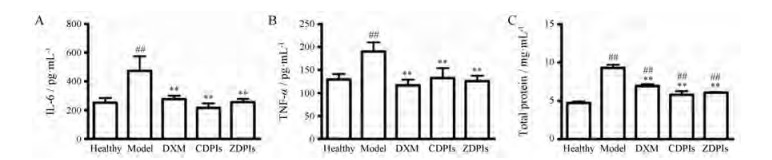
|
Figure 4 Levels of interleukin-6 (IL-6, A), tumor necrosis factor-α (TNF-α, B), and total protein (C) in rat lung tissues. n = 3, x±s; ##P < 0.01 vs healthy group; **P < 0.01 vs the model group |
莪术油及其有效化合物莪术醇作为天然植物提取物具有较好的安全性, 具有抗肿瘤、抗氧化、抗病毒和抗炎等药理作用[35-37], 但其作为油类药物, 难溶于水, 生物利用度差。肺吸入给药系统治疗肺部疾病具有直接将药物递送到病变部位, 减少全身不良反应的优势。将莪术油和莪术醇制备成肺吸入给药系统特别是粉雾剂的难点是药物为油脂类并呈脂溶性。因此先将它们制备成乳剂后进一步制备成粉雾剂是较好的选择。本文选择安全性好的注射级蛋黄卵磷脂作为乳化剂, 采用相转化法制备了分散均匀、稳定性好的O/W型纳米乳剂, 使莪术油和莪术醇均能以纳米乳的形态稳定、均匀地分散在水中。但纳米乳剂是一种热力学不稳定体系, 在存放过程中可能发生粒径增大和药物沉淀析出, 为了提高其理化稳定性, 加入5% (w/v)甘露醇作为冻干保护剂进一步制备成可吸入、适合携带、稳定性更好的粉雾剂, 通过吸入给药使药物靶向到肺部, 提高了药物的溶解度和生物利用度, 并减轻局部刺激和不良反应[35]。以Da为指标, 对肺吸入给药的辅料乳糖和甘露醇进行筛选, 确定甘露醇适合作为纳米乳的冻干保护剂。虽然莪术醇纳米乳处方中加入10%甘露醇冻干后粉末粒径也能达到肺吸入的要求, 但是为了减少辅料的使用, 最终选择5%的甘露醇作为莪术油和莪术醇纳米乳冻干保护剂。
盐酸、过氧化氢和LPS均可导致ALI, 但临床上常将盐酸和过氧化氢作为吸入性肺炎的诱因。LPS作为革兰阴性菌细胞壁中的成分, 是细菌死亡溶解后释放出来的内毒素, 可作为外界病原体吸入后导致ALI的诱因。本文选择使用LPS更好地模拟病毒性肺炎的临床发生和发展[36]。空气中存在大量细菌及其代谢产物, 大量吸入后, 会引起机体发热和内毒素休克等一系列较强的免疫反应, 最终形成ALI[37]。ALI主要发病机制是过度失控的炎性反应和促炎抗炎反应失衡[38]。肺部损伤时, 巨噬细胞释放促炎性因子IL-6和TNF-α等, 导致中性粒细胞从肺微血管进入肺泡中, 活化的中性粒细胞释放白三烯、蛋白酶和血小板活化因子, 后者会导致肺组织损伤、水肿、表面活性剂失活和透明膜形成[39]。本文通过气管喷入LPS造成ALI, 发现ZDPIs和CDPIs均可减轻LPS导致的大鼠ALI, 并证明ZDPIs和CDPIs是抑制IL-6和TNF-α的表达而发挥抗炎作用。另外, ZDPIs和CDPIs可以降低肺组织中总蛋白含量, 推测ZDPIs和CDPIs具有保护肺泡上皮细胞的作用。从含量测定中可以算出, 莪术油中仅含4.59%莪术醇, 但实验中给予等量莪术油和莪术醇的ZDPIs和CDPIs, 二者均能起到很好地治疗LPS导致的ALI, 与阳性药DXM比较均没有显著性差异, 说明莪术醇具有抗炎作用, 而莪术油中其他成分也有抗炎作用。因此, 莪术油及其有效化合物莪术醇均可以制备成粉雾剂, 两种粉雾剂粉末空气动力学粒径均在1~5 μm之间, 符合干粉吸入到达肺呼吸道深部的要求, 且粉末遇水后可以快速复溶, 发挥药效, 所以临床上可以选择干粉剂用于肺部吸入治疗ALI。
新冠肺炎临床症状为全身系统性感染, 主要表现为呼吸系统感染, 如严重致命的ARDS。早期研究发现, 病毒感染后会导致机体内促炎细胞因子浓度的升高造成炎症风暴, 从而形成ALI[40], 进一步恶化形成ARDS。目前临床上ALI治疗药物极其有限, 常通过雾化吸入激素类药物来缓解, 但长期大剂量应用激素会带来严重的不良反应[41]。可有效治疗ALI且安全、稳定的肺吸入制剂具有较高的临床应用价值。本文将莪术油和莪术醇制备成可肺吸入给药的粉雾剂, 直接将药物递送到肺部组织, 可提高药物的肺组织分布, 减少全身其他组织分布及可能的不良反应。两种药物的粉雾剂均呈现显著抗ALI作用, 具有潜在的临床应用价值, 并为中药有效成分和有效化合物的比较研究提供了依据。
| [1] |
Jin Y, Li M. Pulmonary drrugs delivery systems and progress in their applications to lung disease treatment[J]. J Int Pharma Res (国际药学研究杂志), 2015, 42: 289-322. |
| [2] |
Sun W, Wu Q, Shao S. Pathogenesis of acute lung injury induced by virus infection[J]. Int J Respir (国际呼吸杂志), 2011, 31: 1094-1096. |
| [3] |
Wheeler AP, Bernard GR. Acute lung injury and the acute respiratory distress syndrome:a clinical review[J]. Lancet, 2007, 369: 1553-1565. DOI:10.1016/S0140-6736(07)60604-7 |
| [4] |
Tu G, Shi Y, Zheng Y, et al. Glucocorticoid attenuates acute lung injury through induction of type 2 macrophage[J]. J Transl Med, 2017, 15: 181-194. DOI:10.1186/s12967-017-1284-7 |
| [5] |
Huang C, Wang Y, Li X, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China[J]. Lancet, 2020, 20: 30183-30193. |
| [6] |
Chen N, Zhou M, Dong X, et al. Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China:a descriptive study[J]. Lancet, 2020, 20: 30211-30217. |
| [7] |
Zhang G, Huang K. Research progress on the chemical constituents and pharmacological effects of Curcuma Kwangsiensis[J]. Guangzhou Chem Ind (广州化工), 2015, 43: 24-26. |
| [8] |
Zhao Z, Zhang L, Xia T, et al. Advances in anti-inflammatory and anti-tumor effects of the main components of Curcumae Rhizoma[J]. Drug Eval Res (药物评价研究), 2017, 40: 119-124. |
| [9] |
Xia Q, Huang Z, Li S, et al. The experiment study of the anti-virus effects of zedoary oil on influenzavirus and respiratory syncytial virus[J]. Chin Pharmacol Bull (中国药理学通报), 2004, 20: 357-358. |
| [10] |
Liu X, Niu H, Gao J, et al. Effect of Zedoray Turmeric oil on serum lipid and inflammatory factors in rats with atherosclerosis[J]. Mod J Integr Tradit Chin West Med (现代中西医结合杂志), 2016, 20: 2183-2185. |
| [11] |
Ma P, Li H, Yan J, et al. Effect of zedroary turmeric oil injection on the proliferation of cervical cancer cell line HeLa and Wnt/β-catenin signaling[J]. Chin Hosp Pharm J (中国医院药学杂志), 2019, 39: 577-640. |
| [12] |
Xiang X, Lv G, Chen S, et al. Progress in research of quality control and pharmacological actions in essential oil of Curcuma[J]. Chin J Modern Appl Pharm (中国现代应用药学), 2010, 27: 979-982. |
| [13] |
Lu J, Dang Y, Huang M, et al. Anti-cancer properties of terpenoids isolated from Rhizoma Curcumae - a review[J]. J Ethnopharmacol, 2012, 143: 406-411. DOI:10.1016/j.jep.2012.07.009 |
| [14] |
Liao B, Tang C, Pan N, et al. Effects of zedoary turmeric oil on cell proliferation and apoptosis and Caspase-3, Bax, Bcl-2 protein expression in rectal carcinoma cell line SW1463[J]. Drug Eval Res (药物评价研究), 2017, 40: 897-903. |
| [15] |
Wang P, Zhu M, Zhang W. Clinical study of Zedoary Turmeric oil Injection combined with oseltamivir in treatment of children with viral pneumonia[J]. Drugs Clin (现代药物与临床), 2019, 34: 1406-1409. |
| [16] |
Guo P, Wang Y, Weng B, et al. Synthesis, anti-tumor activity, and structure-activity relationships of curcumol derivatives[J]. J Asian Nat Products Res, 2014, 16: 53-58. DOI:10.1080/10286020.2013.857660 |
| [17] |
Zeng J, Chen X, Pan Y, et al. Advances in the study of curcumol[J]. J Chin Med Mater (中药材), 2008, 31: 168-170. |
| [18] |
Li Y, Li G, Dong Y, et al. Orobanone analogues from acid-promoted aromatization rearrangement of curcumol inhibit hypoxia-inducible factor-1(HIF-1) in cell-based reporter assays[J]. Bioorg Chem, 2019, 85: 357-363. DOI:10.1016/j.bioorg.2019.01.013 |
| [19] |
Yang MY, Chan JGY, Chan HK. Pulmonary drug delivery by powder aerosols[J]. J Control Release, 2014, 193228-240. |
| [20] |
Zhang J, Li Y, Xiang M, et al. Preparation and pharmacodynamic study of curcumin liposome dry powder inhalation[J]. Mil Med Sci (军事医学), 2013, 37: 692-695. |
| [21] |
Xiang X, Du L, Li M, et al. Preparation of oridonin dry powder for inhalation and its therapeutic effect on acute lung injury of rats[J]. J Int Pharm Res (国际药学研究杂志), 2014, 41: 211-215. |
| [22] |
Li M, Zhu L, Liu B, et al. Tea tree oil nanoemulsions for inhalation therapies of bacterial and fungal pneumonia[J]. Colloids Surf B Biointerfaces, 2016, 141: 408-416. DOI:10.1016/j.colsurfb.2016.02.017 |
| [23] |
Li M, Zhang T, Zhu L, et al. Liposomal andrographolide dry powder inhalers for treatment of bacterial pneumonia via anti-inflammatory pathway[J]. Int J Pharm, 2017, 528: 163-171. DOI:10.1016/j.ijpharm.2017.06.005 |
| [24] |
Fang C, Xi X, Han F. The effect analysis of Curcuma oil injection atomization in the treatment of viral upper respiratory infection with fever[J]. Asia Pacif Tradit Med (亚太传统医学), 2014, 10: 110-112. |
| [25] |
Wei W, Rasul A, Sadiqa A, et al. Curcumol:from plant roots to cancer roots[J]. Int J Biol Sci, 2019, 15: 1600-1609. DOI:10.7150/ijbs.34716 |
| [26] |
Zeng J, Huang F, Liao Y. New progress of content determination methods and anti-tumor effect of zedoary oil[J]. Anti-tumor Pharm (肿瘤药学), 2012, 2: 19-22. |
| [27] |
Wang C, Shan Y. Determination of Curcumol and Germacrone in Zedoary Turmeric oil emulsion by HPLC[J]. Heilongjiang Med J (黑龙江医药), 2011, 24: 165-167. |
| [28] |
Sun Y, Wu D, Cao Y, et al. Preparation and characterization of nanoemulsion[J]. Chin J Cell Mol Immunol (细胞与分子免疫学杂志), 2005, 21: 71-75. |
| [29] |
Huang C, Wu Y, Huang B, et al. Formulation design, absorption mechanism and bioavailability of nanoemulsions for enhancing oral absorption of raloxifene[J]. Acta Pharm Sin (药学学报), 2018, 53: 1726-1735. |
| [30] |
Cheng S, Kourmatzis A, Mekonnen T, et al. Does upper airway deformation affect drug deposition?[J]. Int J Pharm, 2019, 572: 118773-118782. DOI:10.1016/j.ijpharm.2019.118773 |
| [31] |
Hu Y, Li M, Zhang T, et al. Preparation of liposomal artesunate dry powder inhalers and the effect on the acute lung injury of rats[J]. Acta Pharm Sin (药学学报), 2016, 51: 1906-1912. |
| [32] |
Ge Y, Zhang T, Zhang M, et al. Pulmonary delivery of chlorogenic acid β-cyclodextrin inclusion complexes for therapy of acute lung injury[J]. J Int Pharm Res (国际药学研究杂志), 2018, 45: 772-777. |
| [33] |
Xu R, Fan H, Zhang L, et al. Caffeoyl quinic acids in Chrysanthemum morifolium improve LPS-induced HUVEC vascular endothelial cell injury by regulating ERK/MAPK signaling pathway[J]. Acta Pharm Sin (药学学报), 2019, 54: 1207-1213. |
| [34] |
Pło'ciennikowska A, Hromada-Judycka A, Borzecka K, et al. Co-operation of TLR4 and raft proteins in LPS-induced pro-inflammatory signaling[J]. Cell Mol Life Sci, 2015, 72: 557-581. DOI:10.1007/s00018-014-1762-5 |
| [35] |
Kuzmov A, Minko T. Nanotechnology approaches for inhalation treatment of lung diseases[J]. J Control Release, 2015, 219: 500-518. DOI:10.1016/j.jconrel.2015.07.024 |
| [36] |
Yang R, Qian W, Peng L, et al. Phospholipidomics study of Jiegeng decotion for LPS-induced acute lung injury in mice based on UHPLC-Q-Exactive Orbitrap/MS[J]. Acta Pharm Sin (药学学报), 2019, 54: 144-150. |
| [37] |
Lu Y, Yeh W, Ohasi PS. LPS/TLR4 signal transduction pathway[J]. Cytokine, 2008, 42: 145-151. DOI:10.1016/j.cyto.2008.01.006 |
| [38] |
Zhao H, Zeng Z, Liu L, et al. Polydopamine nanoparticles for treatment of acute inflammation induced injury[J]. Nanoscale, 2018, 10: 6981-6991. DOI:10.1039/C8NR00838H |
| [39] |
Zhang Y, Lv R, Hu X, et al. The role of IL-33 on LPS-induced acute lung injury in mice[J]. Inflammation, 2016, 40: 285-294. |
| [40] |
Zhou S. The study of pathogenesis of acute lung injury induced by virus infection[J]. Int J Virol (国际病毒学杂志), 2015, 22: 221-222. |
| [41] |
Yang Z, Lei X, Li X. Early application of low-dose glucocorticoid improves acute respiratory distress syndrome:a meta-analysis of randomized controlled trials[J]. Exp Ther Med, 2017, 13: 1215-1224. DOI:10.3892/etm.2017.4154 |
 2020, Vol. 55
2020, Vol. 55


