2. 中国医药工业研究总院药物制剂国家工程研究中心, 上海 201203;
3. 上海市食品药品检验所, 上海 201203
2. National Pharmaceutical Engineering Research Center, China State Institute of Pharmaceutical Industry, Shanghai 201203, China;
3. Shanghai Institute for Food and Drug Control, Shanghai 201203, China
地塞米松(DXM)为一种糖皮质激素, 具有消炎、抑制免疫、抗休克及增强应激反应等药理作用, 多用于自身免疫性疾病、过敏、炎症以及皮肤科、眼科疾病, 近年来在癌症治疗中的应用也日益增多[1, 2]。美国食品和药品管理局(FDA)和欧洲药品质量管理局(EDQM)分别于2009年和2017年批准Allergan公司爱尔兰工厂生产的DXM玻璃体内植入剂上市, 用于治疗视网膜静脉阻塞继发黄斑水肿等眼科疾病。在植入玻璃体腔后的2个月中DXM浓度维持较高水平, 并在6个月内持续释放DXM[3-5]。Ren等[6, 7]开发的地塞米松植入剂(DI)可经皮穿刺植入肾囊, 用于治疗肾病综合征, 释药周期可达2个月。本研究团队研制的DI采用热熔挤出法制备, 考察了甘露醇作为亲水性基质在聚乳酸-羟基乙酸共聚物(PLGA)骨架中发挥的作用[5, 8]。
实时体外释放度实验是表征长效注射剂中药物在体内释放的有效手段。释放度方法的设计应参考体内释放的机制, 并且考虑释放部位的温度、分布、药物的体积和渗透压等因素[9, 10]。具有缓释作用的DI释放度实验往往耗时数月, 且实验条件很复杂, 此时, 流池法可发挥其巨大的优势:长时间不间断运行和自动取样。此外, 流池法的特点还表现为: ①满足漏槽原则; ②实验条件如样品池类型、释放介质的种类、组成和体积、流速、温度等容易调整; ③本法已被美国药典、日本药局方和英国药典收载, 便于推广和标准化。
释放度的测定一般以取样时释放介质中溶解的药物总量表示, 即:
| $ R=R_{m} $ | (1) |
式中, R是释放度; Rm是释放介质中的主药量, 通过理化分析方法测定得到。速释制剂或大多数缓控释制剂可用上式计算释放度, 但对于长效注射剂来说, 整个释放度测定周期以周或月计, 期间药物在释放介质中的稳定性需引起关注。已有研究人员发现DXM和纳曲酮在释放介质磷酸盐缓冲液中均会发生降解[11, 12]。对于像多柔比星稳定性差的化合物, 即使释放度实验只有几个小时到十几个小时, 降解仍然不能忽略[13]。
因此, 长效注射剂或主药不稳定的常规制剂的释放度需要用下式修正:
| $ R=R_{m}+R_{d} $ | (2) |
式中, Rd是在释放介质中降解的主药量, 用理化分析方法通常无法直接测定。
目前, 对于式(2)中Rd的处理方式主要有下列几种: ①经典法, 忽略了Rd, 仍按照式(1)计算长效制剂的释放度[14]; ②取样分离法, 及时更换释放介质, 使降解量Rd在释放药物总量R中占比始终处于极少的比例, 从而忽略不计[12, 15, 16]; ③假定释放介质中制剂已释放的药物与相同介质中的原料药降解速率相同, 取原料药溶液同法进行释放度实验, 以取样时制剂与原料药在各自释放介质中药物浓度的比值作为释放度[13]。
本文首次提出的双零级模型(double zero-order model, DZOM)尝试解决(2)式中Rd测定的问题。在任一释放度取样区间内, 如果制剂的释放速率及药物在释放介质中的降解速率均符合或近似符合零级速率, 根据速率理论可推导出该取样区间中长效注射剂的释放度Ri, 将各取样区间的释放度Ri累加后即为释放度R。释放度实验中只需测定释放介质及同法实验的原料药溶液中的药物量, 通过Excel软件计算即可。
材料与方法仪器与试药 CE 7流池法溶出仪(瑞士Sotax公司); 玻璃微纤维滤膜GF/D 25 mm (Whatman公司); Agilent 1100高效液相色谱仪(配有高精度四元梯度泵、在线脱气机、自动进样器、柱温箱和DAD检测器, Agilent公司); DIKMA Diamonsil Plus C18色谱柱(150 mm×4.6 mm, 5 μm, 迪马公司)。
DXM对照品(含量99.7%, 批号10019-201105, 中国食品药品检定研究院); 供试品[处方1: 10%甘露醇DI (含50% DXM、10%甘露醇和40% PLGA), 批号170220-4;处方2: L-PLGA (含50% DXM和50% L-PLGA), 批号170220-2;处方3:无甘露醇DI (含50% DXM和50% PLGA), 批号170220-1]均由药物制剂国家工程研究中心提供, 每支含DXM 700 μg。乙腈、甲醇(色谱纯, 德国Merck公司); 85%磷酸(分析纯, 上海凌峰化学试剂有限公司); 苯扎氯铵(benzalkonium chloride, BC, L610P34, 99.60%, J & K公司); 水为超纯水。
DXM降解速率的测定 色谱条件:色谱柱为DIKMA Diamonsil Plus C18色谱柱(150 mm×4.6 mm, 5 μm), 柱温30 ℃, 流动相为乙腈-水-85%磷酸(35:65:0.59), 流速1 mL·min-1, 进样量20 μL, 检测波长为250 nm。
取DXM对照品适量, 精密称定, 加甲醇使溶解并用水(含0.05 mg·mL-1 BC)定量稀释制成DXM质量浓度约为2 μg·mL-1溶液, 分别置于2只离心管中, 密闭, 分置于44 ℃和37 ℃水浴中。44 ℃条件下分别于0、1、2、3、7、14、21、28、35和42天; 37 ℃条件下分别于0、7、14、21、28、35、42、49和56天, 各取样0.5 mL。精密量取上述溶液各20 μL, 分别注入液相色谱仪, 记录色谱图, 按面积归一化法以峰面积计算各时间点的主药量和杂质总量, 考察DXM在不同温度下在水中的降解速率。
经典法测定释放度 取植入剂小池, 装入植入剂, 以水(含0.05 mg·mL-1 BC)为介质, 体积250 mL, 泵流速8 mL·min-1, 温度为37 ℃, 分别于1、2、3、7、14、21、28、35、42、49和56天, 各取样2 mL, 作为供试品溶液。精密称取105 ℃干燥2 h后的DXM对照品适量, 加甲醇使溶解, 用水(含0.05 mg·mL-1 BC)定量稀释制成DXM质量浓度分别为0.101、1.01和2.02 μg·mL-1溶液, 作为对照品溶液。精密量取对照品溶液和供试品溶液各20 μL, 分别注入液相色谱仪, 记录色谱图, 按外标法以峰面积计算各取样时间点的释放量。1~14、21和28~56天的供试品溶液的质量浓度分别以0.101、1.01和2.02 μg·mL-1对照品溶液校正因子计算。
DZOM测定释放度 如果将DI药物释放的整个过程细分为若干个取样区间, 分别计作t1、t2、t3…tk, 各自区间对应的药物释放量分别计作R1、R2、R3…Rk。因为释放量R具有加和性, 于是:
| $ R=R_{1}+R_{2}+R_{3}+\cdots+R_{k} $ | (3) |
在任一区间ti (1≤i≤k)内, 只要ti足够小, 可以认为药物在此期间按近似恒定的速率释放, 即零级释放。释放曲线通常将相邻两个取样点的释放度通过直线连接, 也就是将制剂按零级释放处理。同时, 因为DXM在介质中是按零级速率降解的, 称之为DZOM。
在ti区间末期, 释放介质中溶解的药物量Rim来源可分为两部分: ① ti-1区间末期已存在于释放介质中的药物R(i-1)m, 又经过ti时间的降解; ② ti区间制剂新释放的药物Ri, 药物到达溶液中随即发生降解。
来源①的贡献量Rim1。R(i-1)m以游离的形式溶解于释放介质中, 与同法实验的原料药溶液以相同的速率降解, 在ti区间末期, R(i-1)m剩余的药物量Rim1为:
| $ R_{i m 1}=R_{(i-1) m} \times\left(C_{i n} / C_{i 0}\right) $ | (4) |
式中, Ci0和Cin分别指同法实验的原料药溶液在ti区间初期和末期的药物浓度。
来源②的贡献量Rim2。植入剂中未释放部分的药物不发生降解, 药物一旦释放到介质中, 降解随即发生。在ti区间内, 把ti等分为ti1、ti2、ti3…tij…tin共n个时间段(n接近于无穷大), 因为药物释放和降解速率均为匀速, 在任意一个时间段tij内, 药物释放量Rij为ti区间药物释放量Ri的1/n, 而这部分药物在释放至介质中, 随即发生降解, ti1~tin 这n个时间段中每个时段释放药物的降解量分别为:
| $ \begin{array}{l} R_{i d 1}=R_{i} / n \times\left(1-C_{i n} / C_{i 0}\right) \times(n-1) / n \\ R_{i d 2}=R_{i} / n \times\left(1-C_{i n} / C_{i 0}\right) \times(n-2) / n \\ R_{i d 3}=R_{i} / n \times\left(1-C_{i n} / C_{i 0}\right) \times(n-3) / n \\ \ldots \ldots \\ R_{i d j}=R_{i} / n \times\left(1-C_{i n} / C_{i 0}\right) \times(n-j) / n \\ \ldots \ldots \\ R_{i d n}=R_{i} / n \times\left(1-C_{i n} / C_{i 0}\right) \times(n-n) / n \end{array} $ |
式中, Ri为ti区间的药物释放量, Ridj为ti区间内第j个时间段内释放的药物的降解量。
将上述等式左右两边分别累加, 可得ti区间植入剂释放药物Ri的降解量为:
| $ \begin{aligned} &\begin{aligned} R_{i d}=& R_{i d 1}+R_{i d 2}+R_{i d 3}+\cdots \cdots+R_{i d j}+\cdots \cdots+R_{i d n} \\ =& R_{i} / n \times\left(1-C_{i n} / C_{i 0}\right) \times(n-1) / n+R_{i} / n \times(1-\\ &\left.C_{i n} / C_{i 0}\right) \times(n-2) / n+R_{i} / n \times\left(1-C_{i n} / C_{i 0}\right) \times(n- \end{aligned}\\ &\text { 3) / } n+\cdots \cdots+R_{i} / n \times\left(1-C_{i n} / C_{i 0}\right) \times(n-j)\\ &n+\cdots \cdots+R_{i} / n \times\left(1-C_{i n} / C_{i 0}\right) \times(n-n) / n\\ =& R_{i} / n \times\left(1-C_{i n} / C_{i 0}\right) \times(n-1+n-2+n-\\ &3+\cdots \cdots n-j+\cdots \cdots+0) / n \\ =& R_{i} / n \times\left(1-C_{i n} / C_{i 0}\right) \times n \times(n-1) / 2 / n \\ \approx & R_{i} \times\left(1-C_{i n} / C_{i 0}\right) / 2 \end{aligned} $ | (5) |
Rim2实际上是ti区间内制剂的药物释放量Ri与随即降解的药物量Rid的差值:
| $ R_{i m 2}=R_{i}-R_{i d}=R_{i}-R_{i} \times\left(1-C_{i n} / C_{i 0}\right) / 2 $ | (6) |
| $ \begin{aligned} &\text { 于是 }, R_{i m}=R_{i m 1}+R_{i m 2}=R_{(i-1) m} \times\left(C_{i n} / C_{i \mathit{0}}\right)+\left[R_{i}-R_{i} \times\right.\\ &\left.\left(1-C_{i} / C_{i 0}\right) / 2\right] \end{aligned} $ | (7) |
公式(7)经变换后, 得到:
| $ R_{i}=\left[R_{i m}-R_{(i-1) m} \times\left(C_{i n} / C_{i 0}\right)\right] \times 2 /\left(1+C_{i n} / C_{i 0}\right) $ | (8) |
公式(8)是DZOM法计算DI释放度R的数学基础。式中, Ri是ti区间的释放度, 一般指相邻两个取样时间点之间的释放度; R(i-1)m和Rim分别为ti区间初期和末期释放介质中的主药量; Ci0和Cin分别为同法实验的原料药溶液在ti区间初期和末期的主药浓度。R(i-1)m、Rim、Ci0和Cin均可通过理化分析方法直接测定得到。
DZOM法测定DI释放度按照经典法测定释放度项下实验, 按外标法以峰面积计算各取样点释放介质中的药物, 即为公式(8)中的Rim, 前一次取样点的Rim即为本次取样点的R(i-1)m。另取DXM质量浓度约为2 μg·mL-1的原料药释放介质溶液250 mL, 置于流池法储液瓶中, 与制剂同法实验, 按面积归一化法以峰面积计算各取样点释放介质中的原料药浓度, 即为公式(8)中的Cin, 前一次取样点的 Cin即为本次取样点的Ci0。通过Excel软件, 将各区间的测定结果Rim、R(i-1)m、Cin和Ci0代入公式(8)计算该区间释放度Ri, 将各Ri代入公式(3)计算释放度R。本次实验中, R1为0~1天的释放量, R2为1~2天的释放量, R3为2~3天的释放量, R4为3~7天的释放量, 其他依次类推。如果要计算7天的药物释放量, 即R = R1+R2+R3+R4; 计算28天的药物释放量, 即R = R1+R2+R3+…+R7。
结果 1 DXM降解速率以降解时间为横坐标, 各温度下DXM百分含量为纵坐标进行线性回归, DXM在水(含0.05 mg·mL-1 BC)中按零级动力学降解:
| $ \begin{array}{l} 44℃: Y=-0.022 X+0.987, r^{2}=0.985 \\ 37℃: Y=-0.010 X+0.965, r^{2}=0.982 \end{array} $ |
所有处方的释放度均在28天达到峰值70%~80%, 然后出现释放曲线下降的现象(图 1), 释放度结果明显低于制剂中主药含量。该释放曲线实际上是制剂中药物释放与溶液中药物降解的综合反映, 类似于药物在体内的药时曲线, 吸收及代谢同时发生。因此, 经典法测定的释放度曲线无法客观评价DI真实的释放量。
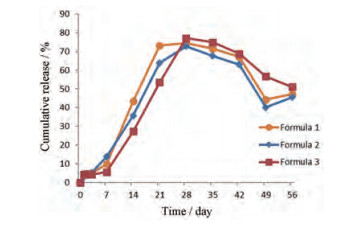
|
Figure 1 Release of dexamethasone implants (DI) using normal method. Formula 1: Containing 50% DXM, 10% mannitol and 40% PLGA; Formula 2: Containing 50% DXM and 50% L-PLGA; Formula 3: Containing 50% DXM and 50% PLGA. PLGA: Poly (lactic-co-glycolic acid) |
以处方3为例, 如果将释放曲线与DXM原料溶液的降解曲线比较, 纵坐标为制剂的释放度或经归一化处理的原料溶液浓度, 见图 2。在释放初期, DI释放速率快于降解速率, 释放度曲线表现为逐渐上升; 在第28天达到顶峰, 此时释放速率等于降解速率, 释放度曲线出现拐点; 28天后释放速率慢于降解速率, 释放度曲线逐渐下降, 待植入剂不再释放药物时, 介质中只有降解发生, 释放度曲线的斜率与药物降解曲线的斜率趋于一致。
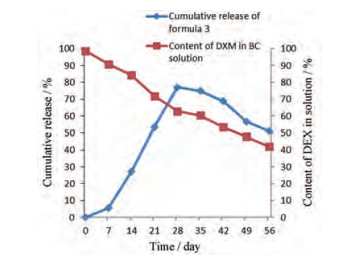
|
Figure 2 Comparison of release of DI and degradation of dexamethasone (DXM) in 0.05 mg·mL-1 benzalkonium chloride (BC) solution |
DZOM法测定的3种处方释放度均在42天达到90%以上, 释放量和达峰时间均明显大于经典法的测定结果, 克服了因降解造成的释放曲线下降的问题(图 3A~C)。

|
Figure 3 Release of formula 1 (A), formula 2 (B) and formula 3 (C) by normal method and double zero-order model (DZOM) |
DZOM法第49天的释放度较第42天有所下降, 其原因在于公式(8)的Rim-R(i-1)m× (Cin / Ci0)部分。由于Rim、R(i-1)m、Cin和Ci0都是通过HPLC法测得, 受到分析方法本身波动性的限制, 当Rim和R(i-1)m、Cin和Ci0数值非常接近时(主要发生在释放的初期和末期), 有可能出现Ri = Rim - R(i-1)m× (Cin / Ci0) < 0, 即ti区间的释放度Ri小于零这一与常理相悖的结果。为了避免这种结果出现, 对于Cin和Ci0的测定, 应尽可能采用面积归一化法定量, 其主药或杂质含量变化趋势性明显强于外标法, 获得Cin ≤ Ci0的结果并不困难。Rim和R(i-1)m的测定只能通过外标法定量, 因此, 当Rim和R(i-1)m在数值上比较接近时, 常用的HPLC等分析方法本身精密度的局限性不能从根本上解决Ri < 0的问题, 此时可以尝试采取以下几种处理方式: ①尽可能一次性而不是分次测定所有的供试品溶液; ②承认分析方法中外标法存在波动性, 允许释放曲线有轻微的下降, 如图 3; ③在发生Ri < 0的取样区间对Ri值进行修正, 令Ri=0, 也就是说, 植入剂在该区间即使药物没有释放, 释放度也不可能为负数, 因此强制其为零。以处方3为例, 方式③的处理结果见图 4。有时, 由于原料药溶液比较稳定或受到检测灵敏度的限制, 有可能在一个取样区间内, 即使用面积归一化法也无法反映出降解的趋势。比如在释放开始的1~2个取样区间内, 杂质量可能始终为零, 但实际上降解已然发生。此时, 可以把原料药溶液降解测定的周期延长, 计算若干个取样区间内总的降解率, 再按零级降解的规律换算出单个取样区间的降解率。
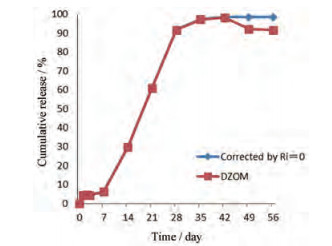
|
Figure 4 DZOM corrected by Ri=0 when Ri < 0 happens |
DZOM法假定任一取样区间制剂的释放呈零级速率, 可能与实际情况不符, 成为方法误差的来源。为了减小这一误差, 理论上是将取样区间分割得越细越好, 但取样区间缩短会导致取样频次的增加, 从而增加了检测的随机误差。在DI释放度测定中, 释放曲线在第7天和28天发生较明显转折, 在第7~28天释放速度最快, 提示可以在此区间增加取样频次, 避免降解反应级数发生变化产生的误差。总之, 释放曲线形态正常, 释放度的数据与制剂本身的含量吻合, 体外释放结果与动物体内释放相关性较好(将另文发表), 7天左右的取样频率对于DI比较适合。
经典法中, 由于DXM降解的问题, 所有处方完全释放的时间和释放度的结果均明显较DZOM法低, 会误导对植入剂释放行为的评价。DZOM法较好地解决了上述问题。在研究思路上, DZOM法吸取了取样分离法和原料降解比值法的优点。在计算药物的释放度时, DZOM法的思路与取样分离法十分相似, DZOM法每个取样区间的释放度等同于取样分离法一次更换介质中的释放度。DZOM法测定的释放度是把每一区间的释放度累加起来, 而取样分离法是将每份介质中的释放度累加起来。在实验中, DZOM法不用定期地更换释放介质, 与取样分离法相比大大节省了工作量, 并且使得流池法溶出仪可以充分发挥其自动化取样的优势。在对降解药物的测定中, DZOM法没有像取样分离法那样回避药物降解的问题, 而是参考了原料降解比值法, 引入了原料药溶液同法降解这一做法, 将降解的药物量化, 同时, DZOM法纠正了原料降解比值法公式的错误, 使释放度结果更加合理。
| [1] |
Wang LJ, Lu W, Zhou TY. Current applications of dexamethasone for cancer treatment[J]. Acta Pharm Sin (药学学报), 2015, 50: 1217-1224. |
| [2] |
Mei F, Zeng WD, Wan T, et al. Dexamethasone acetate microemulsions:formulation and effect on skin permeability[J]. Acta Pharm Sin (药学学报), 2016, 51: 979-984. |
| [3] |
Zhao HK, Wu M, Li YQ. Process in the application of dexamethasone vitreous implant[J]. Int Eye Sci (国际眼科杂志), 2019, 19: 960-963. |
| [4] |
Guo C, Zhou QY, Li Q. Research profile on therapy of retinal vein occlusion macular edema by dexamethasone intravitreal implant[J]. Chin Pharm (中国药房), 2019, 30: 2155-2160. |
| [5] |
Chen YN, Luan HS, Wang H. Investigation on effect of mannitol on in vitro release behavior of dexamethasone PLGA implants[J]. Chin J Pharm (中国医药工业杂志), 2017, 48: 1148-1155. |
| [6] |
Ren CL, Yin QS, Yu M, et al. Assay of dexamethasone implants by HPLC[J]. Anhui Med Pharm J (安徽医药), 2013, 17: 1294-1295. |
| [7] |
Ren CL, Xia LY, Yin QS, et al. An HPLC method for determination of related substances of dexamethasone implants[J]. Anhui Med Pharm J (安徽医药), 2015, 19: 665-668. |
| [8] |
Chen YN. Preparation and Drug Release Behavior Regulation of Dexamethasone Implants (地塞米松植入剂的制备与释药行为调控)[D]. Shanghai: China State Institute of Pharmaceutical Industry, 2017.
|
| [9] |
Burgess D, Crommelin D, Benoit J, et al. Assuring quality and performance of sustained and controlled release parenterals[J]. Eur J Pharm Sci, 2004, 21: 679-690. DOI:10.1016/j.ejps.2004.03.001 |
| [10] |
Martinez M, Rathbone M, Burgess D, et al. In vitro and in vivo considerations associated with parenteral sustained release products:a review based upon information presented and points expressed at the 2007 Controlled Release Society Annual Meeting[J]. J Control Release, 2008, 129: 79-87. DOI:10.1016/j.jconrel.2008.04.004 |
| [11] |
Hickey T, Kreutzer D, Burgess D, et al. Dexamethasone/PLGA microspheres for continuous delivery of an anti-inflammatory drug for implantable medical devices[J]. Biomaterials, 2002, 23: 1649-1656. DOI:10.1016/S0142-9612(01)00291-5 |
| [12] |
Andhariya JV, Choi S, Wang Y, et al. Accelerated in vitro release testing method for naltrexone loaded PLGA microspheres[J]. Int J Pharm, 2017, 520: 79-85. DOI:10.1016/j.ijpharm.2017.01.050 |
| [13] |
Yuan W, Kuai R, Dai Z. Development of a flow-through USP-4 apparatus drug release assay to evaluate doxorubicin liposomes[J]. AAPS J, 2017, 19: 150-160. DOI:10.1208/s12248-016-9958-2 |
| [14] |
Zhao H, Wei W, Zhang MR, et al. Preparation of paeonol sustained-release microspheres and correlation between in vitro release and in vivo absorption characteristics[J]. J Anhui Univ Sci Tech (Nat Sci)[安徽理工大学学报(自然科学版)], 2010, 30: 42-46. |
| [15] |
D'Souza1 SS, DeLuca PP. Methods to assess in vitro drug release from injectable polymeric particulate systems[J]. Pharm Res, 2006, 23: 460-474. DOI:10.1007/s11095-005-9397-8 |
| [16] |
Zolnik BS, Burgess DJ. Evaluation of in vivo-in vitro release of dexamethasone from PLGA microspheres[J]. J Control Release, 2008, 129: 137-145. |
 2020, Vol. 55
2020, Vol. 55


