2. 扬州大学, 江苏高校动物重要疫病与人兽共患病防控协同创新中心, 江苏 扬州 225009
2. Jiangsu Co-innovation Center for Prevention and Control of Important Animal Infectious Diseases and Zoonoses, Yangzhou University, Yangzhou 225009, China
DNA疫苗是衍生于基因治疗研究的一个新领域, 即将一种或多种抗原编码基因克隆到质粒上, 使外源基因在活体内进行抗原表达, 从而激活机体的免疫反应[1]。DNA疫苗的优势在于: ①高效: DNA疫苗可以激发机体的细胞免疫反应, 对细胞内病原体(如流感病毒)的清除更加有效; ②制备简便: DNA疫苗的制备只需对编码抗原的基因进行设计和克隆, 不需在体外表达和纯化蛋白质, 且相关技术已经比较成熟[2]; ③稳定: DNA疫苗化学性质稳定、耐高温, 便于储藏运输。尽管DNA疫苗在免疫治疗中展现出了广阔的前景, 但低水平的DNA转染是限制其诱导免疫反应的主要问题。其原因可以归结为: ①细胞膜为磷脂双分子层结构, 外层的磷酸基团带负电, 使得同样带负电荷的DNA难以通过; ② DNA在体内转运到组织细胞的效率较低, 不能有效表达抗原; ③ DNA进入细胞后不能有效逃逸内涵体/溶酶体, 从而导致抗原表达水平低下[3]。
阳离子聚合物是非病毒类基因载体的一种, 与病毒或阳离子脂质体相比, 具有安全性高、成本低、易于进行功能性改造及大规模生产等优点[4, 5], 可以直接通过静电作用与DNA自组装形成纳米复合物并能克服细胞内外多种递送屏障, 是基因递送载体的重要研究对象[6]。其中, 阳离子超支化聚酰胺-胺具有良好的分子韧性, 合成简便, 可通过一步或“一锅式”聚合反应直接获得[7]。其水溶性高, 使用方便, 可以在生理环境下形成稳定的纳米复合物。此外, 超支化聚酰胺-胺是高度支化的三维树枝状大分子, 含有大量各级胺官能团, 并可进行多种结构修饰以达到不同的目的, 如减小毒性, 提高转染效率等[8]。因此, 超支化聚酰胺-胺在基因递送中前景十分广阔。
氟化修饰是一种提高阳离子聚合物核酸递送能力的新型策略。含氟化合物既不亲水也不亲油, 在极性和非极性环境中都具有很强的相分离能力。氟化修饰可以帮助聚合物纳米粒穿越脂质双分子层, 从而提高其细胞摄取及溶酶体逃逸能力, 能有效提高阳离子聚合物载体的基因转染效率并降低其毒副作用[9]。本课题组近年来在氟化修饰用于聚合物改性及组装方面开展了大量研究工作[10-14], 为进一步拓展氟化修饰阳离子聚合物在疫苗递送中的应用, 设计合成了氟修饰的阳离子聚酰胺-胺[fluorinated hyperbranched poly(amido amine)s, F-HP], 用于DNA疫苗的递送, 对聚合物/DNA纳米复合物的理化性质、细胞内行为、核蛋白(nucleoprotein, NP)表达及体内细胞免疫反应进行了考察, 与未氟化的超支化聚酰胺-胺(HP)对比, 研究氟化修饰在DNA疫苗递送中的潜力。
材料与方法材料与仪器 六亚甲基双丙烯酰胺[N, N′-hexamethylene-bis (acrylamide), HMBA]、3-十二烷氧基丙胺(N, N-dimethyldipropylene-triamine, DMDPTA)及七氟丁酸酐(heptafluorobutyric anhydride, HFBA) (美国Sigma公司); LysoTracker Red、YOYO-1、MTT (碧云天生物技术有限公司); APC-CD8流式抗体(美国Invitrogen公司); FITC-CD3流式抗体(美国eBioscience公司); 电热恒温鼓风干燥箱(上海森信实验仪器有限公司); 冷冻离心机(美国Thermo Scientific公司); PE 2400 SERIES-II元素分析仪(美国PerkinElmer公司); EPS-200电泳仪与HE-90水平电泳槽(上海天能科技有限公司); BI-200SM广角动静态激光光散射仪(美国Brookhaven Instruments公司); 激光共聚焦显微镜(奥林巴斯有限公司); 流式细胞仪(美国BD公司)。
细胞与动物 DC2.4及293T细胞均为本实验室保存; C57/BL6雄性小鼠, 体重(20 ± 2) g, SPF级(扬州大学比较医学中心), 动物合格证号为: 201930788, 动物许可证号为SCXK (苏) 2017-0007, 动物实验获得扬州大学实验动物伦理委员会批准。
氟化超支化聚酰胺-胺的合成 通过迈克尔加成反应获得超支化聚酰胺-胺, 将DMDPTA (0.318 g, 2.0 mmoL)与HMBA (0.448 g, 2.0 mmoL)溶解在3.5 mL甲醇/水中(8/2, v/v), 在50 ℃条件下搅拌3天, 再向反应体系中加入0.1 mmoL DMDPTA继续在50 ℃条件下搅拌12 h, 消耗掉残余的丙烯酰胺基团以终止聚合反应。将反应产物装入透析袋(MWCO 3.5 kDa)中, 在pH 3的去离子水中透析2天, 最终通过冷冻干燥获得超支化聚酰胺-胺(HP), HP结构通过1H NMR进行表征。
对HP进行氟化修饰, 将HP 0.1 g溶解在2 mL甲醇中, 加入HFBA 0.120 g, 迅速加入三乙胺0.030 g, 室温搅拌48 h。反应结束后, 将反应产物装入透析袋(MWCO 3.5 kDa)中, 在pH 3的去离子水中透析2天, 最终通过冷冻干燥获得氟化修饰的超支化聚酰胺-胺(F-HP)。F-HP中氟元素的含量通过氟元素分析方法测定[10]。
流感病毒PR8的NP基因重组质粒构建 根据Gene Bank报道的NP基因序列, 利用Primer 5.0软件设计特异性引物, 扩增NP基因。切胶回收目的基因, 具体步骤见Axygen割胶回收试剂盒说明书。将获得的目的基因片段插入到PCDNA3.1(+)中, 构建含目标基因序列的重组表达载体。连接产物转化T0P10感受态细胞, 涂布于含氨苄青霉素的平板上倒置培养12~16 h。挑取单菌落至LB液体培养基中, 37 ℃、220 r·min-1振荡培养4~6 h后, 提取重组质粒进行酶切鉴定, 并送上海生工生物进行测试验证。
聚合物与质粒DNA纳米复合物的制备及表征 用HEPES (10 mmol·L-1, pH 7.4)缓冲液配制20 μg·mL-1 DNA溶液, 加入不同浓度的聚合物溶液(碳氟链含量除外), 涡旋30 s, 在室温下放置30 min, 最终获得聚合物与DNA不同质量比(0、1、2、3、4和5, w/w)的纳米复合物溶液, 分别为HP/NP和F-HP/NP。为评价所得聚合物的DNA络合能力, 将上述不同质量比w/w纳米复合物溶液进行琼脂糖凝胶电泳实验。制备含有JelRed的1%琼脂糖凝胶, 在90 V电压下电泳30 min, 电泳结束后, 进行凝胶成像显示DNA条带亮度。所得不同质量比w/w (5、7.5及10)的纳米复合物粒径及电位采用粒径仪检测。纳米复合物的粒子形态由透射电镜检测。
细胞毒性 通过MTT实验考察聚合物对DC2.4细胞的细胞毒性。按每孔1×104个细胞铺于96孔板, 培养12~18 h后, 加入不同浓度的聚合物溶液, 孵育24 h后, 每孔加入5 mg·mL-1 MTT溶液10 μL, 4 h后弃掉含有MTT的培养基, 每孔加入DMSO 100 μL, 上机检测。
细胞摄入实验 DNA质粒与核酸绿色荧光染料YOYO-1 (5 μg DNA加入0.1 μmoL YOYO-1)在室温下混合10 min, 并与HP和F-HP形成纳米复合物, 加入到培养有DC2.4细胞的24孔板中, 4 h后消化并重悬细胞, 利用流式细胞仪进行检测。
溶酶体逃逸实验 DC2.4细胞接种于24孔板中, 生长至覆盖孔底面积50%后, 加入YOYO-1标记的纳米复合物(质量比w/w 7.5)孵育2 h, LysoTracker Red染色后使用激光共焦显微镜成像。
免疫荧光鉴定NP蛋白的表达 制备纳米复合物(质量比w/w 7.5), 转染293T细胞, 48 h后, 吸弃培养基, 磷酸盐缓冲液(PBS)洗3次, 用4%多聚甲醛室温固定30 min, PBS洗3次, 再用0.2% TritonX-100溶液破膜10 min, PBS洗3次, 5%牛血清白蛋白(bovine serum albumin, BSA)封闭液覆盖细胞表面于37 ℃封闭1 h, 孵育一抗(抗鼠293T细胞单抗), 37 ℃封闭2 h, 加入二抗(FITC标记的IgG), 37 ℃避光孵育1 h, 封片, 荧光显微镜下观察并拍照。
小鼠免疫及CD3+CD8+ T细胞含量检测 分别设置生理盐水组、HP/NP及F-HP/NP纳米复合物组, 于第0、7和14天, C57/BL6小鼠尾基部皮下注射纳米复合物(质量比w/w 7.5)。第21天, 取脾脏, 制备成单细胞悬液, 收集200万细胞至1.5 mL离心管中, 1 600 r·min-1离心5 min, 去掉上清后用1 mL PBS轻洗2次, 最后用PBS 100 μL重悬, 分别向不同的样品管中加入CD3+及CD8+ T细胞流式抗体, 4 ℃下避光孵育30 min。随后离心, 用PBS洗3次, 离心去上清后, 加入2%多聚甲醛1 mL, 固定20 min。细胞重悬在1 mL PBS中, 待上机检测。
细胞内γ-干扰素(interferon-γ, IFN-γ)含量检测 如上所述, 制备脾脏单细胞悬液, 流式抗体标记CD8+ T细胞并对细胞固定及通透化后, 通过BD Cytofix/Cytoperm™试剂盒检测细胞内IFN-γ。
统计学分析 采用SPSS17.0统计软件对数据进行统计学分析, 多组间比较采用单因素方差分析, 两组间比较采用t检验, P < 0.05表示具有显著性差异。
结果 1.1 超支化聚酰胺-胺阳离子聚合物的合成、氟化修饰及表征本研究的超支化聚合物HP由DMDPTA和HMBA通过迈克尔加成反应获得(图 1)。众多研究结果表明阳离子聚合物的超支化有利于提高基因转染效率, 本课题组前期研究优化了聚合反应条件, 以保证在该反应比例和温度下获得超支化而非线性的聚合物[10, 15]。在该反应中, DMDPTA提供了伯、仲、叔三种类型的氨基, 有利于提高聚合物与DNA的络合能力, 促进基因转染。1H NMR谱进一步验证了所得聚合物的分枝状结构, CH2=CH-信号(δ 5~6.5)消失证明丙烯酰胺基团已经被完全消耗掉。凝胶渗透色谱(gel permeation chromatography, GPC)分析结果显示, HP的分子质量为59.7 kDa, 多分散系数PDI为2.67。为进一步结合氟化修饰研究其对DNA疫苗递送的影响, 将HFBA与HP的仲氨基反应, 获得含有氟烷基侧链的聚合物F-HP (图 1)。通过元素分析测得F-HP中氟元素的含量为20%。
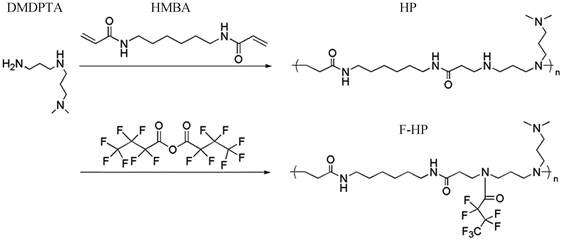
|
Figure 1 Synthesis of fluorinated hyperbranched poly (amido amine)s (F-HP). DMDPTA: N, N-Dimethyldipropylene-triamine; HMBA: N, N′-Hexamethylene-bis (acrylamide) |
提取重组质粒, 并进行BamHI和EcoRI双酶切, 琼脂糖凝胶电泳结果如图 2所示, 双酶切后所得条带与预期片段大小接近。同时, DNA测序结果显示与目的基因序列一致, 说明成功构建了NP的重组表达质粒。
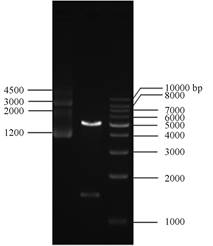
|
Figure 2 Double restriction endonuclease digestion analysis of recombinant plasmid |
通过静电作用制备聚合物/质粒DNA纳米复合物, 琼脂糖凝胶电泳检测聚合物的基因络合能力。在本研究中, 质量比仅为阳离子部分与DNA的比例, 氟碳链含量排除在外。如图 3所示, HP与F-HP均能完全络合质粒DNA, 两者的DNA络合能力有一定差别。其中, HP的DNA络合能力略强于F-HP, 表明氟化修饰对聚合物的DNA络合能力有所影响, 但并没有造成明显的空间位阻。

|
Figure 3 DNA complexation assessed by agarose gel electrophoresis of polyplexes prepared at different weight/weight (w/w) ratios |
动态光散射法测定不同质量比w/w (5、7.5及10)纳米复合物的粒径及ζ电位变化。由图 4A所示, 在本研究的质量比w/w范围内, 纳米复合物的粒径随质量比w/w增加而减小。HP/NP纳米复合物的粒径分别为125.7 ± 15.3 nm (质量比w/w 5)、95.7 ± 9.7 nm (质量比w/w 7.5)及89.0 ± 12.9 nm (质量比w/w 10), 而F-HP/NP纳米复合物的粒径略大于HP/NP, 主要为100~150 nm (质量比w/w 5、7.5及10)。纳米复合物的ζ电位研究表明, 随质量比w/w的增加而有所增加, 都呈现出正电性(图 4B)。在相同的质量比w/w条件下, F-HP/NP纳米复合物的ζ电位略低于HP/NP, 其可能原因在于氟化基团消除了部分表面电荷[10], 导致F-HP与DNA结合的紧密程度降低, 从而解释了其粒径也比HP/NP复合物略大(图 4A), 并且需要更多的聚合物才能完全压缩质粒DNA (图 3)。HP/NP与F-HP/NP纳米复合物在电镜下的形态均为圆球形(图 4C), 直径在100 nm左右, 与动态光散射法测定的粒子大小类似。同时, 该结果说明氟化修饰不会影响纳米粒的形成。

|
Figure 4 Particle size of HP and F-HP complexed with NP plasmid at different w/w ratios (A). ζ Potential of the polyplexes at different w/w ratios (B). TEM images (C). NP: Nucleoprotein |
阳离子聚合物的细胞毒性限制了其体内应用, 同时也是聚合物设计过程中必须考虑的因素。在本课题中, 利用DC2.4细胞研究氟化修饰阳离子聚合物与未经氟化修饰的阳离子聚合物的细胞毒性(图 5)。在HP质量浓度小于5 μg·mL-1、F-HP小于10 μg·mL-1时(氟碳链含量除外), DC2.4细胞活力在90%以上, 其IC50分别为41.23和51.44 μg·mL-1。因此, F-HP比HP的细胞毒性略小, 但无显著性差异。此结果为进一步细胞实验的剂量选择提供重要参考。
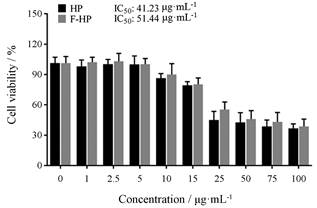
|
Figure 5 Cytotoxicity of HP and F-HP at different concentrations |
纳米复合物跨过细胞膜分布到细胞质中, 对于基因递送至关重要。首先利用YOYO标记的DNA与聚合物形成的纳米复合物来研究其细胞摄取行为。如图 6A所示, 细胞摄取随质量比w/w增加而增加, 在所测试的剂量范围内, 氟化修饰显著提高了纳米复合物的细胞摄取效率(P < 0.01)。除细胞摄取外, 细胞内的溶酶体逃逸对于获得高效的基因递送也非常重要。因此, 进一步利用LysoTracker Red对细胞内的溶酶体进行染色, 观察纳米复合物与溶酶体的共定位情况。如图 6B所示, HP纳米复合物可观察到大量YOYO (绿)与LysoTracker Red (红)重叠的黄色荧光, 表明此时大部分纳米复合物存在于溶酶体中。而HP纳米复合物可以观察到明显的绿色荧光, 表明纳米复合物已经发生了溶酶体逃逸。因此, 氟化修饰可以有效促进纳米复合物进入细胞并实现溶酶体逃逸, 从而有利于DNA的细胞内表达。
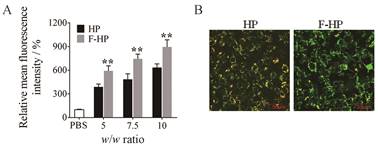
|
Figure 6 Cell uptake determined by flow cytometry (A). Lysosomal escape of complexes in DC2.4 cells 2 h after incubation (B). Lysosomes were stained with LysoTracker Red. n = 3, xx ± s.**P < 0.01 vs HP |
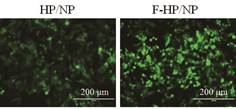
将HP/NP与F-HP纳米复合物分别转染293T细胞后, 通过免疫荧光鉴定目的蛋白的表达。如图 7所示, HP/NP纳米复合物转染后, 可以观察到微弱的绿色荧光, 说明NP蛋白有所表达, 而F-HP/NP纳米复合物转染后则可以观察到大量的绿色荧光, 其原因在于氟化修饰能显著促进纳米复合物的细胞摄取与溶酶体逃逸(图 6), 从而提高了抗原蛋白的细胞内表达水平。
|
Figure 7 Analysis of NP expression in 293T by immunofluorescence staining |
CD8+ T淋巴细胞的激活对于清除细胞内寄生的病原体至关重要[16]。在本研究中, 首先检测了CD8+ T淋巴细胞含量。如图 8A所示, 与生理盐水组相比, HP/NP及F-HP/NP纳米复合物均能诱导CD8+ T淋巴细胞含量增加, 而F-HP/NP组的CD8+ T淋巴细胞含量是HP/NP组的1.6倍(P < 0.001), 结合图 7结果所示, 氟化修饰的纳米复合物具有更高的抗原表达水平, 从而有利于增强对CD8+ T淋巴细胞的抗原递呈而促进其增殖。为评价CD8+ T淋巴细胞激活情况, 进一步通过流式细胞术对CD8+ T细胞内IFN-γ含量进行检测。如图 8B所示, HP/NP免疫后, CD8+ T淋巴细胞IFN-γ的阳性细胞率为(3.7 ± 0.9) %, F-HP/NP组为(4.9 ± 0.6) %, 两组存在显著性差异(P < 0.01)。因此, 氟化修饰能增强纳米复合物对CD8+ T淋巴细胞免疫反应的诱导能力, 从而有利于清除细胞的流感病毒。

|
Figure 8 The proportion of CD3+CD8+ T cells in splenocytes was determined by flow cytometry (A). The proportion of IFN-γ producing CD8+ T cells was determined by flow cytometry (B). n = 6, x ± s.**P < 0.01, ***P < 0.001 vs HP/NP |
DNA疫苗是近年来活跃发展的领域之一, 如何提高其转染效率、增强对免疫反应的诱导是非常值得关注的问题[17]。目前主要有3种不同的基因输送手段:物理转染、病毒载体及非病毒类载体[18]。物理转染方法如基因枪法, 会对细胞造成一定的损伤, 应用具有局限性。病毒类载体由于保留了病毒的感染机制而存在安全性隐患[19]。非病毒类载体主要由阳离子脂质体或阳离子聚合物将DNA包装成纳米复合物进行输送[2]。阳离子脂质体的体液稳定性较差, 在体内复杂环境中无法保证转染效率[20]。相对而言, 阳离子聚合物便于功能化修饰, 有利于提高基因转染效率, 如氟化修饰可以促进聚合物纳米粒的细胞摄取及溶酶体逃逸。
在本研究中, 以氟化超支化聚酰胺-胺作为流感病毒DNA疫苗的递送载体, 聚合物能通过静电作用与DNA疫苗络合形成球形的纳米粒。通过琼脂糖凝胶电泳实验可知HP与F-HP均具有良好的质粒DNA络合能力, HP对DNA的络合能力略强于F-HP, 表明氟化修饰对聚合物的DNA络合能力有所影响, 但不会带来明显的空间位阻。HP/NP与F-HP/NP纳米复合物在电镜下的形态及大小相似, 说明氟化修饰不会影响纳米粒的形成。此外, 发现氟化修饰阳离子聚合物与未经氟化修饰的阳离子聚合物相比, 存在以下优势: ①氟化修饰显著提高了纳米复合物的细胞内分布, 可有效促进纳米复合物进入细胞并实现溶酶体逃逸, 有利于基因递送与抗原表达; ②氟化修饰能增强纳米复合物对CD8+ T淋巴细胞免疫反应的诱导能力, 有利于调动细胞免疫反应, 进而实现胞内流感病毒的清除。本研究为DNA疫苗的递送提供了一种高效的载体, 为氟化修饰的阳离子聚合物应用拓展了思路。
综上所述, 本研究合成了氟化修饰的超支化聚酰胺-胺用于流感DNA疫苗的递送, F-HP具有良好的质粒DNA络合能力, 能形成表面正电性的球形纳米复合物。同时。氟化修饰能显著提高纳米复合物的细胞摄取及溶酶体逃逸能力, 从而促进抗原的细胞内表达, 并进一步激活CD8+ T淋巴细胞用于清除流感病毒。因此, 氟化修饰的阳离子聚合物是一种高效的DNA疫苗递送载体, 进一步研究将聚焦于氟化纳米复合物的体内组织分布与安全性, 并探究其体内抗病毒作用。
| [1] |
Liu MA. DNA vaccines:an historical perspective and view to the future[J]. Immunol Rev, 2011, 239: 62-84. DOI:10.1111/j.1600-065X.2010.00980.x |
| [2] |
Zeng P, Peng M, Xu Y. Advance in the study of poly(lactide-co-glycolide) nano/microparticles as gene vector[J]. Acta Pharm Sin (药学学报), 2010, 45: 1346-1353. |
| [3] |
Luo J, Yang J, Chen Y, et al. Preparation of chitosan nanoparticles containing Crispl-DNA contraceptive vaccine and its expression in vitro[J]. J Reproduct Med (生殖医学杂志), 2016, 25: 947-952. |
| [4] |
Chen JH. Application of cationic polymer vector for gene delivery systems[J]. Acta Pharm Sin (药学学报), 2003, 38: 316-320. |
| [5] |
Ping Y, Chen JH. Dextran-spermine polycation as a vector for gene transfection in vitro[J]. Acta Pharm Sin (药学学报), 2007, 42: 669-674. |
| [6] |
Ma LN, Jin LL, Hong MS, et al. Evaluation of the aspartate graft polythyleneimine as a DNA vaccine carrier in vitro[J]. J Med Sci Yanbian Univ (延边大学医学学报), 2015, 94-98. |
| [7] |
Chen J, Wu C, Oupický D. Bioreducible hyperbranched poly(amido amine)s for gene delivery[J]. Biomacromolecules, 2009, 10: 2921-2927. DOI:10.1021/bm900724c |
| [8] |
Cui T, Hong J, Ding Y, et al. Polymer-modified gold nanoparticles for cancer therapy[J]. Acta Pharm Sin (药学学报), 2016, 53: 281-286. |
| [9] |
Wang M, Liu H, Li L, et al. A fluorinated dendrimer achieves excellent gene transfection efficacy at extremely low nitrogen to phosphorus ratios[J]. Nat Commun, 2014, 5: 3053. DOI:10.1038/ncomms4053 |
| [10] |
Chen G, Wang K, Hu Q, et al. Combining fluorination and bioreducibility for improved siRNA polyplex delivery[J]. ACS Appl Mater Interfaces, 2017, 9: 4457. DOI:10.1021/acsami.6b14184 |
| [11] |
Chen G, Wang K, Wu P, et al. Development of fluorinated polyplex nanoemulsions for improved small interfering RNA delivery and cancer therapy[J]. Nano Res, 2017, 11: 1-16. |
| [12] |
Chen G, Wang K, Wang Y, et al. Fluorination enhances serum stability of bioreducible poly(amido amine) polyplexes and enables efficient intravenous siRNA delivery[J]. Adv Healthcare Mater, 2017, 7: 1700978. |
| [13] |
Chen G, Wang K, Ullah A, et al. Self-assembled fluoropolycation nanomicelles for improved siRNA silencing[J]. J Control Release, 2017, 259: e35-e36. |
| [14] |
Chen G, Wang Y, Wu P, et al. Reversibly stabilized polycation nanoparticles for combination treatment of early- and late-stage metastatic breast cancer[J]. ACS Nano, 2018, 12: 6620-6636. DOI:10.1021/acsnano.8b01482 |
| [15] |
Whitehead KA, Langer R, Anderson DG. Knocking down barriers:advances in siRNA delivery[J]. Nat Rev Drug Discov, 2009, 8: 129-138. DOI:10.1038/nrd2742 |
| [16] |
Uebele J, Stein C, Nguyen MT, et al. Antigen delivery to dendritic cells shapes human CD4+ and CD8+ T cell memory responses to Staphylococcus aureus[J]. PLoS Pathog, 2017, 13: e1006387. DOI:10.1371/journal.ppat.1006387 |
| [17] |
Li M, Dong JN, Li JG, et al. Research status of action mechanism and immune pathway of gene vaccine[J]. Guizhou Med J (贵州医药), 2013, 37: 748-751. |
| [18] |
Wagner E, Ogris M, Zauner W. Polylysine-based transfection systems utilizing receptor-mediated delivery[J]. Adv Drug Deliv Rev, 1998, 30: 97-113. DOI:10.1016/S0169-409X(97)00110-5 |
| [19] |
Temin HM. Safety considerations in somatic gene therapy of human disease with retrovirus vectors[J]. Hum Gene Ther, 1990, 1: 111-123. DOI:10.1089/hum.1990.1.2-111 |
| [20] |
Yang X, Li S, Deng YH. Effect of polyethylene glycol-lipid derivatives on the stability of grafted liposomes[J]. Acta Pharm Sin (药学学报), 2011, 46: 1178-1186. |
 2020, Vol. 55
2020, Vol. 55


