2. 中国科学院大连化学物理研究所, 分离分析重点实验室, 辽宁 大连 116023;
3. 中国科学院大连化学物理研究所, 中国医药城生物医药创新研究院, 江苏 泰州 225316
2. Key Lab of Separation Science for Analytical Chemistry, Dalian Institute of Chemical Physics, Chinese Academy of Sciences, Dalian 116023, China;
3. Innovation Institute of Medicine, China Medical City, Dalian Institute of Chemical Physics, Chinese Academy of Sciences, Taizhou 225316, China
白屈菜是罂粟科白屈菜属植物白屈菜(Chelidonium majus L.)的干燥全草, 别名地黄连、牛金花、土黄连等[1]; 味苦、性凉、有毒; 全草入药具有镇痛、止咳、利尿、解毒的功效, 主治胃痛、腹痛、肠炎、痢疾等[2], 分布于东北、华北地区及长江中下游和四川、陕西、新疆等省区[3]。国内外研究表明其主要有效成分是异喹啉类生物碱。目前发现的生物碱主要属于苯并菲啶类、原小檗碱类、普罗托品类、二聚苯并菲啶类等, 而异喹啉类生物碱中的二氢苯并菲啶类、阿朴菲类鲜有报道, 并且生物碱鉴定方法多为核磁共振等传统手段, 鉴定周期长且方法复杂。因此有必要对白屈菜中化学成分的鉴定进行进一步研究。本研究采用HPLC-Q-TOF/MS技术对白屈菜中的生物碱进行分析鉴定, 并对定性结果进行验证, 为其化学成分的进一步研究和药物基础研究提供科学依据。
材料与方法仪器与试剂 岛津高效液相色谱LC-20AD-四级杆飞行时间质谱仪SCIEX 500B Q-TOF (美国AB SCIEX公司); Milli-Q gradient超纯水仪(德国默克公司); XS105DU型电子天平(瑞士梅特勒-托利多公司)。实验试剂:乙腈, HPLC级(德国默克公司); 甲酸, HPLC级, 纯度≥96% (美国Sigma Aldrich公司)。样品来源:白屈菜(Chelidonium majus L.)药材来自河北承德, 采购于云天中药材公司, 经大连化物所高级工程师杨小平鉴定为白屈菜全草。对照品来源:实验室制备与核磁鉴定得到N-甲基金罂粟碱[(S)-N-methylstylopine], 纯度为99.81%;二氢黄连碱(dihydrocoptisine), 纯度为98.67%;去甲基白屈菜碱(norchelidonine), 纯度为96.50%。
供试品溶液的制备 白屈菜药材采用高压渗漉柱用70%乙醇提取, 浓缩成浸膏状, 然后用二氯甲烷萃取后浓缩制干得白屈菜总碱。取白屈菜总碱样品10 mg溶于50%乙腈-水1 mL中, 超声5 min, 过0.22 μm膜, 稀释10倍后供试用。
对照品溶液的制备 取N-甲基金罂粟碱、二氢黄连碱、去甲基白屈菜碱各1 mg溶于50%乙腈-水1 mL中, 超声5 min, 过0.22 μm膜, 稀释10倍后作为对照品溶液。
液相色谱条件 色谱柱: XCharge C18柱(5 μm, 4.6 mm×250 mm); 流动相A为乙腈, B为0.1%甲酸水(抽滤过膜); 柱温: 30 ℃; 检测波长: 300 nm; 流速: 0.7 mL·min-1; 进样量: 2 μL; 洗脱条件(0~30 min, 13%~20% A, 30~40 min, 20%~45% A, 40~60 min, 45%~70% A, 60~70 min, 70%~90% A)。
质谱条件 离子源: ESI离子源; 正离子模式; 气帘气: 35 psi (1 psi≈6.9 kPa); Gas 1: 60 psi; Gas 2: 60 psi; 温度: 620 ℃; 离子化压力: 5 500 V, 去簇电压: 80 V; 全扫描范围: m/z 50~1 000;裂解电压: 40 V。CE Spread: 20 V。
数据处理 处理液相色谱数据的软件为岛津LCsolution, 处理质谱一级和二级碎片数据的软件为SCIEX OS软件, 根据得到的质谱碎片数据, 参考相关文献, 推测化合物结构并分类, 归纳化合物质谱裂解规律, 画图软件为Chemdraw。
结果与讨论 1 HPLC-Q-TOF/MS主要色谱峰的分析及鉴定图 1为白屈菜生物碱以300 nm为检测波长的高效液相色谱图, 共检测到21个生物碱化合物。根据归纳的质谱规律和对照品验证对检测到的生物碱类化合物进行定性分析。图 1中各色谱峰的保留时间、光谱信息、二级质谱数据和表征结果见表 1。将以21个生物碱为例对白屈菜中生物碱进行结构鉴定。
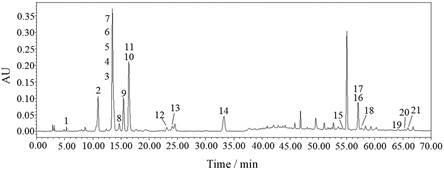
|
Figure 1 Representative base peak chromatograms of Chelidonium majus L. extract (300 nm). Chromatographic peaks 1-21 are identified alkaloids, and several unlabeled peaks are non-alkaloid components. The peak numbers were in accordance with Table 1 |
| Table 1 Qualitative results of Chelidonium majus L. characteristic peak by HPLC-Q-TOF/MS. Twenty-one isoquinoline alkaloids including one aporphine-type alkaloids (No. 1), three protopine-type alkaloids(No. 2, 3, 6), and 12 benzophenanthrine-type alkaloids (No. 4, 5, 7, 12, 13, 15-20) and five protoberberine-type alkaloids (No. 8-11, 14, 21) |
白屈菜中的白屈菜明碱、白屈菜红碱、血根碱等均为苯并菲啶类生物碱, 这类生物碱的质谱裂解规律为: ①为大π共轭系统, 母核一般很难裂解, 仅有一些取代基的丢失; ②如果含有羟基, 则会丢失此羟基或者一分子水形成[M-17]+或[M-18]+的离子碎片[4]; ③如果存在邻二甲氧基, 则会失去1分子甲基后再失去1个氢从而形成亚甲二氧基; ④如果含有亚甲二氧基则会直接丢失1分子CO和2个氢从而形成一个稳定的三元氧环; ⑤如果含有甲氧基, 这个甲氧基会失去1分子甲基后形成羰基, 然后丢失一分子CO形成五元环; ⑥如果苯并菲啶类生物碱的5位或者6位含有甲氧基或者甲基, 则会直接失去这个甲氧基或者甲基从而形成[M-31]+或者[M-15]+的质谱碎片[5]。
1.1.1 六氢苯并菲啶类六氢苯并菲啶类生物碱大多数都含有羟基, 较易丢失羟基或者一分子水形成相应的离子碎片。化合物4, 离子化分子量为m/z 354.135 9 (C20H19NO5), 此化合物碎片m/z 336 [M+H-H2O]+是分子离子失去水分子所致, m/z 323 [M+H-CO-3H]+表示存在亚甲二氧基, 直接丢失一分子CO和2H形成稳定的三元氧环, 通过剩余碎片m/z 305 [M+H-CO-3H-H2O]+和m/z 275 [M+H-CO-3H-H2O-CO-2H]+推测分子中存在两个亚甲二氧基, 参考文献[6], 推断化合物4为白屈菜碱。化合物5, 离子化分子量为m/z 370.168 7 (C21H23NO5), 丢失一分子水后碎片为m/z 352 [M+H-H2O]+, 碎片m/z 336 [M+H-H2O-CH3-H]+可推测此化合物中存在邻二甲氧基, m/z 290 [M+H-H2O-CH3-H-CO-2H]+继续丢失CO和2个氢形成稳定三元氧环, 参考文献[7], 推断化合物5为高白屈菜碱。化合物12, 离子化分子量为m/z 340.125 4 (C19H17NO5), 失去羟基和1个氢后得到m/z 323 [M+H-OH]+和m/z 322 [M+H-OH-H]+的离子碎片, m/z 292 [M+H-OH-H-CO-2H]+是丢失CO和2个氢形成稳定的三元氧环, 综上所述, 推断化合物12为去甲基白屈菜碱。化合物7, 离子化分子量为m/z 370.124 8 (C20H19NO6), m/z 352 [M+H-H2O]+为水分子的掉落, m/z 339 [M+H-CO-3H]+和m/z 291 [M+H-CO-3H-H2O-CO-2H]+为两个亚甲二氧基形成三元氧环, 参考文献[8], 推断化合物7为白屈菜明碱。白屈菜明碱二级质谱图见图 2(a), 质谱裂解途径见图 3。
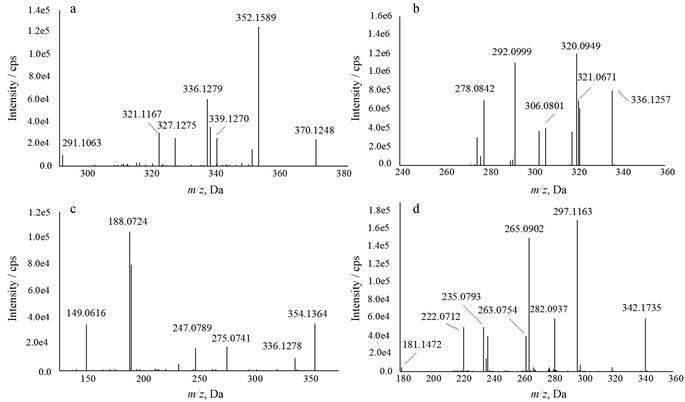
|
Figure 2 Fragment ions (MS/MS) mass spectrum of chelamine (a), berberine (b), protopine (c) and magnoflorine (d) |
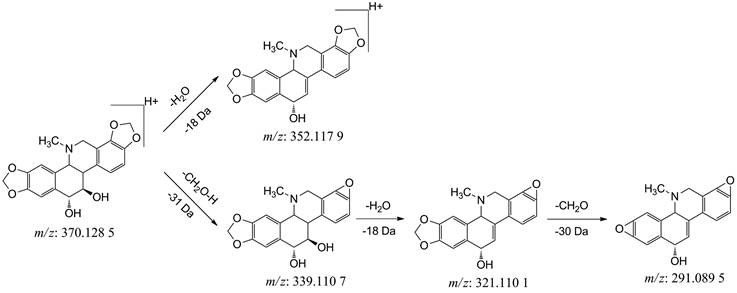
|
Figure 3 The mass cleavage pathway of chelamine |
二氢苯并菲啶类生物碱质谱裂解规律很明显, 会先失去5位或者6位的取代基形成较稳定的相对应的苯并菲啶类生物碱, 然后裂解规律就与相应的苯并菲啶类生物碱相似, 如6位的取代基为氢、甲基、羟基、甲氧基等则会相应的失去这些取代基。
化合物15, 离子化分子量为m/z 380.079 5 (C22H21NO5), 碎片m/z 348 [M+H-CH3O-H]+先失去6号位的甲氧基形成白屈菜红碱, m/z 318 [M+H-CH3O-H-2CH3]+、m/z 290 [M+H-CH3O-H-2CH3-CO]+和m/z 264 [M+H-CH3O-H-2CH3-2CO+2H]+证明了裂解途径和白屈菜红碱相似, 参考文献[9], 推断化合物15为6-甲氧基二氢白屈菜红碱。化合物16, 离子化分子量为m/z 348.086 6 (C20H13NO5), 离子碎片m/z 333 [M+H-CH3]+是丢失5号位的甲基形成, m/z 320 [M+H-CO]+、m/z 319 [M+H-CO-H]+、m/z 305 [M+H-CO-CH3]+和m/z 275 [M+H-2CO-CH3-2H]+碎片裂解途径与血根碱一致, 参考文献[10], 推断化合物16为氧化血根碱。化合物17, 离子化分子量为m/z 348.127 3 (C21H18NO4+), 离子碎片显示有两种裂解途径, 一条为离子碎片m/z 333 [M+H-CH3]+、m/z 332 [M+H-CH3-H]+、m/z 302 [M+H-CH3-H-CH2O]+邻二甲氧基丢失一个甲基后形成亚甲二氧基, 继续丢失一分子CO后形成稳定的三元氧环, 另一条为m/z 318 [M+H-2CH3]+、m/z 290 [M+H-2CH3-CO]+、m/z 260 [M+H-2CH3-CO-CH2O]+, 邻二甲氧基丢失两个甲基后形成两个羰基, 继续失去一个羰基后形成五元环, 参考文献[11], 推测化合物17为白屈菜红碱。化合物18, 离子化分子量为m/z 364.117 9 (C21H17NO5), 失去5号位的甲基形成碎片离子m/z 349 [M+H-CH3]+, 也会丢失6号位的甲氧基形成碎片m/z 332 [M+H-CH3O-H]+, 碎片m/z 304 [M+H-CH3O-H-CO]+表明有亚甲二氧基形成了三元氧环, 参考文献[12], 推断化合物18为6-甲氧基二氢血根碱。化合物19, 离子化分子量为m/z 350.138 7 (C21H19NO4), 碎片离子m/z 335 [M+H-CH3]+和m/z 334 [M+H-CH3-H]+为化合物丢失甲基形成, 碎片m/z 319 [M+H-H-2CH3]+和m/z 290 [M+H-H-2CH3-CO]+可以看出裂解与白屈菜红碱相似, 参考文献[4], 推测化合物19为二氢白屈菜红碱。化合物20, 离子化分子量为m/z 334.109 5 (C20H15NO4), 离子碎片m/z 318 [M+H-H-CH3]+, m/z 304 [M+H-H-CO]+, m/z 276 [M+H-H-2CO]+为丢失一个甲基和形成两个稳定的三元氧环, 参考文献[4], 推测化合物20为二氢血根碱。
1.1.3 苯并菲啶季铵类苯并菲啶季铵碱自带一个电子, 在质谱分析中本身就呈离子化出现。化合物13, 离子化分子量为m/z 332.095 5 (C20H14NO4+), m/z 317 [M-CH3]+是分子离子失去氮甲基形成, m/z 304 [M-CO]+和m/z 274 [M-2CO]+总共失去两分子CO, 推测分子中存在两个亚甲二氧基, 参考文献[13], 推断化合物13为血根碱。
1.2 原小檗碱类生物碱小檗碱、黄连碱、紫堇沙明碱等属于原小檗碱类生物碱, 这类生物碱的质谱裂解规律与苯并菲啶类生物碱相似, 不同的是: ①如果C-3或C-13位含有羟基, 母核会直接失去1分子的H2O从而形成[M-18]+的碎片; ②由于C-5, 6位碳碳单键的存在, 使母核很容易失去2个氢而形成稳定的大π共轭系统; ③裂解形成三元氧环后还可以继续丢失一分子CO发生分子重排, 母核会形成一个五元环; ④有些原小檗碱会发生RDA裂解与α裂解, 如四氢小檗碱[14-17]。
化合物8, 离子化分子量为m/z 338.141 0 (C20H20NO4+), 产生了丰度较大的碎片m/z 190 [M-C9H9O2]+和m/z 149 [M-C11H12NO2]+, 表明化合物发生了RDA和α裂解, 综上所述, 推断化合物8为N-甲基金罂粟碱。化合物10, 离子化分子量为m/z 320.093 9 (C19H14NO4+), 母核失去两个氢形成稳定的大π离子碎片m/z 318 [M-2H]+, 碎片m/z 292 [M-CO]+和m/z 262 [M-CO-2H-CO]+可以推测为亚甲二氧基形成三元环后又丢失一分子CO形成稳定的五元环, 参考文献[11], 推断化合物10为黄连碱。化合物11, 离子化分子量为m/z 322.119 1 (C19H16NO4+), 碎片m/z 294 [M-CO]+和m/z 264 [M-CO-2H-CO]+表明有两个亚甲二氧基存在, 结合分子量和元素组成分析, 推测化合物11为二氢黄连碱。化合物9, 离子化分子量为m/z 324.125 4 (C19H17NO4), 裂解途径比较特别, 碎片m/z 176 [M+H-C9H8O2]+和m/z 149 [M+H-NC10H9O2]+可以看出化合物发生了丰度较大的碎片裂解, 可能发生RDA裂解与α裂解, 结合参考文献[18], 推断化合物9为四氢黄连碱。化合物14, 离子化分子量为m/z 336.123 0 (C20H18NO4+), 碎片m/z 320 [M-CH3-H]+为邻甲氧基形成亚甲二氧基, 碎片m/z 306 [M-2CH3]+或m/z 306 [M-CH2O]+表明有两种裂解途径, 失去两个甲基形成两个羰基或者亚甲二氧基, 形成稳定的三元氧环, 碎片m/z 278 [M-CH2O-CO]+为三元氧环失去一分子CO发生分子重排形成五元环, 参考文献[15], 推测化合物14为小檗碱。化合物21, 离子化分子量为m/z 334.109 5 (C20H16NO4+), 碎片m/z 319 [M-CH3]+为丢失一分子甲基, m/z 304 [M-CH2O]+为形成三元氧环, 结合参考文献[3], 推测化合物21为紫堇沙明碱。小檗碱二级质谱图见图 2(b), 质谱裂解途径见图 4。
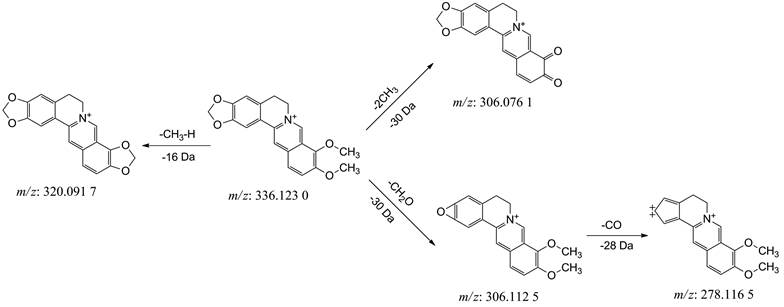
|
Figure 4 The mass cleavage pathway of berberine |
普罗托品类生物碱质谱裂解有如下规律: ①普罗托品类生物碱母核大多是含有羰基的十元环, 该环一般会丢失羰基和一个氢形成两个六元环; ②普罗托品类生物碱没有大π共轭体系, 母核易断裂发生RDA和α裂解, 裂解后的碎片会继续失去一些取代基碎片, 如丢失羟基或水分子形成[M-17]+或者[M-18]+的碎片峰[19, 20]。
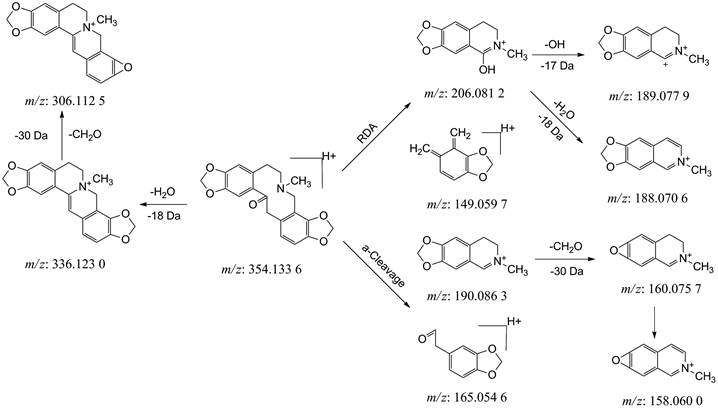
化合物2, 离子化分子量为m/z 354.133 6 (C20H19NO5), 碎片m/z 336 [M+H-H2O]+和m/z 306 [M+H-H2O-CO-2H]+是化合物丢失羰基后形成六元环, 然后亚甲二氧基继续形成三元氧环, 碎片m/z 206 [M+H-C9H8O2]+和m/z 149 [M+H-NC11H12O3]+丰度较大, 为发生了RDA裂解, 碎片m/z 165 [M+H-NC11H13O2]+为发生了α裂解, 碎片m/z 189 [M+H-C9H8O2-OH]+、m/z 188 [M+H-C9H8O2-H2O]+、m/z 160 [M+H-C9H8O3-CO-2H]+为RDA和α裂解后碎片丢失羰基、水分子和形成三元氧环, 参考文献[17], 推断化合物2为原阿片碱。化合物3, 离子化分子量为m/z 370.164 9 (C21H23NO5), 碎片m/z 352 [M+H-H2O]+和m/z 336 [M+H-H2O-CH3-H]+为化合物丢失羰基后又丢失CH4形成亚甲二氧基, 碎片m/z 206 [M+H-C9H8O3]+和m/z 165 [M+H-NC12H15O2]+是发生了RDA和α裂解, 碎片m/z 190 [M+H-C9H8O3-CH3-H]+为RDA裂解后碎片又丢失CH4形成亚甲二氧基, 参考文献[17], 推断化合物3为别隐品碱。化合物6, 离子化分子量为m/z 370.168 9 (C21H23NO5), 碎片有m/z 340 [M+H-CO-2H]+、m/z 339 [M+H-CO-2H-H]+、m/z 290 [M+H-CO-2H-H-CH2O-H2O-CH3-H]+, 结合文献[21], 推断化合物6为隐品碱。原阿片碱二级质谱图见图 2(c), 质谱裂解途径见图 5。
|
Figure 5 The mass cleavage pathway of protopine |
木兰花碱、紫堇碱、蝙蝠葛碱为阿朴菲类生物碱, 这一类生物碱的质谱裂解规律是如果有氮甲基存在, 这一类生物碱会失去(CH3)2NH或者CH3NH2, 只有侧链的断裂与重组, 不会形成丰度较大的碎片离子。
化合物1, 离子化分子量为m/z 342.173 5 (C20H24NO4+), 离子碎片m/z 297 [M+H-NC2H7]+侧链断裂后有两种裂解途径, 一种为碎片m/z 265 [M+H-NC2H7-CH3-OH]+、m/z 237 [M+H-NC2H7-CH3-OH-CO]+、m/z 209 [M+H-NC2H7-CH3-OH-CO-C2H4]+显示的羟基与甲氧基形成稳定的三元氧环, 又继续丢失一分子CO形成母核的五元环, 随后侧链断裂; 另一种为离子碎片m/z 181 [M+H-NC2H7-CH3-OH-2CO-C2H4]+显示的甲氧基丢失甲基后形成羰基, 羰基继续丢失一分子CO形成母核五元环, 两个羟基丢失一分子水形成五元氧环, 五元氧环断裂又形成一个羰基, 随后侧链断裂, 综上所述, 参考文献[12], 推断化合物1为木兰花碱。木兰花碱二级质谱图见图 2(d), 质谱裂解途径见图 6。

|
Figure 6 The mass cleavage pathway of magnoflorine |
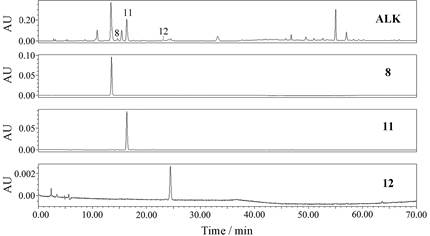
以N-甲基金罂粟碱(峰8)、二氢黄连碱(峰11)和去甲基白屈菜碱(峰12)等3个白屈菜中的化合物为例, 对其进行分离纯化和结构鉴定, 验证上节中定性结果的准确性。通过对比保留时间追踪目标化合物的方法从白屈菜三维馏分中成功得到3个单体化合物, 经冷冻干燥浓缩成粉末。从图 7可以看出, 制备获得的生物碱与峰8、11和12的保留时间一致, 即为目标化合物, 而且其色谱纯度均大于95%。液相分析结果见图 7。
|
Figure 7 HPLC analysis of Chelidonium majus L. total alkaloids extract (ALK) and three alkaloids of (S)-N-methylstylopine (8), dihydrocoptisine (11) and norchelidonine (12) |
色谱峰8, 黄褐色粉末, [M]+: 338.141 0, 计算所得分子式C20H20NO4+, 338.138 7, 误差为6.80×10-6。1H NMR (600 MHz, DMSO-d6): δH 7.10 (s, 1H), 7.01 (d, J= 8.0 Hz, 1H), 6.92~6.86 (m, 2H), 6.14 (s, 1H), 6.10 (s, 1H), 6.06 (d, J = 9.6 Hz, 2H), 5.12 (d, J = 9.0 Hz, 1H), 3.86 (s, 1H), 3.27 (s, 1H), 3.09 (d, J = 17.6 Hz, 1H), 2.95 (dd, J = 17.6, 12.5 Hz, 1H), 2.86 (s, 3H)。13C NMR (150 MHz, DMSO-d6): δC 106.3 (d, C-1), 124.3 (s, C-1a), 147.5 (s, C-2), 144.3 (s, C-3), 108.9 (d, C-4), 123.4 (s, C-4a), 23.6(t, C-5), 59.8 (t, C-6), 60.7 (t, C-8), 109.5 (s, C-8a), 147.8 (s, C-9), 146.3 (s, C-10), 109.1 (d, C-11), 122.3 (d, C-12), 124.7 (s, C-12a), 28.4 (t, C-13), 65.8 (d, C-13a), 102.0 (t, -OCH2O), 102.4 (t, -OCH2O), 39.3 (q, -N-CH3)。以上数据与文献[22]对比一致, 确定化合物8为N-甲基金罂粟碱[(S)-N-methylstylopine)]。
色谱峰11, 褐色粉末, [M]+: 322.119 1, 计算所得分子式C19H16NO4+, 322.117 4, 误差为5.28×10-6。13C NMR (150 MHz, DMSO-d6): δC 104.0 (d, C-1), 124.5 (s, C-1a), 145.2 (s, C-2), 142.7 (s, C-3), 108.4 (d, C-4), 129.8 (s, C-4a), 29.4 (t, C-5), 48.7 (t, C-6), 48.6 (t, C-8), 109.9 (s, C-8a), 147.5 (s, C-9), 146.9 (s, C-10), 107.6 (d, C-11), 116.2 (d, C-12), 129.1 (s, C-12a), 96.9 (d, C-13), 141.4 (s, C-13a), 101.3 (t, -OCH2O), 101.5 (t, -OCH2O)。以上数据与文献[23]对比一致, 确定化合物11为二氢黄连碱(dihydrocoptisine)。
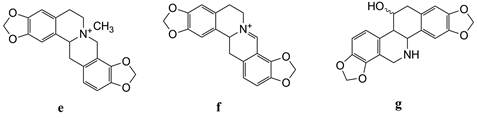
色谱峰12, 淡黄色粉末, [M+H]+: 340.125 4, 计算所得分子式C19H17NO5, 339.127 9, 误差为-7.35×10-6。13C NMR (150 MHz, DMSO-d6): δC 146.0 (s, C-1), 118.8 (s, C-1a), 147.2 (s, C-2), 110.0 (d, C-3), 121.8 (d, C-4), 127.6 (s, C-4a), 39.4 (d, C-5), 55.0 (d, C-6), 43.5 (t, C-8), 71.6 (d, C-9), 38.7 (t, C-10), 130.3 (s, C-10a), 107.2 (d, C-11), 143.1 (s, C-12), 144.9 (s, C-13), 109.2 (d, C-14), 132.0 (s, C-14a), 101.1 (t, -OCH2O), 101.3 (t, -OCH2O)。以上数据与文献[24]对比一致, 确定化合物12为去甲基白屈菜碱(norchelidonine)。上述3个生物碱化学结构见图 8, 与上节中鉴定结果完全相同(表 1)。
|
Figure 8 Three alkaloids chemical structures of (S)-N-methylstylopine (e), dihydrocoptisine (f) and norchelidonine (g) |
本实验通过HPLC-Q-TOF/MS技术对白屈菜中的生物碱进行分析鉴定, 通过对照品的裂解规律和文献核对, 推断出21个生物碱, 其中N-甲基金罂粟碱为白屈菜中首次发现报道, 二氢黄连碱和去甲基白屈菜碱为首次在白屈菜中用该方法鉴定。该方法具有快速、准确、高效等特点, 可以同时得到化合物的保留时间、紫外光谱、相对分子质量及特征结构碎片等丰富的信息, 可以在缺乏对照品确认的情况下快速、准确地指认化学成分, 对天然产物复杂体系中成分的初步定性研究, 以及对生物碱分离纯化工作具有重要意义。
| [1] |
Yuan L. Research progress of comprehensive research in celandine[J]. J Anhui Agric Sci (安徽农业科学), 2015, 43: 15-17, 34. |
| [2] |
Zou X, Wang YM, Wang JQ, et al. Research progress on pharmacological activities of chelidonine[J]. Drugs Clin (现代药物与临床), 2014, 29: 1326-1330. |
| [3] |
Gu Y, Qian DW, Duan JA, et al. Establishment the UPLC specific chromatogram of Chelidonium majus L. and its alkaloids compositions analysis by Q-TOF/MS[J]. Chin J Pharm Anal (药物分析杂志), 2010, 30: 780-786. |
| [4] |
Yang Z, Qing ZX, Xiang F, et al. Identification of isoquinoline alkaloids in Eomecon chionathe by HPLC-Q-TOF/MS[J]. Chin Tradit Pat Med (中成药), 2017, 39: 1439-1443. |
| [5] |
Yu K, Zuo Z, Qin ZX, et al. Identification of alkaloids in Macleaya cordata stems based on mass fragmentation rules of isoquinoline alkaloids[J]. Mod Chin Med (中国现代中药), 2016, 18: 296-302. |
| [6] |
Zhou Q, Liu Y, Wang X, et al. A sensitive and selective liquid chromatography-tandem mass spectrometry method for simultaneous determination of five isoquinoline alkaloids from Chelidonium majus L. in rat plasma and its application to a pharmacokinetic study[J]. J Mass Spectrom, 2013, 48: 111-118. DOI:10.1002/jms.3133 |
| [7] |
Fleming M, Mcmanus H, Rudolph A, et al. Concise enantioselective total syntheses of (+)-homochelidonine, (+)-chelamidine, (+)-chelidonine, (+)-chelamine and (+)-norchelidonine by a PdII-catalyzed ring-opening strategy[J]. Chemistry, 2008, 14: 2112-2124. DOI:10.1002/chem.200701775 |
| [8] |
Yang P, Qin ZX, Zuo Z, et al. Identification of isoquinoline alkaloids in Chelidonium majus by HPLC-Q-TOF/MS[J]. Mod Chin Med (中国现代中药), 2017, 19: 174-182. |
| [9] |
Xiao HJ. Study on the Chemical Constituents and Their Bioactivities from Macleaya cordata (博落回化学成分及其生物活性研究)[D]. Tianjin: Tianjin Medical University, 2013.
|
| [10] |
Qing ZX, Cheng P, Liu XB, et al. Structural speculation and identification of alkaloids in Macleaya cordata fruits by high-performance liquid chromatography/quadrupole-time-of-flight mass spectrometry combined with a screening procedure[J]. Rapid Commun Mass Spectrom, 2014, 28: 1033-1044. DOI:10.1002/rcm.6874 |
| [11] |
Qin ZX, Cheng P, Zeng JG, et al. Research progress on mass spectral fragmentation behaviour of alkaloids in Macleaya cordata[J]. Chin Tradit Herb Drugs (中草药), 2013, 44: 2929-2939. |
| [12] |
Cai M, Zhou Y, Wang X, et al. Rapid structural characterization of isomeric benzo[c]phenanthridine alkaloids from the roots of Zanthoxylum nitidium by liquid chromatography combined with electrospray ionization tandem mass spectrometry[J]. Rapid Commun Mass Spectrom, 2007, 21: 1931-1936.
|
| [13] |
Hoellinger H, Re M, Deroussent A, et al. Quantitative liquid chromatographic determination of sanguinarine in cell culture medium and in rat urine and plasma[J]. J Chromatogr B, 2004, 799: 195-200. DOI:10.1016/j.jchromb.2003.10.023 |
| [14] |
Wang D, Liu Z, Guo M, et al. Structural elucidation and identification of alkaloids in Rhizoma Coptidis by electrospray ionization tandem mass spectrometry[J]. J Mass Spectrom, 2004, 39: 1356-1365. DOI:10.1002/jms.727 |
| [15] |
Ma C, Fan M, Tang Y, et al. Identification of major alkaloids and steroidal saponins in rat serum by HPLC-diode array detection-MS/MS following oral administration of Huangbai-Zhimu herb-pair Extract[J]. Biomed Chromatogr, 2008, 22: 835-850. DOI:10.1002/bmc.1000 |
| [16] |
Ding B, Zhou T, Fan G, et al. Qualitative and quantitative determination of ten alkaloids in traditional Chinese medicine Corydalis yanhusuo W.T. Wang by LC-MS/MS and LC-DAD[J]. J Pharm Biomed Anal, 2007, 45: 219-226. DOI:10.1016/j.jpba.2007.06.009 |
| [17] |
Jeong EK, Lee SY, Yu SM, et al. Identification of structurally diverse alkaloids in Corydalis species by liquid chromatography/electrospray ionization tandem mass spectrometry[J]. Rapid Commun Mass Spectrom, 2012, 26: 1661-1674. DOI:10.1002/rcm.6272 |
| [18] |
Wang HS, Yang HR. Studies on alkaloids of Corydalis dasypterm Maxim[J]. Nat Prod Res Devel (天然产物研究与开发), 1997, 9: 37-39. |
| [19] |
Liu Q, Zhou B, Wang X, et al. Establishment of a search library about benzylisoquinoline alkaloids based on selective separation on the binaphthyl column and standard analysis on C18 column[J]. J Sep Sci, 2012, 35: 3317-3325. DOI:10.1002/jssc.201200605 |
| [20] |
Shi J, Zhang X, Ma Z, et al. Characterization of aromatase binding agents from the dichloromethane extract of Corydalis yanhusuo using ultrafiltration and liquid chromatography tandem mass spectrometry[J]. Molecules, 2010, 15: 3556-3566. DOI:10.3390/molecules15053556 |
| [21] |
Li YW, Fang QC, et al. Isoquinoline alkaloids in Corydalis esquirolii[J]. Chin Tradit Herb Drugs (中草药), 1991, 22: 486-488. |
| [22] |
Azimova SS, Yunusov MS. Natural Compounds Alkaloids[M]. New York: Springer, 2013: 423.
|
| [23] |
Paulsen J, Yahyazadeh M, Hä nsel S, et al. 13, 14-Dihydrocoptisine-the genuine alkaloid from Chelidonium majus[J]. Phytochemistry, 2015, 111: 149-153. DOI:10.1016/j.phytochem.2015.01.006 |
| [24] |
Daskalova E, Iskrenova E, Kiryakov HG, et al. Minor alkaloids of Glaucium flavum[J]. Phytochemistry, 1988, 27: 953-955. DOI:10.1016/0031-9422(88)84134-7 |
 2020, Vol. 55
2020, Vol. 55


