清咽片是由桔梗、柯子(去核)、硼砂、北寒水石、青黛、薄荷脑、冰片、甘草(或甘草霜) 8味中药材和微晶纤维素、硬脂酸镁2种辅料制成的片剂, 具有利咽开音、清凉解热、敛肺止咳、生津止渴等功效, 主要用于咽喉肿痛、声嘶音哑、咽下不利、口舌干燥[1]。目前清咽片混合工艺缺乏合适的质量监测与控制技术, 混合时间仍然依赖人工经验和传统分析手段确定, 然而考虑到原料药材质量差异、工艺波动等诸多因素对混合终点的影响, 采用传统混合方式往往会造成最终产品质量的不稳定[2, 3]。因此借助快速高效的过程分析技术(process analytical technology, PAT)对中药制药混合工艺进行实时监测, 使其成为状态可视、参数可调的柔性工艺, 对于提升产品批次一致性具有重要意义[4]。
近红外(near infrared, NIR)光谱技术作为PAT体系中的一项成熟技术, 因其快速无损、环境友好等特点, 已经被成功应用于众多领域[5-7]。近年来, 关于将NIR光谱技术应用于制药混合工艺质量控制的相关研究报道越来越多。Kuang等[8]以复方丹参片混合过程中的微量冰片为研究对象, 在不同混合位点均匀取样, 采集近红外光谱并计算光谱阀值及欧氏距离, 将其与气相色谱检测出的冰片含量信息对比分析, 建立了一种快速判定复方丹参片生产过程中冰片混合均匀度的新方法。Shikhar等[9]对对乙酰氨基酚和3种辅料的混合终点展开研究, 利用Instron通用测试系统, 建立了包括密度变化的小试规模偏最小二乘回归(partial least squares regression, PLSR)模型和传统混料罐规模模型, 模型预测准确性以紫外可见光谱法测得的含量进行验证, 研究开发出了一种包含密度效应的稳健性更好的模型用于终点判断。然而, 有关粉体粒径差异对混合过程终点影响的研究极少, 实际上, 粉体的剪切力和凝聚力会因粒径差异而发生变化, 进而对混合过程产生影响[10]。为消除粒度差异对混合过程的影响, 常采用多元散射校正(multiplicative scatter correction, MSC)和标准正则(standard normal variate, SNV)变换等光谱预处理方法进行处理, 这些方法虽然能在一定程度上消除颗粒分布不均匀及颗粒大小差异产生的散射影响, 但是粒度效应带来的影响依然存在。所以, 在建模过程中设法将粒度变量包含在训练集之中, 对于减少粒径效应的影响是非常必要的。
本文简化模拟了清咽片混合工艺过程, 设计出5个不同批次混合物, 通过改变桔梗、柯子、硼砂、寒水石4种中药材的粒径, 将粒径变量设计在训练集样品之中, 采集各批次样品完全混匀后的NIR光谱, 经过预处理方法和特征波长筛选后, 利用PLSR方法建立定量模型, 结合移动块标准偏差(moving block standard deviation, MBSD)法对另外3批粒径大小存在差异的样品分别进行混合终点定性定量判别, 实现了清咽片中多种原辅料混合终点的实时监测, 并研究了粒度效应对混合过程的影响。
材料与方法实验仪器与材料 Antaris II傅立叶变换近红外光谱仪(Thermo Fisher, USA), 仪器配有积分球漫反射检测器、TQ Analyst 8.0数据处理软件; AL204型万分之一电子天平(Mettler Toledo, SE); FW135中草药粉碎机(天津市泰斯特仪器有限公司); 桔梗(批号: 1050Z1812005)、柯子(批号: 1052Z1812004)、硼砂(批号: 1057Z1809003-01)、北寒水石(批号: 1051Z1809003-01)药材购自亳州药材市场; 微晶纤维素(郑州保佰德生物科技有限公司)、硬脂酸镁(天津市风船化学试剂科技有限公司)。
建模样品的制备 将桔梗、柯子、硼砂、寒水石4种药材分别投入粉碎机中进行粉碎, 粉碎完毕后用3号~9号标准药筛(符合2015版药典标准)按粒径大小分类。第一批次:总重量50 g, 4种药材粒径大小位于0.25~0.355 mm (50~65目)之间; 第二批次:总重量80 g, 4种药材粒径大小位于0.18~0.25 mm (65~80目)之间; 第三批次:总重量100 g, 4种药材粒径大小位于0.15~0.18 mm (80~100目)之间; 第四批次:总重量200 g, 4种药材粒径大小位于0.125~0.15 mm (100~120目)之间; 第五批次:总重量100 g, 桔梗和柯子粒径 > 0.25 mm (65目), 寒水石和硼砂粒径 < 0.075 mm (200目)。如表 1所示。因为在实际生产过程中, 混合机的大小和旋转角度会对不同层位粉体的密度产生影响, 较大尺寸的混合机增加了光谱采集位点上方粉末的密度, 这种密度变化往往伴随着吸光度偏高的NIR光谱, 从而对模型稳健性产生影响, 所以实验中设计出5种不同重量的样品用于建模, 以消除密度变化对模型性能的影响[11, 12]。另外, 因硬脂酸镁在实际处方中用量极少, 并且其用量对粉体流动性会产生直接影响, 所以在不同批次样品中硬脂酸镁的重量百分比统一设置为0.6。
| Table 1 Details of the eight batches of samples |
近红外光谱采集 依次将5个批次样品置于底部厚度均一的样品杯中, 混合30 min, 每分钟匀速倒置5次, 待混合过程进入最后10 min阶段时, 每混合1 min即采集样品杯底部5个不同位置的近红外光谱。近红外光谱仪以积分球漫反射模式扫描混合物的吸光度, 以空气作为背景, 扫描范围4 000~12 000 cm-1, 分辨率8 cm-1, 增益4 cm-1, 扫描次数为64次, 室温20~25 ℃, 湿度25%~40%。每个位点重复采集3次光谱, 经过处理后得到其平均光谱, 5批样品共采集250张平均光谱用于建模。
样本集的划分 采用随机抽样法将采集到的总共250张平均光谱划分为训练集和验证集, 其中训练集光谱200张, 验证集光谱50张。这种划分方式不受任何主观因素及其他系统因素的影响, 有利于NIR校正模型的建立。
数据处理方法和模型性能评价指标 利用PLSR方法建立桔梗、柯子、硼砂、寒水石和微晶纤维素5种原辅料含量百分比和光谱信息之间的定量模型。建模时经过光谱预处理方法和波段筛选后使模型性能最佳。以校正误差均方根(root mean square error of calibration, RMSEC)、预测误差均方根(root mean square error of prediction, RMSEP)、校正集相关系数(Rc)以及验证集相关系数(Rv)为模型性能评价指标。当RMSEC和RMSEP值越小且相关系数越接近于1时, 模型稳健性更好预测准确度更高[13]。
结果 1 光谱预处理方法选择在建模过程中, 光谱的预处理是非常关键的一步。采用合理的预处理方法可以将光谱中的噪声信息有效过滤, 保留有效信息, 进而降低模型复杂度, 提高模型的稳健性[14, 15]。本研究对桔梗等5种原辅料分别建立定量模型, 比较原始光谱和经不同预处理方法处理后的模型性能, 考察了MSC、SNV、Savitzky-Golay卷积平滑、一阶导数(first derivative, 1stD)和二阶导数(second derivative, 2ndD)对模型性能的影响, 结果如表 2~6所示, 采用SNV方法进行预处理可使模型性能最佳, 原始光谱和经预处理之后的光谱如图 1所示。
| Table 2 Partial least squares regression (PLSR) model performance parameters after different pretreatment methods for Platycodonis Radix. PCs: Number of principal components; RMSEC: Root mean square error of calibration; RMSEP: Root mean square error of prediction; MSC: Multiplicative scatter correction; SNV: Standard normal variate; Rc: Related coefficient of calibration set; Rv: Related coefficient of validation set |
| Table 3 PLSR model performance parameters after different pretreatment methods for Fructus Chebulae |
| Table 4 PLSR model performance parameters after different pretreatment methods for Borax |
| Table 5 PLSR model performance parameters after different pretreatment methods for Hanshuishi |
| Table 6 PLSR model performance parameters after different pretreatment methods for microcrystalline cellulose |
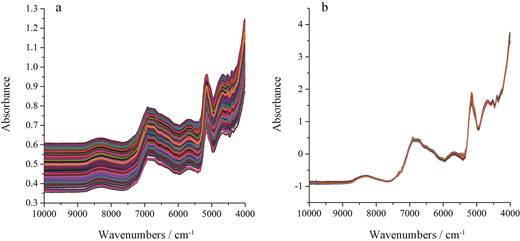
|
Figure 1 The raw near-infrared spectra of five batches of samples (a) and the near-infrared spectra of five batches of samples after standard normal variate (b) |
研究中采用全波长PLSR、无信息变量消除-偏最小二乘回归(uninformative variable elimination-partial least squares regression, UVE-PLSR)、竞争性自适应权重取样-偏最小二乘回归(competitive adaptive weighted resampling method-partial least squares regression, CARS-PLSR) 3种方法建立定量模型。其中UVE-PLSR方法是先利用UVE法进行波长筛选, 该方法是将回归系数作为波长重要性的衡量指标, 将一定数量的随机变量矩阵加入光谱矩阵中, 然后通过蒙特卡洛交互验证建立模型, 根据计算得到的PLSR回归系数平均值与标准偏差的比值进行波长筛选, 然后利用筛选后的波段建模[16, 17]。设置蒙特卡洛采样数为100次, 经过筛选, 选取回归系数较大的前100个变量作为建模波长点。CARS也是一种基于回归系数进行波长选择的方法, 该法模仿达尔文进化论中的“适者生存”原则, 将光谱中每一个波长点看作一个个体, 每次利用自适应加权抽样技术筛选模型中回归系数较大的波长点, 通过交叉验证选出模型中交叉验证误差均方根(root mean square errors of cross-validation, RMSECV)最小的子集作为最优波长组合[18]。本实验采用CARS方法进行波段筛选后, 一共选出了93个波长点用于建模。利用3种方法所建模型的性能参数如表 7所示, 进行波段筛选后, 模型复杂度虽然降低, 但是模型性能却不及全波段模型。因为中药体系极其复杂, 含氢基团化合物种类众多, 采用波段筛选可能造成有效信息的流失最终使模型性能降低, 所以实验最终还是选择光谱全波段进行建模。
| Table 7 The modeling results using different variables selection methods. UVE: Uninformative variable elimination; CARS: Competitive adaptive weighted resampling method |
将建立好的PLSR模型应用于3批混合物(第6~8)的终点判断。如表 1所示, 除粒径差异外3批样品中原辅料含量百分比和总质量完全相同。每批样品混合30 min, 每混合1 min即采集样品杯底部5个点的NIR光谱, 根据采集到的光谱信息利用模型预测5种原辅料的含量百分比, 最终生成整个混合阶段的含量百分比趋势图, 如图 2所示。根据趋势图可以准确判断5种原辅料的混合终点, 为了确定模型预测值之间是否存在显著差异, 根据每种物料混合过程最后10 min的预测值生成95%置信区间, 具体信息可见表 8。
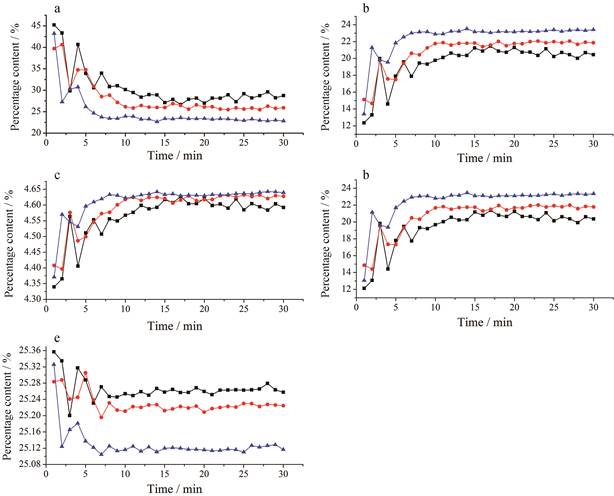
|
Figure 2 PLSR model predictions of Platycodonis Radix (a), Fructus Chebulae (b), Borax (c), Hanshuishi (d) and Microcrystalline cellulose (e) during the blending process. Black represents the batch 6, red represents the batch 7, and blue represents the batch 8 |
| Table 8 The model predictions of three batches blends |
实验中除使用PLSR定量判别混合终点外, 还运用MBSD方法对混合终点进行定性判别, 这种方法是通过计算特定窗口内的连续光谱在不同波长点处吸光度的标准差来比较光谱之间的差异, 通过窗口的移动来表征整个过程中光谱间差异变化趋势, 当标准差低于某一阀值并趋于稳定时可以认为混合均匀[19]。本实验中窗口大小设置为5, 实验结果如图 3所示, 3批样品在第6 min之后混合均匀。为验证MBSD方法分析结果的准确性, 实验中还计算了3批样品NIR光谱的Hotelling's T2统计量值, 该值是将提取出的所有主成分的归一化得分累加得到的, 主要反应采样点偏离模型中心的距离, 如图 4所示。在大约5~6 min之后, Hotelling's T2值低于95%统计限并趋于稳定, 与MBSD预测结果基本一致。从图 3可以看出, 混合过程大致分为3个阶段:第1阶段属于混合初期, 光谱间差异巨大, 但随着混合时间的延长这种差异逐渐减小; 第2阶段属于混合均匀时期, 光谱间差异波动较小并趋于稳定; 第3阶段属于反混合时期, 在这个时期中光谱间差异波动变大, 可能是由于寒水石和硼砂的密度与另外3种物料相比差异悬殊, 在混合后期物料分层最终造成“脱混”现象的发生。
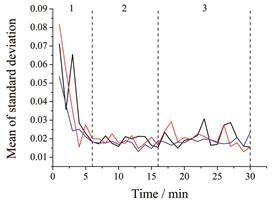
|
Figure 3 The moving block standard deviation (MBSD) trends of the three batches blends |
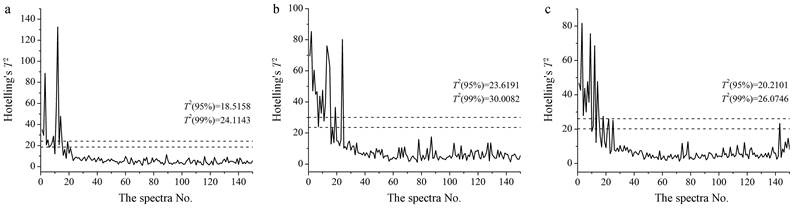
|
Figure 4 Hotelling's T2 values of the near-infrared spectra collected from the three batches of samples (a: Batch 6; b: Batch 7; c: Batch 8) |
本实验分别采用PLSR和MBSD两种方法, 对简化模拟后的清咽片混合过程终点进行判断, 同时, 探究粒径差异对混合终点的影响。根据定量模型预测结果, 粉体粒径最小的第8批次混合物(0.125~0.15 mm)混匀所需时间最短, 粒径较大的两个批次其混合终点相对滞后。探究其原因, 可能是因较小颗粒多数呈球形从而增大了粉体流动性, 相反, 较大颗粒形状多不规则, 颗粒间接触面增大, 由于中药材较为粗糙的表面进而在增大了摩擦力的同时降低了粉体流动性。另外, 研究还发现第8批次样品模型预测准确度最高。因为在混合过程中, 粉体处于一个流动过程, 粉体粒径越大, 颗粒间的间隙会越大, 从而增大了NIR光散射效应对模型预测的影响, 最终造成较大的预测偏差。由此可见, 粒度效应不仅会对混合终点产生影响, 还会通过改变粉体自身的物理特性使NIR光谱信号强度产生偏差, 进而降低模型对混合物整体均匀度的预测能力。
目前, MBSD方法是混合终点判断研究中使用最为频繁的一种定性判别方法, 这种方法无需复杂的建模流程, 使用起来方便快捷, 但它却存在一定的局限性。只有当混合体系中组分之间光谱差异较大时, MBSD方法才能对整体光谱的差异变化进行准确表征。然而, 在中药体系中植物药的NIR光谱往往非常相似, 图 5展示的是本实验中4种中药材的NIR光谱, 可以发现, 桔梗和柯子的光谱差异相比寒水石和硼砂2种矿物药是很小的, 这就导致在本实验中MBSD方法预测准确度不及PLSR方法。所以在混合过程终点判断研究中, 方法的选择应该是灵活多变的, 应该根据具体的混合体系选择最为合适的方法。
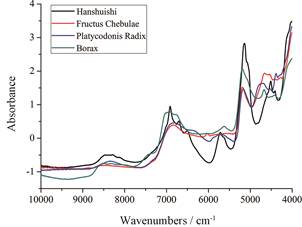
|
Figure 5 The near-infrared spectra of four kinds of traditional Chinese medicines |
在制药生产过程中, 应充分考虑粒度效应对混合工艺的影响, 在混合开始之前即筛选出最佳粉体粒径进而减少粒度效应的干扰, 并利用NIR光谱技术等快速分析技术实现对混合过程的实时监测。混合过程是极其重要的一环, 缺乏混合均匀度会对下游工艺产生影响, 并影响中间体和最终产品的质量, 所以对混合工艺的相关研究应该得到充分重视。
| [1] |
Ma XJ, Su HL. Quality control of Qingyan tablets[J]. Drug Eva Res (药物评价研究), 2013, 36: 190-192. |
| [2] |
Chinese Pharmacopoeia Commission. Pharmacopoeia of People's Republic of China (中华人民共和国药典) [S]. Vol1. 2015 ed. Beijing: China Medical Science Press, 2015: 1547-1548.
|
| [3] |
Wang XL, Jia JZ, Yang X, et al. Rapid determination of ibuprofen sustained-release capsule releasing rate using near infrared transmission spectroscopy technology[J]. Chin J Pharm Anal (药物分析杂志), 2012, 32: 1898-1902. |
| [4] |
FDA. Guidance for Industry, PAT-A Frame-work for Innovative Pharmaceutical Development, Manufacturing, and Quality Assurance. Pharmaceutical CGMPs, FDA, 2004 [2019-12-15].https://www.fda.gov/regulatory-information/search-fda-guidance-documents/pat-framework-innovative-pharmaceutical-development-manufacturing-and-quality-assurance.
|
| [5] |
Lee WB, Widjaja E, Heng PWS, et al. Near infrared spectroscopy for rapid and in-line detection of particle size distribution variability in lactose during mixing[J]. Int J Pharm, 2019, 566: 454-462. DOI:10.1016/j.ijpharm.2019.06.002 |
| [6] |
Chavez PF, Sacré PY, De Bleye C, et al. Active content determination of pharmaceutical tablets using near infrared spectroscopy as process analytical technology tool[J]. Talanta, 2015, 144: 1352-1359. DOI:10.1016/j.talanta.2015.08.018 |
| [7] |
Hattori Y, Sugata M, Kamata H, et al. Real-time monitoring of the tablet-coating process by near-infrared spectroscopy-effects of coating polymer concentrations on pharmaceutical properties of tablets[J]. J Drug Deliv Sci Technol, 2018, 46: 111-121. DOI:10.1016/j.jddst.2018.04.018 |
| [8] |
Kuang YH, Tang HJ, Wang DQ, et al. A method for analyzing uniformity of borneol in manufactory process of compound Danshen tablets by near-infrared spectroscopy[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2018, 24: 7-11. |
| [9] |
Mohan S, Momose W, Katz JM, et al. A robust quantitative near infrared modeling approach for blend monitoring[J]. J Pharm Biomed Anal, 2018, 148: 51-57. DOI:10.1016/j.jpba.2017.09.011 |
| [10] |
Lee WB, Widjaja E, Heng PWS, et al. Investigating the effect and mechanism of particle size distribution variability on mixing using avalanche testing and multivariate modelling[J]. Int J Pharm, 2019, 563: 9-20. DOI:10.1016/j.ijpharm.2019.03.045 |
| [11] |
Otsuka M, Tanabe H, Osaki K, et al. Chemoinformetrical evaluation of dissolution property of indomethacin tablets by near‐infrared spectroscopy[J]. J Pharm Sci, 2007, 96: 788-801. DOI:10.1002/jps.20704 |
| [12] |
Short SM, Cogdill RP, Wildfong PLD, et al. A near‐infrared spectroscopic investigation of relative density and crushing strength in four‐component compacts[J]. J Pharm Sci, 2009, 98: 1095-1109. DOI:10.1002/jps.21473 |
| [13] |
Zhang SN, Xiong HS, Zhou LH, et al. Development and validation of in-line near-infrared spectroscopy based analytical method for commercial production of a botanical drug product[J]. J Pharm Biomed Anal, 2019, 174: 674-682. DOI:10.1016/j.jpba.2019.06.046 |
| [14] |
Liu P, Wang J, Li Q, et al. Rapid identification and quantification of Panax notoginseng with its adulterants by near infrared spectroscopy combined with chemometrics[J]. Spectrochim Acta A, 2019, 206: 23-30. DOI:10.1016/j.saa.2018.07.094 |
| [15] |
Lin Y, Li W, Xu J, et al. Development of a NIR-based blend uniformity method for a drug product containing multiple structurally similar actives by using the quality by design principles[J]. Int J Pharm, 2015, 488: 120-126. DOI:10.1016/j.ijpharm.2015.04.025 |
| [16] |
Sun Z, Nie L, Li L, et al. Data mean and ratio of absorbance to concentration methods: a novel optimization strategy for near infrared spectroscopy modeling[J]. Spectrochim Acta A, 2019, 215: 69-80. DOI:10.1016/j.saa.2019.02.044 |
| [17] |
Liu XS, Zhang SY, Zhao MQ, et al. The prediction of baicalin content in the extraction process of Scutellaria baicalensis by near-infrared spectroscopy combined with different variable selection methods[J]. Acta Pharm Sin (药学学报), 2019, 54: 138-143. |
| [18] |
Chen H, Tan C, Lin Z, et al. Quantifying several adulterants of notoginseng powder by near-infrared spectroscopy and multivariate calibration[J]. Spectrochim Acta A, 2019, 211: 280-286. DOI:10.1016/j.saa.2018.12.003 |
| [19] |
Li WL, Yan X, Chen HL, et al. In-line Vis-NIR spectral analysis for the column chromatographic processes of Ginkgo biloba part I: End-point determination of the elution process[J]. Chemometr Intell Lab, 2018, 172: 159-166. DOI:10.1016/j.chemolab.2017.12.002 |
 2020, Vol. 55
2020, Vol. 55


