2. 中国科学院上海药物研究所, 上海 201203
2. Shanghai Institute of Materia Medica, Chinese Academy of Sciences, Shanghai 201203, China
泼尼松(prednisone, 图 1A)是一种广泛使用的糖皮质激素类药物, 具有抗炎、抗过敏、免疫抑制作用。泼尼松在肝脏中主要通过11-β-羟基类固醇脱氢酶代谢生成活性物质泼尼松龙(prednisolone, 图 1B), 两者可相互转化[1, 2]。醋酸泼尼松(prednisone acetate, 图 1C)是泼尼松的羧酸酯化前药, 口服给药后, 在体内水解生成泼尼松, 水解机制目前尚不明确。美国药典收载的制剂是泼尼松片, 而中国药典收载的制剂是醋酸泼尼松片。

|
Figure 1 The chemical structures of prednisone acetate (A), prednisone (B), and prednisolone (C) |
中国知网目前收录的关于醋酸泼尼松的文献约有600篇, 主要研究醋酸泼尼松与其他药物联合用药的临床疗效, 以及HPLC法检测中药制剂、化妆品、保健品等中非法添加的醋酸泼尼松。1985年, Jia等[3]报道了在健康受试者中, 口服泼尼松及醋酸泼尼松片剂(10 mg)的生物利用度。结果表明, 泼尼松和醋酸泼尼松的生物利用度无显著性差异, 泼尼松龙Cmax约为80 ng·mL-1, 但其生物分析方法并非色谱法, 结果可信性有待考证。Schwartz等[4]采用HPLC法, 报道了健康受试者口服泼尼松片(30 mg)后, 泼尼松及泼尼松龙的药代动力学参数, 其中泼尼松龙Cmax约为340 ng·mL-1。目前未见关于糖皮质激素类药物的醋酸酯前药和原药生物利用度的文献报道, 国内制成醋酸酯前药的片剂有醋酸地塞米松片、醋酸泼尼松龙片、醋酸氢化可的松片、醋酸可的松片等, 但醋酸酯前药对口服吸收的影响以及生物利用度是否存在差异, 尚未得到明确的结论。
文献报道关于生物样本中泼尼松及泼尼松龙的分析方法, 主要有LC-MS/MS法[5-8]、HPLC法[9]和GC-MS法[10]。本实验旨在通过Beagle犬双周期随机交叉灌胃给予醋酸泼尼松和泼尼松, 建立LC-MS/MS法测定血浆中醋酸泼尼松、泼尼松及活性代谢物泼尼松龙的浓度, 比较醋酸泼尼松和泼尼松在Beagle犬体内的生物利用度及其药代动力学差异。
材料与方法药品和试剂 醋酸泼尼松(批号: 181001, 纯度: 98.90%, 水分: 0.1%), 浙江仙琚制药股份有限公司; 泼尼松龙(批号: S0504AS, 纯度: 99.40%, 水分: 0.3%), 上海赛抑生物科技有限公司/大连美仑生物技术有限公司; 地塞米松(批号: M0606AS, 纯度: 99.51%), 无锡福祈制药有限公司/大连美仑生物技术有限公司; 泼尼松(批号: J0412AS, 纯度: 98.12%, 水分: 0.2%)、醋酸泼尼松原料药(批号: D0719A, 纯度: 98.95%)、泼尼松原料药(批号: M0412A, 纯度: 98.10%), 大连美仑生物技术有限公司; 色谱纯羧甲基纤维素钠(CMC-Na)和乙腈, 美国Sigma公司; 色谱纯甲醇, 德国Merck公司; 色谱纯甲酸, 日本TCI公司; 色谱纯醋酸铵, 美国ROE公司; 去离子水由法国Millipore超纯水仪制备。
仪器 质谱系统, Triple Quad 5500型三重四极杆串联质谱仪, 配备电喷雾电离源(ESI源), 美国AB Sciex公司; 液相色谱系统, 包括DGU-20A5R脱气机, LC-30AD液相色谱泵, SIL-30AC MP自动进样器, CTO-20A柱温箱; Analyst 1.6.3定量处理软件, 美国AB Sciex公司。
色谱条件 分析柱: ACQUITY UPLC HSS T3 (50 mm×2.1 mm, 1.8 µm), 安捷伦公司; 流动相: A相(含0.1%甲酸的5 mmol·L-1醋酸铵水溶液), B相(甲醇); 采用的梯度洗脱程序如下: 0~0.3 min, 40% B; 0.3~0.8 min, 40%~70% B; 0.8~2.3 min, 70% B; 2.3~2.4 min, 70%~40% B; 2.4~3.2 min, 40% B。流速为0.5 mL·min-1, 柱温为40 ℃, 进样量为10.0 μL。
质谱条件 离子源为电喷雾电离源(ESI源), 正离子方式检测; 源喷射电压为4 500 V; 温度为500 ℃; 离子源气体1 (N2)压力为20 psi (1 psi ≈ 6.9 kPa); 离子源气体2 (N2) 40 psi; 气帘气体(N2)压力为20 psi, 扫描方式为多反应检测(MRM), 碰撞气压力为7 psi; 扫描时间为100 ms。待测物用于MRM检测的定量离子反应为: m/z 401.2→295.2 (醋酸泼尼松)、m/z 359.2→313.2 (泼尼松)、m/z361.2→325.1 (泼尼松龙)、m/z393.2→373.0 (地塞米松)。
标准系列样品和质控样品的配制 精密称取醋酸泼尼松、泼尼松和泼尼松龙对照品各两份, 用甲醇-水(50:50)溶解并定容, 获得质量浓度为1.00 mg·mL-1的醋酸泼尼松、泼尼松和泼尼松龙的储备液, 分别用于配制不同浓度醋酸泼尼松/泼尼松/泼尼松龙的标准系列溶液和质控工作溶液。精密称取地塞米松对照品一份, 用甲醇-水(50:50)溶解并定容, 获得质量浓度为1.00 mg·mL-1的内标储备液。然后用甲醇-水(50:50)稀释, 获得浓度为20.0 ng·mL-1的内标工作溶液。
取10.0 μL的标准系列工作溶液和质控工作溶液, 加入犬空白血浆190 μL, 获得1.00/2.00/2.00~1000/2000/2000 ng·mL-1线性范围内不同浓度的醋酸泼尼松/泼尼松/泼尼松龙的标准系列样品和质控样品。本实验的犬空白血浆样品中均含有稳定剂10%甲酸水溶液(犬空白血浆中甲酸的含量为1%)。
血浆样品预处理 血浆样品预处理采用沉淀蛋白法。取犬血浆样品25.0 μL, 加入内标溶液(地塞米松, 浓度为20.0 ng·mL-1) 25.0 μL, 加入乙腈100 μL, 涡流混合1 min, 离心5 min (14 000 r·min-1)。取上清液80.0 μL, 加入去离子水(含0.1%甲酸) 120 μL, 涡流混合15 min。取上清10.0 μL, 进行LC-MS/MS分析。
方法验证 对建立的方法进行方法验证, 参照中国药典2015年版指导原则[11]和欧盟EMA相关指导原则[12], 从方法的选择性、标准曲线和定量下限、精密度和准确度、稳定性、回收率、基质效应等方面进行验证。
选择性 取6个不同来源的犬空白血浆和1份溶血的犬空白血浆以及相应犬空白血浆配制的LLOQ样品进行LC-MS/MS分析, 考察是否有干扰测定。
标准曲线 样品处理按照“血浆样品预处理”项下操作, 以每个待测物浓度为横坐标, 待测物与内标物的峰面积比值为纵坐标, 用加权(W =1/x2)最小二乘法进行回归运算, 求得的标准曲线的相关系数(r2)均大于0.99。
定量下限 取LLOQ血浆样品, 进行6样本分析, 连续测定3天, 并根据当日标准曲线计算每一样本的测得浓度, 计算该浓度的日内和日间精密度和准确度。
精密度和准确度 取醋酸泼尼松/泼尼松/泼尼松龙低、中、高浓度质控样品, 按“血浆样品预处理”项下操作, 每个浓度进行6样本分析, 分别在3日内测试测定日内、日间的精密度和准确度。
基质效应 分别取6份不同来源的犬空白血浆30.0 μL, 加入乙腈120 μL, 涡流离心。取上清液120 μL, 加入对照质控溶液5.00 μL和内标溶液25.0 μL, 涡流混匀。取80.0 μL, 加入去离子水(含0.1%甲酸) 120 μL, 涡流15 min, 不同来源血浆样品的低、高浓度各进行三样本分析。取10.0 μL进行LC-MS/MS分析, 分别获得相应的待测物和内标的峰面积。同时另取去离子水30.0 μL代替空白血浆, 按上述处理。以两种处理方法的峰面积比值分别计算分析物和内标的基质效应。
取一份溶血血浆, 分别配制低、高两浓度的质控样品, 按“血浆样品预处理”项下操作, 每一浓度进行六样本分析。根据当日标准曲线计算溶血样品的精密度、准确度, 评价溶血血浆样品的基质效应。
回收率 取低、中、高浓度的质控样品, 按“血浆样品预处理”项下操作, 每一浓度进行六样本分析(A)。同时另取犬空白血浆30.0 μL, 加入乙腈120 μL, 涡流离心。取上清液120 μL, 加入对照质控溶液5.00 μL和内标溶液25.0 μL, 涡流混匀。取80.0 μL, 加入去离子水(含0.1%甲酸) 120 μL, 涡流15 min, 每一浓度进行六样本分析(B)。取10.0 μL进行LC-MS/MS分析, 以每一浓度两种处理方法的峰面积比值计算回收率, 计算公式为A/B×100%。
稳定性 考察加入10%甲酸水溶液的醋酸泼尼松/泼尼松/泼尼松龙低、高浓度血浆样品室温放置24 h、经沉淀蛋白处理后室温放置24 h及处理后4 ℃放置24 h、血浆样品经历-20 ℃、-70 ℃共4次冷冻-解冻循环稳定性和-20 ℃、-70 ℃长期放置稳定性。
药动学研究及数据分析 实验方案经中国科学院上海药物研究所实验动物伦理委员会批准, 动物实验在中国科学院上海药物研究所实验动物中心完成。雄性Beagle犬6只, 体重12.0~15.0 kg; 给药前禁食10 h, 自由饮水, 服药后4、10 h统一进餐。采用双周期随机交叉实验, 将其随机分为A、B两组, 每组各3只。实验分为两周期:第Ⅰ周期A组Beagle犬空腹灌胃给予醋酸泼尼松2.0 mg·kg-1, B组Beagle犬空腹灌胃给予相同摩尔剂量的泼尼松1.8 mg·kg-1; 第Ⅱ周期在首次给药2天后两组Beagle犬交叉灌胃给药。在每一周期给药前及给药后5、15和30 min、1、2、4、6、8、24 h采集静脉血1.0 mL于K2-EDTA抗凝试管中, 在2~8 ℃条件下离心10 min分离血浆(3 500 r·min-1, 4 ℃), 分离血浆400 µL, 立即加入10%甲酸水溶液40 µL, 混匀后将血浆样品于-70 ℃冷冻保存。采用Phoenix WinNonlin 6.4软件以非房室模型计算各待测物的药动学参数。
结果 1 质谱分析在上述质谱条件下, 醋酸泼尼松、泼尼松、泼尼松龙和地塞米松主要产生m/z 401.2→295.2、m/z 359.2→313.2、m/z 361.2→325.1、m/z 393.2→373.0的[M+H]+峰。选择性对[M+H]+峰进行产物离子扫描, 醋酸泼尼松的主要碎片离子为m/z 341.2、m/z 313.2和m/z 295.2, 由于m/z 341.2和m/z 313.2两个离子通道的选择性不好, 基线高, 故选择m/z 295.2作为定量分析检测的产物离子。同样选择m/z 313.2和m/z 325.1分别作为泼尼松和泼尼松龙定量分析检测的产物离子。内标地塞米松的主要碎片离子为m/z 373.0。待测物和内标的产物离子扫描质谱图以及产物离子推断见图 2。
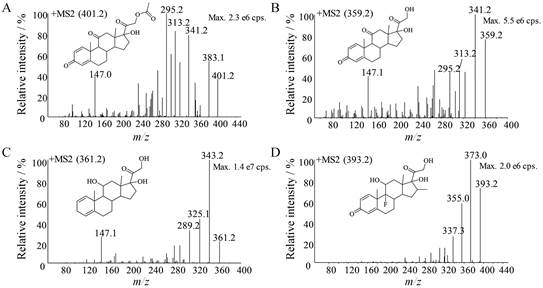
|
Figure 2 The chemical structures and product mass spectra of [M+H]+ ions of prednisone acetate (A), prednisone (B), prednisolone (C) and dexamethason (D) |
结果表明, 犬空白血浆中的内源性物质不干扰待测物醋酸泼尼松、泼尼松、泼尼松龙及地塞米松的测定, 典型色谱图见图 3。
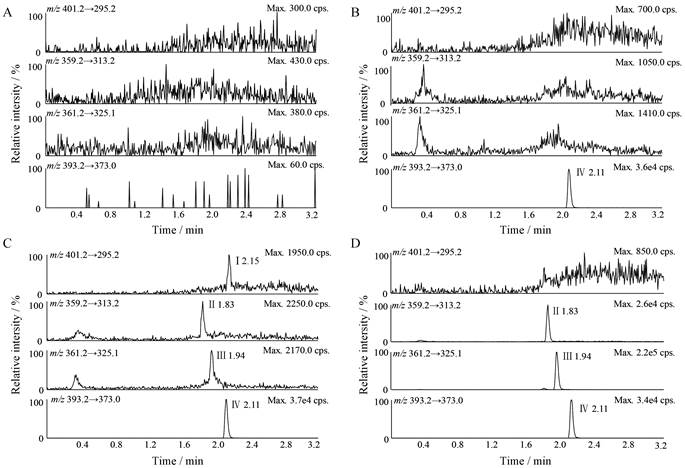
|
Figure 3 Typical MRM chromatograms of prednisone acetate (I), prednisone (II), prednisolone (III), dexamethason (IV) in dog plasma. A: Blank plasma; B: Blank plasma spiked with 20.0 ng·mL-1 dexamethason; C: Blank plasma spiked with 1.00 ng·mL-1 prednisone acetate, 2.00 ng·mL-1 prednisone, 2.00 ng·mL-1 prednisolone and 20.0 ng·mL-1 dexamethason; D: 30 min after administrator of prednisone acetate (2.0 mg·kg-1) |
测定犬血浆醋酸泼尼松、泼尼松和泼尼松龙的线性范围分别为1.00~1 000 ng·mL-1、2.00~2 000 ng·mL-1和2.00~2 000 ng·mL-1。典型标准曲线回归方程为:醋酸泼尼松, y = 0.0439 x + 2.96×10-3 (r = 0.998 8);泼尼松, y = 0.024 1 x + 1.28×10-2 (r = 0.997 6);泼尼松龙, y = 0.028 x - 6.38×10-3 (r = 0.999 3)。
2.3 定量下限血浆样品(醋酸泼尼松/泼尼松/泼尼松龙浓度为1.00/2.00/2.00 ng·mL-1)的醋酸泼尼松的日内精密度为8.6%, 日间精密度为10.6%, 相对误差为0.5%;泼尼松的日内精密度为8.4%, 日间精密度为8.9%, 相对误差为2.2%;泼尼松龙的日内精密度为11.2%, 日间精密度为8.6%, 相对误差为2.7%。结果表明LC-MS/MS同时测定犬血浆中醋酸泼尼松、泼尼松和泼尼松龙的定量下限分别可达到1.00、2.00和2.00 ng·mL-1。
2.4 精密度和准确度每一浓度水平下, 醋酸泼尼松QC样品的日内精密度(RSD)均小于7.8%, 日间精密度(RSD)均小于6.7%, 相对误差(RE)在0.2%~2.0%;泼尼松QC样品的日内精密度(RSD)均小于7.9%, 日间精密度(RSD)均小于7.2%, 相对误差(RE)在0.4%~3.8%;泼尼松龙QC样品的日内精密度(RSD)均小于5.7%, 日间精密度(RSD)均小于8.8%, 相对误差(RE)在0.0%~0.8%。待测物低、中、高质控样品的日内和日间精密度和准确度均符合生物样品测定相关要求。
2.5 基质效应醋酸泼尼松在低、高浓度经内标校正的基质效应分别为95.2%和101.7%, 相对偏差均小于5.0%;泼尼松在低、高浓度经内标校正的基质效应分别为100.5%和100.6%, 相对偏差均小于4.9%;泼尼松龙在低、高浓度经内标校正的基质效应分别为96.4%和100.7%, 相对偏差均小于6.0%。结果表明, 待测物和内标在本实验选择的色谱和质谱条件下, 可忽略基质效应的影响。
溶血血浆配制的低、高浓度水平的醋酸泼尼松质控样品的精密度(RSD)均小于3.0%, 相对误差(RE)在2.8%~4.4%;泼尼松质控样品的精密度(RSD)均小于5.6%, 相对误差(RE)在3.2%~8.0%;泼尼松龙质控样品的精密度(RSD)均小于6.5%, 相对误差(RE)在2.4%~7.3%。结果表明, 待测物在本实验选择的色谱和质谱条件下, 可忽略溶血血浆基质效应的影响。
2.6 样品处理回收率醋酸泼尼松在低、中、高浓度的回收率分别为88.2%、91.4%和92.2%;泼尼松在低、中、高浓度的回收率分别为96.1%、97.6%和94.3%;泼尼松龙在低、中、高浓度的回收率分别为101.1%、97.4%和96.8%。
2.7 稳定性加入10%甲酸水溶液的醋酸泼尼松/泼尼松/泼尼松龙低、高浓度血浆样品室温放置24 h; 预处理后室温放置24 h; 预处理后4 ℃放置24 h; 经历-20 ℃/-70 ℃下4次冷冻-解冻循环; 血浆样品-20 ℃/ -70 ℃长期放置27天。在上述条件下, 血浆样品中醋酸泼尼松、泼尼松及泼尼松龙均稳定。
3 药动学研究Beagle犬交叉给予相同摩尔剂量醋酸泼尼松(2.0 mg·kg-1)和泼尼松(1.8 mg·kg-1)后, 泼尼松及泼尼松龙的平均药时曲线见图 4, 泼尼松及泼尼松龙的主要药动学参数分别见表 1、表 2。

|
Figure 4 Mean plasma concentration-curves of prednisone (A) and prednisolone (B) after oral administration at dose of 2.0 mg·kg-1 prednisone acetate and 1.8 mg·kg-1 prednisone in Beagle dogs. n= 6, x ± s |
| Table 1 Pharmacokinetic parameters of prednisone after oral dose of 2.0 mg·kg-1 prednisone acetate and 1.8 mg·kg-1 prednisone in Beagle dogs. n = 6, x ± s |
| Table 2 Pharmacokinetic parameters of prednisolone after oral dose of 2.0 mg·kg-1 prednisone acetate and 1.8 mg·kg-1 prednisone in Beagle dogs. n = 6, x ± s |
醋酸泼尼松在血浆中的浓度低于分析方法的定量下限1.0 ng·mL-1, 说明醋酸泼尼松在吸收过程中快速水解。Beagle犬给予泼尼松后, 泼尼松Cmax约为给予醋酸泼尼松的2.6倍, 泼尼松龙Cmax约为给予醋酸泼尼松的2.8倍; 泼尼松AUC0-t约为给予醋酸泼尼松的1.4倍, 泼尼松龙AUC0-t约为给予醋酸泼尼松的1.8倍。通过计算泼尼松龙AUC0-t的比值, 得到醋酸泼尼松相对于泼尼松的生物利用度仅为(57.1 ± 10.5)%。
讨论目前, 运用LC-MS/MS法研究醋酸泼尼松和泼尼松的相对生物利用度未有文献报道。考虑到人体药动学实验的成本、可操作性等困难, 本文选择体型相对较大的Beagle犬作为实验动物模型, 初步考察醋酸泼尼松和泼尼松的药代动力学特征, 为临床实验设计提供参考依据。醋酸泼尼松的结构中含有酯键, 血浆中的酯酶会影响其稳定性, 从而导致测定的分析物浓度结果出现偏差。Sirok等[13]研究发现, 草酸钾和氟化钠作为抗凝剂和酯酶抑制剂, 并将人血浆和12%甲酸水溶液以体积比10:1混合, 可保证乙酰水杨酸在血浆中的稳定。本文尝试了温度、稳定剂类型等条件后, 发现加入10%甲酸水溶液(血浆中甲酸含量为1%), 可以保证醋酸泼尼松在血浆中的稳定性。色谱条件优化过程中, 发现泼尼松和泼尼松龙离子通道之间存在干扰, 为保证两个待测物尽可能色谱分离, 本实验采用梯度洗脱方式, 分别考察了甲醇和乙腈作为有机相。结果发现甲醇作为有机相时, 两者更容易实现色谱分离。
本实验结果表明, 醋酸泼尼松在Beagle犬血浆中的浓度低于分析方法的定量下限1.00 ng·mL-1, 说明醋酸泼尼松在吸收过程中快速水解。与给予泼尼松相比, 给予醋酸泼尼松显著改变了Beagle犬体内泼尼松及活性代谢物泼尼松龙的药动学参数, 两者的浓度水平明显降低。醋酸泼尼松与泼尼松在人体内的相对生物利用度是否与此结果相似, 尚需临床实验证明。
结论本实验建立了快速、灵敏的LC-MS/MS法同时测定Beagle犬血浆中醋酸泼尼松、泼尼松及活性代谢物泼尼松龙的浓度, 并成功应用于醋酸泼尼松和泼尼松在Beagle犬体内的生物利用度及药代动力学研究。结果表明, 醋酸泼尼松相对于泼尼松的生物利用度仅为57.1%。
致谢: 中国科学院上海药物研究所郑成、沈嘉睦和徐锦涛开展了动物实验。
| [1] |
Gambertoglio JG, Amend WJ, Benet LZ. Pharmacokinetics and bioavailability of prednisone and prednisolone in healthy volunteers and patients:a review[J]. J Pharmacokinet Biopharm, 1980, 8: 1-52. DOI:10.1007/BF01059447 |
| [2] |
Disanto AR, Desante KA. Bioavailability and pharmacokinetics of prednisone in humans[J]. J Pharm Sci, 1975, 64: 109-112. DOI:10.1002/jps.2600640122 |
| [3] |
Jia YR, Zhou BY, Zhou WB, et al. Comparative study on bioavailability of prednisone and its acetate tablet[J]. Acta Acad Med Sichuan (四川医学院学报), 1985, 16: 259-261. |
| [4] |
Schwartz JI, Mukhopadhyay S, Porras AG, et al. Effect of rofecoxib on prednisolone and prednisone pharmacokinetics in healthy subjects[J]. J Clin Pharmacol, 2003, 43: 187-192. DOI:10.1177/0091270002239828 |
| [5] |
Ionita IA, Fast DM, Akhlaghi F. Development of a sensitive and selectivemethod for the quantitative analysis of cortisol, cortisone, prednisolone andprednisone in human plasma[J]. J Chromatogr B, 2009, 877: 765-772. DOI:10.1016/j.jchromb.2009.02.019 |
| [6] |
Frerichs VA, Tornatore KM. Determination of the glucocorticoids prednisone, prednisolone, dexamethasone, and cortisol in human serum using liquid chromatography coupled to tandem mass spectrometry[J]. J Chromatogr B, 2004, 802: 329-338. DOI:10.1016/j.jchromb.2003.12.015 |
| [7] |
Huang YS, Luan XY, Wang YF., et al. Concentration determination of prednisone in Beagle dog plasma by LC-MS/MS[J]. Chin J Pharm Anal (药物分析杂志), 2017, 37: 101-107. |
| [8] |
Fung EN, Xia YQ, Aubry AF, et al. Full-scan high resolution accurate massspectrometry (HRMS) in regulated bioanalysis:LC-HRMS for the quantitation of prednisone and prednisolone in human plasma[J]. J Chromatogr B, 2011, 879: 2919-2927. DOI:10.1016/j.jchromb.2011.08.025 |
| [9] |
Center SA, Randolph JF, Warner KL, et al. Influence of body condition on plasma prednisolone and prednisone concentrations in clinically healthy cats after single oral dose administration[J]. Res Vet Sci, 2013, 95: 225-230. DOI:10.1016/j.rvsc.2013.02.004 |
| [10] |
Shibasaki H, Nakayama H, Furuta T, et al. Simultaneous determination of prednisolone, prednisone, cortisol, and cortisone in plasma by GC-MS:estimating unbound prednisolone concentration in patients with nephrotic syndrome during oral prednisolone therapy[J]. J Chromatogr B, 2008, 870: 164-169. DOI:10.1016/j.jchromb.2008.03.003 |
| [11] |
Chinese Pharmacopoeia Commission. Guidance for bioanalytical method validation[S]//Pharmacopoeia of the People's Republic of China (中华人民共和国药典). 2015 ed. Vol 4. Beijing:China Medical Science Press, 2015:363-368.
|
| [12] |
European Medicines Agency. Guideline on Bioanalytical Method Validation[S/OL]. London:European Medicines Agency. 2015-12-10[2019-12-20].http://www.ema.europa.eu/docs/en_GB/document_library/Scientific_guideline/2011/08/WC500109686.pdf.
|
| [13] |
Sirok D, Pátfalusi M, Szeleczky G, et al. Robust and sensitive LC/MS-MS method for simultaneous detection of acetylsalicylic acid and salicylic acid in human plasma[J]. Microchem J, 2018, 136: 200-208. DOI:10.1016/j.microc.2016.11.005 |
 2020, Vol. 55
2020, Vol. 55


