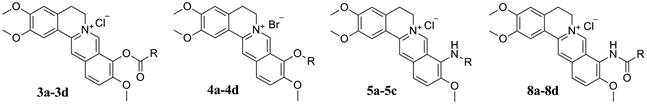
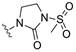
2. 中国医学科学院/北京协和医学院药物研究所, 天然药物活性物质与功能国家重点实验室, 北京 100050
2. State Key Laboratory of Bioactive Substance and Function of Natural Medicines, Institute of Materia Medica, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100050, China
幽门螺旋杆菌(Helicobacter pylori, Hp)是一类具有严重致病性和传染性的革兰阴性菌, 与黄曲霉素、砒霜等被世界卫生组织共列为I类致癌物[1], 不仅可诱发胃癌和胃淋巴瘤等肿瘤, 还与心脑血管疾病、肝胆疾病、慢性支气管炎和缺铁性贫血等其他系统疾病发生有关[2-5]。1982年澳大利亚学者Marshall和Warren首次报道Hp, 并为此共享2005年诺贝尔生理学与医学奖。流行病学研究显示Hp感染形式严峻, 在家庭内有明显的聚集现象, 自愈率几乎为零; 全球感染率超过50%[6], 而我国Hp感染率约为58%~64%, 明显高于发达国家水平。因单一用药不能有效清除Hp, 目前临床多采用联合用药治疗方案[7-9], 以三联疗法质子泵抑制剂(PPI) +克拉霉素+阿莫西林/甲硝唑(Met)最为常见。但由于抗生素的大量使用, Hp对抗生素耐药率不断提高, 如克拉霉素为20%~50%, Met为40%~70%。因此, 寻找新的结构骨架和作用机制的Hp治疗药物尤为迫切。
本课题组长期致力于从生物碱天然产物中寻找化学结构新颖、作用机制独特的创新药物, 如在小檗碱、苦参碱等结构修饰和生物活性挖掘方面进行了深入研究[10-14]。Hp脲酶在人类和动物Hp感染的发病机制中起着重要作用[15, 16], 是研究和寻找抗Hp先导物的热门靶点之一[17]。来源于黄连的原小檗碱类生物碱巴马汀(palmatine, 1)是一类新颖的Hp脲酶抑制剂, 虽然其对Hp感染引起的胃炎和消化性溃疡以及其他与脲酶相关的疾病有潜在的治疗作用, 然而其最低抑Hp浓度(MIC)介于100~200 μg·mL-1之间[18, 19], 抗菌活性不理想, 并且其衍生物抗Hp活性和构效关系未见文献报道。综上, 为获得抗Hp活性更好的候选物, 本文以1为先导物, 保留A环二甲氧基侧链, 针对其9-位衍生物易合成特点, 设计合成了一系列1的9-位取代衍生物(图 1), 探讨了9-位取代衍生物的抗Hp构效关系(structure-activity relationship, SAR), 并对活性较好的化合物开展了急性毒性与初步作用机制等研究。
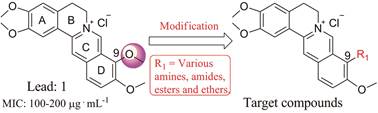
|
Figure 1 Chemical structure of 1, and its structure modification strategy |
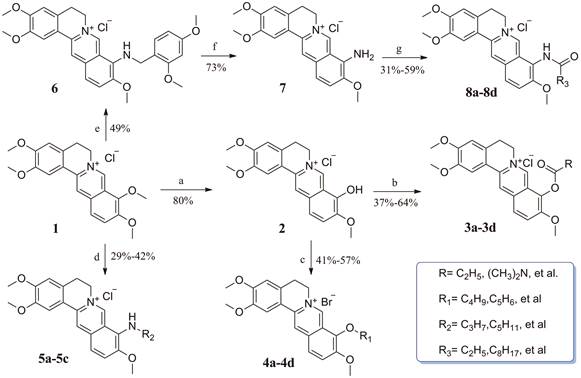
|
Scheme 1 Chemical structure of 1, and its structure modification strategy Reagents and conditions: (a) 195-210 ℃, 30-40 mmHg, 60 min; (b) RCOCl, triethylamine, CH3CN, 65 ℃, 3-8 h; (c) Halogenated hydrocarbons, K2CO3 for 4a, 4b and 4d, K2CO3 and NaI for 4c, CH3CN, 71 ℃, 2-24 h; (d) RNH2, 95-120℃, 4-72 h; (e) 2, 4-Dimethoxybenzylamine, 116 ℃, 7 h; (f) 1:1 HCl/CH3OH, rt, 24 h; (g) R3COCl, pyridine, CH3CN, 71 ℃, 3-24 h |
目标化合物的合成见合成路线1。首先, 以市售1为原料, 选择性脱除9位甲基后, 经盐酸乙醇酸化得到关键中间体9-羟基巴马汀2[20], 随后在碱性条件下, 与相应的酰氯或卤代烃经过酯化或者醚化反应得到目标物3a~3d和4a~4d[13, 20-22]。其次, 以1为原料, 在95~120 ℃条件下, 与相应的胺(既是反应溶剂, 也是反应试剂)反应, 得到胺类衍生物5a~5c[22, 23]。经上述方法, 1与2, 4-二甲氧基苄胺反应得到关键产物6, 在酸性条件下脱除保护基后得到中间体7[22], 随后以吡啶为缚酸剂, 7与相应的酰氯反应得到酰胺类衍生物8a~8d[22]。所有目标化合物结构经1H NMR、13C NMR以及HR-MS分析确证。目标化合物的收率、理化参数和波谱数据见表 1。
| Table 1 Structures, physical properties and spectra data of all synthesized compounds |
以Met和1为阳性对照, 以纸片法药敏试验评价了所有目标化合物对5株(ATCC43504、CCPMAP160010、CCPMAP160008、CCPMAP160007和CCPMAP160017) Met耐药的Hp的体外抑菌活性(表 2)。9-位烷基、芳香基和含氮杂原子基等酯类衍生物3a~3d抗菌活性部分或完全丧失, 均弱于先导物, 说明9-位被酯基取代可能不利于抗菌活性提高。随后将9-位酯连接臂转化为醚, 由此获得9-位烷基和芳香基醚衍生物4a~4d。除化合物4d仅对临床菌株CCPMAP160008和CCPMAP160007的抗菌活性稍强于先导物外, 其他衍生物的抗菌活性均弱于先导物, 其中4a~4d对菌株CCPMAP160017均未显示活性。基于含氨基等可离子化氮原子的小分子更有利于在阴性菌内聚集进而杀灭细菌[24], 设计合成了3个9-位链状氨基取代的胺类衍生物5a~5c, 其对测试菌株的抗菌活性均优于1, 说明9-位氨基取代时可能有利于衍生物抗Hp活性的提高。同时, 为进一步证实氨基取代对抗菌活性的影响, 相继合成并测定了离子化能力相对较弱的9-位烷基、芳香基巴马汀酰胺类衍生物8a~8d的抗Hp活性, 活性结果符合推断:仅8b对菌株CCPMAP160007抗菌活性强于先导物外, 其他衍生物抗菌活性均降低甚至丧失。
| Table 2 Antibacterial activities of the target compounds against H. pylori strains. aThe American Type Culture Collection (ATCC); bClinical isolated strains from patients in Chinese hospitals provided by CAMS-CCPM; cNA: Inhibition zone diameters less than 12 mm |
选择对Met耐药的致病菌具有较好的抑制作用的化合物5a~5c, 采用平皿二倍稀释法测定对5株致病菌的MIC, 结果见表 3。化合物5a~5c的抗Hp活性均优于先导物1和Met, 其中化合物5a抗菌活性最好, 对菌株CCPMAP160008的抗菌活性强于先导物32倍, 为此选取化合物5a进行下一步初步安全性和初步机制研究。
| Table 3 The MIC values of compounds 5a-5c |
首先, 使用ADMET Predictor 9.5软件预测了化合物5a的致癌性、生殖毒性和肝毒性, 并对整体毒性性质进行打分(表 4)。结果显示, 化合物5a对上述毒性都在合理范围内, 提示化合物5a可能具有较好的安全性。
| Table 4 Toxicity prediction results of 5a. aRat-TD50, suggested values: ≥ 6.5; bMouse-TD50, suggested values: ≥ 35; cRepro-Tox, reproduction toxicity; dSer-AlkPhos, alkaline phosphatase level; eSer-GGT, γ-glutamyl transpeptidase level; fSer-LDH, lactic dehydrogenase level; gSer-AST, serum glutamic oxalacetic transaminase; hSer-ALT, serum glutamic pyruvic transaminase; iTox-Risk, druglike risk about toxicity, suggested values: TOX Risk ≤ 2.0 |
昆明小鼠单次灌胃(i.g.)给药, 化合物5a剂量分别为0、250、500和1 000 mg·kg-1, 密切观察7天。小鼠灌胃急性毒性结果显示半数致死量(LD50)大于1 000 mg·kg-1, 说明化合物5a具有较好的安全性。
4 化合物5a分子对接研究鉴于1是较好的Hp脲酶抑制剂[19], 本研究将化合物5a和先导物1分别与Hp脲酶进行了分子对接研究。使用Discovery Studio 4.5软件, 以分子对接方法模拟代表性化合物5a和1分别与Hp脲酶(1E9Y)活性腔的相互作用[25, 26]。化合物5a和Hp脲酶对接打分(LibDock Score = 101.74)明显大于先导物1 (LibDock Score = 92.14)。另外, 如图 2所示, 化合物5a与1相比, 与Hp脲酶作用模式除主要有氢键、分子间范德华力、碳氢键等外, 还有其9-位氨基氢与Hp脲酶残基GLYB:279产生强的氢键相互作用, 进而能更好的匹配Hp脲酶的活性腔。上述结果说明, 化合物5a可能同样是通过抑制Hp脲酶活性来起到较强的抗Hp活性。
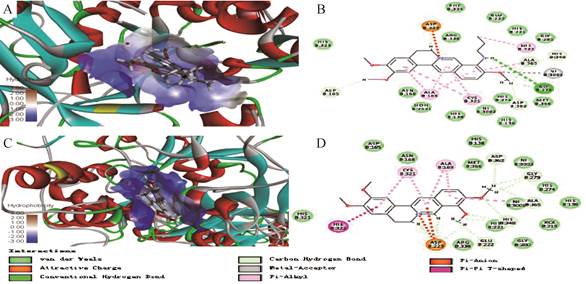
|
Figure 2 Solid surface map of the interaction pocket with compound 5a. (B) Binding modes within the receptor Hp urease active pocket with compound 5a. (C) Solid surface map of the interaction pocket with compound 1. (D) Binding modes within the receptor Hp urease active pocket with compound 1. The receptor structure is shown in surface form. Key bonds are indicated by dashed lines between the atoms involved, and the colors of key bonds and residues are shown according to the interaction mode |
本研究以1为先导物, 以抗Hp活性为导向, 共设计合成了15个化合物9-位取代衍生物, 初步构效关系表明: 9-位引入适当的可离子化氮原子取代基利于抗菌活性的提高。代表性化合物5a对5株Met耐药的Hp活性明显优于阳性对照药Met和先导物1, 对于CCPMAP160010、CCPMAP160008和CCPMAP160007等菌株的MIC可达4 μg·mL-1。另外, 化合物5a小鼠口服急毒LD50大于1 000 mg·kg-1, 表明具有较好的安全性特征。并且, 分子对接实验结果提示5a作用靶点可能是Hp脲酶。巴马汀类衍生物有希望发展成一类化学骨架新颖的抗Hp化合物, 值得进一步研究。
实验部分熔点用CXM-300型精密熔点仪测定, 温度未校正; 1H NMR和13C NMR用Bruker Avance Ⅲ 600核磁共振仪测定, 溶剂均为DMSO-d6; HR-MS用Autospec Ultima-TOF质谱测定仪测定; Flash柱分离纯化用Combiflash Rf 200快速制备液相; 荧光检测用ZF-20D暗箱式紫外分析仪; 薄层色谱(TLC)采用E-Merck公司预铺硅胶铝箔卷; 试剂均为分析纯。
1 化学合成 1.1 化合物3a~3d和4a~4d的合成在195~210 ℃负压(20~30 mmHg, 1 mmHg = 133 Pa)下, 对1加热30 min后, 将反应体系冷却, 将紫黑色固体产物用5%盐酸/乙醇酸化, 减压除去溶剂, 以二氯甲烷/甲醇为流动相, 经硅胶柱梯度洗脱, 分离纯化得棕黄色固体2。
将2 (100 mg, 0.27 mmol)溶于无水乙腈(5 mL)中, 65 ℃条件下, 加入三乙胺(1.22 mmol)和相应酰氯(0.81 mmol), 继续反应3~8 h。冷却反应体系, 减压抽滤, 滤渣以二氯甲烷/甲醇为流动相, 经硅胶柱梯度洗脱, 分离纯化得目标物3a~3d。
将2 (100 mg, 0.27 mmol)溶于无水N, N-二甲基甲酰胺(5 mL)中, 71 ℃条件下, 加入K2CO3 (1.08 mmol)或者K2CO3 (1.08 mmol)和NaI (1.08 mmol), 10 min后加入相应的卤代烷烃, 继续反应2~24 h。冷却反应体系, 减压抽滤, 滤渣以二氯甲烷/甲醇为流动相, 经硅胶柱梯度洗脱, 分离纯化得目标物4a~4d。
1.2 化合物5a~5c在95~120 ℃、N2保护条件下, 将1 (500 mg, 1.29 mmol)加入到相应的胺(5 mL)中, 继续反应4~72 h, 趁热将反应体系抽滤, 用乙酸乙酯洗涤滤渣, 再用二氯甲烷/甲醇为流动相, 经硅胶柱分离纯化得5a~5c。
1.3 化合物8a~8d中间体化合物6的合成方法与化合物5a~5c的合成方法一致。
将6 (522 mg, 1.0 mmol)加入到体积比1:1 HCl/CH3OH (10 mL)溶液中, 室温继续反应24 h, 真空减压旋干反应体系, 所得固体用二氯甲烷/甲醇为流动相, 经硅胶柱分离纯化得7。
将7 (100 mg, 0.27 mmol)溶于无水乙腈(5 mL)中, 65 ℃条件下, 加入吡啶(1.22 mmol)和相应酰氯(0.81 mmol), 继续反应3~24 h。冷却反应体系, 减压抽滤, 滤渣以二氯甲烷/甲醇为流动相, 经硅胶柱梯度洗脱, 分离纯化得目标物8a~8d。
2 生物实验 2.1 药敏纸片法测定抑菌活性菌株在含有5%脱纤维羊血和选择性抗生素的哥伦比亚琼脂培养基上培养72 h后收集, 调节至麦氏浓度2.0 (约1×108 CFU·mL-1)的细菌悬液。将100 μL菌液涂布于不含药物的MHA平板上, 贴上空白药敏纸片, 滴加10 μL含有浓度为10 mg·mL-1的不同药液。将平皿放入培养罐中并放入产气包, 细菌在微需氧条件下(10% CO2, 5% O2和85% N2)于37 ℃孵育72 h。使用游标卡尺测定抑菌圈直径, 判读不同药物对幽门螺杆菌抑菌活性。菌株ATCC43504、CCPMAP160010、CCPMAP160008、CCPMAP160007和CCPMAP160017由中国医学科学院病原微生物菌(毒)种保藏中心药用微生物相关菌(毒)种保藏分中心(Chinese Academy of Medical Sciences-Collection Center of Pathogen Microorganisms, CAMS-CCPM)提供。
2.2 抗Hp活性MIC测定参照CLSI标准, 采用平皿二倍稀释法进行抗菌药敏实验。菌株在含有5%脱纤维羊血和选择性抗生素的哥伦比亚琼脂培养基上培养72 h后收集, 调节至麦氏浓度2.0 (约1×108 CFU·mL-1)的细菌悬液。将2.5 μL/点的细菌悬液接种至含有不同浓度药液(0.5~256 μg·mL-1)及5%脱纤维羊血的MHA琼脂培养基上, 每个接种点均设立3个重复。将平皿放入培养罐中并放入产气包, 细菌在微需氧条件下(10% CO2, 5% O2和85% N2)于37 ℃孵育72 h。幽门螺杆菌ATCC43504菌株用作质控菌株。肉眼观察若无细菌生长或只有多个离散的菌落生长均记为该药物的MIC。Met的耐药折点定义为≥8 μg·mL-1。
2.3 急性毒性实验以昆明种小鼠(18~20 g)为动物模型, 称重后随机分组, 每组10只, 雌雄各半。动物实验遵循中国医学科学院药物研究所动物实验中心标准操作规程。将化合物5a在研钵中充分研磨, 分别配制成0、25、50和100 mg·mL-1混悬液, 给药前充分震荡, 使药物混悬均匀, 每只小鼠给药0.2 mL, 按照0、250、500和1 000 mg·kg-1的剂量灌胃给药, 密切观察动物7天内的死亡情况, 计算LD50。
3 分子对接实验本实验用以对接的活性腔选自Hp脲酶和化合物乙酰氧肟酸共结晶中配体所占的蛋白腔体(PDB code 1E9Y, resolution: 3 Å )[26]。对接软件为Discovery Studio 4.5工作站中LibDock。对接之前先将小分子配体和目标蛋白进行预处理, 如小分子配体能量最低化、目标蛋白加氢、去水等[25]。最后选择打分最高相互作用模式作为最终对接结果。
| [1] |
World Health Organization. Schistosomes, liver flukes and Helicobacter pylori[M]//IARC Monographs on the Evaluation of Carcinogenic Risks to Humans. Vol: 60. Lyon: International Agency for Research on Cancer, 1994.
|
| [2] |
Atherton JC. The pathogenesis of Helicobacter pylori-induced gastro-duodenal diseases[J]. Annu Rev Pathol, 2006, 1: 63-96. DOI:10.1146/annurev.pathol.1.110304.100125 |
| [3] |
Rajesh V, Ramalingam V. Role of Helicobacter pylori infection in pathogenesis of atherosclerosis[J]. World J Cardiol, 2015, 7: 134-143. DOI:10.4330/wjc.v7.i3.134 |
| [4] |
Rabelogonç alves EM, Roesler BM, Zeitune JM. Extra gastric manifestations of Helicobacter pylori infection:possible role of bacterium in liver and pancreas diseases[J]. World J Hepatol, 2015, 7: 2968-2979. DOI:10.4254/wjh.v7.i30.2968 |
| [5] |
Chmiela M, Karwowska Z, Gonciarz W, et al. Host pathogen interactions in Helicobacter pylori related gastric cancer[J]. World J Gastroenterol, 2017, 23: 1521-1540. DOI:10.3748/wjg.v23.i9.1521 |
| [6] |
Cid TP, Fernandez MC, Martinez SB, et al. Pathogenesis of Helicobacter pylori infection[J]. Helicobacter, 2013, 18: 12-17. DOI:10.1111/hel.12076 |
| [7] |
Malfertheiner P, Megraud F, O'Morain CA, et al. Management of Helicobacter pylori infection-the maastricht IV/Florence consensus report[J]. Gut, 2012, 61: 646-664. DOI:10.1136/gutjnl-2012-302084 |
| [8] |
Glupczynski Y, Burette A. Drug therapy for Helicobacter pylori infection:problems and pitfalls[J]. Am J Gastroenterol, 1990, 85: 1545-1551. |
| [9] |
Marshall BJ. Treatment strategies for Helicobacter pylori infection[J]. Gastroenterol Clin North Am, 1993, 22: 183-198. |
| [10] |
Li YH, Yang P, Kong WJ, et al. Berberine analogues as a novel class of the low-density-lipoprotein receptor up-regulators:synthesis, structure-activity relationships, and cholesterol-lowering efficacy[J]. J Med Chem, 2009, 52: 492-501. DOI:10.1021/jm801157z |
| [11] |
Wang YX, Fu HG, Li YH, et al. Synthesis and biological evaluation of 8-substituted berberine derivatives as novel anti-mycobacterial agents[J]. Acta Pharm Sin B, 2012, 2: 581-587. DOI:10.1016/j.apsb.2012.10.008 |
| [12] |
Li YH, Fu HG, Su F, et al. Synthesis and structure-activity relationship of 8-substituted protoberberine derivatives as a novel class of antitubercular agents[J]. Chem Cent J, 2013, 7: 117. DOI:10.1186/1752-153X-7-117 |
| [13] |
Fan TY, Wang YX, Tang S, et al. Synthesis and antibacterial evaluation of 13-substituted cycloberberine derivatives as a novel class of anti-MRSA agents[J]. Eur J Med Chem, 2018, 157: 877-886. DOI:10.1016/j.ejmech.2018.08.050 |
| [14] |
Fan TY, Hu XX, Wang YX, et al. Anti-MRSA activities of cycloberberine derivatives with a novel chemical scaffold[J]. Acta Pharm Sin (药学学报), 2019, 54: 1627-1635. |
| [15] |
Mobley HLT, Island MD, Hausinger RP. Molecular biology of microbial ureases[J]. Microbiol Rev, 1995, 59: 451-480. DOI:10.1128/MMBR.59.3.451-480.1995 |
| [16] |
Burne RA, Chen YM. Bacterial ureases in infectious diseases[J]. Microbes Infect, 2000, 2: 533-542. DOI:10.1016/S1286-4579(00)00312-9 |
| [17] |
Follmer C. Ureases as a target for the treatment of gastric and urinary infections[J]. J Clin Pathol, 2010, 63: 424-430. DOI:10.1136/jcp.2009.072595 |
| [18] |
Li C, Xie J, Chen X, et al. Comparison of Helicobacter pylori urease inhibition by rhizoma coptidis, cortex phellodendri and berberine:mechanisms of interaction with the sulfhydryl group[J]. Planta Med, 2016, 82: 305-311. |
| [19] |
Zhou JT, Li CL, Tan LH, et al. Inhibition of Helicobacter pylori and its associated urease by palmatine:investigation on the potential mechanism[J]. PLoS One, 2017, 12: e0168944. DOI:10.1371/journal.pone.0168944 |
| [20] |
Lu ZM, Zhao SH, Liang JQ, et al. Synthesis and characterization of 9-O-alkyl substituted palmatine derivatives[J]. China J Chin Mater Med (中国中药杂志), 2014, 39: 699-703. |
| [21] |
Fan TY, Hu XX, Wang YX, et al. Design, synthesis and anti-MRSA activities of cycloberberine derivatives with a novel chemical scaffold[J]. Acta Pharm Sin (药学学报), 2018, 53: 887-894. |
| [22] |
Fan TY, Hu XX, Tang S, et al. Discovery and development of 8-substituted cycloberberine derivatives as novel antibacterial agents against MRSA[J]. ACS Med Chem Lett, 2018, 9: 484-489. DOI:10.1021/acsmedchemlett.8b00094 |
| [23] |
Burov ON, Kletskii ME, Fedik NS, et al. Experimental and quantum-chemical study of nucleophilic substitution mechanism in berberine[J]. Chem Heterocycl Compd, 2015, 51: 997-1007. DOI:10.1007/s10593-016-1810-1 |
| [24] |
Richter MF, Drown BS, Riley AP, et al. Predictive compound accumulation rules yield a broad-spectrum antibiotic[J]. Nature, 2017, 545: 299-304. DOI:10.1038/nature22308 |
| [25] |
Yang YS, Wei W, Hu XX, et al. Evolution and antibacterial evaluation of 8-hydroxy-cycloberberine derivatives as a novel family of antibacterial agents against MRSA[J]. Molecules, 2019, 24: 984. DOI:10.3390/molecules24050984 |
| [26] |
Ha NC, Oh ST, Sung JY, et al. Supramolecular assembly and acid resistance of Helicobacter pylori urease[J]. Nat Struct Mol Biol, 2001, 8: 480. DOI:10.1038/88527 |
 2020, Vol. 55
2020, Vol. 55