2. 南京中医药大学江苏省中药资源产业化过程协同创新中心, 江苏 南京 210023;
3. 南京中医药大学中药资源产业化与方剂创新药物国家地方联合工程研究中心, 江苏 南京 210023
2. Jiangsu Collaborative Innovation Center of Chinese Medicinal Resources, Nanjing University of Chinese Medicine, Nanjing 210023, China;
3. National and Local Collaborative Engineering Center of Chinese Medicinal Resources Industrialization and Formulae Innovative Medicine, Nanjing University of Chinese Medicine, Nanjing 210023, China
慢性肾病(chronic kidney disease, CKD)是在全球范围内流行性极广的一种慢性疾病, 已经成为影响人类健康的重大公共卫生问题[1]。在中国, CKD的患病率为11%~13%, 其中超过100万的终末期肾病患者必须接受透析或肾移植治疗[2]。随着CKD的进展以及肾脏功能的丧失, 体内代谢产生的氮质废物不能及时排出体外, 在体内不断堆积形成的对机体有毒性的物质称作尿毒素。近年来, 由肠道微生物代谢产生的尿毒素引发广泛的关注, 其中硫酸对甲酚(p-cresyl sulfate, PCS)是研究最多且最具代表性的尿毒素。据报道, 硫酸对甲酚可引起肾小管细胞氧化应激, 产生炎症因子, 加速CKD的进展, 也是导致CKD患者死亡的重要原因[3-5]。
在哺乳动物中, 尿毒素硫酸对甲酚的形成共分为两步。首先, 肠道细菌将膳食中的酪氨酸(tyrosine, Tyr)代谢为对甲酚(p-cresol, PC); 随后, 对甲酚通过肠道黏膜和肝脏中的磺基转移酶转化为硫酸对甲酚。对甲酚不仅仅是硫酸对甲酚的重要前体, 对甲酚本身对宿主也具有危害性。对甲酚可诱导间充质干细胞衰老, 抑制结肠细胞呼吸和增殖[6]。此外, 对甲酚可诱导肠道微生物群障碍并破坏小鼠粪便代谢物生物多样性[7]。因此, 靶向肠道细菌中的代谢通路, 抑制肠道细菌中对甲酚的生成, 降低体内尿毒素硫酸对甲酚的水平, 减轻对甲酚及硫酸对甲酚对机体的损伤, 这样的治疗策略应引起广泛重视。
在临床治疗CKD的一线药物黄葵胶囊的基础上, 本课题组进一步优化得到中药组方黄葵四物方。该组方是由黄葵、黄芪、虎杖和姜黄四味中药配伍而成。方中黄葵清热解毒; 黄芪益气消肿; 虎杖利湿退黄; 姜黄破瘀止痛。组方具有清利活血、通淋消肿、补泻同施、标本兼顾之功。本课题组前期研究发现, 黄葵四物方可显著减轻CKD模型大鼠肾脏炎症细胞浸润、减少肾小球基底膜沉积、降低肾纤维化的程度; 可显著抑制CKD模型大鼠血浆、肝脏和肾脏中尿毒素分子硫酸对甲酚的堆积, 显著抑制肠道中对甲酚的合成, 提示黄葵四物方保护CKD的作用可能与其抑制肠道菌群中对甲酚合成, 减轻体内硫酸对甲酚堆积相关[8]。因此, 本研究以肠道菌群中尿毒素前体分子对甲酚的代谢通路为切入点, 研究黄葵四物方靶向肠道菌群代谢通路、干预肠道菌群中尿毒素合成的作用机制。
材料与方法实验动物 雄性SPF级的SD大鼠, 体重180~220 g, 购自北京维通利华实验动物技术有限公司(中国), 许可证号: SCXK (北京) 2015-0001, 动物合格号: NO. 201807103。大鼠饲养于南京中医药大学药物安全评价中心, 动物实验获得南京中医药大学动物伦理委员会批准(伦理审核号: 201805A002)。
药物和试剂 黄葵(批号: 180901)、黄芪(批号: 180401)、虎杖(批号: 180501)、姜黄(批号: 180201)均采购自安徽省万生中药饮片有限公司; 酪氨酸(批号: 129C045), 采购自北京索莱宝科技有限公司; 对羟基苯丙酮酸(p-hydroxyphenylketonic acid, HPPA, 批号: BCBV4151)、对甲酚(批号: BCBN4429V)、对羟基苯乙酸(p-hydroxyphenylacetate, PHA, 批号: WXBC0263V)、对羟基苯乳酸(p-hydroxyphenyllactic acid, PPA, 批号: SLBT9188)和对羟基苯丙酸(p-hydroxyphenylpropionic acid, PHPA, 批号: STBG9970)均采购自美国Sigma-Aldrich公司。
动物实验分组、造模及给药 将30只SD大鼠随机分配3组, 即假手术组(sham)、模型组(model)和黄葵四物方组(HKSWF), 每组10只。5/6肾脏切除诱导慢性肾病大鼠模型的造模方法参考以往文献[9, 10]。所有大鼠腹腔注射2.0%苯巴比妥钠(30 mg·kg-1)麻醉, 假手术组仅进行开腹手术, 不切除肾脏。模型组和黄葵四物方组首次切除2/3左肾, 1周后进行右单侧肾切除手术, 术后恢复一周。恢复后进行给药:假手术组和模型组每天灌胃生理盐水1次, 黄葵四物方组大鼠每日灌胃1.25 g·kg-1黄葵四物方1次, 连续灌胃8周。实验结束后收集各组大鼠粪便。
肠道细菌16S rDNA测序 收集的新鲜的大鼠粪便委托派森诺生物科技有限公司(上海)进行粪便微生物16S rDNA测序。微生物生物多样性测序平台为Illumina Miseq, 测序原理为合成测序法。采取门纲目科属分类, 进行菌群的分类学组成分析。
药物制备 黄葵四物方总提液:按一定比例称取相应重量的黄葵、黄芪、虎杖和姜黄(3.35:5:1.5:1), 加入10倍量的水煮沸后微沸1.5 h后取出, 再加入10倍量95%乙醇煮沸后微沸1.5 h后, 将醇提液与水提液混合并进行旋蒸浓缩; 黄葵四物方用无菌LB液体培养基稀释至100 mg·mL-1, 涡旋, 作为给药液, 现配现用。
细菌培养及给药 新鲜粪便样品采集于正常雄性7~8周龄的SD大鼠并置于10 mL离心管内, 按1:4 (m/v)的比例加入无菌生理盐水, 匀浆, 离心(200 ×g, 10 min), 取上清即为大鼠肠道细菌母液。用无菌LB液体培养基将母液稀释后, 固定A600 nm数值用于实验, 从而保证每次细菌的初始浓度一致。在前期实验中, 观察了A600 nm不同数值时实验的稳定性, 最终发现在A600 nm值为1.0时, 肠道细菌可以稳定生成对甲酚。在1.5 mL无菌离心管中加入混合菌液500 μL作为空白对照组; 加入混合菌液480 μL和底物20 μL作为底物对照组; 加入混合菌液460 μL、底物20 μL和药物20 μL作为给药组, 每组样品平行3次, 在37 ℃厌氧培养相应时间[10-12]。
样品的处理及检测 将培养完成的肠道细菌样品从厌氧箱中拿出, 离心(10 000 ×g; 3 min), 取上清液100 µL加入乙腈300 µL, 涡旋后离心(12 000 ×g; 10 min), 取上清液置于进样小瓶。通过HPLC-UV-FLD分析上清液中成分含量。色谱柱: C18柱(250 mm×4.6 mm; Alltima, 美国)用来检测对甲酚, 色谱柱为C18柱(250 mm×4.6 mm; Richland, 美国)用来检测Tyr、PPA、PHPA和PHA。柱温为35 ℃ (表 1)。
| Table 1 The optimal detection parameters of tyrosine (Tyr), p-hydroxyphenylpropionic acid (PHPA), p-hydroxyphenyllactic acid (PPA), p-hydroxyphenylacetate (PHA) and p-cresol (PC) |
统计学方法 采用GraphPad Prism version 7.0软件进行数据统计分析。对甲酚合成的抑制率以(1-给药组/底物对照组)×100%确定。所有结果均以x±s表示, n ≥ 3。采用Nonparametric Mann-Whitney test进行组间差异性分析, P < 0.05为有显著性差异。
结果 1 黄葵四物方改善慢性肾病模型大鼠肠道菌群紊乱尿毒素硫酸对甲酚的体内合成主要包括两个环节, 肠道细菌将酪氨酸分解代谢成对甲酚, 对甲酚进而在肠黏膜和肝脏的作用下合成硫酸对甲酚[13]。CKD模型大鼠体内硫酸对甲酚及对甲酚的水平均会显著升高[14], 而黄葵四物方对蓄积的硫酸对甲酚及对甲酚均有显著的减轻作用[8]。由于对甲酚主要是由肠道菌群合成的, 所以本研究首先观察了黄葵四物方对肠道菌群的影响, 探讨黄葵四物方是否通过直接抑制相关肠道菌群丰度, 从而抑制对甲酚的合成。
结果发现, 与空白对照组相比, 5/6肾切模型组大鼠肠道细菌门水平组成发生改变(图 1A), 主要表现为变形菌门丰度显著升高; 细菌科水平的变化主要表现为棒状杆菌科(Corynebacteriaceae)、双歧杆菌科(Bifidobacteriaceae)、肠球菌科(Enterococcaceae)和肠杆菌科(Enterobacteriaceae)的菌群丰度显著升高(图 1B~D和F), 优杆菌科(Mogibacteriaceae)的菌群丰度显著降低(图 1E), 提示CKD模型大鼠体内肠道菌群发生紊乱, 与文献[9, 15]报道一致。

|
Figure 1 Effect of Huang-Kui-Si-Wu Formula (HKSWF) on the gut microbiota composition in chronic kidney disease (CKD) model rats. A: Gut microbiota composition at the phylum level in CKD model rats; B-F: Abundance of Enterobacteriaceae, Corynebacteriaceae, Bifidobacteriaceae, Mogibacteriaceae and Enterococcaceae in rats. Sham: n =7; model: n = 8; HKSWF: n= 6, x±s. *P < 0.05, **P < 0.01 vs sham group |
据报道, 在终末期肾病患者体内, 条件致病细菌:放线菌门(Actinobacteria)和变性菌门(Proteobacteria)中短状杆菌科(Brachybacterium)、肠杆菌科、假单胞菌科(Pseudomonadaceae)等细菌丰度显著升高; 在CKD模型大鼠体内, 肠道菌群发生紊乱, 条件致病菌丰度升高, 而益生菌如乳杆菌科(Lactobacillaceae)和普雷沃氏菌科(Prevotellaceae)丰度降低[9]。黄葵四物方灌胃8周对肠道菌群具有一定程度的调节作用, 对变形菌门, 以及棒状杆菌科、双歧杆菌科、肠球菌属、肠杆菌属和优杆菌科(Mogibacteriaceae)的菌群丰度异常变化有一定改善的作用, 但是未表现出显著差异。结果提示黄葵四物方并不是通过直接抑制细菌的丰度来降低对甲酚含量的, 可能与其抑制肠道菌群中对甲酚的合成途径有关。
2 黄葵四物方抑制肠道菌群代谢产物对甲酚的生成CKD大鼠由于肠道菌群紊乱, 肠道中的对甲酚合成会显著增加。本研究采用大鼠肠道细菌与酪氨酸共培养下对甲酚大量合成的体外厌氧体系, 评价黄葵四物方对肠道菌群中对甲酚合成环节的影响。结果显示, 高浓度黄葵四物方(4 mg·mL-1)作用24和48 h后, 肠道细菌中对甲酚合成的抑制作用较强, 但随着作用时间的继续延长(72 h), 黄葵四物方的抑制率逐渐降低(图 2A), 因此, 将黄葵四物方与肠道细菌共培养的最佳时间确定为24和48 h。此外, 对大鼠肠道菌与酪氨酸的共培养体系进行了条件优化, 确定最佳肠道细菌浊度为A600 nm=1.0, 最佳酪氨酸浓度为1 mg·mL-1。在该培养体系下, 不同浓度(4 000、400和40 µg·mL-1)黄葵四物方对于对甲酚的合成均具有显著的抑制作用, 并且这种抑制作用呈现剂量依赖关系, 黄葵四物方浓度越高抑制作用越强(图 2B~D)。
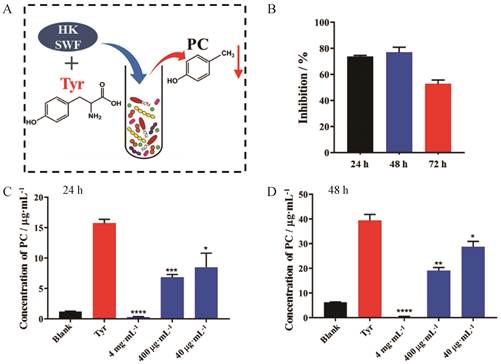
|
Figure 2 Effect of HKSWF on PC production of gut bacteria. Schematic diagram of p-cresol concentration in intestinal bacteria culture supernatant after co-incubated with HKSWF (A). The inhibition rate of PC production when intestinal bacteria was co-cultured with HKSWF (B: 24 h, 48 h and 72 h). When intestinal bacteria was incubated anaerobically with Tyr (C: 24 h, D: 48 h), the effect of HKSWF (40, 400, 4 000 μg·mL-1) on PC production. n = 3, x±s. *P < 0.05, **P < 0.01, ***P < 0.001, ****P < 0.000 1 vs Tyr group |
黄葵四物方可显著抑制肠道细菌中对甲酚的合成, 但是, 黄葵四物方抑制对甲酚合成的作用机制尚不明确。因此, 本研究进一步探究黄葵四物方抑制肠道菌群合成对甲酚的具体机制。首先在文献研究的基础上总结了肠道菌群中酪氨酸合成对甲酚的代谢途径:酪氨酸被分解生成HPPA后分别进入氧化途径和还原途径[13, 16]。在氧化途径中, HPPA被转化成PHA, PHA进一步被代谢成对甲酚; 在还原途径中, HPPA被代谢成PPA及PHPA (图 3)。随后将基于此代谢途径多环节评价黄葵四物方对酪氨酸代谢过程中氧化途径及还原途径的影响。

|
Figure 3 The metabolism of Tyr can be classified into two pathways, the oxidative pathway and the reductive pathway. In the oxidative pathway, p-hydroxyphenylpyruvate (HPPA), a primary metabolite of Tyr, was transformed to PHA by p-hydroxyphenylpyruvate oxidase, and PHA is further metabolized to PC by p-hydroxyphenylacetate decarboxylase. In the reductive pathway, HPPA is further metabolized to generate PPA and then PHPA (A). Liquid chromatogram of PHA (B), PC (C), PPA (D) and PHPA (E). Liquid chromatogram of the four compounds in fecal mixed bacteria culture supernatant after co-incubated with Tyr (F, G) |
为了整体评价黄葵四物方对酪氨酸代谢过程的影响, 测定了酪氨酸代谢过程中氧化途径及还原途径产生的4种代谢产物(PPA、PHPA、PHA和对甲酚)含量。结果显示, 黄葵四物方(4 mg·mL-1)作用24和48 h后, 氧化途径和还原途径中的4种代谢产物均发生了显著变化, 主要表现为还原途径中PHPA的摩尔浓度显著增加(图 4A), 氧化途径中PHA和对甲酚的摩尔浓度显著降低(图 4B)。将氧化途径和还原途径综合分析发现, 黄葵四物方作用24 h后氧化途径代谢产物所占百分比由82.83%下降到38.87%, 还原途径代谢产物所占百分比由17.17%提高到61.13% (图 4C), 共培养48 h显示出相似的结果(图 4D~F)。此外, 黄葵四物方与含有酪氨酸初级代谢产物(HPPA; 500 μg·mL-1)的肠道细菌共培养24 h后, 其作用与以酪氨酸作为底物时的结果相似(图 4G~I)。这些结果表明, 黄葵四物方抑制酪氨酸代谢产物进入氧化途径, 促进其进入还原途径, 即促进酪氨酸代谢途径中氧化途径向还原途径转化, 最终抑制位于氧化途径中对甲酚的生物合成。
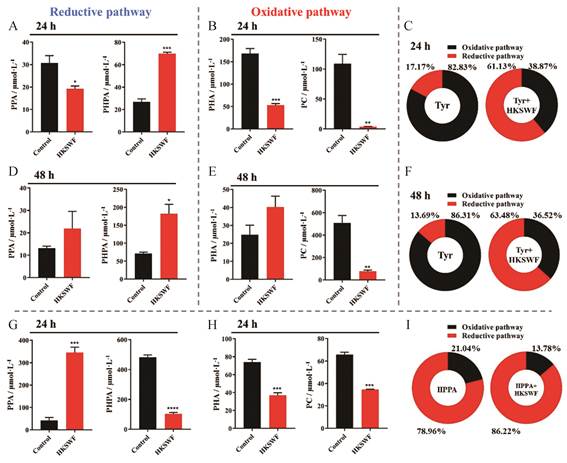
|
Figure 4 HKSWF inhibited PC production by switching Tyr metabolism from oxidative pathway to reductive pathway. The concentration of PPA, PHPA, PHA and PC in culture supernatant when Tyr was co-incubated with HKSWF for 24 h (A, B) and 48 h (D, E) or HPPA for 24 h (G, H). Percentage of redox pathways when fecal mixed bacteria was co-incubated with Tyr or Tyr + HKSWF for 24 h (C) and 48 h (F). Percentage of redox pathways when fecal mixed bacteria was co-incubated with HPPA or HPPA + HKSWF for 24 h (I). n = 3, x±s. *P < 0.05, **P < 0.01, ***P < 0.001, ****P < 0.000 1 vs control group |
肠道细菌与酪氨酸或HPPA共培养后, 黄葵四物方对酪氨酸代谢过程中的氧化途径有明显的抑制作用。接下来, 将进一步探究黄葵四物方对酪氨酸代谢过程中氧化途径的抑制作用机制。在酪氨酸代谢的氧化途径中, PHA是对甲酚的唯一前体。因此, 将黄葵四物方与含有PHA (125 μg·mL-1)的肠道细菌共培养10 h和24 h, 结果发现, 在共培养24 h后, 黄葵四物方显著降低了对甲酚的摩尔浓度, 同时, 显著升高了PHA的摩尔浓度(图 5C); 共培养10 h也存在类似的结果(图 5B)。结果表明, 黄葵四物方除了可以促进氧化途径向还原途径转化进而减少对甲酚合成外, 还可以通过直接阻断氧化途径中PHA向对甲酚的转化, 多环节抑制肠道细菌生成对甲酚(图 5A)。
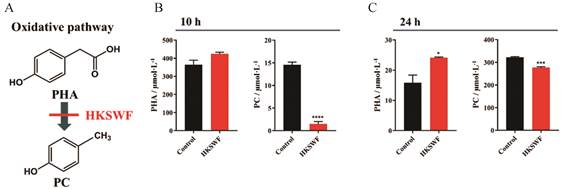
|
Figure 5 HKSWF inhibited PC production by directly blocking the transformation of PHA to PC in the oxidative pathway. HKSWF inhibited PC production in oxidative pathway (A). The concentration of PHA and PC in culture supernatant when PHA was co-incubated with HKSWF (B: 10 h; C: 24 h). n = 3, x±s. *P < 0.05, ***P < 0.001, ****P < 0.000 1 vs control group |
硫酸对甲酚是一种蛋白结合型尿毒素, 由于与血浆蛋白的结合率高[13], 在肾功能衰竭时, 不能顺利排出体外, 进而对人体健康造成危害[17]。终末期CKD患者临床清除尿毒素的方法以透析和肾脏移植为主[17], 但是, 硫酸对甲酚与血浆蛋白结合后分子量较大, 绝大部分不能通过透析排出体外; 肾脏移植又存在治疗费用高、肾源少以及排异现象严重等问题。而辅助干预尿毒素蓄积的方式如使用吸附剂、泻药及益生菌等[13]又均存在一定缺陷, 如吸附剂AST120在停止摄入后, 体内硫酸对甲酚又会出现蓄积现象[18], 并且吸附剂容易吸附其他药物降低其他药物的治疗效果[19]; 长期服用泻药会导致肠道菌群和水电解质失衡; 益生菌存在特异性差的缺点。目前临床缺乏安全有效清除尿毒素硫酸对甲酚的方法或药物, 因此探索清除尿毒素以延缓CKD进展的新策略具有重要的科学意义和临床转化价值。
前期研究发现, 黄葵四物方可显著减少硫酸对甲酚蓄积, 对CKD具有治疗作用[8]。硫酸对甲酚是肠道菌群-宿主共代谢产物:食物来源的酪氨酸经肠道菌群代谢生成对甲酚, 对甲酚经宿主肝脏和肠黏膜代谢生成硫酸对甲酚。近年来, 通过调控肠道菌群来延缓疾病进程的治疗策略引发了研究者的热切关注[20-23]。因此, 本研究针对肠道内对甲酚的合成途径, 靶向探究了黄葵四物方对尿毒素前体对甲酚生成的影响机制。
肠道菌群代谢是对甲酚生物合成的关键环节, 肠道菌群紊乱将导致对甲酚在体内大量蓄积[14, 24, 25]。本研究通过基因测序方法发现CKD大鼠肠道菌群紊乱, 黄葵四物方灌胃8周对模型大鼠肠道菌群具有一定程度的调节作用, 但是未表现出显著差异。结果提示黄葵四物方并不是通过直接抑制细菌的丰度来降低对甲酚含量的, 可能与其抑制肠道菌群中对甲酚的合成途径有关。
为了探究黄葵四物方对肠道菌群中对甲酚合成途径的影响, 本课题组在前期研究中分别采集了正常大鼠和CKD模型大鼠的粪便作为肠道菌群的来源。结果发现, 正常大鼠和CKD模型大鼠的粪便菌群均可以将酪氨酸等底物生成对甲酚, 且模型大鼠粪便菌群合成对甲酚的能力更强, 提示模型大鼠肠道菌群出现紊乱后生成对甲酚的能力更强。而黄葵四物方与正常大鼠以及CKD模型大鼠的粪便菌群共同培养后, 均可抑制对甲酚的合成, 并且具有相似的作用趋势, 但是对于正常大鼠粪便菌群的作用更加稳定。因此, 本研究选择正常大鼠粪便作为肠道菌群来源构建体外厌氧培养体系。
肠道细菌体外厌氧培养结果表明, 黄葵四物方可剂量依赖性抑制肠道菌群中对甲酚的合成, 其作用途径主要包括两条:其一, 黄葵四物方促使酪氨酸代谢过程中氧化途径向还原途径转化, 导致氧化途径中对甲酚的生成显著减少; 其二, 黄葵四物方对生成对甲酚的氧化途径还具有直接的抑制作用, 直接抑制对羟基苯乙酸分解生成对甲酚(图 6)。酪氨酸还原途径中有两个关键的代谢产物PPA和PHPA, 其中PPA具有抗霉菌作用[26], PHPA具有增强I型干扰素信号预防流感的作用[27], 提示黄葵四物方不仅可抑制氧化途径减少尿毒素前体的生成, 还可能参与机体对抗外源性有害细菌以及抗流感的过程。但是这些还原性产物与慢性肾病之间的关系还没有报道。本课题组也会在后期的研究中继续关注这些代谢产物的生物学作用。
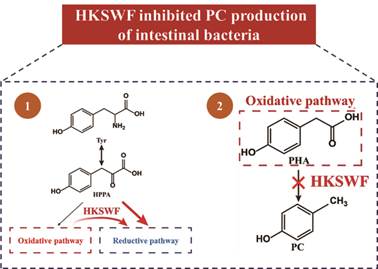
|
Figure 6 HKSWF could inhibit the formation of PC by modulating the metabolic pathway of Tyr in gut microbiota |
综上所述, 黄葵四物方可改善CKD导致的肠道菌群紊乱, 在肠道菌群合成对甲酚的代谢途径中, 可通过抑制氧化途径以及促进还原途径多环节调控作用抑制对甲酚的生物合成(图 6)。近年来, 通过调控肠道菌群延缓疾病进展的治疗策略具有广阔发展前景, 本研究表明黄葵四物方可通过调控肠道菌群减轻体内尿毒素堆积最终延缓CKD进程, 为临床应用黄葵四物方治疗CKD提供了理论依据。
| [1] |
Cai GY, Chen XM. Complications of chronic kidney disease current management and challenge[J]. Chin J Pract Intern Med (中国实用内科杂志), 2010, 30: 102-103. |
| [2] |
Zhang L, Wang F, Wang L, et al. Prevalence of chronic kidney disease in China:a cross-sectional survey[J]. Lancet, 2012, 379: 815-822. DOI:10.1016/S0140-6736(12)60033-6 |
| [3] |
Watanabe H, Miyamoto Y, Honda D, et al. p-Cresyl sulfate causes renal tubular cell damage by inducing oxidative stress by activation of NADPH oxidase[J]. Kidney Int, 2013, 83: 582-592. DOI:10.1038/ki.2012.448 |
| [4] |
Watanabe H, Miyamoto Y, Otagiri M, et al. Update on the pharmacokinetics and redox properties of protein-bound uremic toxins[J]. J Pharm Sci, 2011, 100: 3682-3695. DOI:10.1002/jps.22592 |
| [5] |
Wu IW, Hsu KH, Lee CC, et al. p-Cresyl sulphate and indoxyl sulphate predict progression of chronic kidney disease[J]. Nephrol Dial Transplant, 2011, 26: 938-947. DOI:10.1093/ndt/gfq580 |
| [6] |
Lee JH, Yun CW, Hur J, et al. Fucoidan rescues p-cresol-induced cellular senescence in mesenchymal stem cells via FAK-Akt-TWIST axis[J]. Mar Drugs, 2018, 16: 121. DOI:10.3390/md16040121 |
| [7] |
Passmore IJ, Letertre MPM, Preston MD, et al. Para-cresol production by Clostridium difficile affects microbial diversity and membrane integrity of Gram-negative bacteria[J]. PLoS Pathog, 2018, 14: e1007191. DOI:10.1371/journal.ppat.1007191 |
| [8] |
Liu Y. Protective Effect and Mechanism of Huang-Kui-Si-Wu Formula on Chronic Kidney Disease (黄葵四物方对慢性肾病的保护作用及机理研究)[D]. Nanjing: Nanjing University of Traditional Chinese Medicine, 2018.
|
| [9] |
Vaziri ND, Wong J, Pahl M, et al. Chronic kidney disease alters intestinal microbial flora[J]. Kidney Int, 2013, 83: 308-315. DOI:10.1038/ki.2012.345 |
| [10] |
Wang YY, Li JP, Lu JB, et al. Effect and mechanism of Huangkui capsule on reduction of uremic toxin accumulation in an animal model of chronic kidney disease[J]. Acta Pharm Sin (药学学报), 2019, 54: 2267-2276. |
| [11] |
Wang YY. Study on Regulation of Gut Bacteria-Mediated Metabolic Pathway of Urinary Toxin by Abelmoschus manihot and its Mechanism (黄葵调控肠道菌群介导的尿毒素代谢通路及其作用机制研究)[D]. Nanjing: Nanjing University of Traditional Chinese Medicine, 2019.
|
| [12] |
Cui X, Tao JH, Jiang S, et al. Study on the interaction between berberine and intestinal flora[J]. Chin J Microecol (中国微生态学杂志), 2017, 29: 1373-1377. |
| [13] |
Gryp T, Vanholder R, Vaneechoutte M, et al. p-Cresyl sulfate[J]. Toxins, 2017, 9: 52. DOI:10.3390/toxins9020052 |
| [14] |
Ose R, Hirano K, Maeno S, et al. The ability of human intestinal anaerobes to metabolize different oligosaccharides:novel means for microbiota modulation?[J]. Anaerobe, 2018, 51: 110-119. DOI:10.1016/j.anaerobe.2018.04.018 |
| [15] |
Hughes ER, Winter MG, Duerkop BA, et al. Microbial respiration and formate oxidation as metabolic signatures of inflammation-associated dysbiosis[J]. Cell Host Microbe, 2017, 21: 208-219. DOI:10.1016/j.chom.2017.01.005 |
| [16] |
Dodd D, Spitzer MH, Van Treuren W, et al. A gut bacterial pathway metabolizes aromatic amino acids into nine circulating metabolites[J]. Nature, 2017, 551: 648-652. DOI:10.1038/nature24661 |
| [17] |
Meyer TW, Hostetter TH. Uremic solutes from colon microbes[J]. Kidney Int, 2012, 81: 949-954. DOI:10.1038/ki.2011.504 |
| [18] |
Yamamoto S, Kazama JJ, Omori K, et al. Continuous reduction of protein-bound uraemic toxins with improved oxidative stress by using the oral charcoal adsorbent AST-120 in haemodialysis patients[J]. Sci Rep, 2015, 5: 14381. DOI:10.1038/srep14381 |
| [19] |
Koya Y, Uchida S, Machi Y, et al. Prediction of drug interaction between oral adsorbent AST-120 and concomitant drugs based on the in vitro dissolution and in vivo absorption behavior of the drugs[J]. Eur J Clin Pharmacol, 2016, 72: 1353-1361. DOI:10.1007/s00228-016-2102-5 |
| [20] |
Wang Y, Jiang JD. A new research mode of drug PK-PD mediated by the gut microbiota:insights into the pharmacokinetics of berberine[J]. Acta Pharm Sin (药学学报), 2018, 53: 659-666. |
| [21] |
Zhang JH, Zhang JM, Wang R, et al. Interaction of amoxicillin and nifedipine mediated by intestinal flora[J]. Acta Pharm Sin (药学学报), 2018, 53: 1721-1725. |
| [22] |
Gao XJ, Li T, Wei B, et al. Regulatory mechanisms of gut microbiota on intestinal CYP3A and P-glycoprotein in rats with dextran sulfate sodium-induced colitis[J]. Acta Pharm Sin (药学学报), 2017, 52: 34-43. |
| [23] |
Lin Z, Zu XP, Xie HS, et al. Research progress in mechanism of intestinal microorganisms in human diseases[J]. Acta Pharm Sin (药学学报), 2016, 51: 843-852. |
| [24] |
Sabatino A, Regolisti G, Cosola C, et al. Intestinal microbiota in type 2 diabetes and chronic kidney disease[J]. Curr Diabetes Rep, 2017, 17: 16. DOI:10.1007/s11892-017-0841-z |
| [25] |
Cigarran Guldris S, Gonzalez Parra E, Cases Amenos A. Gut microbiota in chronic kidney disease[J]. Nefrologia, 2017, 37: 9-19. DOI:10.1016/j.nefro.2016.05.008 |
| [26] |
Al Hinai EA, Kullamethee P, Rowland IR, et al. Modelling the role of microbial p-cresol in colorectal genotoxicity[J]. Gut Microbes, 2018, 1-14. |
| [27] |
Steed AL, Christophi GP, Kaiko GE, et al. The microbial metabolite desaminotyrosine protects from influenza through type I interferon[J]. Science, 2017, 357: 498-502. DOI:10.1126/science.aam5336 |
 2020, Vol. 55
2020, Vol. 55


