2. 中国医学科学院、北京协和医学院药物研究所, 北京 100050;
3. 山西振东制药股份有限公司, 山西 长治 047100
2. Institute of Materia Medica, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100050, China;
3. Shanxi Zhendong Pharmaceutical Co., Ltd., Changzhi 047100, China
衰老是机体组织、器官功能随年龄增长而发生的退行性变化, 是体内外多种因素共同作用的结果。衰老会导致细胞生长停滞, 组织功能和代谢的受损, 最终影响机体的寿命, 所以近年来对衰老的研究日益受到人们的关注[1]。
黄芩(Scutellaria baicalensis Georgi)在《神农本草经》中记载为唇形科草本植物, 以干燥的根入药, 其药效成分主要为黄酮及其苷类[2], 具有抗氧化、抗炎、神经保护等多种药理活性[3, 4], 能够提高小鼠体内抗氧化酶活性、清除自由基、减轻氧化损伤、改善学习记忆能力[5]。由于黄芩为多年生宿根草本, 因此黄芩叶的储量是相当大的。黄芩地上部分作为别样茶的一种, 在我国使用已有近千年的历史[6], 民间常采集黄芩茎叶进行加工制成黄芩茶饮。但因为过去茎叶不分, 外观较差, 饮用不方便, 因此一些公司对黄芩茶在加工方式上做了较大的改进, 只取黄芩叶加工成黄芩茶。目前对黄芩叶与黄芩茶抗衰老作用及机制方面的研究甚少。因此, 为了综合开发黄芩药材资源, 扩大黄芩叶的应用范围及市场知名度, 将黄芩叶变废为宝, 本文对黄芩叶与黄芩茶的抗衰老作用展开研究。
在衰老研究中, 果蝇作为模式生物取得了巨大的突破[7, 8]。其具有易饲养、生长周期短、雌雄易分辨的优势[9]。因此选择果蝇衰老模型探索黄芩叶与黄芩茶抗衰老药效及作用机制。
代谢组学可全面揭示机体受到刺激时内源性代谢物的变化, 从而发现疾病的生物标志物和阐明药物的作用机制[10]。核磁共振技术在代谢组学中广泛应用, 具有操作简单、不破坏样品结构和性质、分析时间短和方法重现性好等优势[11, 12]。
本研究给予果蝇黄芩叶与黄芩茶水提物后研究其对果蝇寿命的影响, 同时结合果蝇摄食量与繁殖力的变化进而评价黄芩叶与黄芩茶水提物是否具有抗衰老的效果, 运用代谢组学技术对其抗衰老作用机制进行研究, 为开发利用黄芩叶资源, 推广黄芩茶的应用提供了理论依据。
材料与方法实验动物 野生型W1118品系黑腹果蝇由山西大学应用生物学研究所提供, 饲养于温度为25 ℃, 湿度为65%, 自然昼夜节律光照的智能人工气候箱中。
仪器与主要试剂 果蝇培养管(北京中创宏达科技有限公司); LDZX-30KBS立式压力蒸汽灭菌器(上海申安医疗器械厂); FA2004电子天平(上海良平仪器仪表有限公司); MGC-HP人工气候箱(上海一恒科技有限公司); 玻璃匀浆器(江苏盐城泓宇玻璃仪器厂); RE-52A旋转蒸发器(上海亚荣生化仪器厂); SCIENTZ-12N真空冷冻干燥机(宁波新芝生物科技股份有限公司); TGL-16高速台式冷冻离心机(湖南湘仪离心机仪器有限公司); BSA124S分析天平(Sartorius, 德国); SPT-24氮空吹扫浓缩仪(北京斯珀特科技有限公司); Bruker600-MHzAVANCEⅢ核磁共振仪(Bruker, 德国); 玉米粉(市售); 无水乙醇、蔗糖、丙酸、氯仿(天津市风船化学试剂科技有限公司); D2O (Sigma, 美国); 3-三甲基硅基[2, 2, 3, 3-d4]氘代丙酸钠(TSP, Cambridge Isotope Laboratories Inc., MA, 美国); 磷酸二氢钠、磷酸氢二钠(分析纯, 天津光复精细化工研究所)。
黄芩叶与黄芩茶提取物的制备 干燥的黄芩叶与黄芩茶购于山西佳辰中药材开发有限公司, 由本实验室秦雪梅教授鉴定为唇形科植物黄芩(Scutellaria baicalensis Georgi)的干燥叶, 黄芩茶是由黄芩叶采用现代茶工艺制作而成, 保存于山西大学中医药现代研究中心。取干燥黄芩叶与黄芩茶分别在水温89℃条件下, 第1次加15倍量的水提取1 h, 过滤; 第2次加10倍量, 提取1 h, 过滤, 合并两次的滤液浓缩, 再将浓缩液冷冻干燥从而获得提取物。本实验中黄芩叶水提物的提取率为43.24%, 黄芩茶水提物的提取率为44.96%。
培养基的制备 将琼脂10 g、蔗糖70 g、玉米粉85 g和酵母粉18 g, 加水至1 L加热煮沸。之后加入丙酸5 mL配制成空白培养基。在空白培养基中, 分别添加黄芩叶水提物低剂量(LL, 1 g·L-1)、中剂量(LM, 3 g·L-1)、高剂量(LH, 5 g·L-1)和黄芩茶水提物低剂量(TL, 1 g·L-1)、中剂量(TM, 3 g·L-1)、高剂量(TH, 5 g·L-1)制备成含药培养基。本实验给药组剂量依据本课题组前期基于果蝇模型研究黄芩醇提物抗衰老作用的基础上确定[13]。
果蝇寿命实验 收集3天内羽化的雄性果蝇成虫, 随机分为7组, 即对照组(K)、SLE低剂量(LL, 1 g·L-1)、中剂量(LM, 3 g·L-1)、高剂量(LH, 5 g·L-1)和STE低剂量(TL, 1 g·L-1)、中剂量(TM, 3 g·L-1)、高剂量(TH, 5 g·L-1), 每组250只, 对照组为空白培养基培养; 给药组为各含药培养基分别培养。所有实验组果蝇均于恒温恒湿智能人工气候箱中培养, 温度25 ℃、湿度65%的, 每隔3天更换1次相应的新鲜培养基。每天统计死亡的果蝇数量, 直至果蝇全部死亡, 绘制生存曲线, 计算果蝇的平均寿命、中位寿命和最高寿命[14]。
黄芩叶与黄芩茶水提物对果蝇摄食量和繁殖力的影响 测定果蝇的摄食量时, 收集3天内羽化的雄果蝇成虫, 随机分为7组(同寿命实验分组), 每组4管, 每管约15只。喂养10天后将各组果蝇转移至各剂量组对应的含0.2% FD & C no. 1蓝色食用素培养基的管中。24 h后, 每组选10只果蝇用生理盐水充分匀浆, 离心, 取上清200 μL在625 nm处测定吸光度。
测定果蝇的繁殖力时, 收集8 h内羽化的果蝇成虫, 雌雄分开, 随机分为7组(同寿命实验分组), 每组雌雄各4管, 每管10只。喂养5天后, 雌雄果蝇各10只放入同一个管中, 于第10天记录各管果蝇的蛹数。
果蝇代谢组学实验
分组及给药 收集3天内羽化的雄果蝇成虫, 随机分为6组, 各组均为1 200只果蝇, 平均每200只果蝇为一个样本, 每组共6个样本。实验分组为3天龄组(K); 30天龄组(M)、SLE低剂量组(LL, 1g·L-1)、SLE中剂量组(LM, 3 g·L-1)、STE低剂量组(TL, 1 g·L-1)、STE中剂量组(TM, 3 g·L-1)。3天组为空白培养基喂养3天, 作为年轻对照组; 30天组为空白培养基喂养30天, 作为衰老对照组[15], 给药组为各含药培养基分别喂养30天, 且所有实验组果蝇均在相同条件下培养。
果蝇样品的收集与处理 样本收集前, 饥饿两小时, 各组果蝇样本分别收集于相应的EP管中, 且一个样本对应一个EP管, 并以液氮速冻, 置于-80 ℃保存, 待测。
1H NMR果蝇组织样品测定 根据参考文献报道方法[16]并稍加改进, 果蝇样品前处理:称取果蝇组织100 mg, 于2 mL EP管中, 加氯仿-甲醇-水(2:7:1) 1.5 mL于冰浴上匀浆提取, 涡旋, 以13 000 r·min-1离心15 min, 将上清液转移至2 mL EP管中后空气吹, 吹干后的样品加含TSP的磷酸盐缓冲液(pH 7.4, 包含D2O、0.01% TSP) 600 μL, 超声溶解, 涡旋, 于4 ℃、13 000 r·min-1离心15 min, 取全部上清液置于5 mm核磁管中。
1H NMR测定与图谱处理 样本于Bruker 600 MHz AVANCE Ⅲ NMR共振波谱仪采集数据(25 ℃), 采用Nuclear Overhauser Effect Spectroscopy (NOESY RD-90°-t1-90°-tm-90°- acquire)序列以压制水峰, 扫描次数为64次。样本核磁谱图采用MestReNova (version 11.0 Mestrelab Research, Santiago de Compostella, 西班牙)软件处理。对所有1H NMR图谱进行傅里叶转换以及相位、基线调整, 以TSP (δ 0.00)为标准对谱图进行化学位移的校正, 对δ 0.60~9.00区域的谱图进行δ 0.01等宽度分割, 切除δ 4.67~5.20区域以消除水峰的影响。对图谱进行分段积分, 将所产生的所有积分数据归一化。归一化后的数据导入SIMCA-P 14.0 (Umetrics, Umea, 瑞典)软件, 进行多元统计分析。
统计学分析 采用GraphPad Prism 7软件进行数据分析处理, 通过单因素方差分析及t检验进行各组间差异比较, 结果用x±s表示。
代谢通路分析 将筛选出的代谢产物上传到MetPA平台, 采用果蝇代谢物数据库进行代谢物匹配之后进行代谢通路富集分析和拓扑分析。应用MetPA平台分析黄芩叶与黄芩茶水提物干预机体后显著影响的代谢通路。
结果 1 药效学 1.1 果蝇生存寿命分析对不同组果蝇寿命进行统计分析, 寿命曲线如图 1所示, 各组对自然衰老果蝇寿命实验的影响统计如表 1所示。SLE和STE (1、3 g·L-1)均可显著改善果蝇的寿命情况(P < 0.05)。与对照组相比, 1 g·L-1和3 g·L-1的SLE可分别提高平均寿命8.20%和11.17%, 且分别提高中位生存时间9.76%和12.20%, 提高最高寿命2.34%和4.40%; 1 g·L-1、3 g·L-1 STE可分别提高平均寿命6.76%和14.27%, 且分别提高中位生存时间7.32%和21.95%, 提高果蝇最高寿命4.64%和4.92%。因此可得, SLE和STE (1、3 g·L-1)可延长果蝇寿命。由图 1A生存曲线可以看出, TL组在60~70天果蝇存活率明显优于LL组, 同时由表 1得TL组果蝇的最高寿命显著高于LL组; 图 1B生存曲线可以看出, TM组在30~55天果蝇存活率明显高于LL组, 且由表 1得TM组的中位寿命高于LM组, 因此得出黄芩茶较黄芩叶在延长果蝇寿命方面效果稍佳。
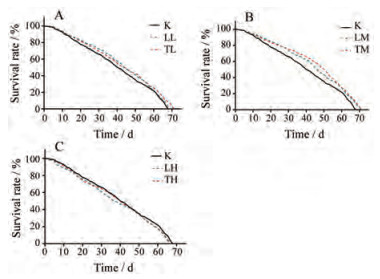
|
Figure 1 Lifespan curves of male Drosophila melanogaster in each group. A: Lifespan curves of K, LL and TL groups; B: Lifespan curves of K, LM and TM groups; C: Lifespan curves of K, LH and TH groups. K: Control group; LL: Low dose of Scutellaria baicalensis leaves group; LM: Medium dose of Scutellaria baicalensis leaves group; LH: High dose of Scutellaria baicalensis leaves group; TL: Low dose of Scutellaria baicalensis tea group; TM: Medium dose of Scutellaria baicalensis tea group; TH: High dose of Scutellaria baicalensis tea group |
| Table 1 Effects of Scutellaria baicalensis leaves (SLE) and Scutellaria baicalensis tea (STE) on lifespan of male Drosophila melanogaster. Mean: Mean lifespan; Median: Median lifespan; Max: Maximum lifespan. *P < 0.05, **P < 0.01, ***P < 0.001 vs K group; ###P < 0.001 vs LL group |
与空白对照组相比, 黄芩茶与黄芩叶对雄性果蝇摄食量没有明显影响(图 2A)。繁殖力测定结果表明, 与空白对照组相比, 黄芩叶与黄芩茶低、中剂量均可显著提高果蝇繁殖力。且对图 2B进一步分析可得, TM组比LM组提高果蝇繁殖力的效果更佳(P < 0.01) (图 2B)。
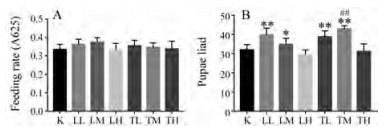
|
Figure 2 Effects of Scutellaria baicalensis leaves and Scutellaria baicalensis tea on food intake and fecundity of Drosophila melanogaster. A: Feeding rate of Drosophila melanogaster in each group. n = 15, x±s; B: Pupae Liad of Drosophila melanogaster in each group. n = 10, x±s. *P < 0.05, **P < 0.01 vs K group; ##P < 0.01 vs LM group |
结合每个代谢物的化学位移, 裂峰情况及偶合常数, 并且参照Chenomx NMR Suite (Chenomx Inc., Edmonton, AB, 加拿大), the Human Metabolome Database (HMDB), Biological Magnetic Resonance Data Bank (BMRB)数据库以及文献[17, 18]报道中数据, 对果蝇组织代谢产物进行指认, 共指认出42种内源性代谢产物, 结果见表 2, 图 3。
| Table 2 Peak attribution in 1H NMR spectra for main metabolites in tissues of D. melanogaster. 2-HPPA: 4-Hydroxyphenylpyruvic acid; IMP: Inosine monophosphate; AMP: Adenosine monophosphate |
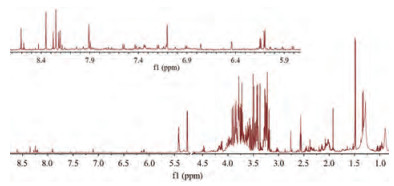
|
Figure 3 Typical 1H NMR spectrum of D. melanogaster from K group (K: Control 3 d). The metabolites labeled with numbers are listed in Table 2 |
1H NMR图谱提供了果蝇组织中内源性代谢物的基本信息, 为了进一步确定各组间的代谢物差异, 需要对复杂数据进行降维处理, 以消除多信息共存中的重叠部分而提取出主要成分进行分析。为了获得更加理想的组间分离及增强对分类贡献大的变量的识别, 所以采用偏最小二乘-判别分析(PLS-DA)方法对各组数据进行代谢轮廓分析。PLS-DA得分图(R2X= 0.898、R2Y = 0.843、Q2 = 0.417)显示K组与M组均明显分开, 表明伴随年龄的变化, 代谢轮廓会产生一定的变化。黄芩叶和黄芩茶组介于K组与M组之间, 说明给予SLE和STE后, 果蝇的衰老有明显改善作用(图 4A), 且黄芩茶低、中剂量组与M组分开的趋势更加明显, 表明黄芩茶低、中剂量组对30日龄的果蝇代谢产物回调作用更为显著。

|
Figure 4 Multivariate statistical analysis of the effect of SLE and STE on D. melanogaster metabolism. A: PLS-DA scores plots from K, M, TL, TM, LL and LM groups; B: Permutation test from PLS-DA; C: OPLS-DA scores plots from K group and M group; D: S-plot from OPLS-DA |
为了验证模型的可靠性, 对模型数据进行外部模型验证(R2X = 0.864、R2Y = 0.903、Q2 = 0.762, 图 4B), 结果表明R2与Q2参数接近, 模型斜率稍大且与纵轴截距为负值, 表明模型拟合良好, 预测有效、可信。对K和M组的数据进行有监督的OPLS-DA分析(R2X = 0.875、R2Y = 0.998、Q2 = 0.979, CV-ANOVA, P < 0.05, 图 4C)以筛选出与衰老相关的差异变量。OPLS-DA得分显示K组与M组显著分离, 表明衰老后机体代谢轮廓发生显著变化, 并结合S-plot得分图(图 4D)和VIP值, 对这些代谢物的峰面积进行独立样本t检验, 通过VIP > 1与P < 0.05筛选潜在生物标志物, 共确定14种相对峰面积具有显著性的差异代谢物(图 5)。与K组比较, M组果蝇中谷氨酰胺、α-酮戊二酸、甘氨酸、2-羟苯丙酮酸(2-HPPA)、肌氨酸、甘油、丙氨酸、肌苷、肌酐的显著降低, 乳酸、葡萄糖、N-乙酰谷氨酸显著升高。给予SLE 30天后, LL组能显著回调12个, LM组能显著回调13个。给予STE 30天后, TL组能显著回调14个, TM组能显著回调14个。表明SLE与STE对衰老果蝇潜在生物标志物有干预作用。

|
Figure 5 The effect of SLE and STE on the relative peak areas of D. melanogaster differential metabolites. n = 6, x±s. #P < 0.05, ##P < 0.01 vs K group; *P < 0.05, **P < 0.01 vs M group |
分别将来自黄芩叶组的13个与衰老相关的差异标志物和来自黄芩茶组的14个与衰老相关的差异标志物, 输入Metaboanalyst (http://www.Metaboanalyst.ca)数据库中进行代谢通路分析, 结果如图 6所示, 图 6中横坐标(pathway impact)表示由拓扑分析所计算出的代谢通路重要性值, 纵坐标-log P表示代谢通路富集分析的显著性水平。代谢通路的Pathway impact与-log P值越大, 不同组间代谢差异的相关性越高, 图中的圆圈就越大。本研究中将代谢通路影响值大于0.10的通路视为与衰老相关的靶标代谢通路。分别筛选黄芩叶和黄芩茶得到最相关的5条代谢通路, 且两者调控的通路相同, 分别为甘氨酸、丝氨酸和苏氨酸代谢; 丙氨酸、天冬氨酸和谷氨酸代谢; 乙醛酸和二羧酸酯代谢; 淀粉和蔗糖代谢和甘油酯代谢5条通路。图 6B中2号通路的pathway impact和-log P值大于图 6A中的2号通路的pathway impact和-log P值, 其余4条通路的这两个值都一样。由此可得, 黄芩茶干预后对丙氨酸、天冬氨酸和谷氨酸代谢这条通路的影响大于黄芩叶组。将这些代谢途径中相关的生物标志物相联系, 构建衰老相关的代谢网络示意图, 结果如图 7所示。
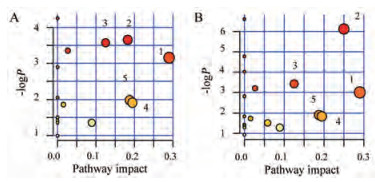
|
Figure 6 MetPA analysis of metabolic pathway of differential metabolomics in 1H NMR spectra of D. melanogaster. A: Regulation of SLE extracted on the metabolic pathway of Drosophila melanogaster with aging; B: Regulation of STE extracted on the metabolic pathway of Drosophila melanogaster with aging. 1: Glycine, serine and threonine metabolism; 2: Alanine, aspartate and glutamate metabolism; 3: Glyoxylate and dicarboxylate metabolism; 4: Starch and sucrose metabolism; 5: Glycerolipid metabolism |
|
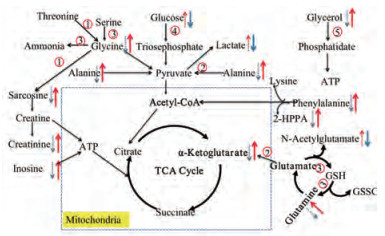
Figure 7 Metabolic network diagram associated with aging in Drosophila. The blue dotted arrow indicated that the metabolites in non-administered 30-day group (M group) decreased with age compared with that in 3 d control group (K group), and the red dotted arrow indicated that the metabolites in M group increased with age. The blue arrow indicated that the metabolites in SLE and STE groups decreased with age compared with that in M group, and the red arrow indicated that the metabolites in SLE and STE groups increased with age, but α-ketoglutarate was increased only in STE group. The numbers in the red circle indicated the pathways in which the metabolites participate, and the numbers correspond to those in Figure 6. ATP: Adenosine triphosphate; TCA cycle: Tricarboxylic acid cycle; GSH: Glutathione; GSSG: Glutathione (oxidized) |
甘氨酸和肌氨酸参与甘氨酸、丝氨酸和苏氨酸的代谢途径, 该途径为TCA循环提供重要的能量代谢前体。据报道, 甘氨酸是人体非必需氨基酸, 在人体合成代谢过程中具有重要作用, 其在体内主要是通过甘氨酸裂解酶系统参与代谢, 甘氨酸裂解酶系统主要存在于线粒体膜上[19]。研究表明, 肌氨酸是甘氨酸的甲基化衍生物, 在肌肉中以磷酸肌酸的形式存在, 而磷酸肌酸可促进ATP的合成, 机体主要靠ATP提供能量[20]。本研究结果显示分别给予黄芩叶与黄芩茶干预后甘氨酸和肌氨酸的含量发生回调。
谷氨酰胺、α-酮戊二酸和丙氨酸参与丙氨酸、天冬氨酸和谷氨酸代谢。据报道, 谷氨酰胺能促进营养物质的同化作用, 调节蛋白的合成, 刺激生长激素的产生, 同时也是体内铵盐的主要存在形式, 其可参与机体代谢, 含量伴随年龄的增长降低[21]。α-酮戊二酸作为TCA循环过程中的重要物质, 其含量降低可影响TCA循环过程和能量生成[22]。有研究报道, 丙氨酸是人体非必需氨基酸, 其作为糖酵解的重要中间产物之一, 可通过乙酰辅酶A和三羧酸循环实现体内糖、脂肪和氨基酸之间的相互转化, 参与机体代谢[23]。本研究结果显示分别给予黄芩叶与黄芩茶30天后, 果蝇体内的丙氨酸和谷氨酰胺含量显著增加。给予黄芩茶30天后, 机体内α-酮戊二酸含量显著增加。
研究表明, 乙醛酸和二羧酸酯代谢通路可以产生柠檬酸盐和琥珀酸盐, 参与机体能量代谢[24]。谷氨酸可通过转化为谷氨酰胺从而参与乙醛酸和二羧酸酯代谢途径; 丝氨酸通过相应的酶作用于甘氨酸从而参与乙醛酸和二羧酸酯代谢途径。本研究结果显示黄芩叶与黄芩茶干预后, 谷氨酰胺和甘氨酸两者含量显著回调。
机体能量代谢的主要来源为葡萄糖, 其参与淀粉和蔗糖代谢。随着年龄的增长, 机体细胞吸收葡萄糖的能力下降, 糖氧化代谢减缓, 能量代谢出现紊乱[25]。本研究结果显示黄芩叶与黄芩茶干预后, 机体内葡萄糖含量显著回调。
甘油是机体脂质合成和能量生成的必需物质[26], 其参与甘油酯代谢。本研究显示黄芩叶与黄芩茶干预后, 甘油含量显著回调, 该通路可调控能量代谢失衡从而延缓果蝇衰老。
综上所述, 本研究表明黄芩叶和黄芩茶水提物可以延缓果蝇寿命, 提高果蝇繁殖力且对果蝇摄食量没有影响。从代谢组学角度分析鉴定了14个与衰老相关的生物标志物, 黄芩叶与黄芩茶水提物干预后差异代谢物发生不同程度的回调, 同时经MetPA筛选得到最相关的5条代谢通路。本研究仅基于1H NMR技术的代谢组学进行数据分析, 对复杂机体的代谢物分析有一定的局限性。在未来的研究中, 将采用多种技术如LC-MS、GC-MS等开展代谢组学研究, 从而更全面阐述黄芩叶与黄芩茶对机体衰老过程的调节作用, 并结合其他组学技术, 进一步深入探索和阐明黄芩叶与黄芩茶延缓衰老的作用机制。
| [1] |
Gutteridge JM. Biological origin of free radicals, and mechanisms of antioxidant protection[J]. Chem Biol Interact, 1994, 91: 133-140. DOI:10.1016/0009-2797(94)90033-7 |
| [2] |
Ji XL. A review on chemical constituents and pharmacological effects of Radix[J]. Clin J Chin Med (中医临床研究), 2017, 9: 128-129. |
| [3] |
Huang WH, Lee AR, Yang CH. Antioxidative and anti-inflammatory activities of polyhydroxyflavonoids of Scutellaria baicalensis Georgi[J]. Biosci Biotechnol Biochem, 2006, 70: 2371-2380. DOI:10.1271/bbb.50698 |
| [4] |
Zhang Y, WU B, XU JW. Research progress of pharmacological effect of Scutellariae baicalensis Georgi[J]. Med Recapitul (医学综述), 2013, 19: 1091-1093. |
| [5] |
Cao Y, Liang L, Xu J, et al. The effect of Scutellaria baicalensis stem-leaf flavonoids on spatial learning and memory in chronic cerebral ischemia-induced vascular dementia of rats[J]. Acta Biochim Biophys Sin, 2016, 48: 437-446. DOI:10.1093/abbs/gmw024 |
| [6] |
He CN, Peng Y, Xiao W, et al. Application history and research status of Astragalus membranaceus[J]. Mod Chin Med (中国现代中药), 2011, 13: 3-7. |
| [7] |
Rubin GM, Lewis EB. A brief history of Drosophila's contributions to genome research[J]. Science, 2000, 287: 2216-2218. DOI:10.1126/science.287.5461.2216 |
| [8] |
Giot L, Bader JS, Brouwer C, et al. A protein interaction map of Drosophila melanogaster[J]. Science, 2003, 302: 1727-1736. DOI:10.1126/science.1090289 |
| [9] |
Swadhin CJ, Mónica BD, Bénédicte D, et al. Drosophila melanogaster as a model for basal body research[J]. Cilia, 2016, 5: 1-7. |
| [10] |
Puchades-Carrasco L, Pineda-Lucena A. Metabolomics in pharmaceutical research and development[J]. Curr Opin Biotechnol, 2015, 35: 73-77. DOI:10.1016/j.copbio.2015.04.004 |
| [11] |
Xu GW, Lu X, Yang SL. Recent advances in metabonomics[J]. Acta Acad Med Sin (中国医学科学院学报), 2007, 29: 701-711. |
| [12] |
Duan DD, Wang KX, Zhou YZ, et al. Baicalein exerts beneficial effects in d-galactose-induced aging rats through attenuation of inflammation and metabolic dysfunction[J]. Rejuvenation Res, 2017, 20: 506-516. DOI:10.1089/rej.2017.1919 |
| [13] |
Yan ML, Zhou YZ, Li MH, et al. Metabonomic study of alcohol extract from Scutellariae Radix in prolonging lifespan of Drosophila melanogaster based on 1H-NMR[J]. Chin Tradit Herb Drugs (中草药), 2016, 47: 1714-1722. |
| [14] |
Lin W, Chen J, Wang J, et al. The anti-aging effects of Ludwigia octovalvis on Drosophila melanogaster and SAMP8 mice[J]. Age, 2014, 36: 689-703. DOI:10.1007/s11357-013-9606-z |
| [15] |
Yan ML. Metabonomics Study on Drosophila melanogaster Gender Gap in Aging Process and Scutellaria baicalensis Georgi Anti-aging Pharmacological Activity (基于代谢组学的果蝇衰老过程性别差异及黄芩醇提物抗衰老活性研究)[D]. Taiyuan: Shanxi University, 2017.
|
| [16] |
Zhang Y, Aa JY, Wang GJ, et al. Organic solvent extraction and metabonomic profiling of the metabolites in erythrocytes[J]. J Chromatogr B, 2009, 877: 1751-1757. DOI:10.1016/j.jchromb.2009.04.041 |
| [17] |
Overgaard J, Malmendal A, Sorensen JG, et al. Metabolomic profiling of rapid cold hardening and cold shock in Drosophila melanogaster[J]. J Insect Physiol, 2007, 53: 1218-1232. DOI:10.1016/j.jinsphys.2007.06.012 |
| [18] |
Gey C, Seeger K. Metabolic changes during cellular senescence investigated by proton NMR-spectroscopy[J]. Mech Ageing Dev, 2013, 134: 130-138. DOI:10.1016/j.mad.2013.02.002 |
| [19] |
Barbara P, Sylvia S, Edith S, et al. Oral β-hydroxybutyrate supplementation in two patients with hyperinsulinemic hypoglycemia:monitoring of β-hydroxybutyrate levels in blood and cerebrospinal fluid, and in the brain by in vivo magnetic resonance spectroscopy[J]. Pediatric Res, 2002, 52: 301-306. DOI:10.1203/00006450-200208000-00025 |
| [20] |
Zhou Y, Zheng X, Liu X, et al. Metabonomic analysis of urine from chronic unpredictable mild stress rats using gas chromatography-mass spectrometry[J]. Chromatographia, 2012, 75: 157-164. DOI:10.1007/s10337-011-2167-3 |
| [21] |
Fuld JP. Creatine supplementation during pulmonary rehabilitation in chronic obstructive pulmonary disease[J]. Thorax, 2005, 60: 531-537. DOI:10.1136/thx.2004.030452 |
| [22] |
Holecek M. Branched-chain amino acids and ammonia metabolism in liver disease:therapeutic implications[J]. Nutrition, 2013, 29: 1186-1191. DOI:10.1016/j.nut.2013.01.022 |
| [23] |
Holecek M. Ammonia and amino acid profiles in liver cirrhosis:effects of variables leading to hepatic encephalopathy[J]. Nutrition, 2015, 31: 14-20. DOI:10.1016/j.nut.2014.03.016 |
| [24] |
Shu JS, Fang SS, Bing KX, et al. Anti-inflammation effect of Jinlingzi San in rat metabonomics based on 1H-NMR and LC-MS technology[J]. China J Chin Mater Med (中国中药杂志), 2017, 42: 363-369. |
| [25] |
Hoffman JM, Soltow QA, Li S, et al. Effects of age, sex, and genotype on high-sensitivity metabolomic profiles in the fruit fly, Drosophila melanogaster[J]. Aging Cell, 2014, 13: 596-604. DOI:10.1111/acel.12215 |
| [26] |
Mccabe CF, Perng W. Metabolomics of diabetes in pregnancy[J]. Curr Diab Rep, 2017, 17: 57. DOI:10.1007/s11892-017-0890-3 |
 2020, Vol. 55
2020, Vol. 55


