2. 北京市公安局司法鉴定中心 法庭毒物分析公安部重点实验室, 北京 100192;
3. 中国政法大学, 北京 100091
2. The Judicial Identification Center of Beijing Public Security, Key Laboratory of Forensic Toxicology, Ministry of Public Security, Beijing 100192, China;
3. China University of Political Science and Law, Beijing 100091, China
合成大麻素是全球滥用最为严重的新精神活性物质, 它含有类似传统大麻毒品的主要有效成分四氢大麻酚(Δ9-THC)的物质, 可以同时作用于中枢神经的大麻受体CB1和CB2, 产生比传统大麻毒品更强的药理生理作用。人类若摄入过量的合成大麻素, 会出现焦虑、麻木、癫痫、口齿不清和血压升高等症状, 极大地危害人体健康[1, 2]。
近几年, 由该类物质引发的急诊案例数目越来越多, 并与全球范围内不断出现的重度中毒、死亡案例有关[3-7]。由于近些年合成大麻素新型结构开始被立法管制, 地下制毒工厂也不断对这类物质的结构进行修改, 从2006年出现了JWH-073作为第一代萘甲酰吲哚类合成大麻素, 到2014年第一次检出吲哚酰胺类合成大麻素, 短短8年时间, 合成大麻素已经发展至第八代。目前, 国内外有报道的相关物质已达250多种[8]。
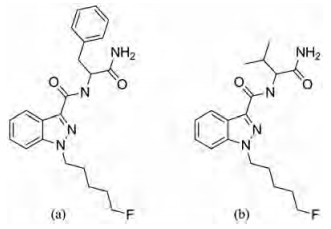
N-(1-氨甲酰基-2-苯基乙基)-1-(5-氟戊基)吲唑-3-甲酰胺(PX-2)为吲唑-3-甲酰胺类合成大麻素, 是N-(1-氨甲酰基-2-甲基丙基)-1-(5-氟戊基)吲唑-3-甲酰胺(5F-AB-PINACA)结构的衍生物(图 1)。2015年PX-2在瑞典首次被检出, 随后多次在国内外毒品缴获物中被发现。2016年, 我国警方缴获99包可疑物质, 通过气相色谱-质谱联用(GC-MS)对其进行定性定量分析, 结果显示其中48包为PX-2[9]。近几年PX-2不断出现在国际毒品市场上, 具有很强的滥用可能性, 引起各国禁毒部门的高度重视[10, 11]。2015年美国路易斯安那州议会通过将该物质列为危险物质, 瑞典等国家陆续将这一物质列为危险物质[12]。我国于2018年9月1日起实施的《非药用类麻醉药品和精神药品管制品种增补目录》将PX-2列入管制精神药品[13]。
|
Figure 1 Chemical structure of N-(1-amino-1-oxo-3-phenylpropan-2-yl)-1-(5-fluoropentyl)-1H-indazole-3-carboxamide (PX-2, a) and N-[1-amino-3-methyl-1-oxobutan-2-yl]-1-(5-fluropentyl)-1-pentylindazole-3-carboxamide(5F-AB-PINACA, b) |
由于吲唑酰胺类SCs只需要很小的吸食量就会产生麻醉、兴奋的作用, 且进入体内代谢迅速, 尿液中几乎无原药检出, 检验难度很大[14]。因此急需通过推断这类物质的代谢过程确定代谢标志物, 为建立生物样品中该类毒品的检验方法提供依据。由于健康伦理及法律等问题, 难以通过人体进行体内代谢研究, 而且针对这类物质的人体阳性样本收集难度大, 对真实样本进行代谢物分析的文献报道较少。Haschimi等[15]对4F-MDMB-BINACA的尿液阳性样本进行了Ⅰ、Ⅱ相代谢分析, 其中Ⅱ相代谢物均为葡萄糖醛酸化的代谢物。另外, 大鼠等其他动物可用于代谢研究, 但实验过程复杂、操作难度大、目标物浓度低、成本高[16]。人肝微粒体体外温孵法可以模拟人体代谢过程, 目前已应用于医药学领域, 具有简便、快捷等优点, 在法庭科学领域对新型毒品代谢物的研究方面也具有很好的应用推广前景。
目前, 国外的相关研究仅Cooman等[17]报道了通过肝微粒体温孵系统分析PX-2的部分Ⅰ相代谢物。本研究结合人肝微粒体体外温孵法, 采用液相色谱Q Exactive™ HF组合型四极杆Orbitrap质谱联用技术分析了PX-2体外人肝微粒体Ⅰ相、Ⅱ相代谢物, 确定了潜在的代谢标志物, 并推断代谢途径, 从而为公安禁毒实战中合成大麻素PX-2的检验提供依据。
材料与方法仪器与试剂 Q Exactive™ HF组合型四极杆Orbitrap质谱(美国Thermo Fisher Scientific公司); GL-21M高速冷冻离心机(上海卢湘仪离心机仪器有限公司); AL104 Mettler Toledo电子天平(瑞士Mettler Toledo公司); Mill-Q去离子水(德国Merck公司); VORTEX 2涡旋定速混匀器(德国IKA公司)。PX-2对照品(1 mg·mL-1, 法庭毒物分析公安部重点实验室, 北京)。乙腈、甲醇、甲酸和超纯水(德国Merck公司)。肝微粒体(pHLM)、NADPH再生A液和NADPH再生B液、0.1 mol·L-1磷酸盐缓冲溶液(北京iPhase生物科技有限公司)。尿苷二磷酸葡萄糖醛酸(UDPGA, 上海Rild肝脏研究所)。
LC-QE-HF-MS分析条件
色谱条件 选择Thermo Hypersil GOLD C18 (50 mm×2.1 mm, 1.9 μm)色谱柱。采用流动相A为5 mmol·L-1甲酸铵, 0.1%甲酸/水、流动相B为0.1%甲酸/乙腈进行梯度洗脱, 共13 min。洗脱程序按以下方式进行: 0~0.5 min为5%流动相B和95%流动相A, 0.5~6.5 min流动相B从5%增加到95%, 6.5~11.5 min保持流动相B为95%洗脱, 11.5~13 min降低至5%流动相B, 至洗脱结束, 流速0.3 mL·min-1, 柱温30 ℃[18]。
质谱条件 离子化模式:电喷雾电离源(H-ESI); 喷雾电压: 3.8 kV; 电子能量: 15、35、55 eV; 离子源温度: 320 ℃; 传输线温度: 350 ℃; 采集模式:正离子全扫描(Full scan); 质量分辨率: 60 000;自动增益控制(AGC), 106; 扫描范围: m/z 50~1 000。
体外人肝微粒体代谢模型实验 取PX-2标准溶液2 μL, 加入到NADPH再生系统溶液(含NADPH再生液A 10 μL、NADPH再生液B 2 μL、肝微粒体10 μL、0.1 mol·L-1磷酸盐缓冲液178 μL, 终体积为200 μL)中, 在37 ℃条件下温孵60 min。再加入葡萄糖醛酸(UDPGA) 10 μL, 孵育30 min。向反应体系中加入冰乙腈200 μL终止反应, 在4 ℃, 15 000×g下离心10 min, 提取上清液后进样, 用TranceFinder 4.1通用版(美国Thermo Fisher Scientific)对样品进行数据采集并分析。
用相同的方法做两个对照样品A和B。其中, A样品组成为: NADPH再生液A 10 μL、NADPH再生液B 2 μL、0.1 mol·L-1磷酸盐缓冲液188 μL, B样品组成为:肝微粒体10 μL、0.1 mol·L-1磷酸盐缓冲液190 μL。
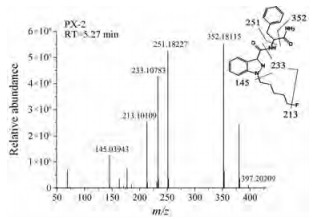
结果与讨论 1 PX-2 (原药)的质谱分析PX-2的保留时间为5.27 min, 在m/z 397.203 43 (C22H25FN4O2)处形成质子化分子离子[M+H]+, 图 2所示为带有化学结构和特征碎片结构的质谱图。PX-2经过裂解产生的特征离子, m/z 352 (C21H23FN3O1+)是由酰胺键断裂形成, 特征峰强度最高; m/z 251 (C13H14FN3O+)是由C-N键断裂形成; m/z 233 (C13H13N2OF+)是吲唑酰胺基团的C-N键断裂后形成碎片离子, 在此基础上, 戊烷基链尾端的C-F键断裂形成m/z 213 (C13H13N2O+)的特征离子, 或脱去5-氟戊基形成m/z 145 (C8H5N2O+)。
|
Figure 2 Mass spectra of PX-2 |
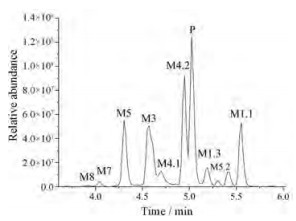
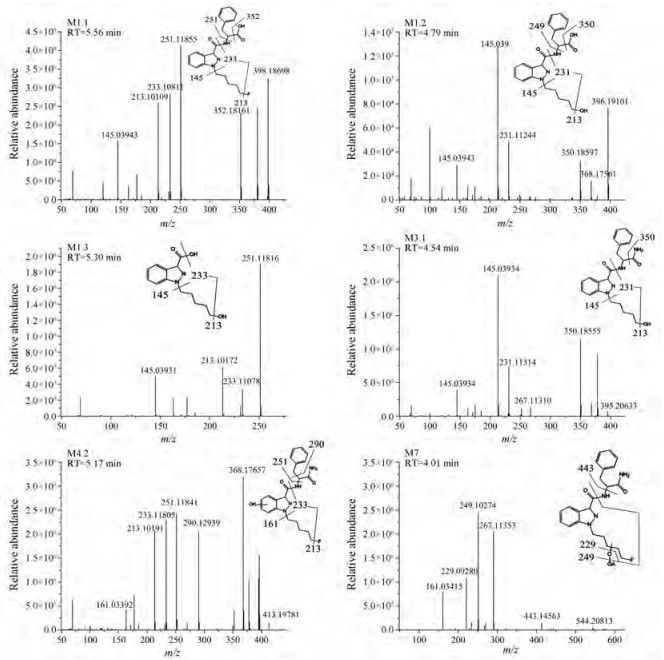
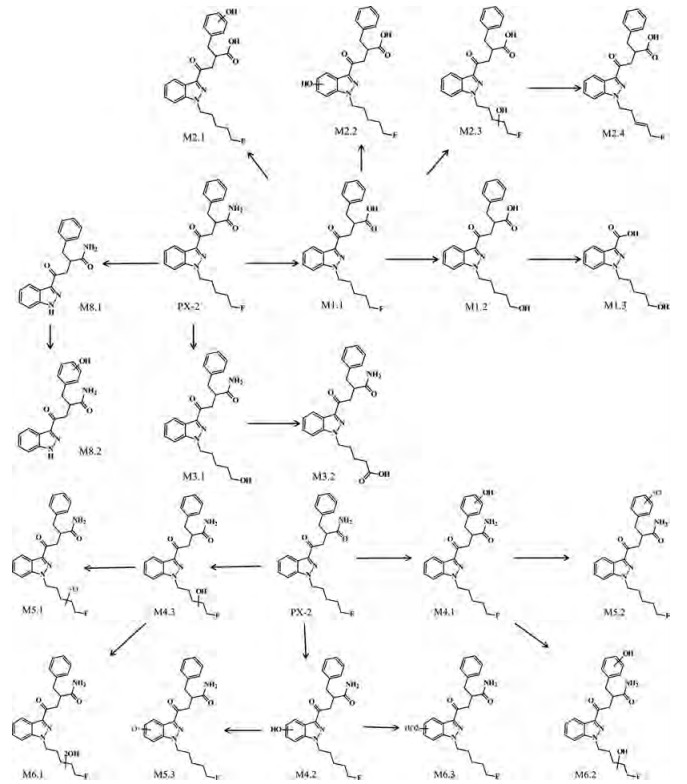
实验研究了吲唑酰胺类合成大麻素PX-2的代谢过程, 采用LC-QE-HF-Orbitrap-MS技术, 发现并鉴定了18种Ⅰ相体外代谢物和3种葡萄糖醛酸化的Ⅱ相体外代谢物, 图 3是21种代谢物的色谱图。PX-2的主要生物转化途径是单羟基化, 在酰胺位置的水解产物是主要代谢物。水解的PX-2还会发生羟基化和脱氢等生物转化途径。表 1总结了实验过程中鉴定的所有代谢产物信息, 包括生物转化反应类型、代谢物保留时间、质子化分子离子[M+H]+质量数(m/z)、代谢物峰面积、化学结构式、特征离子碎片及误差。其中, 原药标记为P, 代谢物标记为M。图 4是21种代谢物的质谱图及碎片结构信息。
|
Figure 3 Combined extracted ion chromatograms of PX-2's metabolites (M1-M8) identified in human liver microsomes |
| Table 1 Identification of PX-2 metabolites after 60 min incubation with human liver microsomes |
|
Figure 4 Chemical structure and mass spectrum of main metabolites of PX-2 |
M1组包括3种代谢物, 其中M1.1 (C22H24FN3O3)是主要代谢物, 经过氧化脱氮再羟基化形成, 保留时间为5.56 min, 质子化的分子离子[M+H]+为m/z 398.187 45, 产生的主要碎片结构与PX-2相同, 只是产生m/z 352时脱去的碎片分别为-CONH2和-COOH。M1.1在戊烷基链氧化脱氟再羟基化形成M1.2 (C22H25N3O4, [M+H]+ m/z 396.191 78), 其特征碎片m/z 350、249、231分别是M1.1的特征碎片m/z 352、251、233脱氟加羟基形成。M1.1酰胺基处C-N键容易断裂, 脱去苯丙氨酸后羟基化形成M1.3 (C13H15FN2O2, [M+H]+ m/z 251.119 03), 其特征碎片m/z 233、213、145与M1.1一致。
另外, M1.1还可以在苄基、戊烷基链以及吲唑环上的羟基化形成代谢物M2.1~2.4, 结构式均为C22H24FN3O4, m/z 414.182 36, 属于同分异构体。M2.2在m/z 161处有特征碎片, 是由m/z 145羟基化形成, 说明羟基化位点在吲唑环的苯环上。M2.3的特征碎片m/z 249和m/z 267分别是M1.1的特征碎片m/z 233和m/z 251的羟基化产物, 且在M2.3的特征碎片中没有m/z 161, 所以确定其羟基化位点在戊烷基链上。M2.1的特征碎片m/z 369是M1.1的特征碎片m/z 352羟基化形成的, M2.1的其他特征碎片与M1.1相似, 说明羟基化位点在脱去中性离子的苯环上。
2.2 M3代谢物分析M3组代谢物是由PX-2的戊烷基链尾端羟基化形成。M3.1 (C22H24N4O4, [M+H]+ m/z 395.207 77), 其特征碎片m/z 350和m/z 231是M1.1的特征碎片m/z 352和m/z 233经戊烷基链尾端脱氟, 再羟基化形成。羟基进一步氧化成羧基M3.2 (C22H24N4O4, [M+H]+ m/z 409.187 03), 特征碎片m/z 364、245分别是M3.1的特征碎片m/z 350、231氧化形成, 且M3.2的特征碎片m/z 217 (C12H13O2N2+)也说明戊烷基链上有羧基存在。
2.3 M4、M5、M6、M7代谢物分析M4.1~4.3是PX-2在苄基、戊烷基链以及吲唑环的羟基化代谢物(C22H25FN4O3, [M+H]+ m/z 413.198 35), 三者为同分异构体。M4.2的特征离子存在特征碎片m/z 161, 但无m/z 145, 说明羟基化位点在吲唑环的苯环上。M4.3的特征碎片m/z 249和m/z 229分别是PX-2的特征碎片m/z 233和m/z 213经羟基化形成。M4.1的特征碎片m/z 368是PX-2的特征碎片m/z 352羟基化形成的, 且存在的特征碎片m/z 251、233、213与PX-2相同, 说明羟基化位点在脱去中性离子的苯环上。
M5.1 (C22H23FN4O3, [M+H]+ m/z 411.182 7)是在M4.3羟基化位点再氧化生成酮。M5.3 (C22H23FN4O3, [M+H]+ m/z 411.182 7)在m/z 265、247、227处存在特征碎片, 分别是PX-2的特征碎片m/z 251、233、213在苯环上发生环氧化形成, 说明环氧化位点在吲唑的苯环上。M5.2 (C22H23FN4O3, [M+H]+ m/z 411.182 7)的特征碎片m/z 366是M4.1的特征碎片m/z 368发生环氧化形成, 且其他特征碎片与M4.1一致, 说明环氧化发生的位点在脱去中性离子的苯环上。
双羟基化也是吲唑酰胺类合成大麻素的常见代谢途径, M6组代谢物(C22H25FN4O4, [M+H]+ m/z 429.193 26)就包括了3种PX-2的双羟基化代谢物M6.1-M6.3, M6.1和M6.3的双羟基化位点与M4的羟基化位点一致。M6.2的特征碎片m/z 384是由PX-2的特征碎片352双羟基化形成, 但M6.1的特征碎片m/z 267是PX-2的特征碎片m/z 251单羟基化形成, 说明该物质是双羟基化代谢物, 但羟基化位点不同, 在戊烷基链上存在一个羟基化位点, 且M6.2存在特征碎片m/z 145和m/z 163, 说明羟基化位点不在吲唑环上, 因此M6.2的双羟基化分别在戊烷基链和苄基上形成。
M7组代谢物是一组Ⅱ相代谢物(C28H33FN4O9, [M+H]+ m/z 589.230 43), 由M4组代谢物分别在羟基化位点与葡萄糖醛酸结合, 形成M7.1~M7.3。
2.4 M8代谢物分析PX-2的结构在吲唑环上的N原子脱戊烷基链, 形成M8.1 (C17H16N4O2, [M+H]+ m/z 309.134 60), 在m/z 264、163、145存在特征碎片, 且PX-2中含有戊烷基链的特征碎片m/z 251、233、213与M8.1的特征碎片完全不同, 说明这一代谢物是脱5-氟戊烷基形成。M8.1在苄基经过羟基化形成M8.2, M8.2 ([M+H]+ m/z 310.118 62)的特征碎片m/z 308和m/z 280分别是M8.1的特征碎片m/z 292和m/z 264羟基化形成, 且m/z 145和m/z 163说明羟基化位点不在吲唑环, 由此说明羟基化位点在苄基上。
2.5 代谢途径推断PX-2的Ⅰ相代谢物主要通过羟基化形成, 由于该物质在甲酰胺上的氨基在代谢过程中易被氧化脱去氮形成羟基化代谢物, 在代谢过程中PX-2原药首先脱氨基羟基化后形成M1.1, 其峰面积为4.13×106, 在所鉴定的代谢物中含量最高, 因此M1.1是PX-2的主要代谢物。在M1.1的苄基、吲唑环和戊烷基链位点分别羟基化形成M2.1、M2.2、M2.3。通过对PX-2的结构分析, 除了在氨基位点容易断裂外, 戊烷基链尾端的氟也容易被氧化脱去形成羟基化代谢物M1.2和M3.1。氧化脱氟的羟基化代谢物进一步氧化成羧基, 形成M3.2, 这一过程与人体内药物代谢最终形成羧酸排出体外一致。M4.1、M4.2、M4.3是在苄基、吲唑环以及戊烷基链上的位点直接羟基化形成代谢物。因为羟基化是Ⅰ相代谢的主要途径, 且PX-2的结构中可以羟基化的位点较多, 通过分析不同位点的特征碎片, 得到该物质的代谢途径。葡萄糖醛酸化是Ⅱ相代谢的主要途径。Ⅰ相代谢物在其羟基化位点与葡萄糖醛酸的氧结合形成Ⅱ相代谢物, M7.1~7.3是PX-2在羟基化后, 再经过葡萄糖醛酸化形成的Ⅱ相代谢物。图 5阐释了PX-2的模拟人体代谢过程的代谢途径。
|
Figure 5 Metabolic pathway of PX-2 in human |
实验中有两组空白对照, 在未加肝微粒体的样品中没有检测出代谢物, 说明代谢物是由肝微粒体模拟人体代谢产生。另一组未加NADPH还原辅酶的样品中, 仅检测出通过酰胺水解的代谢物M1.1 (m/z 398.187 45), 说明NADPH还原辅酶是药物在生物转化反应中不可缺少的辅助条件。
2.7 确定代谢标志物新一代吲唑酰胺类合成大麻素的代谢途径主要是酰胺水解、酯水解以及羟基化代谢[19]。通过比较实验鉴定了21种代谢物色谱峰面积的大小(表 2), 结果可知, M1.1、M4.2、M3.1和M1.3是色谱峰面积最大, 含量最高的4种代谢物。这一类合成大麻素如5F-ADBICA和5F-AB-PINACA在吲唑酰胺基团处C-N键断裂后, 羟基化也可形成M1.3 [20]。因此, 单独鉴定出代谢物M1.3不足以表明吸食人员摄入了PX-2。推荐M1.1、M4.2、M3.1联合M1.3作为PX-2物质的代谢标志物。
| Table 2 Basic information on potential poisoning markers in PX-2 |
本文提出了一种简便快捷的鉴定PX-2的代谢物及代谢途径的方法, 通过人肝微粒体模拟人体外代谢模型, 利用液相色谱Q Exactive™ HF组合型四极杆Orbitrap质谱联用技术分析代谢物。实验结果发现, PX-2在肝微粒体中模拟人体代谢过程, 产生18种Ⅰ相体外代谢物和3种葡萄糖醛酸化的Ⅱ相体外代谢物, 其中Ⅰ相代谢途径有酰胺水解、氟代戊烷基侧链氧化脱氟、苄基羟基化、吲唑环羟基化等。从代谢物的色谱峰面积得知, M1.1、M4.2、M3.1、M1.3峰面积最大, 含量最高, 但其中M1.3不能单独作为代谢标志物, 要与M1.1、M4.2、M3.1相结合, 加以判断。下一步可以通过制备代谢物对照品对以上代谢物结构加以证实。
PX-2代谢实验结果显示, PX-2在生物体内稳定性低, 会被迅速代谢。本研究虽然通过体外肝微粒体温孵模型鉴定了代谢物并推荐了代谢标志物, 但仍需进一步收集分析真实血尿等生物检材, 与其中的代谢物对比筛查, 进一步确认最终代谢标志物, 为公安禁毒工作和司法实践中对这一物质及其吸食者实施有效监控提供更加有力的依据。
| [1] |
Sekuła K, Zuba D, Lorek K. Analysis of fragmentation pathways of new-type synthetic cannabinoids using electrospray ionization[J]. J Am Soc Mass Spectrom, 2018, 29: 1941-1950. DOI:10.1007/s13361-018-2008-9 |
| [2] |
Lin K, Wang JF, Xu DQ. Research progress in methods for determination of synthetic cannabinoids[J]. Chem Bull (化学通报), 2017, 80: 334-340. |
| [3] |
Malaca S, Busardò FP, Gottardi M, et al. Dilute and shoot ultra-high performance liquid chromatography tandem mass spectrometry (UHPLC-MS/MS) analysis of psychoactive drugs in oral fluid[J]. J Pharm Biomed Anal, 2019, 170: 63-67. DOI:10.1016/j.jpba.2019.02.039 |
| [4] |
Hess C, Stockhausen S, Kernbach-Wighton G, et al. Death due to diabetic ketoacidosis:induction by the consumption of synthetic cannabinoids?[J]. Forensic Sci Int, 2015, 257: 6-11. DOI:10.1016/j.forsciint.2015.08.012 |
| [5] |
Shanks K G, Behonick G S. Death after use of the synthetic cannabinoid 5F-AMB[J]. Forensic Sci Int, 2016, 262: 21-24. DOI:10.1016/j.forsciint.2016.03.004 |
| [6] |
Chinnadurai T, Shrestha S, Ayinla R. A curious case of inhalation fever caused by synthetic cannabinoid[J]. Am J Case Rep, 2016, 17: 379-383. DOI:10.12659/AJCR.898500 |
| [7] |
Coppola M, Mondola R, Oliva F, et al. Treating the phenomenon of new psychoactive substances:synthetic cannabinoids and synthetic cathinones[J]. Am J Case Rep, 2016, 1: 679-686. |
| [8] |
Franz F, Jechle H, Wilde M, et al. Structure-metabolism relationships of valine and tert-leucine-derived synthetic cannabinoid receptor agonists:a systematic comparison of the in vitro phase Ⅰ metabolism using pooled human liver microsomes and high-resolution mass spectrometry[J]. Forensic Toxicol, 2019, 37: 316-329. DOI:10.1007/s11419-018-00462-x |
| [9] |
Cui MW, Wu B, Cao Y. Gas chromatography-mass spectrometry 5F-AMB, PX-2, FUB-PB-22 qualitative and quantitative analysis[J]. J China Crim Police Coll (刑警学院学报), 2018, 5: 111-114. |
| [10] |
UNODC. The Challenge of New Psychoactive Substances[R/OL]. New York: UNODC. 2013-03-12[2019-10-20]. https://www.unodc.org/unodc/en/scientists/the-challenge-of-new-psychoactive-substances-global-smart-programme.
|
| [11] |
Evans-Brown M. New psychoactive substances in Europe. An update from the Early Warning System[R/OL]. Lisbon: EMCDDA. 2015-03-26[2019-10-20]. http://www.emcdda.europa.eu/publications/rapid-communications/2015/new-psychoactive-substances_en.
|
| [12] |
Canazza I, Ossato A, Trapella C, et al. Effect of the novel synthetic cannabinoids AKB48 and 5F-AKB-48 on "tetrad", sensorimotor, neurological and neurochemical responses in mice. In vitro and in vivo pharmacological studies[J]. Psychopharmacology, 2016, 233: 3685-3709. DOI:10.1007/s00213-016-4402-y |
| [13] |
CFDA. The Supplementary List of Non-medicinal Narcotic Drugs and Psychotropic Substances[R/OL]. Beijing: CFDA. 2018-10-01[2019-10-20]. http://samr.sfda.gov.cn/WS01/CL0056/130753.html.
|
| [14] |
Li C, Wang JF, Xu DQ, et al. In section of phase Ⅰ metabolites of synthetic cannabinoid JWH-073 in human liver microsomes by ultra high performance liquid chromatography-high resolution mass spectrometry[J]. Phys Test Chem Anal (理化检验化学分册), 2019, 55: 869. |
| [15] |
Haschimi B, Mogler L, Halter S, et al. Detection of the recently emerged synthetic cannabinoid 4F-MDMB-BINACA in 'legal high' products and human urine specimens[J]. Drug Test Anal, 2019, 11: 1377-1386. DOI:10.1002/dta.2666 |
| [16] |
Li J, Hua ZD, Wang YM. Analysis of metabolites and metabolic pathway of 5F-AMB in vitro using UPLC-HR-MS[J]. Acta Pharm Sin (药学学报), 2017, 52: 1743-1747. |
| [17] |
Cooman T, Bell S. In vitro metabolism of the synthetic cannabinoids PX-1, PX-2, and PX-3 by high resolution mass spectrometry and their clearance rates in human liver microsomes[J]. Rapid Commun Mass Spectrom, 2019, 33: 1816-1825. DOI:10.1002/rcm.8543 |
| [18] |
Xu D, Zhang W, Li J, et al. Analysis of AMB-FUBINACA biotransformation pathways in human liver microsome and zebrafish systems by liquid chromatography-high resolution mass spectrometry[J]. Front Chem, 2019, 7: 240. DOI:10.3389/fchem.2019.00240 |
| [19] |
Kavanagh P, Grigoryev A, Krupina N. Detection of metabolites of two synthetic cannabimimetics, MDMB-FUBINACA and ADB-FUBINACA, in authentic human urine specimens by accurate mass LC-MS:a comparison of intersecting metabolic patterns[J]. Forensic Toxicol, 2017, 35: 284-300. DOI:10.1007/s11419-017-0356-y |
| [20] |
Hsin-Hung Chen M, Dip A, Ahmed M, et al. Detection and characterization of the effect of AB-FUBINACA and its metabolites in a rat model[J]. J Cell Biochem, 2016, 117: 1033-1043. DOI:10.1002/jcb.25421 |
 2020, Vol. 55
2020, Vol. 55


