气管插管是药理学研究的重要方法之一, 是构建多种呼吸系统疾病模型及气道内给药的有效手段。虽然无创气管插管在临床中应用十分普遍, 但在实验动物上进行这一操作却存在很大挑战, 特别是对小鼠进行气管插管。小鼠气道直径较小, 进行气管插管时很难正确观察到气道位置, 容易将插管插入食道造成食道或咽部损伤。早在1999年Brown等[1]就发表了关于小鼠气管插管的方法。这一技术被广泛应用于肺功能检测及支气管灌洗[2]。随后便有很多研究针对小鼠气管插管进行改进并提供相应的解决方案[3-6]。虽然这些方案均可成功进行小鼠气管插管, 然而这些操作方法的便捷性以及设备的可及性并不尽如人意, 绝大多数操作需要专业培训且操作成本较高。在这些报道中, 大多小鼠气管插管的方法依赖大型冷光源或者检耳镜, 导致操作较为复杂或后续操作不便, 且普遍存在的主要问题是, 当插管接近气管时, 插管本身会挡住光线, 因此操作会在最关键的步骤时变得困难。理想的小鼠气管插管方法应当符合硬件设备体积小且易获得, 操作过程简单便捷, 操作时视野暴露完全, 对小鼠气道及其他组织结构损伤小, 重现性好等特点。应用恰当的小鼠气管插管可以实现小鼠气道给药、肺功能测定、病毒感染和肺部损伤造模等操作。其中, 有些操作需要对同一小鼠进行反复气管插管, 这就要求操作不能给实验动物带来损伤。本研究提供了一种简单便捷的小鼠无创气管插管方法, 同时应用此方法绘制了小鼠肺功能发育曲线, 并完成了气道内给药造模等操作。
材料与方法试剂 博莱霉素(bleomycin, BLM)购自日本化药株式会社; 羟脯氨酸检测试剂盒购自南京建成生物工程技术有限公司; Masson三色染色试剂盒购自上海碧云天生物技术有限公司。
气管插管工具 套管: 10~15 g小鼠使用22 G套管针, 套管长度为16 mm, 体重大于15 g的小鼠使用20 G套管针, 套管长度为20 mm (图 1A)。导丝:直径0.4 mm直导丝, 材质为聚丙烯(图 1B)。光源:卡兰德新专利X6型光导纤维自然色冷光手电(图 1C和D)。自制小鼠插管平台:使用泡沫塑料板作为平台底座, 底座上倒放置一U型铁丝用于固定小鼠体位(图 1E)。

|
Figure 1 The equipment of mouse trachea intubation. A: Intubation cannula: deep access Ⅳ catheters, 22 G, 16 mm (blue) for mice with body weight of 10-15 g, deep access Ⅳ catheters, 20 G, 20 mm (red) for mice with body weight over 15 g; B: Guide wire with diameter of 0.4 mm; C, D: Optical fiber flashlight with natural color; E: Self-made operating pad for mouse trachea intubation |
气管插管步骤 将麻醉后小鼠腹部朝下, 上门牙悬挂于操作台弯曲的铁丝上, 使用冷光源照射小鼠颈部皮肤。用一弯头镊子将小鼠舌头拉出, 用另一镊子伸入小鼠口腔, 同时观察口腔内光线。若光线不足可调整冷光源照射位置, 以确保小鼠口腔内的可视性。用伸入口腔镊子一端顶住小鼠上颚, 一端压住小鼠舌根, 尽量暴露视野, 并在冷光源的辅助下观察声带的位置(图 2A, 见视频1)。注意小鼠气管位置较为贴近舌根, 在食管靠颈后侧, 但食管在操作时并不可见其开口, 因此应当密切注意声带处变化, 以便进行后续操作。在冷光源照射下小鼠气管开口处为一亮点, 且跟随小鼠呼吸声带会横向开合, 若观察不到声带位置可调整视线角度, 直至看到开合的声带便可进行下一步操作。对于10~15 g的小鼠采用22 G套管针插管, 对于15 g以上的小鼠采用20 G套管针插管。将套管针套于导丝上, 导丝露出套管针顶部约10 mm。使用导丝将套管针引导至气管后(图 2B, 箭头指引部位为导丝, 见视频2), 取回导丝, 将套管针推入小鼠气管完成插管(图 2C, 见视频3)。每只小鼠可以使用一个新的无菌套管针和导丝, 但是在75%的乙醇中消毒后也可重复使用该插管及导丝。插管后将小鼠从操作台上取下, 平躺于操作台面上, 用手指堵住插管针一端, 若观察到小鼠呼吸频率及幅度减慢, 松开手指后小鼠呼吸频率及幅度恢复至原先水平, 即代表插管成功。本研究所使用套管针长度可保证在进行气管插管后套管针开口部位位于支气管分叉上方3~6 mm (图 2D)。

|
Figure 2 The procedure of mouse trachea intubation. A: Expose of the vocal cords; B: A guide wire is inserted into the trachea, the arrowhead represents guide wire; C: The cannula is inserted through the guide wire; D: The analysis of the position of cannula |
肺纤维化动物模型 本实验所有动物实验均通过中国医学科学院药物研究所伦理审查委员会审查。雄性C57BL/6J小鼠, SPF级别, 体重20 g左右, 6~8周龄, 购自斯贝福(北京)生物技术有限公司(实验动物许可证号002802)。多次BLM诱导肺纤维化模型制备方法:小鼠隔夜禁食, 使用三溴乙醇麻醉小鼠, 气管内给予BLM (1 U·kg-1)。使用气管插管或滴鼻方法向气管内给予50 μL BLM, 并迅速旋转操作板, 使BLM能够均匀进入肺叶, 而后直立放置5 min。整个操作在约60 ℃左右的手术操作台进行。小鼠2周造模1次, 总共6次[7]。
小鼠肺功能检测 小鼠使用三溴乙醇麻醉后置于Flexivent小动物肺功能系统上(flexiVent, SCIREQ Inc公司)。小鼠设定通气量为10 mL·kg-1, 呼吸频率为每分钟150次, 小动物肺功能分析仪检测小鼠的吸气、呼气气道阻力和肺顺应性等数据, 并进行数据分析[8]。
病理评分 取材后的小鼠肺组织, 经4%多聚甲醛固定之后, 脱水后石蜡包埋, 切成4 μm厚度的肺切片。进行Masson三色染色, 并做炎症评分, 得分越高, 说明炎症损伤程度越大。Ashcroft评分标准: 0分:正常肺组织; 1分:肺泡或支气管壁轻微增厚; 3分:肺泡或支气管壁中度增厚, 但不伴有明显的肺泡结构紊乱; 5分:肺泡结构受到破坏, 条索状纤维带或小范围纤维灶形成; 7分:肺泡结构被严重破坏, 广泛的纤维灶形成, 蜂窝状肺可归于此级; 8分:全视野纤维化病变; 2、4、6分介于相应的分数之间。
羟脯氨酸含量检测 称量小鼠左肺湿重, 匀浆后取200 μL上清, 在玻璃试管中加入550 μL的水解液, 混匀后在95 ℃水解20 min。调节pH值后定容, 使用活性炭处理后, 离心取上清。按照试剂盒说明书进行操作, 测各管的吸光度, 使用吸光度计算羟脯氨酸的含量, 详见南京建成羟脯氨酸测定试剂盒。
小鼠肺功能发育测定 测定小鼠肺功能体重发育曲线时选择体重10~12 g雄性C57BL/6J小鼠, 每周测量小鼠肺功能, 直至小鼠体重超过25 g。测定小鼠肺功能周龄发育曲线时选择周龄4周的雄性C57BL/6J小鼠, 每周测量小鼠肺功能, 直至小鼠9周龄。
小鼠气道内给药可及性 使用气管插管法或滴鼻法向小鼠气管内给予50 μL印度墨水, 并迅速旋转操作板, 使墨水能够均匀进入肺叶, 而后直立放置5 min。随后取出小鼠肺脏, 计算印度墨水染色面积。
统计学分析 除炎症评分外, 文中的结果采用均值±标准差(x±s)表示, 两组之间的均值比较采用Student's t检验, 多于两组的组间分析使用one-way ANOVA Tukeys' multiple comparison检验; 炎症评分的结果使用箱线图来展示, 统计采用卡方检验进行显著性分析。
结果 1 小鼠肺功能发育曲线脏器功能发育是研究药物及病理生理的重要指标, 本研究使用上述无创气管插管法对一组固定小鼠进行肺功能测定, 绘制肺功能体重曲线和肺功能周龄曲线。结果显示, 10 g体重下小鼠深吸气量为0.49 mL, 18~20 g时增加至0.99 mL (图 3A); 10 g体重下小鼠动态弹性为1.45 cmH2O·s·mL-1, 18~20 g时降低至0.82 cmH2O·s·mL-1 (图 3B); 10 g体重下小鼠动态阻力为55.72 cmH2O·mL-1, 18~20 g时降低至31.62 cmH2O·mL-1 (图 3C); 10 g体重下小鼠动态顺应性为0.018 4 mL·cmH2O-1, 18~20 g时增加至0.035 6 mL·cmH2O-1 (图 3D); 10 g体重下小鼠主气道阻力为0.79 cmH2O·mL-1, 18~20 g时降低至0.289 cmH2O·mL-1 (图 3E); 10 g体重下小鼠组织衰减为9.71 mL·cmH2O-1, 18~20 g时降低至6.05 cmH2O·mL-1 (图 3F), 由此可见小鼠体重在18~20 g时肺功能发育成熟。与肺功能体重曲线相比, 肺功能周龄曲线有很多相似之处。小鼠深吸气量及动态顺应性由第4周龄起增加至8周龄时到达平台期(图 3G和J)。小鼠动态弹性、动态阻力、主气道阻力和组织衰减由第4周龄起降低至8周龄时到达平台期(图 3H、I、K、L), 说明小鼠于8周龄时肺功能发育成熟, 同时证明本研究所提供气管插管方法可无创对同一实验动物反复操作。

|
Figure 3 Growth curve of mouse lung function. A-F: Lung function-for-weight curve of mice; G-L: Lung function-for-age curve of mice. IC: Inspiratory capacity; Rrs: Respiratory system resistance; Ers: Respiratory system elastance; Crs: Respiratory system compliance; Rn: Airway resistance; G: Tissue damping |
气管插管是肺内给药的重要途径之一, 本研究验证了应用提供的气管插管方法对肺内给药的可行性, 除此之外, 也对比了传统滴鼻法是否可以满足肺内给药需求。结果显示, 应用不同方法对小鼠肺内给予印度墨水后, 滴鼻组染色部位集中在气管和主支气管, 肺实质染色比例极为有限。应用气管插管向肺内滴注墨水后可以观察到绝大部分肺实质存在着色, 气管虽有着色但明显浅于滴鼻法(图 4A)。统计学结果显示, 气管插管法可使96%表面积的肺部染色, 显著高于滴鼻组的17% (图 4B)。

|
Figure 4 Feasibility analysis of intrapulmonary exposure through trachea intubation. A: Representative images of Indian ink exposed lungs; B: Indian ink stained area ratio |
肺内给予BLM是制备肺纤维化模型的重要策略, 然而单次气管内给予BLM仅能造成急性肺纤维化, 但肺内多次给予小剂量BLM可以诱导更加贴近于临床的慢性肺纤维化。因此, 无创造模在多次肺内损伤模型制备中极为重要。本研究同样对比了多次BLM滴鼻和气管插管滴注制备慢性肺纤维化模型的可靠性。结果显示, 气管插管造模与滴鼻造模相比, 肺部出现明显纤维化(图 5A), 肺重指数和肺内羟脯氨酸含量明显增高(图 5B和C), 小鼠肺功能显著降低(图 5D)。与此同时, 气管插管组肺部炎症评分也显著高于滴鼻组(图 5E)。
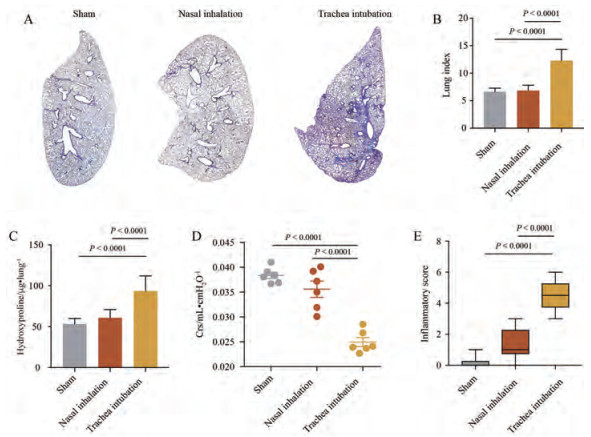
|
Figure 5 The preparation of multiple bleomycin injury induced pulmonary fibrosis mouse model. A: Masson staining was performed to evaluate fibrotic changes in lungs; B: Lung index of the indicated mice; C: Hydroxyproline content in the right lung of the indicated mice; D: Lung function of the indicated mice; E: Inflammatory score of the indicated mice |
与之前报道[1]的经典和改进的方法比较, 本研究描述的方法有以下几方面的优点。首先, 本方法所使用设备较为简单, 易于获得且价格便宜, 便于加工改造。使用传统检耳镜作为光源虽然同样在便捷性上可以满足实验需求, 但是当检耳镜深入小鼠口腔并接近气管开口时, 操作者很难看到气管开口。本研究作用导丝直径为0.4 mm, 这种导丝不仅可以最大限度暴露操作视野, 同时还可避免直接插入插管对小鼠造成的物理创伤。本研究中所使用光源为商业化自然色冷光源, 其穿透力强, 光源集中易于调整照射角度。在目前的研究工作中, 本课题组通过反复验证这一操作的可靠性, 证实该方法易于进行小鼠肺内给药、肺内损伤造模和无创肺功能测量等操作。
本研究制备了多次BLM肺内损伤所致小鼠肺纤维化模型, 该模型需要对小鼠进行总计6次造模, 因此无创造模方法极为重要[7]。目前仅有无创气管插管和滴鼻两种主要的肺内无创造模方式。然而本研究结果显示, 滴鼻仅能将造模液体主要送至支气管, 较难进入肺泡, 因此不适合进行肺泡损伤的造模方法。小鼠滴鼻法通常可用于向小鼠肺部给予表达Cre酶的病毒, 用以实现对转基因小鼠肺癌的造模[9]。然而这种造模方式和急性及慢性肺损伤造模原理不同。腺病毒Cre肺内感染仅需感染少量细胞便可产生自发肿瘤, 但肺损伤模型需刺激剂到达广泛的肺泡才能成功造模, 因此本方法更适合于肺损伤相关模型的制备。本课题组最近应用这一方法, 成功构建了多次BLM小鼠肺纤维化模型, 证明在慢性损伤刺激下, 蛋白激酶GSK-3β通过与泛素编辑酶A20相互作用, 抑制其酶活性, 导致其底物蛋白核转录因子C/EBPβ不能被泛素化降解而堆积在巨噬细胞, 引起并维持巨噬细胞的促纤维化表型, 从而促进肺纤维化的发生和发展。该研究证实了这一插管方法的有效性和可靠性[10]。
本方法在进行插管时, 需注意在最初用镊子撑开嘴巴时, 尽量将舌根部压低, 这样可以最大可能地暴露插管视野。如果使用无保护的镊子, 很容易造成舌头损伤, 这可能会导致小鼠死亡。在首次学习此插管方法时, 最重要的是根据小鼠头颈部位置调整目视方向, 以使气管开口可视化。如果正确完成操作, 并在小鼠舌部施加足够的牵引力, 则很容易看到声带并观察到声带的开合。最初, 如果此可视化存在问题, 则通常是由于操作人员并未给予足够的拉力施加于舌头。稍微增加此拉力将舌头拉直可视化路径, 以便可以看到声带。一旦看到气管开口, 则随后插入导丝则相对简单。然而在将套管针送入气管时, 手部可能会感受到阻力存在, 这是由于声带的开合有时会阻挡套管针进入气管。此时, 应当轻微调整套管针插入角度并反复尝试, 但动作应当保持轻微, 以免损伤声带。尽管Das等[11]描述了一个独特的微观可视化气管插管系统, 且该描述的系统具有较高的插管效率, 但需要专用光纤设备, 增加了操作的不便捷性。值得注意的是, 本方法针对不同体重的小鼠采用了不同直径的套管针进行插管。本方法针对体重在10~15 g的小鼠使用22 G套管针(外径0.7 mm), 而对15 g体重以上小鼠使用20 G套管针(外径0.9 mm), 这样的设计可以使得套管与气管间有较好的密闭性, 同时体重较低的小鼠也不会由于套管针外径过大导致插管失败和损伤小鼠气道。为了保证两种不同直径套管针的可比性, 本课题组对体重在15~16 g的小鼠使用了22 G和20 G套管针进行了肺功能测量, 结果显示对于同一只小鼠两种套管针测量的结果偏差在8%以内, 这证明两种套管针所测得肺功能数据具有可比性。同时显示本方法所提供的套管针可以与小鼠气管产生良好的密封性, 满足机械通气以及肺功能测量的要求。本研究发现20 G套管针在体重 < 30 g的小鼠中均可产生良好的气密性, 因此本研究使用两种套管针所测量的小鼠肺功能发育曲线是可靠的。本研究所描述小鼠肺功能发育曲线有助于判断药物及基因对小鼠肺发育影响。特别是对于儿童药物进行研发时, 应当更多关注脏器发育安全性问题。
本研究所测小鼠肺功能发育曲线提示小鼠体重在18~20 g时肺功能发育成熟, 对应周龄为8周龄。这与通常药理学实验所用C57BL/6J小鼠规格相似, 说明在这一体重周龄下所做呼吸功能研究不会受到小鼠体重周龄增加而导致的偏差影响。同时这一时间也与小鼠肺部组织结构发育一致[12]。另一方面, 通过本研究可以观察到小鼠体重在10~17 g, 周龄在4~6周龄时小鼠肺功能变化较大, 因此在这一体重周龄范围内进行动物实验需考虑到肺发育问题。本研究所提供小鼠肺功能发育曲线存在一定的局限性。首先, 本研究采用C57BL/6J雄性小鼠进行肺功能检测, 因此同一品系雌性小鼠, 或是不同品系小鼠肺功能发育曲线可能存在偏差。另外, 本研究最小观察体重为10 g, 最小观察周龄为4周龄, 因此本研究所提供小鼠肺功能发育曲线缺乏体重 < 10 g或周龄 < 4周的相关数据。
本文中视频1、视频2、视频3见网页: https://kns.cnki.net/kcms/detail/11.2163.R.20200515.1230.003.html
| [1] |
Brown RH, Walters DM, Greenberg RS, et al. A method of endotracheal intubation and pulmonary functional assessment for repeated studies in mice[J]. J Appl Physiol, 1999, 87: 2362-2365. DOI:10.1152/jappl.1999.87.6.2362 |
| [2] |
Walters DM, Wills-Karp M, Mitzner W. Assessment of cellular profile and lung function with repeated bronchoalveolar lavage in individual mice[J]. Physiol Genomics, 2000, 2: 29-36. DOI:10.1152/physiolgenomics.2000.2.1.29 |
| [3] |
Hamacher J, Arras M, Bootz F, et al. Microscopic wire guide-based orotracheal mouse intubation:description, evaluation and comparison with transillumination[J]. Lab Anim, 2008, 42: 222-230. DOI:10.1258/la.2007.006068 |
| [4] |
Spoelstra EN, Ince C, Koeman A, et al. A novel and simple method for endotracheal intubation of mice[J]. Lab Anim, 2007, 41: 128-135. DOI:10.1258/002367707779399400 |
| [5] |
Vergari A, Polito A, Musumeci M, et al. Video-assisted orotracheal intubation in mice[J]. Lab Anim, 2003, 37: 204-206. DOI:10.1258/002367703766453047 |
| [6] |
Zhao X, Wu N, Zhou J, et al. A technique for retrograde intubation in mice[J]. Lab Anim, 2006, 35: 39-42. |
| [7] |
Cao Z, Lis R, Ginsberg M, et al. Targeting of the pulmonary capillary vascular niche promotes lung alveolar repair and ameliorates fibrosis[J]. Nat Med, 2016, 22: 154-162. DOI:10.1038/nm.4035 |
| [8] |
Lv XX, Wang XX, Li K, et al. Rupatadine protects against pulmonary fibrosis by attenuating PAF-mediated senescence in rodents[J]. PLoS One, 2013, 8: e68631. DOI:10.1371/journal.pone.0068631 |
| [9] |
Cicchini M, Buza EL, Sagal KM, et al. Context-dependent effects of amplified MAPK signaling during lung adenocarcinoma initiation and progression[J]. Cell Rep, 2017, 18: 1958-1969. DOI:10.1016/j.celrep.2017.01.069 |
| [10] |
Liu SS, Lv XX, Liu C, et al. Targeting degradation of the transcription factor C/EBPβ reduces lung fibrosis by restoring activity of the ubiquitin-editing enzyme A20 in macrophages[J]. Immunity, 2019, 51: 522-534. DOI:10.1016/j.immuni.2019.06.014 |
| [11] |
Das S, MacDonald K, Chang HY, et al. A simple method of mouse lung intubation[J]. J Vis Exp, 2013, 21: e50318. |
| [12] |
Mund SI, Stampanoni M, Schittny JC. Developmental alveolarization of the mouse lung[J]. Dev Dyn, 2008, 237: 2108-2116. DOI:10.1002/dvdy.21633 |
 2020, Vol. 55
2020, Vol. 55


