以靶向药物和免疫治疗为主的肿瘤精准治疗, 明显降低了肿瘤患者的病情进展, 提高了5年存活率[1]。免疫治疗与化疗、放疗等多种方法组合应用, 是肿瘤治疗的重要方向[2]。组蛋白去乙酰化抑制剂西达本胺(chidamide, CHI)和恩替诺特(entinostat, ENT, 又名MS-275)均属于苯酰胺类, 具有良好的抗肿瘤作用, 已经批准在临床应用[3, 4]。ENT能明显增强程序性死亡受体1 (programmed death 1, PD-1)抗体对肺癌和肾癌肿瘤的抑制作用[5]; CHI能增强PD-1表达的免疫细胞对外周T淋巴瘤的抑制活性[6]。不过, 因肿瘤高度异质性而导致的耐药性, 往往使肿瘤单药或组合治疗容易失败[7]。
肿瘤细胞多药耐药性表现为对化学结构不同、作用机制不同的抗肿瘤药物均具有耐药性, 主要特征之一是细胞膜转运蛋白, 如ATP结合盒转运蛋白1 (ATP-binding cassette B1, ABCB1)的过表达, 还有其他多种机制介导耐药性的发生[8-10]。CHI是我国自主研发的抗肿瘤药物, 未见其作用多药耐药肿瘤细胞的研究报道。而ENT对多药耐药细胞的作用存在矛盾, 认为ENT能直接降低ABCB1蛋白水平[11, 12], 需要进一步的研究阐明其作用特点。为此, 本文选取人乳腺癌耐多柔比星(doxorubicin, DOX)的MCF-7细胞及其敏感细胞为模型, 深入研究CHI和ENT对多药耐药细胞的作用特征, 为临床应用提供理论依据。
材料与方法主要试剂和抗体二甲基亚砜(dimethyl sulfoxide, DMSO)、碘化丙啶(propidium iodide, PI)、DOX、长春新碱(vincristine, VCR)、顺铂(cis-diammine-dichloroplatinum, DDP)和罗丹明123 (rohdamine 123, RHO 123)均购自美国Sigma公司。粉防己碱(tetrandrine, TET)购于中国药品生物制品检定所。CHI由深圳微芯生物科技有限责任公司惠赠, ENT购自美国Selleck公司。CHI和ENT使用DMSO溶解成50 mmol·L-1母液, 保存在-20 ℃备用。RPMI1640培养基和胎牛血清购自美国Thermo Fisher公司。CCK-8试剂盒购自北京鼎国生物科技有限公司。小鼠抗ABCB1单抗、小鼠抗Actin抗体、兔抗PARP-1和p53抗体购自Cell Signaling Technology公司。山羊抗兔二抗和山羊抗鼠二抗均购自中杉金桥生物科技有限公司。
细胞株和细胞培养 人乳腺癌MCF-7细胞、人乳腺癌耐多柔比星细胞(MCF-7/DOX)来自美国国立癌症研究院。细胞培养在添加10%胎牛血清的RPMI 1640培养基、37 ℃、5% CO2的培养箱中。
CCK-8法检测细胞存活率 取对数生长期的适量细胞接种于96孔培养板, 培养24 h, 加入不同浓度药物处理96 h。按照厂家的建议, 加入CCK8, 在37 ℃细胞培养箱中孵育2~4 h, 酶标仪450 nm处测定吸光度值(opital density, OD)。细胞存活率(%) = (加药组细胞OD值-本底OD值)/(对照组细胞OD值-本底OD值) × 100%, 然后计算IC50值。
Coulter细胞计数法分析细胞存活率 对数生长期的细胞接种24孔板, 培养24 h后加药处理72 h。取出24孔板倒去培养液, 消化细胞后, 用磷酸盐缓冲液(PBS)吹打成细胞悬液, 使用Coulter细胞计数仪进行细胞计数, 计算细胞存活率。细胞存活率(%) = (处理组活细胞数-接种细胞数) / (对照组活细胞数-接种细胞数) × 100%。
罗丹明123滞留检测 取对数生长期的细胞接种于6孔板中, 培养24 h后加入药物处理2 h, 消化细胞后, 600 ×g离心5 min离心收集, 使用PBS重悬细胞, 每管加入5 μg·mL-1 RHO 123孵育1 h。离心弃上清, PBS重悬细胞, 使用流式细胞仪进行检测。
流式细胞术分析细胞周期 取对数生长期的细胞接种于6孔板中, 培养24 h后加入药物处理24 h。消化细胞后, 600 ×g离心5 min收集细胞。加1 mL预冷的70%乙醇, 吹打成悬浮细胞, 4 ℃固定过夜。测定前, 用PBS洗2遍, 加入100 μg·mL-1 RNA酶, 37 ℃水浴30 min。加入终质量浓度50 μg·mL-1 PI, 常温避光染色1 h。流式细胞仪测定PI荧光强度, 使用软件MODFIT分析细胞周期的变化。
Western blot检测相关蛋白的表达 细胞经过药物处理一定时间后, 按照以前发表的方法进行实验[13]。用Bradford法测定蛋白浓度, SDS-PAGE凝胶电泳分离蛋白质, 然后将蛋白转移到PVDF膜, 一抗温育过夜。然后二抗孵育1 h, Bio-Rad凝胶成像系统曝光获得图像。
统计学分析 使用SPSS 17.0统计软件对数据进行分析。所有实验数据以均数±标准差(x±s)表示, 使用两组独立样本的t检验进行组间比较, P < 0.05认为差异存在统计学意义。
结果 1 MCF-7/DOX耐药细胞对CHI和ENT具有一定的耐药性首先, 使用CCK-8法检测各种药物对MCF-7敏感和耐药细胞的增殖抑制作用。如图 1A和B所示, 与敏感细胞相比, MCF-7/DOX细胞对DOX和VCR表现为高度的耐药性, 耐药倍数分别为144和756倍。ENT对MCF-7敏感细胞具有较强的抑制作用, 其IC50值为2.5 μmol·L-1, 而对耐药细胞为7.1 μmol·L-1, 具有轻微的耐药性(图 1C)。CHI对MCF-7细胞的抑制作用明显弱于ENT, 抑制MCF-7敏感细胞增殖的IC50值为21.6 μmol·L-1; 此外, 使用高浓度CHI 100 μmol·L-1处理细胞, MCF-7/DOX耐药细胞的存活率仍然有60% (图 1D)。
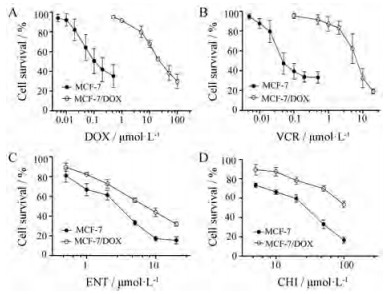
|
Figure 1 The resistance to CHI or ENT in MCF-7/DOX cells. The cell survival was assayed with CCK-8 method after the cells were treated with DOX (A), VCR (B), ENT (C) and CHI (D) for 96 h. n = 3, x±s. CHI: Chidamide; ENT: Entinostat; DOX: Doxorubicin; VCR: Vincristine |
由于CCK-8法对部分药物的检测灵敏度差, 本研究采用Coulter直接计数法进一步比较了ENT和CHI对两种细胞的增殖抑制作用, 结果也是CHI的抑制作用较弱(结果未显示)。本研究进一步选取对细胞抑制作用较弱浓度的ENT与化疗药物DDP合用, 检测到ENT对低浓度的DDP具有明显的增强作用(图 2)。
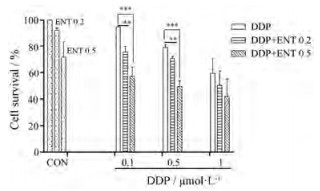
|
Figure 2 The proliferation-inhibitory action of cis-diammine-dichloroplatinum (DDP) potentiated by ENT on MCF-7/DOX cells. The cell survival was determined with Coulter counter method after the cells were treated with ENT or DDP alone, and DDP+ENT for 72 h. The concentrations of ENT used were 0.2 and 0.5 μmol·L-1. n = 3, x±s. **P < 0.01, ***P < 0.001 |
MCF-7/DOX耐药细胞的一个重要特征是ABCB1的高表达, 把抗肿瘤药物泵到细胞外, 表现为多药耐药性。Western blot检测到ABCB1在耐药细胞中高表达(图 3A)。荧光染料RHO 123是ABCB1的外排底物, 使用流式细胞术也可检测MCF-7/DOX耐药细胞中的RHO 123荧光强度远低于MCF-7敏感细胞(图 3B)。以RHO 123滞留初步确定CHI或ENT是否为ABCB1的底物。阳性药物粉防己碱(TET)可以明显增加MCF-7/DOX耐药细胞内RHO 123的滞留。与对照组相比, CHI对RHO 123滞留影响不明显(图 3C iii, iv)。ENT虽然可引起RHO 123滞留有所增加, 但增加ENT作用浓度, 并没有增加RHO 123的荧光强度(图 3C v, vi)。这些实验说明CHI和ENT均不是ABCB1的底物。
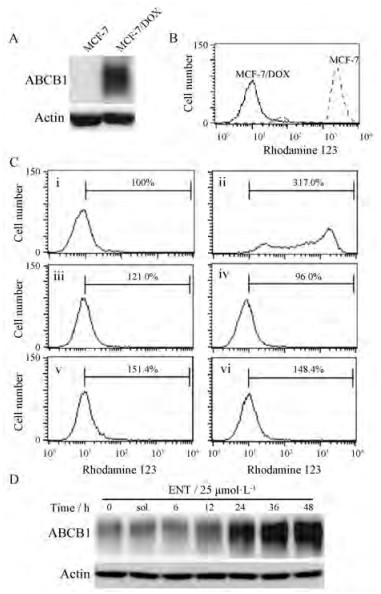
|
Figure 3 Effects of ATP-binding cassette B1 (ABCB1) function by ENT or CHI in MCF-7/DOX resistant cells. A: high expression of ABCB1 was detected by Western blotting in the resistant cells; B: Lower accumulation of rhodamine 123 was determined by flow cytometry in the resistant cells; C: CHI or ENT is not a substrate of ABCB1 using rhodamine 123 accumulaition assay in the resistant cells. i: Control; ii: TET 2 μmol·L-1; iii: CHI 50 μmol·L-1; iv: CHI 100 μmol·L-1; v: ENT 5 μmol·L-1; vi: ENT 10 μmol·L-1. D: ABCB1 expression was induced by ENT 25 μmol·L-1 for different time points in the resistant cells. In the figure, "sol" indicates solvent. One of reprentative result from three experiments was shown |
为了进一步确定ENT是否影响ABCB1蛋白表达, 本研究使用固定浓度的ENT (25 μmol·L-1)处理耐药细胞。ENT处理后12 h, ABCB1蛋白的表达就有所增加, 24 h时ABCB1蛋白的表达增加显著(图 3D)。该结果表明, 长时间使用ENT, 有可能增加耐药性。
4 CHI和ENT对细胞周期的影响为了进一步分析CHI和ENT对耐药细胞的影响, 本研究观察两药处理24 h后的细胞周期变化。50 μmol·L-1 CHI可明显增加MCF-7敏感细胞G1期和G2/M期细胞(图 4A); 当浓度增加到100 μmol·L-1时, 主要引起G2/M期阻滞。与敏感细胞不同的是CHI主要引起MCF-7/DOX耐药细胞G1期阻滞。ENT在较低浓度下就能明显地影响细胞周期, 对两种细胞作用类似, 均表现为G1期阻滞, 在高浓度时也增加G2/M阻滞(图 4B)。上述细胞周期影响结果再次表明: CHI和ENT作用MCF-7敏感和耐药细胞的特征有所不同。
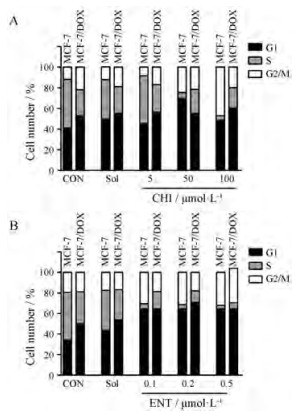
|
Figure 4 Effects of CHI (A) and ENT (B) on the distrabution of cell cyle. The assay was determined by flow cytometer. One of presentive result from two experiments is shown |
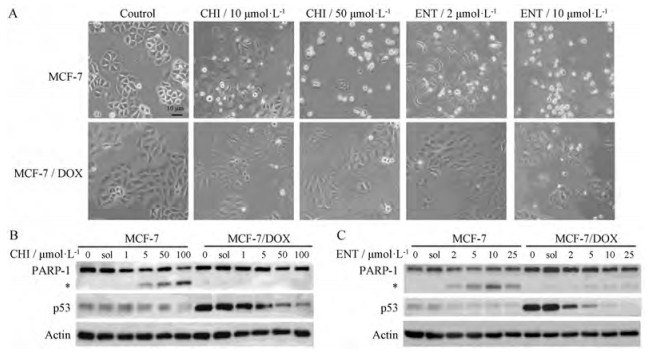
为了更好地研究CHI和ENT对耐药细胞的影响, 本研究从细胞凋亡角度进行分析。从细胞形态变化看, 50 μmol·L-1 CHI处理MCF-7敏感细胞24 h后, 出现大量变圆的凋亡样细胞, 但耐药细胞几乎没有出现类似的变化(图 5A); 10 μmol·L-1 ENT处理敏感细胞, 就出现大量的变圆细胞。虽然两药处理后的细胞形态变化的趋势是一致的, 但ENT的作用浓度明显低于CHI。
|
Figure 5 Effects of apoptosis by CHI or ENT on the sensitive and resistant MCF-7 cells. A: The morphological changes of both cell lines after exposure to CHI or ENT for 24 h. Magnification 100×; B: The changes of apoptosis-related proteins after the cells were treated with CHI; C: The changes of apoptosis-related proteins after the cells were treated with ENT. In figure B and C, "*" indicates a cleavage fragment of PARP-1. One of presentive results from three experiments is shown |
细胞凋亡过程中, 启动了凋亡信号通路, 其中关键分子caspase-3活化后, 切割PARP-1。因此, PARP-1切割片段的出现, 可以认为是出现凋亡的标志。使用不同浓度的CHI或ENT处理细胞24 h, 出现PARP-1的切割片段, 且具有浓度依赖性(图 5B)。此外, 本研究还发现凋亡相关蛋白p53均表现为下降的趋势。
讨论本论文阐明了CHI作用ABCB1介导耐药性的作用特征。研究结果表明: ABCB1介导的耐药细胞对CHI或ENT均具有一定的耐药性, 耐药细胞抗细胞凋亡作用可能是其机制之一。从研究结果看, CHI的抑制细胞活性没有ENT高。而本文的两种药物抑制细胞增殖的结果与以前的报道有所不同。以前有报道CHI或ENT作用MCF-7敏感细胞的IC50值, 没有明显的差异[14]; 而本研究结果却显示ENT对MCF-7敏感细胞的抑制作用强于CHI。可能是检测细胞成活率的方法不同所致, 本研究使用CCK-8法检测细胞成活率, 而之前的研究是使用MTT法。
CHI是我国自主研发的抗肿瘤药物, 对某些类型的肿瘤治疗具有明显的优势。不过, 如果把CHI应用于表达ABCB1的肿瘤患者要谨慎, 可能达不到预期的效果。ENT处理可以明显地诱导ABCB1表达(图 3), 说明增加其耐药性, 而CHI也有诱导ABCB1蛋白表达的作用(结果未显示)。另一个组蛋白去乙酰化酶抑制剂丙戊酸也能诱导ABCB1蛋白的表达[15]。本研究发现ENT不是ABCB1的外排底物(图 3C), 该结果与以前的报道相一致[12]。虽然已经有大量研究报道组蛋白去乙酰化酶抑制剂增强其他靶向抗肿瘤药物的作用, 如ENT可以逆转伊马替尼的耐药性[16], 但对于ABCB1引起的耐药性而言, ENT或CHI可能都不是合适的组合使用的药物。
本研究表明: CHI或ENT均能阻断MCF-7敏感和耐药细胞于G1期, ENT阻断肿瘤细胞于G1的结果与以前的报道一致[17, 18], 说明耐药细胞在产生耐药性过程中, 细胞周期相关特性仍然与敏感细胞相似。耐药细胞对CHI和ENT均具有一定的耐药性, 还表现为抗细胞凋亡的作用。虽然本文未深入研究其作用机制, 根据相关报道: c-Myc信号通路的变化导致人乳腺癌细胞对ENT耐药[19], 或许类似的机制也存在于耐DOX的MCF-7细胞中。
综上所述, 本文通过研究CHI和ENT作用人乳腺癌MCF-7敏感和耐药细胞的特征, 充分阐明了这类药物抑制肿瘤耐药细胞的特点及其差异。这些结果对指导临床用药, 从表观遗传学角度阐明耐药性形成机制, 均具有重要的理论意义和应用价值。
| [1] |
Sanmamed MF, Chen L. A paradigm shift in cancer immuno-therapy:from enhancement to normalization[J]. Cell, 2018, 175: 313-326. DOI:10.1016/j.cell.2018.09.035 |
| [2] |
Sharma P, Allison JP. Immune checkpoint targeting in cancer therapy:toward combination strategies with curative potential[J]. Cell, 2015, 161: 205-214. DOI:10.1016/j.cell.2015.03.030 |
| [3] |
Shi Y. Current status and progress of lymphoma management in China[J]. Int J Hematol, 2018, 107: 405-412. DOI:10.1007/s12185-018-2404-8 |
| [4] |
Connolly RM, Rudek MA, Piekarz R. Entinostat:a promising treatment option for patients with advanced breast cancer[J]. Future Oncol, 2017, 13: 1137-1148. DOI:10.2217/fon-2016-0526 |
| [5] |
Orillion A, Hashimoto A, Damayanti N, et al. Entinostat neutralizes myeloid-derived suppressor cells and enhances the antitumor effect of PD-1 inhibition in murine models of lung and renal cell carcinoma[J]. Clin Cancer Res, 2017, 23: 5187-5201. DOI:10.1158/1078-0432.CCR-17-0741 |
| [6] |
Zhang W, Shen H, Zhang Y, et al. Circulating PD-1(+) cells may participate in immune evasion in peripheral T-cell lymphoma and chidamide enhance antitumor activity of PD-1(+) cells[J]. Cancer Med, 2019, 8: 2104-2113. DOI:10.1002/cam4.2097 |
| [7] |
He Q. Tumor heterogeneity and drug resistance of targeted antitumor agents[J]. Acta Pharm Sin (药学学报), 2016, 51: 197-201. |
| [8] |
Robey RW, Pluchino KM, Hall MD, et al. Revisiting the role of ABC transporters in multidrug-resistant cancer[J]. Nat Rev Cancer, 2018, 18: 452-464. DOI:10.1038/s41568-018-0005-8 |
| [9] |
Zhao W, Dong Z, Shi Z, et al. Down-regulation of miR-205-5p sensitizes HNE1/DDP to cisplatin induced apoptosis in vitro[J]. Acta Pharm Sin (药学学报), 2019, 54: 1200-1206. |
| [10] |
Zhang R, Li D, Yang Z, et al. Mechanisms of doxorubicin resistance of breast cancer MCF-7 cells mediated by exosomes[J]. Acta Pharma Sin (药学学报), 2019, 55: 861-866. |
| [11] |
Huang XP, Li X, Situ MY, et al. Entinostat reverses cisplatin resistance in esophageal squamous cell carcinoma via down-regulation of multidrug resistance gene 1[J]. Cancer Lett, 2018, 414: 294-300. DOI:10.1016/j.canlet.2017.10.023 |
| [12] |
Tomono T, Machida T, Kamioka H, et al. Entinostat reverses P-glycoprotein activation in snail-overexpression adenocarcinoma HCC827 cells[J]. PLoS One, 2018, 13: e0200015. DOI:10.1371/journal.pone.0200015 |
| [13] |
Li Y, Xu R, Zhang X, et al. Mechanism of apoptosis induced by SIRT1 deacetylase inhibitors in human breast cancer MCF-7 drug-resistant cells[J]. Acta Pharm Sin (药学学报), 2008, 43: 1003-1010. |
| [14] |
Wang H, Guo Y, Fu M, et al. Antitumor activity of chidamide in hepatocellular carcinoma cell lines[J]. Mol Med Rep, 2012, 5: 1503-1508. |
| [15] |
Tang R, Faussat AM, Majdak P, et al. Valproic acid inhibits proliferation and induces apoptosis in acute myeloid leukemia cells expressing P-gp and MRP1[J]. Leukemia, 2004, 18: 1246-1251. DOI:10.1038/sj.leu.2403390 |
| [16] |
Nguyen T, Dai Y, Attkisson E, et al. HDAC inhibitors potentiate the activity of the BCR/ABL kinase inhibitor KW-2449 in imatinib-sensitive or -resistant BCR/ABL+ leukemia cells in vitro and in vivo[J]. Clin Cancer Res, 2011, 17: 3219-3232. DOI:10.1158/1078-0432.CCR-11-0234 |
| [17] |
Androutsopoulos VP, Spandidos DA. Antiproliferative effects of TSA, PXD-101 and MS-275 in A2780 and MCF7 cells:acetylated histone H4 and acetylated tubulin as markers for HDACI potency and selectivity[J]. Oncol Rep, 2017, 38: 3412-3418. DOI:10.3892/or.2017.6015 |
| [18] |
Saito A, Yamashita T, Mariko Y, et al. A synthetic inhibitor of histone deacetylase, MS-27-275, with marked in vivo antitumor activity against human tumors[J]. Proc Natl Acad Sci U S A, 1999, 96: 4592-4597. DOI:10.1073/pnas.96.8.4592 |
| [19] |
Tanioka M, Mott KR, Hollern DP, et al. Identification of Jun loss promotes resistance to histone deacetylase inhibitor entinostat through Myc signaling in luminal breast cancer[J]. Genome Med, 2018, 10: 86. DOI:10.1186/s13073-018-0597-3 |
 2020, Vol. 55
2020, Vol. 55


