2. 南华大学药物药理研究所, 湖南 衡阳 421001;
3. 南华大学附属南华医院, 湖南 衡阳 421001
2. Institute of Pharmaceutical Pharmacology, University of South China, Hengyang 421001, China;
3. The Affiliated Nanhua Hospital, University of South China, Hengyang 421001, China
氯喹(chloroquine)是在母体药物奎宁的基础上合成的衍生物。1934年, 由德国科学家Hans Andersag合成[1], 之后应用于抗疟疾。1964年, 氯喹衍生物—羟氯喹(hydroxychloroquine)被合成, 其吸收比氯喹更快, 体内分布也更广。由于抗氯喹恶性疟原株的出现, 氯喹渐渐被青蒿素取代。但是研究者们发现氯喹能有效地抑制人类免疫缺陷病毒(human immunodeficiency virus, HIV)复制, 继而发现其对黄病毒、冠状病毒和丝状病毒具有广谱的抗病毒作用, 同时氯喹能对患者体内的炎症风暴因子起到调节作用。老药新用是一种对已知药物(包括已经上市)的应用进行重新探索和开发, 并将其用于治疗其他疾病的新药研发策略, 老药新用作为药物开发策略越来越受到重视[2]。在2019年出现的新型冠状病毒(severe acute respiratory syndrome coronavirus 2, SARS-CoV-2)感染患者中, 氯喹也初步显示了较好的临床疗效。氯喹的广谱抗病毒作用, 在未来抗病毒药物治疗领域将会起到重要的作用。
1 氯喹及羟氯喹的性质比较氯喹化学名为4-(4-二乙氨基-1-甲基丁氨基)-7-氯喹啉, 属于4-氨基喹啉类药物, 呈弱碱性。氯喹的侧链端甲基被羟基取代后变为羟氯喹。临床上氯喹是作为磷酸盐给药, 而羟氯喹是作为硫酸盐给药。氯喹具有芳香族母体结构, 且由于碱性侧链的存在而呈弱碱性。研究者们认为碱性侧链有助于氯喹在内吞体和溶酶体的蓄积。氯喹存在R构型和S构型的对映异构体, 氯喹的R-(-)和S-(+)异构体在体外的作用相似[3], 对大鼠的胚胎毒性也相当[4]。而R-(-)羟氯喹在血液中的浓度高于S-(+)羟氯喹[5], 表明该药物在体内分布或代谢过程中存在立体选择性, 不同构型羟氯喹的有效性和安全性也可能不同。目前已有单独异构体的开发研究, 用于减少不良反应, 如视网膜病变的风险, 但效果还需要进一步的临床试验[6-8]。氯喹因为分布容积大, 半衰期长达40~60天[9], 其剂量-反应关系及毒性阈值还未完全确定。同时氯喹与黑色素有很强的结合作用, 可以在皮肤和眼睛等含黑色素的组织中沉积, 这在一定程度上解释了氯喹治疗皮肤疾病方面的疗效和引起视网膜病变的风险。临床观察显示, 羟氯喹与氯喹相比, 羟氯喹的视网膜病变风险较低, 这可能是羟氯喹的分布容积低于氯喹的原因[10]。氯喹与羟氯喹的主要性质比较见表 1[11-14]。
| Table 1 Comparison of main properties of chloroquine (CQ) and hydroxychloroquine (HCQ) |
溶酶体是细胞降解循环的生物大分子, 维持稳态平衡的重要细胞器, 溶酶体腔内含有近60种酸性水解酶, 在pH 4.5~5.5环境下发挥作用。ATP酶质子泵通过水解ATP的能量, 往溶酶体腔内泵入氢离子来维持其酸性环境[15]。氯喹以非质子化形式被动向溶酶体扩散, 非质子化的氯喹停留在溶酶体内。在ATP酶质子泵的作用下, 氯喹螯合H+质子化, 导致溶酶体pH值升高(图 1)[16-19], 继而干扰溶酶体中的大多数酶[20, 21], 例如组织蛋白酶B[19]。氯喹在溶酶体内的累积[22, 23], 会使溶酶体中蛋白质泄漏到细胞质中[24], 泄漏的蛋白质在细胞质中泛素化, 抑制主要组织相容性复合物Ⅱ (major histocompatibility complex class Ⅱ, MHC Ⅱ)交叉呈递, 同时泛素化蛋白过量会产生细胞毒性[25]。另外, 氯喹无法清除不依赖于pH值的H7N3禽流感病毒的感染, 这也从侧面佐证了氯喹通过pH值依赖机制, 抑制病毒的复制。目前氯喹对溶酶体确切的分子靶点还没有确定, 一项研究发现棕榈酰蛋白硫酯酶1 (palmitoyl protein thioesterase 1, PPT1)是氯喹和氯喹衍生物潜在的溶酶体靶点[26]。PPT1是一种参与脂质修饰蛋白分解代谢的酶, 在类风湿关节炎患者的滑膜组织中PPT1过表达, 而羟氯喹被证实可以抑制PPT1的活性[27]。
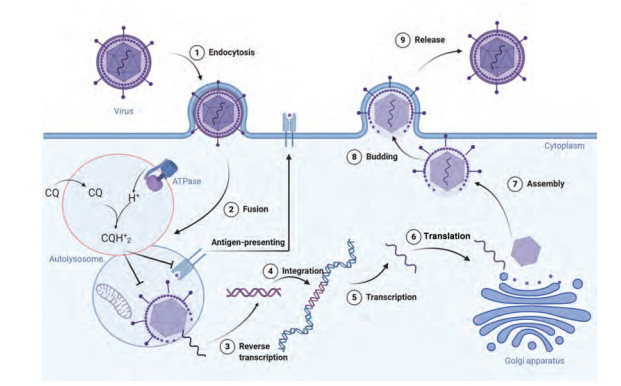
|
Figure 1 The pathway of virus replication and possible mechanism of chloroquine to virus endocytosis, fusion, reverse transcription, integration, transcription, translation, assembly, budding, release. Chloroquine enters and accumulates in lysosomes along a pH gradient. In lysosome, chloroquine inhibits the degradation of cargo derived externally or internally in autolysosomes by increasing the pH to prevent the activity of lysosomal enzymes. This process can reduce the replication of virus. Inhibition of lysosomal activity can prevent MHC Ⅱ-mediated autoantigen presentation. MHC Ⅱ: Major histocompatibility complex class Ⅱ |
自噬是一种重要的细胞机制, 能够降解老化和功能失调的蛋白质和细胞器[28]。当自噬小体与溶酶体融合时, 会发生自噬, 导致蛋白质和细胞器的破坏。溶酶体内部蛋白质的破坏, 有利于抗原呈递细胞APC产生与MHC Ⅱ类分子结合的肽[29, 30], 进一步激活抗原特异性CD4+ T细胞, 同时自噬促使与主要组织相容性复合物Ⅰ类(major histocompatibility complex class Ⅰ, MHC Ⅰ)分子结合肽的产生, 增强CD8+ T细胞对病毒的毒性反应[31]。研究显示氯喹能够抑制自噬依赖性MHC Ⅰ分子结合肽的产生, 这表明氯喹削弱了溶酶体和自噬小体的功能, 抑制了免疫活化。
2.3 抑制Toll样受体(toll-like receptor, TLR)信号转导氯喹通过抑制TLR信号转导, 干扰TLR9[32]和TLR7[33]的加工, 减少炎症细胞因子(IL-6、IL-1)、肿瘤坏死因子-α (TNF-α)和γ干扰素(IFNγ)产生[34]。但氯喹抑制TLR7和TLR9确切的分子机制还需进一步阐释。值得关注的是, 有一种与IL-1受体相关的激酶4 (interleukin-1 receptor-associated kinase 4, IRAK-4), 它是TLR7和TLR9信号通路的组成部分, 实验证实IRAK-4小分子抑制剂比羟氯喹更能显著降低外周血单核细胞(peripheral blood mononuclear cell, PBMC)中细胞因子的产生。
3 氯喹抗病毒的体外实验作者总结了氯喹对9种不同病毒(含5种人冠状病毒):人冠状病毒229E (human coronavirus 229E, HCoV-229E)、严重急性呼吸道综合征冠状病毒(severe acute respiratory syndrome coronavirus, SARS-CoV)、中东呼吸综合征冠状病毒(middle east respiratory syndrome coronavirus, MERS-CoV)、人冠状病毒OC43 (human coronavirus OC43, HCoV-OC43)、SARS-CoV-2、埃博拉病毒(Ebola virus, EBOV)、寨卡病毒(Zika virus, ZIKV)、基孔肯雅病毒(chikungunya virus, CHIKV)和单纯疱疹病毒Ⅰ型病毒(herpes simplex virus 1, HSV-1), 在不同细胞非洲绿猴肾细胞(Vero E6)、非洲绿猴肾细胞(Vero)、人结肠癌细胞(HRT-18)、人脑微血管内皮细胞(hBMEC)、人神经干细胞(hNSC)、人宫颈癌细胞(HeLa)和人肝癌细胞(Huh7)的活性和毒性实验, 分别用半数有效浓度(50% effective concentration, EC50)和半数毒性浓度(50% cytotoxic concentration, CC50)评价, CC50与EC50之比为选择指数(selective index, SI), 用以评价氯喹对不同病毒感染后细胞的安全性范围, 比值愈大愈安全。
3.1 氯喹对人冠状病毒HCoV-229E、SARS-CoV、MERS-CoV、HCoV-OC43、SARS-CoV-2的体外实验冠状病毒是单股正链的RNA病毒, 可感染人的冠状病毒有人冠状病毒NL63 (human coronavirus NL63, HCoV-NL63)、人冠状病毒HKU1 (human coronavirus HKU1, HCoV-HKU1)、HCoV-229E、HCoV-OC43、SARS-CoV、MERS-CoV和SARS-CoV-2, 且主要引发呼吸系统感染。De Wilde等[35]研究证实氯喹、氯丙嗪、洛培酰胺和洛匹那韦在低微摩尔浓度下(EC50 = 3~8 μmol·L-1)抑制MERS-CoV的复制, 其中氯喹呈剂量依赖性抑制MERS-CoV复制(EC50 = 3.0 μmol·L-1; CC50 = 58.1 μmol·L-1; SI = 19.4)。氯喹作为网格蛋白介导的内吞抑制剂, 能在较长时间内抑制MERS-CoV早期感染。这与氯喹对HCoV-229E的抑制浓度(EC50 = 3.0 μmol·L-1; CC50 > 50 μmol·L-1; SI > 15)相当。另外, 该研究显示氯喹也能在低微摩尔浓度下抑制SARS-CoV (EC50 = 4.1 μmol·L-1; CC50 > 128 μmol·L-1; SI > 31), 且安全范围较广, 与文献[36, 37]报道的一致。Keyaetrs等[36]研究显示氯喹对HCoV-OC43体外复制具有抑制作用(EC50 = 0.306 μmol·L-1; CC50 = 419 μmol·L-1; SI = 1 369)。需要注意的是, 两个研究团队对HCoV-229E、SARS-CoV、MERS-CoV和HCoV-OC43冠状病毒采用的宿主细胞分别是Huh7、Vero E6、Huh7和HRT-18细胞。
SARS-CoV-2的临床症状以发热为主, 7天后出现呼吸困难, 严重者快速进展为急性呼吸窘迫综合征。肖庚富课题组[38]评估了利巴韦林、喷昔洛韦、硝唑尼特、那法莫司、法拉匹韦、氯喹和瑞德西韦7种药物在体外Vero E6细胞实验对SARS-CoV-2的临床分离株的抗病毒作用, 其中氯喹(EC50 = 1.13 μmol·L-1; CC50 > 100 μmol·L-1; SI > 88.50)和瑞德西韦(EC50 = 0.77 μmol·L-1; CC50 > 100 μmol·L-1; SI > 129.87)在低浓度下能有效抑制SARS-CoV-2感染并且显示出高的选择指数, 同时氯喹对SARS-CoV-2感染Vero E6细胞的EC90值为6.90 μmol·L-1, 该浓度在临床上是可以实现的[39]。进一步加药时间分析实验显示, 氯喹在Vero E6细胞中, 对SARS-CoV-2的进入和进入后阶段均有抑制作用。另外, 刘东阳课题组[40]评估了氯喹和羟氯喹在Vero细胞中对SARS-CoV-2的活性, 结果显示, 羟氯喹(EC50 = 0.72 μmol·L-1)的活性优于氯喹(EC50 = 5.47 μmol·L-1), 但没有测试二者相关的CC50, 因而无法评估二者相关的SI值。两个研究团队采用的宿主细胞有所区别, 分别是Vero E6和Vero细胞。
3.2 氯喹对EBOV的体外实验EBOV是一种包膜丝状病毒, 主要引起急性出血热, 是人类危害最严重的传染病之一, 2014年非洲西部暴发了最严重的埃博拉疫情, 造成了上万人死亡。Madrid等[41]评价了氯喹和氯硝柳胺等在体外抑制EBOV复制、进入的活性及细胞毒性。氯硝柳胺(复制EC50 = 1.5 μmol·L-1; 进入EC50 < 10 μmol·L-1; CC50 > 50; SI > 33)的体外活性最好。氯喹(复制EC50 = 16 μmol·L-1; 进入EC50 = 4.7 μmol·L-1; CC50 > 50; SI > 3.1)抑制EBOV的活性不是特别突出。
3.3 氯喹对ZIKV的体外实验ZIKV于1947年在乌干达首次被发现, 截止2016年4月, 64个国家和地区报道了ZIKV的传播。ZIKV感染后, 症状总体上是轻微的, 但成人感染后导致胎儿小颅畸形和神经系统损害。最近的研究表明, 神经干细胞对ZIKV具有高度的容许性, ZIKV引起的干细胞库的枯竭是导致小颅畸形的机制之一[42-44]。Rodrigo等[45]研究发现, 氯喹对ZIKV感染的3种细胞Vero、hBMEC和hNSC的EC50值为9.82~14.2 μmol·L-1, CC50为94.95~134.54 μmol·L-1。EC50值明显低于对HIV感染(100 μmol·L-1)[46]和DENV感染(约25 μmol·L-1)[47]。这表明氯喹对亚洲暴发的ZIKV感染能够起到很好的抑制作用。Han等[48]研究了氯喹和去乙基氯喹(desethylchloroquine, DECQ)对不同ZIKV临床分离株(PLCal ZV、MR 766、PRVABC59)的细胞活性和毒性, 氯喹的EC50值分别为5.31 ± 0.64、6.74 ± 0.77和9.97 ± 1.06 μmol·L-1, DECQ的EC50值分别为7.01 ± 0.81、10.15 ±1.28和10.72 ± 1.45 μmol·L-1。结果显示, 氯喹和DECQ对ZIKV均有抗病毒活性。
3.4 氯喹对CHIKV的体外实验CHIKV是一种单股正链RNA病毒, 最初于1952年在非洲发现, 可通过埃及伊蚊和白纹伊蚊传播, 感染率高, 能够引起长达数月至数年的关节炎症状, 严重者会造成残疾甚至致死。近几年来, CHIKV在全球范围内广泛传播, 每年导致数百万人感染。Khan等[49]评价了氯喹在体外Vero细胞中抗CHIKV的活性, 在感染前24 h、感染时和感染后1 h分别给予0、5、10和20 μmol·L-1氯喹处理, 结果显示, 氯喹对CHIKV的抑制作用呈剂量依赖性。在20 μmol·L-1剂量下, 氯喹对病毒斑块形成的抑制率分别为94%、70%和65%。另外实验还显示, 当感染3 h后加入氯喹, 其抗病毒作用显著降低, 当感染6 h后加入氯喹没有抑制作用。体外实验表明, 氯喹能够降低CHIKV的病毒载量, 抑制CHIKV复制, 且这种抑制机制涉及病毒复制的早期阶段。
3.5 氯喹对HSV-1的体外实验疱疹病毒属α疱疹病毒科、单纯疱疹病毒属, 分为HSV-1和HSV-2两个血清型。在发达国家, HSV-1是导致病毒性角膜失明和病毒性脑炎的主要原因之一[50]。Lima等[51]将氯喹制成聚乳酸纳米粒(chloroquine in hydrophobic nanoparticles, CQ-NP), 用于提高氯喹对HSV-1病毒的活性。实验证明, CQ-NP (EC50 = 4.3 ± 1.4 μg·mL-1; CC50 = 67.9 ± 2.1 μg·mL-1; SI = 15.6)的细胞活力高于氯喹(EC50 = 6.7 ± 0.6 μg·mL-1; CC50 = 222.6 ± 5.4 μg·mL-1; SI = 33.0), 且CQ-NP的抑制作用与阳性对照药阿昔洛韦相似。
以上氯喹及其衍生物对不同病毒感染后细胞的活性和毒性的实验数据汇总, 见表 2。
| Table 2 Cytoactivity and toxicity of chloroquine to different viruses. All experiments were performed in triplicate and data were expressed as mean ± standard deviation (SD), except reference 38, 40, 41 not mentioned; DECQ: Desethylchloroquine; HCoV-229E-GFP: Green fluorescent protein-expressing recombinant Human coronavirus 229E; SARS-CoV: Severe acute respiratory syndrome coronavirus; MERS-CoV: Middle east respiratory syndrome coronavirus; HCoV-OC43: Human coronavirus OC43; SARS-CoV-2: Severe acute respiratory syndrome coronavirus 2; EBOV: Ebola virus; ZIKV MR766: A Zika virus strain of the Africa; ZIKV PLCal_ZV: A Zika virus strain of the Asian lineage; CHIKV: Chikungunya virus; HSV-1: Herpes simplex virus 1; EC50: 50% Effective concentration; CC50: 50% Cytotoxic concentration; EC90: 90% Effective concentration; IC50: 50% Inhibitory concentration; IC90: 90% Inhibitory concentration; SI: Selective index (SI = CC50/EC50); ND: Not determined |
作者总结了针对不同病毒SARS-CoV、HCoV-OC43、EBOV、非人灵长类动物免疫缺陷病毒(Simian immunodeficiency virus, SIV)、ZIKV和CHIKV, 在不同动物模型BALB/c、C57BL/6和A129小鼠, 以及非人灵长类动物中国恒河猴和食蟹猴中, 给予不同剂量(1~90 mg·kg-1)氯喹后动物生存率的变化。
4.1.1 氯喹对SARS-CoV和HCoV-OC43的动物实验2003年SARS-CoV暴发[52]。Barnard等[53]在BACL/c小鼠感染前腹腔注射或鼻饲50、10和1 mg·kg-1氯喹, 每天2次, 结果发现, 氯喹对SARS-CoV病毒的复制没有影响, 且各剂量间没有差别, 这可能与选取的动物模型、氯喹未达到足够高的血浆浓度及机体系统性机制可以代偿被阻断的靶标效应有关[54, 55]。同时, 实验显示IFN-α也没有降低SARS-CoV病毒滴度, 这可能是人类IFN-α与小鼠IFN-1受体之间的物种屏障[56]。Keyaetrs等[36]将6周龄的雄性和雌性C57BL/6小鼠进行配对, 从分娩前两天开始, 每天对雌性受孕小鼠皮下注射1、5和15 mg·kg-1剂量氯喹, 小鼠分为3组:产前注射、产后注射和未接受氯喹注射的感染对照组, 研究持续60天, 每天监测新生小鼠的死亡率, 评估氯喹对HCoV-OC43母鼠和幼鼠感染的影响。母鼠分娩前氯喹1、5、15 mg·kg-1处理后, 幼鼠中观察到的存活率为33.3%、92.9%、100%, 呈剂量依赖性。母鼠分娩前氯喹15和5 mg·kg-1处理幼鼠的生存曲线显著不同(P = 0.023 7)。后续课题组还将受孕小鼠分为两组, 第1组母鼠分娩前1天接受氯喹处理, 第2组母鼠未接受氯喹处理, 之后将两组的幼鼠对换, 第2组幼鼠通过母乳接受氯喹, 存活率为69.0% (20/29), 第1组幼鼠仅经胎盘接受过氯喹, 存活率为0% (0/27), 两组有显著差异(P < 0.000 1)。仅经胎盘接受氯喹的幼鼠全部死亡的原因可能是氯喹的浓度过低导致的。一方面早有文献[57-59]报道氯喹在人和兔子中的胎盘有分布; 另一方面, 绵羊的动物模型显示氯喹从母体到胎儿的转移率很低[60]。这也提示母鼠产前经15 mg·kg-1氯喹处理, 幼鼠体内的氯喹浓度不足以防止HCoV-OC43感染, 而氯喹能够在乳腺组织中很好地累积。同时研究显示在母鼠产前或产后给予氯喹30 mg·kg-1, 该剂量导致幼鼠死亡。结合两项研究, Barnard等[53]未观察到SARS-CoV在体内复制显著减少, 该结果与体外研究[36, 37]相反, 这可能是由于动物模型的差异, Barnard等[53]采用的BALB/c小鼠感染模型为非致死性模型, 而Keyaetrs等[36]采用的新生C57BL/6小鼠感染模型为致死性模型; 另外, 氯喹对HCoV-OC43的体外抗病毒作用强于SARS-CoV, 氯喹在SARS-CoV的动物实验不理想, 很可能是没有达到足够高的血浆浓度。
4.1.2 氯喹对EBOV的动物实验Madrid等[41]评估了氯喹、胺碘酮、丙氯拉嗪、苯扎托品、阿奇霉素、金霉素和克罗米芬通过腹膜内给药或口服给药在小鼠体内的效果。结果显示, 腹腔注射氯喹(90 mg·kg-1, 每天2次)、阿奇霉素(100 mg·kg-1, 每日2次)和胺碘酮(60 mg·kg-1, 每天2次)在小鼠模型中均显著提高了小鼠感染后的存活率, 但重复实验后, 仅发现氯喹可在小鼠模型中产生显著疗效, 生存率为80% (P < 0.000 1), 并且口服氯喹(40 mg·kg-1, 每天1次)没有提高小鼠的存活率。研究还考察了氯喹在90 mg·kg-1、每天2次剂量下的药代动力学, 氯喹在0.5 h达到最高浓度(Cmax = 5.333 µg·mL-1), 在35~40 h达到稳态浓度2.5 µg·mL-1, 同时还测定了氯喹的半衰期为7 h。
4.1.3 氯喹对SIV的动物实验HIV实际上是一种动物源性病毒, 是由SIV跨种传播给人类并进化演变而来。张立国课题组[61]选取了3只SIV阴性中国恒河猴和6只SIVMac239感染的中国恒河猴(3只感染晚期、3只慢性感染)。为了评价氯喹对SIV感染中国恒河猴免疫应激的抑制作用, 感染的猴子均隔日给予氯喹25 mg·kg-1, 连续30天治疗。结果显示, 中国恒河猴在感染晚期的免疫激活水平高于慢性感染, 且氯喹在体内和体外都能有效地抑制血浆细胞样树突状细胞(plasmacytoid dendritic cell, pDC)的激活, 前期的实验数据已表明pDC激活在HIV诱导的免疫激活中起重要作用, 但氯喹对T细胞活化及病毒载量的降低无明显影响。
4.1.4 氯喹对ZIKV的动物实验秦成峰课题组[62]将3~4周龄的BALB/c雌性小鼠及A129雄性小鼠分组, 治疗组用氯喹100 mg·kg-1, 对照组用磷酸盐缓冲液(phosphate buffer saline, PBS)进行灌胃治疗。氯喹治疗组显著抑制了小鼠的ZIKV感染, 对IFN-α/β受体(IFNAR)缺陷的A129小鼠模型进一步评估氯喹对ZIKV感染小鼠的保护作用, 在治疗第3天和第5天, 均显示氯喹明显降低ZIKV病毒载量。另外, 在新生小鼠模型中也测试了氯喹对ZIKV感染的影响, 发现母鼠经过氯喹20 mg·kg-1腹膜注射治疗, 可以将感染ZIKV新生小鼠的存活率提高至90%, 同时还保护小鼠免受ZIKV感染引起的小颅畸形。如果在母鼠感染后12 h才使用氯喹, 新生小鼠存活率会明显下降; 在感染24 h后使用, 氯喹的保护作用完全消失。
4.1.5 氯喹对CHIKV的动物实验Pierre等[63]建立了3~4岁雄性食蟹猕猴的感染模型, 口服或皮下注射氯喹7或14 mg·kg-1, 发现口服处理组氯喹的血浆浓度低于预期的抑制浓度; 皮下注射组氯喹在1 h后达到最大浓度为5.16 μmol·L-1、最小浓度为1.8 μmol·L-1, 这些浓度与氯喹治疗疟疾患者体内相似[64], 并且与CHIKV感染Vero E6细胞的IC50值相近[49, 65]。治疗组的猕猴在第5天出现体重显著下降, 在第8天和第12天仍能检测到1×103~9.2×105 vRNA/mL的病毒载量(P < 0.001), 表明氯喹延迟了CHIKV病毒的清除。同时在氯喹治疗组观察到C反应蛋白浓度高于对照组, 且淋巴细胞减少。第15天治疗组的IgM滴度低于安慰剂组(P=0.043 2), 这种差异在第23天不明显。这些数据充分证明尽管有强烈的IFN-Ⅰ反应, 氯喹延迟了抗原特异性免疫。
以上氯喹对不同病毒感染的动物实验结果汇总, 见表 3。
| Table 3 The animal experiments of chloroquine to different viruses. SIV: Simian immunodeficiency virus; ZIKV: Zika virus; ip: Intraperitoneal; bid: Bis in die; in: Intranasal; sc: Subsutaneous; qod: Quaque omni die; hpi: Hours post-incubation; ND: Not determined |
2020年2月17日, 中国国务院召开新闻发布会表示, 磷酸氯喹在中国进行的多中心临床试验中, 对SARS-CoV-2相关性肺炎有明显的疗效和安全性。已有100名患者的结果显示, 磷酸氯喹在抑制肺炎恶化、改善肺部影像学、促进核酸转阴和缩短病程方面优于对照治疗[66]。2020年2月19日, 国家卫生健康委员会在第六版新型冠状病毒肺炎诊疗方案中增加了磷酸氯喹, 磷酸氯喹的用法用量为成人500 mg, 每日2次, 疗程不超过10天。为确保氯喹在临床使用中更加安全有效, 2020年3月3日, 国家卫生健康委员会发布第七版新型冠状病毒肺炎诊疗方案, 磷酸氯喹用法用量调整为18~65岁成人, 体重大于50公斤患者, 每次500 mg, 每日2次, 疗程7天; 体重小于50公斤患者, 第1、2天每次500 mg, 每日2次, 第3~7天每次500 mg, 每日1次。更新后的诊疗方案根据患者体重在第3~7天减量, 疗程由10天缩减至7天。
Borba等[67]参考了磷酸氯喹治疗新型冠状病毒肺炎的专家共识[68]后, 评估氯喹在2种不同剂量下治疗81例SARS-CoV-2感染的严重呼吸综合征患者的安全性和有效性, 高剂量组为每次600 mg, 每日2次, 连续10天; 低剂量组为每次450 mg, 每日2次, 连续4天, 结果发现, 高剂量组QTc间期延长更常见, 且高剂量组有2名患者经历室性心动过速后死亡。高剂量组的死亡率为39% (16/41), 低剂量组为15% (6/40), 项目组立即中断了高剂量组患者的招募, 将高剂量组患者恢复到低剂量组。需要注意的是, 所有患者都接受了阿奇霉素的治疗, 89.6%患者也因疑似流感感染而服用了奥司他韦, 阿奇霉素[68]、奥司他韦[69]与氯喹均具有潜在的心脏毒性, 因而不建议将大剂量氯喹(10天内服用12 g)用于治疗严重的SARS-CoV-2感染患者, 特别是同时接受阿奇霉素和奥司他韦治疗的患者。该临床试验也存在局限性: ①样本量小; ②单中心设计; ③缺乏安慰剂对照组; ④缺乏基于患者QTc间期基线的排除标准。
另外, 陈军等[70]初步评价硫酸羟氯喹治疗普通型2019新型冠状病毒肺炎(coronavirus disease 2019, COVID-19)患者的疗效和安全性。该研究显示没有证据支持羟氯喹的治疗优于对照组。同时有报道显示氯喹抗病毒治疗的临床试验至少需要纳入250名患者, 才能使治疗组和对照组间在1天内指标参数的差异有意义(P < 0.05)[65], 这提示临床试验需要纳入足够的样本量。Drifa等[71]总结了全球353项注册的COVID-19相关临床研究试验, 截止2020年3月7日, 对其中115项临床试验(其中氯喹11项)进行数据分析。注册的临床试验计划纳入研究对象的中位数为63 (interquartile range, 36~120), 只有52 % (n = 60)报告了治疗剂量, 34% (n = 39)报告了持续时间, 该研究强调在疾病暴发期间应尽可能详细地注册临床试验, 提高结果的可重复性。目前英国牛津大学启动了大规模COVID-19预防性临床试验(NCT04303507)[72], 共50家中心参与, 计划入组10 000人, 干预组给予10 mg·kg-1负荷剂量, 之后给予磷酸氯喹250 mg持续3个月, 旨在研究氯喹对COVID-19预防的能力。
4.2.2 氯喹对HIV的临床试验Murray等[73]进行了一项随机、双盲、安慰剂对照临床试验, 评估在没有抗逆转录病毒(antiretroviral therapy, ART)治疗的情况下, 氯喹对慢性艾滋病毒感染者的影响。纳入标准包括CD4 T细胞计数 > 250个/mL。该研究共纳入了13名慢性HIV患者, 4名患者停用ART治疗16个月以上, 9名患者未进行过ART治疗。其中6人每天服用氯喹250 mg, 3人每天服用氯喹500 mg, 4人接受为期2个月的安慰剂治疗。在治疗开始时、治疗1个月后和治疗2个月后抽取外周血, 对每个患者进行病毒RNA载量和CD4 T细胞计数。结果显示, 治疗组与安慰剂组受试者的血浆病毒RNA载量在2个月期间没有显著变化, 但氯喹显著降低了T细胞免疫活性, 这对HIV感染患者可能是有益的。后续研究证实氯喹的治疗降低了患者T细胞的免疫激活, 氯喹通过抑制TLR信号, 导致CD38+、HLA-DR+和CD8 T细胞减少。但Routy等[74]进行的临床研究显示了不同的结果, 该研究纳入19例接受ART治疗且CD4+ T细胞计数 < 350个/mL的患者, 每天口服氯喹250 mg, 连续使用24周, 评估CD4+和CD8+ T细胞计数、病毒载量、T细胞活化、浆细胞样树突状细胞比例和血浆炎症标志物。研究结果发现, 氯喹治疗后CD4+和CD8+ T细胞的变化较治疗前无显著差异(P = 0.98, P = 0.99)。两项研究的局限性: ①针对HIV, 氯喹的剂量不足, 参与者每天服用氯喹250 mg不足以降低病毒载量。另一项临床试验已经证实氯喹500 mg治疗后, 检测到病毒载量的下降[75, 76]; ②纳入的样本量过小。
4.2.3 氯喹对DENV的临床试验Tricou等[77]进行了一项随机、双盲、安慰剂对照的临床试验, 评估氯喹对登革热的有效性和安全性。临床试验纳入307名疑似登革热成人患者, 其中257名被实验室确诊。患者分为两组: 154名接受安慰剂治疗作为安慰剂组; 153名接受氯喹治疗作为氯喹组, 第1、2天剂量均为600 mg, 第3天为300 mg。两组之间的基线特征基本平衡, 临床试验以DENV病毒血症清除时间为主要评价终点。结果显示, 氯喹组和安慰剂组的病毒血症清除时间无显著差异, 其中意向性分析(风险比为0.8, 95%置信区间[0.62-1.05], P = 0.10), 符合方案分析(风险比为0.8, 95%置信区间[0.61-1.05], P = 0.11)。在不良反应中, 氯喹组有2名患者出现了可能与氯喹相关的严重不良事件, 均为3级。1名呕血患者入住重症监护病房(intensive care unit, ICU) 3天, 另1名患者出现厌食和呕吐, 出现一个狭窄的脉压100/80 mmHg, 入住ICU 3天。安慰剂组没有严重不良事件。试验观察到氯喹在治疗人群中具有适度的退热作用, 但没有证据表明氯喹可以减少成人登革热患者的病毒血症或登革热NS1抗原血症的持续时间, 也没有证据表明氯喹降低了细胞因子或T细胞对DENV感染的反应程度。这可能与以下几个原因有关: ①在DENV发生复制的网状内皮细胞内, 氯喹没有达到抑制浓度; ②增加治疗剂量、样本量及患者早期给药可能会增强氯喹对DENV病毒血症和登革热NS1抗原血症持续时间的体内效应; ③该研究存在局限性, 可能不能反映最初患病群体情况, 这些群体可能只是轻微感染; 研究的群体是成年人, 通常可以很好地补偿毛细血管的渗透性, 儿童可能会观察到不同结果; 研究缺乏对氯喹的药代动力学分析。
4.2.4 氯喹对CHIKV的临床试验De Lamballerie等[65]进行一项随机、双盲、对照临床试验, 评估氯喹治疗基孔肯雅病的有效性和安全性。其中27名患者接受安慰剂治疗, 27名患者接受氯喹治疗, 第1、2、3天剂量为600 mg, 第4、5天为300 mg。第1、3天, 两组在高热性关节炎的持续时间和病毒血症的减少没有明显差别, 所有患者在第6天的核酸检测均转为阴性。但是后续的回访发现, 接受氯喹的患者中61%患关节痛的频率更高(P < 0.01), 安慰剂组中患者出现的比例为23 %。另外, 氯喹治疗组中有7名患者观察到轻度不良反应, 主要是恶心和瘙痒(P ≤ 0.01)。该临床试验结果不支持氯喹能够有效地治疗基孔肯雅热病毒感染。
作者总结氯喹体内外抗不同病毒的研究(表 4), 涉及到RNA病毒类有①冠状病毒: HCoV-229E、SARS-CoV、MERS-CoV、HCoV-OC43、SARS-CoV-2; ②纤丝病毒: EBOV; ③逆转录病毒: HIV; ④黄病毒: DENV、ZIKV; ⑤披膜病毒: CHIKV; 还有DNA病毒类的疱疹病毒: HSV-1。现有的文献显示氯喹抗不同病毒的基础研究较多, 尤其是对人冠状病毒, 但目前还未见氯喹抗HCoV-NL63、HCoV-HKU1的报道, 且只有氯喹抗SARS-CoV-2、HIV、DENV、CHIKV病毒进入了临床研究阶段, 其中关于人冠状病毒的临床研究仅有SARS-CoV-2。这也提示针对目前的新冠肺炎疫情, 临床应用氯喹需要格外谨慎。
| Table 4 The introduction of different viruses and experiments related to chloroquine in vitro and in vivo. HcoV-229E: Human coronavirus 229E; HIV: Human immunodeficiency virus; dsDNA: Double-stranded DNA; +ssRNA: Positive-sense single-stranded RNA; -ssRNA: Negative-sense single-stranded RNA |
氯喹通过结合H+质子化, 升高酸性囊泡中pH值, 继而影响病毒的复制。这也间接提示在临床应用中, 要避免增加胃酸pH值的药物应用, 可能会降低氯喹的生物利用度[78]。但是一项关于系统性红斑狼疮患者的研究显示[79], 服用质子泵抑制剂的患者和未服用质子泵抑制患者之间羟氯喹的血浆浓度没有差异。
5.2 眼睛毒性自60年代以来, 人们就知道氯喹的眼毒性作用[1, 80]。长时间摄入氯喹(500 mg·d-1, 长达10年)会导致不良反应, 如口干、疲劳、食欲和体重下降。老年人(约67.4岁)长期(约8.4年)接受氯喹治疗有视网膜毒性的风险[81]。一项对1 207例因氯喹治疗引起的视网膜毒性患者的随访研究表明, 日剂量显著影响了眼部损伤[82]。因此, 日剂量被认为是导致视网膜毒性的关键因素。在80年代后期, 由于高剂量和高的治疗频率, 约20%氯喹使用者出现了眼损伤。在日本, 氯喹相关性视网膜病已成为一个社会问题, 1974年氯喹停产。因此, Nathalie等[83]总结了氯喹和羟氯喹的眼毒性研究, 建议每天给予氯喹剂量≤5 mg·kg-1, 可以将眼毒性风险降至最低。而氯喹应用于抗病毒的疗程一般较短, 从体内试验结果来看, 还未出现眼毒性的报告。另外, 氯喹过量可能致死, 且发生在心律失常后, 氯喹在成人中的致死剂量是4 g, 在儿童中1 g可能致死[84]。
6 总结和展望虽然氯喹的作用机制清楚地表明可抑制病毒感染, 但一些临床试验使用氯喹治疗由低pH值依赖病毒引起的急性病毒感染, 如DENV和A、B型流感, 都报告了氯喹没有临床疗效[85]。另外, 氯喹对HIV[73]、DENV[77]和CHIKV[65]的临床试验均显示氯喹与安慰剂组在病毒血症的清除时间上没有明显差别。氯喹在体内和体外实验中出现结果不一致性, 可能是以下几个原因: ①目前还不清楚氯喹在体内、体外最重要的抗病毒机制。氯喹除了影响病毒的转运, 还被证明通过高尔基体, 损害用于指导新生病毒蛋白运输和成熟的糖基化机制, 继而干扰病毒复制, 抑制TLR信号; ②针对冠状病毒, 各研究选取的宿主细胞不同, 有研究显示Vero E6细胞是SARS-CoV的敏感细胞株, SARS-CoV的发现、培养、研究都离不开它[86]。最近一项研究证实在感染48 h的人体免疫细胞中未检测到SARS-CoV-2病毒复制, 而在Vero E6中可以扩增至很高的滴度[87]。这些都表明研究选取的宿主细胞很重要, 也直接影响动物实验和临床试验中药物剂量的选择; ③体外细胞实验显示, 10~20 μmol·L-1氯喹在不同细胞中吸收均较好, 而氯喹浓度大于30 μmol·L-1, 吸收则较少; 氯喹的药物代谢动力学分析表明, 小鼠有效的氯喹给药剂量为90 mg·kg-1, 每天2次, 稳态血清浓度约为7.81 μmol·L-1[88], 按人体表面积换算可得出剂量为7 mg·kg-1或约500 mg。I期临床试验在3天内给予氯喹1 500 mg, 其血清浓度约为3.44 μmol·L-1[64]; 另外, 氯喹的分布体积(> 100 L·kg-1)较大, 其影响了药物的血药浓度和达到稳态浓度所需的时间。尽管氯喹口服生物利用度好, 连续输注药物可能是递送氯喹的一种更好的方式[41]; 血浆和全血氯喹浓度分别为约3.125和16 μmol·L-1时, 在体内和体外均显示抑制了病毒复制和免疫介质的过度产生[88-92]。从这一方面分析体内外结果不一致的原因, 很可能是氯喹的浓度没有达到有效的治疗浓度[85]。同时在体内, 全血氯喹EC50为17.7 μmol·L-1时与明显的心血管效应有关, 被认为是氯喹在体内的毒性阈值; ④各体内动物实验选取的小鼠模型不一样, 有致死性动物模型和非致死性动物模型, 且给予氯喹的时机也不同; ⑤临床研究的设计有局限性, 没有涉及病毒复制的早期阶段, 无法解释氯喹在靶组织中对病毒的药效学问题, 采用的氯喹剂量过小, 且大多研究纳入的样本量过小等。
自新冠肺炎疫情发生后, 许多药物在体外显示了具有抗SARS-CoV-2的活性。氯喹作为一种抗疟疾的老药, 对SARS-CoV-2感染患者初步显示了较好的疗效。希望通过科学的临床试验设计, 给予患者合适的剂量和疗程, 让更多的SARS-CoV-2感染患者从中受益, 也为未来可能的病毒治疗提供依据和临床治疗方案。
| [1] |
Thomé R, Lopes SC, Costa FT, et al. Chloroquine:modes of action of an undervalued drug[J]. Immunol Lett, 2013, 153: 50-57. DOI:10.1016/j.imlet.2013.07.004 |
| [2] |
Li J, Jiang XY, Xu SJ, et al. Medicinal chemistry strategies in seeking coronavirus inhibitors[J]. Acta Pham Sin (药学学报), 2020, 55: 537-553. |
| [3] |
Witiak DT, Grattan DA, Heaslip RJ, et al. Synthesis and preliminary pharmacological evaluation of asymmetric chloroquine analogues[J]. J Med Chem, 1981, 24: 712-717. DOI:10.1021/jm00138a014 |
| [4] |
Tagoe CN. Effects of chloroquine and its enantiomers on the development of rat embryos in vitro[J]. Teratology, 1995, 52: 137-142. DOI:10.1002/tera.1420520305 |
| [5] |
Rainsford KD, Parke AL, Clifford-Rashotte M, et al. Therapy and pharmacological properties of hydroxychloroquine and chloroquine in treatment of systemic lupus erythematosus, rheumatoidarthritis and relateddiseases[J]. Inflammopharmacology, 2015, 23: 231-269. DOI:10.1007/s10787-015-0239-y |
| [6] |
Ducharme J, Fieger H, Ducharme MP, et al. Enantioselective disposition of hydroxychloroquine after a single oral dose of the racemate to healthy subjects[J]. Brit J Clin Pharmacol, 1995, 40: 127-133. DOI:10.1111/j.1365-2125.1995.tb05768.x |
| [7] |
Tett SE, McLachlan AJ, Cutler DJ, et al. Pharmacokinetics and pharmacodynamics of hydroxychloroquine enantiomers in patients with rheumatoid arthritis receiving multiple doses of racemate[J]. Chirality, 1994, 6: 355-359. DOI:10.1002/chir.530060420 |
| [8] |
Brocks DR. Stereoselectivity in the pharmacodynamics and pharmacokinetics of the chiral antimalarial drugs[J]. Clin Pharmacokinet, 2003, 42: 1359-1382. DOI:10.2165/00003088-200342150-00004 |
| [9] |
Cutler DJ, MacIntyre AC. Pharmacokinetics and cellular uptake of 4-aminoquinoline antimalarials[J]. Agents Actions Suppl, 1988, 24: 142-157. |
| [10] |
Rynes RI, Bernstein HN. Ophthalmologic safety profile of antimalarial drugs[J]. Lupus, 1993, 2: 17-19. DOI:10.1177/0961203393002001051 |
| [11] |
Ducharme J, Farinotti R. Clinical pharmacokinetics and metabolism of chloroquine. Focus on recent advancements[J]. Clin Pharmacokinet, 1996, 31: 257-274. DOI:10.2165/00003088-199631040-00003 |
| [12] |
FDA approved drug products: chloroquine phosphate oral tablets[DB/OL]. fda.gov, 2009[2020-04-17]. https://www.accessdata.fda.gov/drugsatfda_docs/label/2009/083082s050lbl.pdf.
|
| [13] |
FDA approved drug products: hydroxychloroquine oral tablets [DB/OL]. fda.gov, 2018[2020-04-17]. https://www.accessdata.fda.gov/drugsatfda_docs/label/2019/009768Orig1s051lbl.pdf.
|
| [14] |
Furst DE. Pharmacokinetics of hydroxychloroquine and chloroquine during treatment of rheumatic diseases[J]. Lupus, 1996, 5: 11-15. |
| [15] |
González A, Hall MN, Lin SC, et al. AMPK and TOR:the Yin and Yang of cellular nutrient sensing and growth control[J]. Cell Metab, 2020, 31: 472-492. DOI:10.1016/j.cmet.2020.01.015 |
| [16] |
De DC, De BT, Poole B, et al. Commentary:lysosomotropic agents[J]. Biochem Pharmacol, 1974, 23: 2495-2531. DOI:10.1016/0006-2952(74)90174-9 |
| [17] |
Sundelin SP, Terman A. Different effects of chloroquine and hydroxychloroquine on lysosomal function in cultured retinal pigment epithelial cells[J]. APMIS, 2002, 110: 481-489. DOI:10.1034/j.1600-0463.2002.100606.x |
| [18] |
Fox RI. Mechanism of action of hydroxychloroquine as an antirheumatic drug[J]. Semin Arthritis Rheum, 1993, 23: 82-91. DOI:10.1016/S0049-0172(10)80012-5 |
| [19] |
Mares V, Schultze B, Maurer W. Stability of DNA in Purkinje cell nuclei of the mouse. An autoradiographic study[J]. J Cell Biol, 1974, 63: 665-674. DOI:10.1083/jcb.63.2.665 |
| [20] |
Homewood CA, Warhurst DC, Peters W, et al. Lysosomes, pH and the anti-malarial action of chloroquine[J]. Nature, 1972, 235: 50-52. DOI:10.1038/235050a0 |
| [21] |
McChesney EW, Banks WF, Sullivan DJ. Metabolism of chloroquine and hydroxychloroquine in albino and pigmented rats[J]. Toxicol Appl Pharm, 1965, 7: 627-636. DOI:10.1016/0041-008X(65)90050-5 |
| [22] |
Circu M, Cardelli J, Barr MP, et al. Modulating lysosomal function through lysosome membrane permeabilization or autophagy suppression restores sensitivity to cisplatin in refractory non-small-cell lung cancer cells[J]. PLoS One, 2017, 12: e0184922. DOI:10.1371/journal.pone.0184922 |
| [23] |
Mauthe M, Orhon I, Rocchi C, et al. Chloroquine inhibits autophagic flux by decreasing autophagosome-lysosome fusion[J]. Autophagy, 2018, 14: 1435-1455. DOI:10.1080/15548627.2018.1474314 |
| [24] |
Bergmann M, Schütt F, Holz FG, et al. Inhibition of the ATP-driven proton pump in RPE lysosomes by the major lipofuscin fluorophore A2-E may contribute to the pathogenesis of age-related macular degeneration[J]. FASEB J, 2004, 18: 562-564. DOI:10.1096/fj.03-0289fje |
| [25] |
Li Z, Jansen M, Pierre S, et al. Neurodegeneration:linking ubiquitin/proteasome pathway impairment with inflammation[J]. Int J Biochem Cell Biol, 2003, 35: 547-552. DOI:10.1016/S1357-2725(02)00384-9 |
| [26] |
Rebecca VW, Nicastri MC, Fennelly C, et al. PPT1 promotes tumor growth and is the molecular target of chloroquine derivatives in cancer[J]. Cancer Discov, 2019, 9: 220-229. DOI:10.1158/2159-8290.CD-18-0706 |
| [27] |
Schrezenmeier E, Dörner T. Mechanisms of action of hydroxychloroquine and chloroquine:implications for rheumatology[J]. Nat Rev Rheumatol, 2020, 16: 155-166. DOI:10.1038/s41584-020-0372-x |
| [28] |
Rubinsztein DC, Gestwicki JE, Murphy LO, et al. Potential therapeutic applications of autophagy[J]. Nat Rev Drug Discov, 2007, 6: 304-312. DOI:10.1038/nrd2272 |
| [29] |
Ghislat G, Lawrence T. Autophagy in dendritic cells[J]. Cell Mol Immunol, 2018, 15: 944-952. DOI:10.1038/cmi.2018.2 |
| [30] |
Munz C. Autophagy beyond intracellular MHC class Ⅱ antigen presentation[J]. Trends Immunol, 2016, 37: 755-763. DOI:10.1016/j.it.2016.08.017 |
| [31] |
Demachi-Okamura A, Torikai H, Akatsuka Y, et al. Autophagy creates a CTL epitope that mimics tumor-associated antigens[J]. PLoS One, 2012, 7: e47126. DOI:10.1371/journal.pone.0047126 |
| [32] |
Kuznik A, Bencina M, Svajger U, et al. Mechanism of endosomal TLR inhibition by antimalarial drugs and imidazoquinolines[J]. J Immunol, 2011, 186: 4794-4804. DOI:10.4049/jimmunol.1000702 |
| [33] |
Lau CM. RNA-associated autoantigens activate B cells by combined B cell antigen receptor/Toll-like receptor 7 engagement[J]. J Exp Med, 2005, 202: 1171-1177. DOI:10.1084/jem.20050630 |
| [34] |
Dijkmans BAC, Iersel ML, Rooij HHV, et al. Chloroquine and hydroxychloroquine equally affect tumor necrosis factor-alpha, interleukin 6, and interferon-gamma production by peripheral blood mononuclear cells[J]. J Rheumatol, 1997, 24: 55-60. |
| [35] |
De Wilde AH, Jochmans D, Posthuma CC, et al. Screening of an FDA-approved compound library identifies four small-molecule inhibitors of middle east respiratory syndrome coronavirus replication in cell culture[J]. Antimicrob Agents Chemother, 2014, 58: 4875-4884. DOI:10.1128/AAC.03011-14 |
| [36] |
Keyaetrs E, Li S, Vijgen L, et al. Antiviral activity of chloroquine against human coronavirus OC43 infection in newborn mice[J]. Antimicrob Agents Chemother, 2009, 53: 3416-3421. DOI:10.1128/AAC.01509-08 |
| [37] |
Vincent MJ, Bergeron E, Benjannet S, et al. Chloroquine is a potent inhibitor of SARS coronavirus infection and spread[J]. Virol J, 2005, 2: 69. DOI:10.1186/1743-422X-2-69 |
| [38] |
Wang M, Cao R, Zhang L, et al. Remdesivir and chloroquine effectively inhibit the recently emerged novel coronavirus (2019-nCoV) in vitro[J]. Cell Res, 2020, 30: 269-271. DOI:10.1038/s41422-020-0282-0 |
| [39] |
Mackenzie AH. Dose refinements in long-term therapy of rheumatoid arthritis with antimalarials[J]. Am J Med, 1983, 75: 40-45. |
| [40] |
Yao X, Ye F, Zhang M, et al. In vitro antiviral activity and projection of optimized dosing design of hydroxychloroquine for the treatment of severe acute respiratory syndrome coronavirus 2(SARS-CoV-2)[J]. Clin Infect Dis, 2020. DOI:10.1093/cid/ciaa237 |
| [41] |
Madrid PB, Panchal RG, Warren TK, et al. Evaluation of Ebola virus inhibitors for drug repurposing[J]. ACS Infect Dis, 2015, 1: 317-326. DOI:10.1021/acsinfecdis.5b00030 |
| [42] |
Garcez PP, Loiola EC, Madeiro da Costa R, et al. Zika virus impairs growth in human neurospheres and brain organoids[J]. Science, 2016, 352: 816-818. DOI:10.1126/science.aaf6116 |
| [43] |
Tang H, Hammack C, Ogden SC, et al. Zika virus infects human cortical neural progenitors and attenuates their growth[J]. Cell Stem Cell, 2016, 18: 587-590. DOI:10.1016/j.stem.2016.02.016 |
| [44] |
Qian X, Nguyen HN, Song MM, et al. Brain-region-specific organoids using mini-bioreactors for modeling ZIKV exposure[J]. Cell, 2016, 165: 1238-1254. DOI:10.1016/j.cell.2016.04.032 |
| [45] |
Rodrigo D, Luiza H, Paula P, et al. Chloroquine, an endocytosis blocking agent, inhibits Zika virus infection in different cell models[J]. Viruses, 2016, 8: 322. DOI:10.3390/v8120322 |
| [46] |
Tsai WP, Nara PL, Kung HF. Inhibition of human immunodeficiency virus infectivity by chloroquine[J]. AIDS Res Hum Retrov, 1990, 6: 481-489. DOI:10.1089/aid.1990.6.481 |
| [47] |
Farias KJ, Machado PR, da Fonseca BA. Chloroquine inhibits Dengue virus type 2 replication in Vero cells but not in C6/36 cells[J]. Sci World J, 2013. DOI:10.1155/2013/282734 |
| [48] |
Han Y, Pham HT, Xu H, et al. Antimalarial drugs and their metabolites are potent Zika virus inhibitors[J]. J Med Virol, 2019, 91: 1182-1190. DOI:10.1002/jmv.25440 |
| [49] |
Khan M, Santhosh SR, Tiwari M, et al. Assessment of in vitro prophylactic and therapeutic efficacy of chloroquine against chikungunya virus in Vero cells[J]. J Med Virol, 2010, 82: 817-824. DOI:10.1002/jmv.21663 |
| [50] |
Shoji H, Azuma K, Nishimura Y, et al. Acute viral encephalitis:the recent progress[J]. Internal Med, 2002, 41: 420-428. DOI:10.2169/internalmedicine.41.420 |
| [51] |
Lima TLC, Feitosa RC, Dos Santos-Silva E, et al. Improving encapsulation of hydrophilic chloroquine diphosphate into biodegradable nanoparticles:a promising approach against herpes virus simplex-1 infection[J]. Pharmaceutics, 2018, 10: E255. DOI:10.3390/pharmaceutics10040255 |
| [52] |
Hsueh PR, Yang PC. Severe acute respiratory syndrome (SARS) - an emerging infection of the 21st century[J]. J Formosan Med Assoc, 2003, 102: 825-839. |
| [53] |
Barnard DL, Day CW, Bailey K, et al. Evaluation of immunomodulators, interferons and known in vitro SARS-CoV inhibitors for inhibition of SARS-CoV replication in BALB/c mice[J]. Antiviral Chem Chemother, 2006, 17: 275-284. DOI:10.1177/095632020601700505 |
| [54] |
Huang TG, Sun L, Zhan P, et al. Recent advances in the research of broad-spectrum antiviral agents[J]. Acta Pham Sin (药学学报), 2020, 55: 679-693. |
| [55] |
Martinez JP, Sasse F, Bronstrup M, et al. Antiviral drug discovery:broad-spectrum drugs from nature[J]. Nat Prod Rep, 2015, 1: 29-48. |
| [56] |
Crnic LS, Segall MA. Behavioral effects of mouse interferons-alpha and -gamma and human interferon-alpha in mice[J]. Brain Res, 1992, 590: 277-284. DOI:10.1016/0006-8993(92)91106-O |
| [57] |
Akintonwa A, Gbajumo SA, Mabadeje AF. Placental and milk transfer of chloroquine in humans[J]. Ther Drug Monit, 1988, 10: 147-149. DOI:10.1097/00007691-198802000-00004 |
| [58] |
Akintonwa A, Meyer MC, Yau MK. Placental transfer of chloroquine in pregnant rabbits[J]. Res Commun Chem Pathol Pharmacol, 1983, 40: 443-455. |
| [59] |
Essien EE, Afamefuna GC. Chloroquine and its metabolites in human cord blood, neonatal blood, and urine after maternal medication[J]. Clin Chem, 1982, 28: 1148-1152. DOI:10.1093/clinchem/28.5.1148 |
| [60] |
Augustijns P, Jongsma HW, Verbeke N. Transplacental distribution of chloroquine in sheep[J]. Dev Pharmacol Ther, 1991, 17: 191-199. DOI:10.1159/000457522 |
| [61] |
Ma JP, Xia HJ, Zhang GH, et al. Inhibitory effects of chloroquine on the activation of plasmacytoid dendritic cells in SIVmac239-infected Chinese rhesus macaques[J]. Cell Mol Immunol, 2012, 9: 410-416. DOI:10.1038/cmi.2012.22 |
| [62] |
Li CF, Zhu XL, Ji X, et al. Chloroquine, a FDA-approved drug, prevents Zika virus infection and its associated congenital microcephaly in mice[J]. EBioMedicine, 2017, 24: 189-194. DOI:10.1016/j.ebiom.2017.09.034 |
| [63] |
Pierre R, Simon-Djamel T, Laurence DM, et al. Paradoxical effect of chloroquine treatment in enhancing Chikungunya virus infection[J]. Viruses, 2018, 10: E268. DOI:10.3390/v10050268 |
| [64] |
Mzayek F, Deng H, Mather FJ, et al. Randomized dose-ranging controlled trial of AQ-13, a candidate antimalarial, and chloroquine in healthy volunteers[J]. PLoS Clin Trials, 2007, 2: e6. DOI:10.1371/journal.pctr.0020006 |
| [65] |
De Lamballerie X, Boisson V, Reynier JC, et al. On chikungunya acute infection and chloroquine treatment[J]. Vector Borne Zoonotic Dis, 2008, 8: 837-839. DOI:10.1089/vbz.2008.0049 |
| [66] |
Gao JJ, Tian ZX, Yang X. Breakthrough:chloroquine phosphate has shown apparent efficacy in treatment of COVID-19 associated pneumonia in clinical studies[J]. BioSci Trends, 2020, 14: 72-73. DOI:10.5582/bst.2020.01047 |
| [67] |
Borba MGS, Val FFA, Sampaio VS, et al. Effect of high vs low dose of chloroquine diphosphate as adjunctive therapy for patients hospitalized with severe acute respiratory syndrome coronavirus 2(SARS-CoV-2) infection:a randomized clinical tiral[J]. JAMA Netw Open, 2020, 3: e208857. DOI:10.1001/jamanetworkopen.2020.8857 |
| [68] |
Multicenter Collaboration Group of Department of Science and Technology of Guangdong Province and Health Commission of Guangdong Province for Chloroquine in the Treatment of Novel Coronavirus Pneumonia. Expert consensus on chloroquine phosphate for the treatment of novel coronavirus pneumonia[J]. Chin J Tuberc Respir Dis (中华结核和呼吸杂志), 2020, 43: 185-188. |
| [69] |
Hama R. The mechanisms of delayed onset type adverse reactions to oseltamivir[J]. Infect Dis (Lond), 2016, 48: 651-660. DOI:10.1080/23744235.2016.1189592 |
| [70] |
Chen J, Liu DP, Liu L, et al. A pilot study of hydroxychloroquine in treatment of patients with common coronavirus disease-19(COVID-19)[J]. J Zhejiang Univ Med Sci (浙江大学学报医学版), 2020. DOI:10.3785/j.issn.1008-9292.2020.03.03 |
| [71] |
Drifa B, Nathan PS, Yazdan Y, et al. A brief review of antiviral drugs evaluated in registered clinical trials for COVID-19[J/OL]. medRxiv, 2020. https://doi.org/10.1101/2020.03.18.20038190.
|
| [72] |
Chloroquine prevention of coronavirus disease (COVID-19) in the healthcare setting (COPCOV)[DB/OL]. ClinicalTrials.gov, 2020[2020-03-27]. https://clinicaltrials.gov/ct2/show/NCT04303507?term=NCT04303507&draw=2&rank=1.
|
| [73] |
Murray SM, Down CM, Boulware DR, et al. Reduction of immune activation with chloroquine therapy during chronic HIV infection[J]. J Virol, 2010, 84: 12082-12086. DOI:10.1128/JVI.01466-10 |
| [74] |
Routy JP, Angel J, Patel M, et al. Assessment of chloroquine as a modulator of immune activation to improve CD4 recovery in immune nonresponding HIV-infected patients receiving antiretroviral therapy[J]. HIV Med, 2015, 16: 48-56. DOI:10.1111/hiv.12171 |
| [75] |
Joshi SR, Butala N, Patwardhan MR, et al. Low cost anti-retroviral options:chloroquine based ARV regimen combined with hydroxyurea and lamivudine:a new economical triple therapy[J]. J Assoc Physicians India, 2004, 52: 597-598. |
| [76] |
Savarino A, Di Trani L, Donatelli I, et al. New insights into the antiviral effects of chloroquine[J]. Lancet Infect Dis, 2006, 6: 67-69. DOI:10.1016/S1473-3099(06)70361-9 |
| [77] |
Tricou V, Minh NN, Van TP, et al. A randomized controlled trial of chloroquine for the treatment of Dengue in Vietnamese adults[J]. PLoS Negl Trop Dis, 2010, 4: e785. DOI:10.1371/journal.pntd.0000785 |
| [78] |
Namazi MR. The potential negative impact of proton pump inhibitors on the immunopharmacologic effects of chloroquine and hydroxychloroquine[J]. Lupus, 2009, 18: 104-105. DOI:10.1177/0961203308097574 |
| [79] |
Jallouli M, Galicier L, Zahr N, et al. Determinants of hydroxychloroquine blood concentration variations in systemic lupus erythematosus[J]. Arthritis Rheumatol, 2015, 67: 2176-2184. DOI:10.1002/art.39194 |
| [80] |
Hobbs HE, Sorsby A, Freedman A. Retinopathy following chloroquine therapy[J]. Lancet, 1959, 274: 478-480. DOI:10.1016/S0140-6736(59)90604-X |
| [81] |
Madalena BV, Oshima A. Amsler grid and visual field on screening for chloroquine retinopathy[J]. Arq Bras Oftalmol, 2012, 75: 170-173. DOI:10.1590/S0004-27492012000300004 |
| [82] |
Levy GD, Munz SJ, Paschal J, et al. Incidence of hydroxychloroquine retinopathy in 1207 patients in a large multicenter outpatient practice[J]. Arthritis Rheum, 1997, 40: 1482-1486. DOI:10.1002/art.1780400817 |
| [83] |
Nathalie CC, Bertrand D, Gaëlle L, et al. A critical review of the effects of hydroxychloroquine and chloroquine on the eye[J]. Clin Rev Allergy Immunol, 2015, 49: 317-326. DOI:10.1007/s12016-015-8469-8 |
| [84] |
Tanenbaum L. Antimalarial agents chloroquine, hydroxychloroquine, and quinacrine[J]. Arch Dermatol, 1980, 116: 587-591. DOI:10.1001/archderm.1980.01640290097026 |
| [85] |
Hephzibah A. Chloroquine could be used for the treatment of filoviral infections and other viral infections that emerge or emerged from viruses requiring an acidic pH for infectivity[J]. Cell Biochem Funct, 2016, 34: 191-196. DOI:10.1002/cbf.3182 |
| [86] |
Ksiazek TG, Erdman D, Goldsmith CS, et al. A novel coronavirus associated with severe acute respiratory syndrome[J]. N EngI J Med, 2003, 348: 1953-1966. DOI:10.1056/NEJMoa030781 |
| [87] |
Banerjee A, Nasir JA, Budylowski P, et al. Isolation, sequence, infectivity and replication kinetics of SARS-CoV-2[J/OL]. bioRxiv, 2020. https://doi.org/10.1101/2020.04.11.037382.
|
| [88] |
Madrid PB, Chopra S, Manger ID, et al. A systematic screen of FDA-approved drugs for inhibitors of biological threat agents[J]. PLoS One, 2013, 8: e60579. DOI:10.1371/journal.pone.0060579 |
| [89] |
Augustijns P, Geusens P. Chloroquine levels in blood during chronic treatment of patients with rheumatoid arthritis[J]. Eur J Clin Pharmacol, 1992, 42: 429-433. |
| [90] |
Picot S, Peyron F, Vuillez JP, et al. Chloroquine inhibits tumor necrosis factor production by human macrophages in vitro[J]. J Infect Dis, 1991, 164: 830. |
| [91] |
Browning DJ. Hydroxychiloroquine and Chloroquine Retinopathy:Pharmacology of Chloroquine and Hydroxychloroquine[M]. New York: Springer Press, 2014: 35-63.
|
| [92] |
Munster T, Gibbs JP, Shen D, et al. Hydroxychloroquine concentration-response relationships in patients with rheumatoid arthritis[J]. Arthritis Rheum, 2002, 46: 1460-1469. DOI:10.1002/art.10307 |
 2020, Vol. 55
2020, Vol. 55




