近年来, 肿瘤免疫治疗已成为癌症治疗的一个重要手段, 与化疗、靶向治疗、手术和放射治疗并驾齐驱。正常情况下, 免疫系统可以识别并清除肿瘤细胞。但肿瘤细胞具有免疫逃逸的能力, 可通过不同环节抑制免疫系统对肿瘤细胞的有效识别和杀伤, 从而产生免疫耐受, 甚至促进肿瘤的发生和发展。肿瘤免疫治疗主要是通过引导免疫系统靶向肿瘤相关抗原, 增强抗肿瘤免疫应答, 进而攻击、杀伤肿瘤细胞。它是一种通过重新启动并维持肿瘤-免疫循环, 恢复机体正常的抗肿瘤免疫反应, 从而控制与清除肿瘤的治疗方法。肿瘤免疫治疗主要包括非特异性免疫治疗、癌症疫苗、溶瘤病毒治疗、治疗性抗体、免疫检查点阻滞剂、细胞治疗、细胞因子和小分子抑制剂等[1, 2]。
目前, 免疫检查点抑制剂、嵌合抗原受体T细胞(chimeric antigen receptor T cells, CAR-T cells)和双特异性抗体已被广泛应用于肿瘤治疗, 以克服免疫抑制和潜在的T细胞耗竭。近年来, 肿瘤免疫治疗的好消息接连不断, 已在多种肿瘤如黑色素瘤、非小细胞肺癌、肾癌和前列腺癌等实体瘤的治疗中展示出了强大的抗肿瘤活性。多种肿瘤免疫治疗药物已经获得美国FDA (Food and Drug Administration)批准用于临床, 特别是目前基于抗体的肿瘤免疫治疗剂的研究和发展最快, 包括肿瘤靶向相关配体受体结合阻断抗体、免疫检测点阻滞抗体、胞外具有抗体结构域的CAR-T/NK (natural killer)细胞、连接免疫细胞的双特异性抗体和T细胞受体样抗体等[1, 2]。
截至11月底, 2019年度已有5种新的抗体治疗剂在美国或欧盟获得首次批准, 还有13种新的抗体治疗药物正在进行审查批准。目前, 共有79种新抗体正在进行后期临床研究评估, 其中40种为癌症治疗性抗体, 包括抗PD-1 (programmed cell death protein 1)抗体10个、抗PD-L1 (programmed death-ligand 1)抗体4个、抗HER2 (human epidermal growth factor receptor 2)抗体3个、抗CD20抗体2个、抗CTLA-4 (cytotoxic T lymphocyte antigen-4)抗体2个、双特异性抗体5个、还有其他几个免疫检查点阻滞抗体, 一半以上为免疫治疗性抗体。这些后期临床评价的抗体中, 有9个抗体可能在2019年底或2020年进入监管审查, 其中4个为免疫检查点阻滞抗体[3]。
上述肿瘤免疫治疗药物中, 基于抗体的肿瘤免疫治疗发展最快, 过去20多年里已有30多种治疗性抗体药物批准上市, 单克隆抗体已成为针对人类恶性肿瘤疗效显著且类型新颖的药物之一。肿瘤免疫治疗通常比肿瘤放疗和化疗在内的非特异性治疗方法更具有针对性。特别是免疫检查点调节治疗, 其作用机制独特并具有多样性, 免疫系统可以训练记忆癌细胞, 在治疗完成后可以保持持久的抗肿瘤免疫应答。
1 抗体肿瘤免疫治疗的作用机制 1.1 靶向肿瘤相关抗原的作用机制靶向肿瘤相关抗原(tumor-associated antigen, TAA)的治疗性抗体可以通过不同途径来杀伤肿瘤细胞, 主要机制为: ①抗体依赖细胞介导的细胞毒作用(antibody-dependent cell-mediated cytotoxicity, ADCC); ②补体依赖的细胞毒作用(complement-dependent cytotoxicity, CDC); ③抗体依赖性细胞吞噬作用(antibody dependent cellular phagocytosis, ADCP) (图 1); ④抗体直接诱导细胞凋亡。
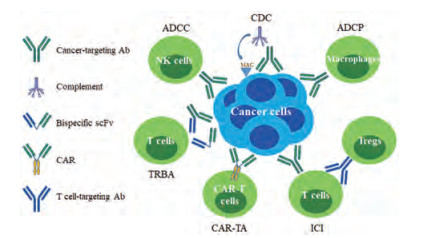
|
Figure 1 Antibody-targeted immune cells and its mechanism of action. Ab: Antibody; scFv: Single chain variable fragment; CAR: Chimeric antigen receptor; ADCC: Antibody-dependent cell-mediated cytotoxicity; CDC: Complement-dependent cytotoxicity; MAC: Membrane attack complex; ADCP: Antibody dependent cellular phagocytosis; NK: Natural killer; TRBA: T cell-redirecting bispecific antibody; CAR-TA: CAR-T cell activation; ICI: Immune checkpoint inhibition; Tregs: Regulatory T cells |
ADCC的作用机制是抗体的Fab (fragment antigen-binding region)段结合肿瘤细胞的抗原表位, 其Fc (fragment crystallizable region)段与杀伤细胞如NK细胞、巨噬细胞、中性粒细胞等表面的Fc受体(Fc receptor, FcR)结合, 介导杀伤肿瘤细胞, 其中活化的NK细胞能够释放穿孔素、颗粒酶等细胞毒物质, 直接杀伤肿瘤靶细胞[4]。在这些杀伤细胞中, NK细胞是介导ADCC的主要细胞[5]。
CDC的作用机制是抗体的Fab段结合肿瘤细胞的抗原表位, 其Fc段与补体C1q结合, 接着激活C2-C9补体系统, 在肿瘤细胞表面形成攻膜复合物, 导致肿瘤细胞的裂解, 这种效应称为补体依赖的细胞毒作用[5]。很多抗肿瘤抗体都可以引起CDC作用, 如抗CD20、CD52、CEA (carcinoembryonic antigen)等抗体。
ADCP的作用机制是基于一种具有吞噬潜能的效应细胞(如巨噬细胞和单核细胞)内吞靶细胞(如肿瘤细胞)的细胞过程。抗体通过与其抗原识别结合到靶细胞上, 随后将吞噬细胞与其Fc段结合到靶细胞上, 一旦与吞噬细胞的FcR结合, 目标细胞即被吞噬, 吞噬体与溶酶体融合并降解[6]。这个过程还导致效应细胞产生可溶性因子, 帮助启动和驱动免疫反应。
1.2 靶向免疫检查点分子的作用机制T细胞在肿瘤免疫治疗中起重要作用, 肿瘤微环境中免疫检查点(immune checkpoint)分子PD-1、PD-L1、CTLA-4、TIM-3 (T cell immunoglobulin and mucin 3 domain)、LAG-3 (lymphocyte-activation gene 3)、TIGIT (T cell immunoreceptor with Ig and ITIM domains)、CD73、VISTA (V-domain Ig suppressor of T cell activation)、B7-H3的上调是T细胞抗肿瘤活性的重要机制[7]。其中, 具有代表性的免疫检查点分子是CTLA-4和PD-1, 已经成为临床上单克隆抗体治疗药物的主要作用靶点。
CTLA-4在抑制T细胞免疫方面起着至关重要的作用[8], 其配体是CD80和CD86。CD28作为一种与CTLA-4相关的蛋白在幼稚T细胞上表达, 与抗原呈递细胞(antigen-presenting cell, APC)上的CD80和CD86结合时增强T细胞活化, 而CTLA-4在T细胞活化后的2天内表达增加。CTLA-4在Treg (regulatory T cell)上也高度表达, 并在对Treg的稳态和抑制功能中发挥重要作用。CTLA-4与其配体结合后, 其确切信号转导途径很大程度上仍然未知。越来越多的证据表明, CTLA-4主要通过竞争CD28与CD80和/或CD86的结合来发挥其抑制功能。此外, 研究显示, CTLA-4下调APC上的CD80和CD86, 从而抑制CD28介导的共刺激信号[7]。抗CTLA-4抗体通过阻断CTLA-4与CD80和/或CD86的结合, 促进CD28与CD80和CD86的结合, 增强T细胞活化, 进而杀伤肿瘤细胞。
PD-1作为适应性和先天性免疫反应的抑制因子, 在活化的T细胞、NK细胞、B淋巴细胞、巨噬细胞、树突状细胞(dendritic cell, DC)和单核细胞上诱导表达, 并在肿瘤特异性T细胞上高表达。在生理条件下, PD-1负性调节T细胞活性, 维持外周免疫耐受, 避免免疫病理改变。它通过与配体PD-L1和PD-L2结合来实现, 从而激活细胞内酪氨酸磷酸酶, 进而抑制参与T细胞激活的下游激酶信号传导, 降低T细胞的增殖和减弱T细胞的激活[8]。PD-1是一种由活化的T细胞和B细胞表达的共抑制受体。实验研究表明, PD-L1表达于人类肿瘤, PD-1/PD-L1的相互作用在抑制TAA特异性CD8+ T细胞效应器功能中发挥作用。PD-1与其配体PD-L1或PD-L2结合, 导致肿瘤微环境中T细胞功能衰竭和免疫耐受。抗PD-1或抗PD-L1抗体通过阻断PD-1通路来恢复“衰竭”T细胞的功能, 诱导细胞程序性死亡, 从而产生显著的抗肿瘤活性。
1.3 基因工程抗体免疫细胞作用机制CAR-T细胞是通过病毒载体将特定的嵌合抗原受体(chimeric antigen receptor, CAR)基因插入自体或异体T细胞而产生的。CAR是典型的基因工程T细胞受体, 由具有特异识别肿瘤抗原的基于抗体的胞外结构域(单链抗体)、跨膜部分和激活T细胞的胞内结构域组成, 其作用机制是通过以主要组织相容性复合体(major histocompatibility complex, MHC)独立方式的抗原特异性识别, 通过免疫受体酪氨酸激活基序磷酸化, 在体内激活T细胞, 从而导致细胞因子分泌, 大量释放多种效应因子, 高效杀灭肿瘤细胞, 达到治疗肿瘤的目的[9]。
CAR-NK细胞是通过病毒载体将特定的CAR基因插入NK细胞而产生的。NK细胞在肿瘤监测中发挥重要的作用, 它对多种恶性肿瘤具有细胞毒性, 包括血液系统急性髓细胞白血病(acute myeloid leukemia, AML)、慢性淋巴细胞白血病(chronic lymphocytic leukemia, CLL)、多发性骨髓瘤(multiple myeloma, MM), 以及许多实体瘤, 如神经母细胞瘤、卵巢癌、结肠癌、肾细胞癌和胃癌。但是, 许多肿瘤发展了免疫逃避策略, 以规避自身被NK细胞杀伤。如一些白血病和淋巴瘤细胞保持人白细胞抗原(human leukocyte antigen, HLA)分子的高表达, 使其忽视NK细胞的攻击, 或者缺少通过激活NK细胞受体发出信号的配体。因此, 许多研究者已探索了增强NK细胞活性的策略, 如给NK细胞装上特异性识别肿瘤的CAR, 进一步加强了识别和杀伤癌细胞的能力。当识别肿瘤细胞之后, NK细胞通过释放杀伤介质穿孔素和颗粒酶使靶细胞凋亡, 并通过表达TNF (tumor necrosis factor)家族分子诱导靶细胞凋亡等杀伤肿瘤细胞[10]。
1.4 募集免疫细胞的双特异性抗体作用机制目前, 临床试验中的大多数双特异性抗体(bispecific antibody, biAb)是免疫细胞参与的, ClinicalTrials.gov网上报道的57个肿瘤相关biAb中, 有38个是这种类型的抗体, 这其中的36个通过与T细胞受体CD3结合, 而这36个抗体中有18个靶向血液恶性肿瘤、其余的靶向实体瘤[11]。BiAb的抗肿瘤作用机制是通过一只臂靶向肿瘤细胞表面受体, 另一只臂募集和激活T细胞, 进一步诱导高效的和选择性的细胞毒性[12]。当T细胞和肿瘤细胞同时被biAb结合时, 介导了T细胞与肿瘤细胞之间的细胞溶解突触的形成, 该细胞溶解突触包含T细胞释放的孔形成蛋白(穿孔素)和细胞毒性颗粒酶B, 导致肿瘤细胞的杀伤。该作用在体外得到证明, 并可以通过共聚焦显微镜观察获得。值得注意的是, 在没有靶细胞的情况下, biAb与T细胞结合后不能激活T细胞。
此外, 无论T细胞受体(T cell receptor, TCR)特异性和MHC如何限制, biAb均可同时识别T细胞CD3和TAA, 从而使效应T细胞与癌细胞交联。这种交联都会导致T细胞活化和直接的细胞毒性, 而细胞因子应答的诱导可能进一步触发对邻近细胞的旁观者效应, 杀伤周边的肿瘤细胞[13]。尽管该作用机制简单, 但将其简化为实践却受到了众多分子和细胞因素的困扰, 如细胞溶解突触的有效形成将会受到biAb双臂的亲和力的影响, 也会受到它们在T细胞和肿瘤细胞上的靶标的表位、密度和流动性的影响。
2 肿瘤免疫治疗作用靶分子自1986年以来, 美国或欧盟总共首次批准90个治疗性抗体药物上市。其中, 抗肿瘤抗体药物35个, 共有40多个不同的肿瘤适应症。而肿瘤靶分子只有21个, 有的靶分子拥有多个抗体, 例如抗PD1/PDL1单抗有6个、抗CD20单抗有5个、抗HER2单抗有4个、抗EGFR (epidermal growth factor receptor)单抗有3个、抗VEGF (vascular endothelial growth factor)/VEGFR (VEGF receptor)单抗有3个、抗IL6 (interleukin 6)/IL6R (IL6 receptor)单抗有2个[14]。因此, 基于肿瘤的多样性和特异性, 还有更多的肿瘤相关靶分子有待进一步发掘。
2.1 特异性肿瘤相关抗原TAA分子在多种肿瘤上特异性高表达。已获批上市的抗肿瘤抗体靶分子包括: CD20、EpCAM (epithelial cell adhesion molecule)、CD3、HER2、EGFR、VEGF、CTLA-4、CD30、VEGFR2、PD-1、CD19、CD52、GD2、CD38、SLAMF7 (SLAM family member 7)、PDGFR-α (platelet derived growth factor receptor alpha)、PD-L1、CD22、CD33、CD79b和nectin-4等。在这些治疗性抗体药物中, 有许多单克隆抗体通过ADCC、CDC和ADCP机制杀伤肿瘤细胞:如1997年, 第1个被美国FDA批准上市的抗CD20嵌合抗体利妥昔单抗(美罗华), 用于治疗非霍奇金淋巴瘤; 1998年, 第1个抗HER2人源化抗体曲妥珠单抗(赫赛汀), 用于治疗乳腺癌; 2006年, 第1个抗EGFR人源抗体帕尼莫单抗(维克替比), 用于治疗结直肠癌等。这些抗体与靶分子结合后都能激活免疫系统杀灭肿瘤细胞[15]。此外, 还有一些靶分子如c-Met (tyrosine-protein kinase Met)、uPA (urokinase plasminogen activator)、抗氧化酶(膜过氧化氢酶、超氧化物歧化酶)、DR5 (death receptor 5)、TRAIL (TNF-related apoptosis-inducing ligand)、CEA、TNF-α、趋化因子受体CXCR4 (C-X-C chemokine receptor 4)和CXCR7等。目前, 有许多抗TAA抗体正处在临床研究中(表 1)。
| Table 1 The targeting molecules and mechanisms of antibodies related with cancer immunotherapy in clinical trials. TAA: Tumor-associated antigen; NHL: Non-Hodgkin's lymphoma; CLL: Chronic lymphoblastic leukemia; HER2: Human epidermal growth factor receptor 2; AML: Acute myeloid leukemia; EGFR: Epidermal growth factor receptor; VEGF: Vascular endothelial growth factor; VEGFR: VEGF receptor; ALL: Acute lymphoblastic leukemia; PDGFR-α: Platelet derived growth factor receptor alpha; CTLA-4: Cytotoxic T lymphocyte antigen-4; APCs: Antigen-presenting cells; PD-1: Programmed cell death protein 1; DCs: Dendritic cells; LAG3: Lymphocyte-activation gene 3; TIGIT: T cell immunoreceptor with Ig and ITIM domains; TIM-3: T cell immunoglobulin and mucin 3 domain; VISTA: V-domain Ig suppressor of T cell activation; CEACAM1: Carcinoembryonic antigen related cell adhesion molecule 1; GITR: Glucocorticoid-induced tumor necrosis factor receptor; ICOS: Inducible T cell costimulator; CNSL: Central nervous system lymphoma; MSLN: Mesothelin; PSCA: Prostate stem cell antigen; CLDN18.2: Isoform 2 of the tight junction molecule claudin-18; EGFRvⅢ: Epidermal growth factor receptor variant Ⅲ; BCMA: B-cell maturation antigen; CSPG4: Chondroitin sulfate proteoglycan-4; MUC1: Mucin 1; CLEC12A: C-type lectin domain family 12 member A; GPC3: Glypican-3; CEA: Carcinoembryonic antigen; scFv: Single-chain variable fragment; EpCAM: Epithelial cell adhesion molecule; PSMA: Prostate-specific membrane antigen; MPS: Myeloproliferative syndrome; DLL3: Delta-like ligand 3 |
TCR样抗体能够识别肿瘤特异性抗原多肽/MHC复合物, 导致触发ADCC、CDC和ADCP应答, 并杀伤肿瘤细胞[16]。此外, TCR样抗体可转化为CAR结构, 介导T细胞(如CAR-T细胞)对肿瘤细胞的特异性识别。这种肿瘤特异性多肽可分为4类: ①肿瘤病毒抗原, 如EBNA1-3 [EBV (Epstein-Barr virus) nuclear antigen 1-3]、EBV [LMP (low malignant potential) 1和2]、HBV (hepatitis B virus) (HBV X protein, HBx)、HCV (hepatitis C virus) (NS3和NS5A)、HPV (human papillomavirus) (E5、E6和E7)和CMV (cytomegalovirus) (PP65)等; ②肿瘤细胞染色体/基因突变产物, 如β-连环蛋白(S37F)、α-肌动蛋白-4 (K122N)、热休克蛋白70-2 (F293I)、K-ras (G12D)、MYD88 (myeloid differentiation factor 88) (L265P)、BCR (breakpoint cluster region protein)-ABL (Aberlson murine leukemia)融合蛋白; ③肿瘤-睾丸抗原; ④正常细胞极少或有限表达的肿瘤抗原, 如癌胚抗原(CEA)和酪氨酸激酶10等[17]。
许多免疫活性分子可以各种形式与抗体结合, 其中最重要的一类分子是细胞因子, 包括白细胞介素2 (IL-2)、粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony-stimulating factor, GM-CSF)、肿瘤坏死因子-α (TNF-α), 其中IL-12已被证实能在癌症患者中引起理想的临床应答。这些细胞因子的主要缺点是与获得抗肿瘤效果所需的高血细胞浓度相关的严重全身毒性。当细胞因子与抗体连接后, 形成细胞因子抗体融合蛋白(免疫细胞因子), 通过抗体把细胞因子直接靶向肿瘤, 既利用了细胞因子在肿瘤治疗中的优势, 同时又减少了其不良的全身不良反应。免疫细胞因子发挥抗肿瘤作用的机制是诱导免疫反应, 包括IFNγ (interferon gamma)分泌、T细胞和NK细胞活化、ADCC增强、多形核黏附和脱颗粒等[18]。携带细胞因子的抗体进一步促进了适应性抗肿瘤免疫作用, 如①Ⅰ型干扰素(包括IFN-α、IFN-β、IFN-ε、IFN-κ和IFN-ν)通过影响巨噬细胞、NK细胞、DC、单核细胞和B/T细胞的活化、迁移、分化和存活参与调节先天性和适应性免疫应答; ②作为肿瘤坏死因子超家族成员14 (tumor necrosis factor superfamily member 14, TNFSF14), 又称为LIGHT, 是用于T细胞活化的共刺激分子之一; ③ IL-2是一种多效性细胞因子, 可促进抗原刺激诱导的NK和T细胞增殖[15]。目前, 临床研究中的抗体融合蛋白有6种, 包括抗EDB (extradomain-B)-IL-12、抗EDB-IL-2、抗EDB-TNF-α、抗肌腱蛋白C-IL-2、抗GD2-IL-2和抗CD20-IL-2融合蛋白, 细胞因子有IL-12、IL-2和TNF-α, 针对的TAA是EDB、肌腱蛋白C、GD2和CD20。
2.2 免疫检查点靶分子尽管肿瘤发生发展过程中已建立了免疫抑制机制, 但有效的抗肿瘤免疫应答仍依赖于先天性和适应性免疫系统的强烈激活, 最终消除恶性细胞。2013年, 由于明确了免疫检查点受体CTLA-4和PD-1参与肿瘤诱导免疫抑制的T细胞共同抑制分子的阻断作用, 肿瘤免疫治疗取得显著的突破。2011年, 美国批准抗CTLA-4伊匹木单抗, 用于治疗转移性黑色素瘤; 2014年批准抗体PD-1帕博利珠单抗(可瑞达)和尼武单抗(欧狄沃), 用于治疗黑色素瘤和非小细胞肺癌; 2016年批准抗体PD-L1阿替唑单抗, 用于治疗膀胱癌。免疫检查点相关的靶分子主要在T细胞、NK细胞、Treg和巨噬细胞上表达, 以及在抗原提呈细胞和肿瘤细胞上表达。其中, 一种是免疫共刺激因子: CD28/CD80, 86 (B7.1/2)、CD137 (4-1BB)/4-1BBL、OX40/OX40L、CD27/CD70、ICOS (inducible T cell costimulator)/ICOSL (B7RP1)、GITR (glucocorticoid-induced tumor necrosis factor receptor)/GITRL、TMIGD2 (transmembrane and immunoglobulin domain-containing protein 2) (CD28H)/B7-H7 (HERV-H LTR-associating protein 2, HHLA2)、HVEM (herpes virus entry mediator) (CD270)/LIGHT、CD40 (GITR)/CD40L、DNAM-1 (DNAX accessory molecule-1) (CD226)/PVR (poliovirus receptor) (CD155)、2B4 (CD244)/CD48、SIRPα (signal-regulatory protein alpha)/CD47、CD94/NKG2 (natural killer group 2)/MHC-I、CD2/LFA3 (lymphocyte function-associated antigen 3) (CD58)、LFA1/ICAM (intercellular adhesion molecule)和TCR/CD3/MHC-Ⅰ, Ⅱ; 另一种是免疫共抑制因子: CTLA-4 (CDD153)/CD80, 86 (B7.1/2)、PD-1 (CD270)/PD-L1, 2、B7-1 (CD80)/PD-L1 (CD274)、IDO (indoleamine-pyrrole 2, 3-dioxygenase) 1, 2, TDO (tryptophan 2, 3-dioxygenase)、BTLA (B and T lymphocyte attenuator), CD160/HVEM (CD270)、TIM-3/GAL9 (galectin-9), HMGB1 (high mobility group box 1)、CD96, DNAM-1/PVR (CD155)、CD112R, TIGIT/PVRL2 (CD112)、A2aR (adenosine A2a receptor)、CD200R/CD200、IL20RA (interleukin 20 receptor subunit alpha)/B7-H3 (CD276)、VISG-3/B7-H5 (VISTA)、KIR (killer immunoglobulin-like receptor)/MHC-Ⅰ和LAG-3/MHC-Ⅰ, Ⅱ, PGL1 (paragangliomas-1)等[13, 19]。
除免疫检查点外, 还有吞噬检查点(phagocytosis checkpoints)的研究报道。天然免疫检查点通过吞噬作用干扰恶性细胞的检测和清除, 抑制天然免疫应答, 在肿瘤介导的免疫逃逸中也起着关键作用, 因此可能成为癌症免疫治疗的潜在靶点[20]。巨噬细胞对肿瘤细胞的吞噬作用受到许多吞噬作用和抗吞噬作用(“不要吃我”)信号的调节, 肿瘤细胞依赖“不要吃我”信号的表达, 包括CD47、PD-L1、β2-微球蛋白(beta-2 microglobulin, B2M)、以及其他配体, 它们与LILRB2 (leukocyte immunoglobulin like receptor B2)结合, 抑制吞噬细胞的吞噬作用。CD47在多种肿瘤中高表达, 也是肿瘤的一个不良预后因素。临床前和早期临床研究已经确定了靶向吞噬检查点, 如CD47信号调节蛋白α (SIRPα)轴的免疫治疗作用, 靶向CD47的治疗药物可以单独应用, 也可以与其他抗癌药物联合应用。目前, 临床上研究的吞噬检查点阻断抗体为抗CD47单抗, 它阻断CD47的“不要吃我”信号, 可增加巨噬细胞介导的吞噬作用, 并消除各种实体瘤。
2.3 含抗体胞外结构域的CAR细胞治疗靶分子CAR细胞是含有胞外单链抗体(single chain variable fragment, scFv)结构域的免疫细胞, 共研发了五代CAR细胞。第一代, CAR链接胞内结构域CD3ζ, 以激活T细胞的细胞内信号; 第二代, 包含额外的共刺激域, 如CD134、CD28、CD137或4-1BB, 这些细胞内信号结构域的参与改善了细胞因子分泌、T细胞增殖、靶细胞裂解和抗凋亡蛋白表达, 如Bcl-xl (B-cell lymphoma-extra large); 第三代, 包含多个共刺激结构域, 如CD28-OX40、CD28-41BB或CD137, 以增强T细胞活性; 第四代, 为T细胞样共刺激配体和IL-12添加了额外的因子, 以增强T细胞的扩张、持久性和抗肿瘤活性; 第五代, 能够通过IL-2Rβ和STAT3 (signal transducer and activator of transcription 3)结合位点的细胞内结构域诱导细胞因子信号, 从而激活JAK (Janus kinase)-STAT3/5信号通路[1]。
CAR细胞免疫治疗是最有前途的现代肿瘤治疗方法之一。迄今为止, 只有2种抗CD19的CAR-T细胞产品金里亚(Kymriah)和叶卡特(Yescarta)被美国FDA批准, 用于治疗淋巴母细胞白血病和B细胞淋巴瘤, 这标志着细胞和基因治疗领域一个重要里程碑[21]。长期以来, 应用CAR-T细胞控制实体瘤一直被认为是最困难的治疗任务之一。尽管在肉瘤和神经母细胞瘤患者中进行的前2个临床试验中显示CAR-T细胞的临床益处, 但仍有许多障碍阻碍人们获得有效的治疗[22]。与单克隆抗体一样, CAR-T细胞只能识别肿瘤细胞膜上表达的TAA。CAR转导的T细胞靶向的TAA包括CD19、MSLN (mesothelin)、GPC3 (glypican-3)、BCMA (B-cell maturation antigen)、CLDN18.2 (isoform 2 of the tight junction molecule claudin-18)、CEA、CSPG4 (chondroitin sulfate proteoglycan-4)、FOLR1 (folate receptor 1)、GD2、GD3、CD30、CD133、CD138和HER2等[2]。
大多数CAR-NK细胞还处在临床前研究阶段, 其靶向的TAA包括: CD19、EGFR、HER2、GD2、CD20、CD33、CD133、CD70、CD138、EpCAM、CS-1、PSCA (prostate stem cell antigen)、IL-13Rα2、EGFRvⅢ (epidermal growth factor receptor variant Ⅲ)、EPHA2 (erythropoietin-producing hepatocellular receptor A2)和CSPG4等[10, 23, 24]。尽管抗CD19 CAR-T细胞疗法在B细胞癌症中显示出显著的临床疗效, 然而CAR-T细胞可诱导明显的细胞毒性作用, 经过修饰的抗CD19 CAR-NK细胞具有克服这些局限性的潜力[25]。在Ⅰ和Ⅱ期临床试验中, 对11例复发或难治性CD19阳性非霍奇金淋巴瘤或慢性淋巴细胞性白血病(chronic lymphoblastic leukemia, CLL)患者给予抗CD19 CAR-NK细胞。结果显示, CAR-NK细胞的给药与细胞因子释放综合征、神经毒性或移植物抗宿主病的发生无关, 并且包括IL-6在内的炎性细胞因子的水平也没有增加。在接受治疗的11位患者中, 有8位(73%)有应答, 有7位(4例淋巴瘤患者和3例CLL患者)完全缓解, 有1位部分缓解, 但CLL持续存在, 其应答迅速, 并且在总剂量水平的输注后保持30天。研究结论表明大多数患者对CAR-NK细胞的治疗有应答, 且没有出现重大毒性作用。由此可见, CAR-NK细胞疗法有望成为免疫治疗新宠。
2.4 双特异性抗体靶分子2014年, 美国FDA批准抗CD3×CD19 T细胞结合双特异性抗体(T cell-binding bispecific antibody, T-biAb)布莱那妥单抗, 用于治疗成人和儿童难治性或复发性前B细胞急性淋巴细胞白血病[12]。免疫治疗性双特异性抗体可分为3类:细胞毒性效应细胞重定向抗体、肿瘤靶向免疫调节抗体和双重免疫调节抗体[26]。其中, ①细胞毒性效应细胞重定向抗体:主要是T细胞重定向, T-biAb参与肿瘤相关抗原和T细胞受体/CD3复合物形成, 从而重定向T细胞对恶性细胞的毒性。这是最成熟的一类双特异性免疫疗剂, 有2种化合物已上市, 且许多T-biAb正在临床开发中。常选用的T细胞重定向因子为CD3, 肿瘤靶分子为CD19、EpCAM、CD20、CD123、BCMA、B7H3、CEA、PSMA、EGFR、HER2、HER3、CD95和CD63等。替代T细胞杀伤肿瘤的另一种方法是将NK细胞的细胞毒性功能重定向并激活至恶性细胞, 常用的NK细胞重定向因子为CD16、NKp30、NKp46、NKG2D和DNAM-1, 肿瘤靶分子为CD30、CD33、EGFR和BCMA等[11]; ②肿瘤靶向免疫调节抗体:是一类新兴的双特异性免疫治疗剂, 是与TAA和免疫调节受体(如CD40或4-1BB)结合的biAb。这种biAb通常被设计成在与肿瘤抗原结合之前不起作用, 从而将免疫刺激定位到肿瘤环境中, 同时最小弱化其他部位的免疫激活。这有望诱导肿瘤特异性T细胞的强烈激活, 降低发生免疫相关不良事件的风险, 如由共刺激分子CD40或4-1BB与肿瘤靶分子HER2、FAP (familial adenomatous polyposis)、trophoblast glycoprotein (5T4)构成的biAb; ③双重免疫调节抗体:是结合2个不同免疫靶分子的biAb。双免疫调节剂是结合2个不同免疫调节剂靶点(靶向2个T细胞检查点途径)的双特异性biAb, 通常结合PD-1/PD-L1和LAG-3/TIM-3。其原理是诱导比单一特异性抗体对同一靶点优越的肿瘤免疫, 组合靶分子有: PD-L1×TGF-β (transforming growth factor beta)、PD-1×LAG-3、PD-1×TIM-3、PD-1×CTLA-4和CTLA-4×OX40等。
过去20多年里, 用重组基因工程技术获得了50多种biAb, 其中T-biAb占据主导地位, 此外双特异性scFv已成为一种成功的和有前途的免疫治疗平台。临床研究中的T-biAb可以分为10种[27], 包括7种全长抗体: Triomab、Duobody、IgG-cLC、IgG-Crossmab、XmAb、BEAT和ADAPTIR, 其特征是血清半衰期长, 具有ADCC和CDC作用; 以及3种Fc段缺失抗体: BiTE、DART和TandAb, 特征是缺乏Fc结构域, 可降低非选择性T细胞活化, 且小分子可增强组织穿透力。T-biAb是肿瘤治疗的有力工具, 临床研究表明其在血液系统恶性肿瘤中具有很强的抗肿瘤作用。
3 存在的问题与研究趋势尽管抗体免疫疗法取得了惊人的结果, 但有效的治疗方法仅限于部分癌症类型和患者, 其中许多患者的临床获益很少或没有[1]。通过设计修饰抗体结构域, 以增加抗体对肿瘤抗原靶标的亲和力, 或通过操纵抗体Fcγ结构域, 以增加其对Fcγ受体的亲和力, 可增强抗原呈递和T细胞活化能力来改善ADCC效应; 也可以将肿瘤抗原特异性抗体与其他促进抗原呈递的制剂(如Toll受体激动剂)共刺激(如抗CTLA-4抗体)或T细胞激活或其他制剂结合使用。在肿瘤临床治疗上, ADCC介导的几种有用的免疫治疗性抗体通常与化学治疗药物联合使用。最新研究显示, 双特异性抗体药物融合蛋白能够把力达霉素定向导入肿瘤细胞, 阻断mTOR (mammalian target of rapamycin)和PD-L1双信号途径, 显著增强抗肿瘤疗效[28]。此外, 探索靶向新免疫治疗分子的单克隆抗体研究也在不断进行中, 包括趋化因子受体阻断抗体的研究。在23种人类肿瘤中, CXCR4是最常过表达的趋化因子受体, 其配体是CXCL12 (C-X-C motif chemokine ligand 12)。CXCR4的过表达与肿瘤细胞存活、生长、血管生成、转移和抗药性相关。抗趋化因子受体CXCR4、CCR2 (C-C chemokine receptor type 2)和CCR4的单克隆抗体用于癌症治疗的临床试验正在进行中[29]。
肿瘤免疫治疗包括单克隆抗体、检查点抑制抗体和免疫效应细胞治疗(如CAR-T), 改善了癌症患者的预后和生活质量。但是, 可能会出现严重的危及生命的不良反应, 主要是细胞因子风暴和神经毒性, 是干扰抗体和CAR细胞免疫治疗应用的2个问题, 其引起的不良反应太过于严重, 甚至会出现死亡。细胞因子风暴(即细胞因子释放综合征)是免疫治疗的一种严重临床并发症, 它可导致移植物抗宿主病发生。免疫治疗的大多数不良反应是由针对正常组织的过度T细胞反应引起的, 导致高水平的促炎性细胞因子的产生, 其毒性通常继发于“靶向毒性”。研究显示抗体(如T-biAb)在肿瘤组织的原位表达可降低其毒副作用[12], 具体包括: ①溶瘤病毒(oncolytic virus, OV)可刺激系统性免疫反应, 选择性或直接裂解肿瘤细胞而不损害健康细胞和组织, 对它们进行设计和改造还可装配上编码治疗性转基因表达盒。例如由肿瘤细胞原位表达递送功能性T-biAb可增强选择性杀伤肿瘤作用。这种“特洛伊木马”的概念非常具有吸引力, 因为它取消了对T-biAb制备和纯化的需求。针对T-biAb表达进行工程改造的OV包括腺病毒和麻疹病毒, 使用腺病毒可以将CD3/FAP T-biAb递送到肿瘤相关的成纤维细胞。此外, 将抗CD3×EGFR的T-biAb基因和抗-EGFRvⅢ的CAR基因同时导入T细胞, 可解决肿瘤异质性问题并限制T-biAb在肿瘤组织中的表达; ② CAR-T切换是桥接T-biAb和CAR-T的新概念, 即“可切换CAR-T”, 它由双特异性衔接蛋白募集并激活。抗体biAb可识别癌细胞表面抗原, 并充当双特异性衔接蛋白, 可活化休眠状态的CAR-T。CAR-T的活性和特异性由双特异性衔接蛋白控制, 从而减轻了“细胞因子风暴”和其他不良事件[12]。
尽管抗体免疫治疗在肿瘤治疗中取得了显著进展, 但对抗体单一疗法相对较弱的应答以及肿瘤耐药性仍然是主要的悬而未决的问题。克服耐药性可能需要: ①同时阻断主要靶点和新出现次要靶点的抗体药物的联合治疗; ②抗体和细胞毒性(化疗和放疗)或激酶抑制剂的联合治疗; ③抑制免疫检查点和/或生长因子受体的单克隆抗体的联合治疗; ④靶向不同抗原(异源组合)或同一抗原(同源组合)不同表位的寡克隆抗体治疗。模拟多克隆免疫应答的寡克隆抗体可能成为肿瘤治疗的主要手段之一[30]。了解和克服抗体药物的耐药机制也是非常有必要的, 如激活和抑制Fcγ受体(Fcγ receptor, FcγR)可以协同调节肿瘤直接靶向抗体的治疗活性, 有望提高应答率、应答持续时间和潜在总体生存率。研究表明FcγRs在控制免疫调节抗体(如检查点抑制剂)疗效方面有类似的作用, 已知的抑制性抗体检查点FcγRIIB的靶向阻断有助于克服耐药性并提高抗体在癌症免疫治疗中的活性[31]。治疗性抗体抑制肿瘤患者的免疫检查点受体与许多不良反应有关, 这些不良反应类似于自身免疫反应。此外, 尽管许多癌症患者对免疫检查点阻断抗体反应良好, 但这些肿瘤中的很大一部分最终会发展成肿瘤抵抗并会进一步发展。因此, 在肿瘤免疫治疗和寻找克服耐药性的新治疗手段之间找到适当的平衡将会显著改善临床效果[13]。
综上所述, 基于抗体的肿瘤免疫治疗具有类型新颖、作用机制多样和效果显著等特点, 在现有肿瘤免疫治疗中发挥重要作用。未来抗体肿瘤免疫治疗剂的主要研究策略包括寻找新的抗体作用靶分子、克服肿瘤对抗体的耐受性、降低细胞因子风暴等毒副作用和探索不同肿瘤免疫治疗剂的联合应用。
| [1] |
Taefehshokr N, Baradaran B, Baghbanzadeh A, et al. Promising approaches in cancer immunotherapy[J]. Immunobiology, 2019. DOI:10.1016/j.imbio.2019.11.010 |
| [2] |
Marin-Acevedo JA, Soyano AE, Dholaria B, et al. Cancer immunotherapy beyond immune checkpoint inhibitors[J]. J Hematol Oncol, 2018, 11: 8. DOI:10.1186/s13045-017-0552-6 |
| [3] |
Kaplon H, Muralidharan M, Schneider Z, et al. Antibodies to watch in 2020[J]. MAbs, 2020, 12: e1703531. DOI:10.1080/19420862.2019.1703531 |
| [4] |
Alderson KL, Sondel PM. Clinical cancer therapy by NK cells via antibody-dependent cell-mediated cytotoxicity[J]. J Biomed Biotechnol, 2011, 2011: 379123. |
| [5] |
Weiner LM, Surana R, Wang S. Monoclonal antibodies:versatile platforms for cancer immunotherapy[J]. Nat Rev Immunol, 2010, 10: 317-327. DOI:10.1038/nri2744 |
| [6] |
Weiskopf K, Weissman IL. Macrophages are critical effectors of antibody therapies for cancer[J]. MAbs, 2015, 7: 303-310. DOI:10.1080/19420862.2015.1011450 |
| [7] |
Chen X, Song X, Li K, et al. FcγR-binding is an important functional attribute for immune checkpoint antibodies in cancer immunotherapy[J]. Front Immunol, 2019, 10: 292. DOI:10.3389/fimmu.2019.00292 |
| [8] |
Gravbrot N, Gilbert-Gard K, Mehta P, et al. Therapeutic monoclonal antibodies targeting immune checkpoints for the treatment of solid tumors[J]. Antibodies (Basel), 2019, 8: E51. DOI:10.3390/antib8040051 |
| [9] |
Zhang C, Liu J, Zhong JF, et al. Engineering CAR-T cells[J]. Biomark Res, 2017, 5: 22. DOI:10.1186/s40364-017-0102-y |
| [10] |
Rezvani K, Rouce R, Liu E, et al. Engineering natural killer cells for cancer immunotherapy[J]. Mol Ther, 2017, 25: 1769-1781. DOI:10.1016/j.ymthe.2017.06.012 |
| [11] |
Suurs FV, Lub-de Hooge MN, de Vries EGE, et al. A review of bispecific antibodies and antibody constructs in oncology and clinical challenges[J]. Pharmacol Ther, 2019, 201: 103-119. DOI:10.1016/j.pharmthera.2019.04.006 |
| [12] |
Rader C. Bispecific antibodies in cancer immunotherapy[J]. Curr Opin Biotechnol, 2019, 65: 9-16. |
| [13] |
Christofi T, Baritaki S, Falzone L, et al. Current perspectives in cancer immunotherapy[J]. Cancers (Basel), 2019, 11: E1472. DOI:10.3390/cancers11101472 |
| [14] |
Luo J, Nishikawa G, Prasad V. A systematic review of head-to-head trials of approved monoclonal antibodies used in cancer:an overview of the clinical trials agenda[J]. J Cancer Res Clin Oncol, 2019, 145: 2303-2311. DOI:10.1007/s00432-019-02984-2 |
| [15] |
Sun Z, Fu YX, Peng H. Targeting tumor cells with antibodies enhances anti-tumor immunity[J]. Biophys Rep, 2018, 4: 243-253. DOI:10.1007/s41048-018-0070-2 |
| [16] |
Neefjes J, Jongsma ML, Paul P, et al. Towards a systems understanding of MHC class Ⅰ and MHC class Ⅱ antigen presentation[J]. Nat Rev Immunol, 2011, 11: 823-836. DOI:10.1038/nri3084 |
| [17] |
He Q, Liu Z, Liu Z, et al. TCR-like antibodies in cancer immunotherapy[J]. J Hematol Oncol, 2019, 12: 99. DOI:10.1186/s13045-019-0788-4 |
| [18] |
Fuenmayor J, Montaño RF. Novel antibody-based proteins for cancer immunotherapy[J]. Cancers (Basel), 2011, 3: 3370-3393. DOI:10.3390/cancers3033370 |
| [19] |
Marhelava K, Pilch Z, Bajor M, et al. Targeting negative and positive immune checkpoints with monoclonal antibodies in therapy of cancer[J]. Cancers (Basel), 2019, 11: E1756. DOI:10.3390/cancers11111756 |
| [20] |
Feng M, Jiang W, Kim BYS, et al. Phagocytosis checkpoints as new targets for cancer immunotherapy[J]. Nat Rev Cancer, 2019, 19: 568-586. DOI:10.1038/s41568-019-0183-z |
| [21] |
Elsallab M, Levine BL, Wayne AS, et al. CAR T-cell product performance in haematological malignancies before and after marketing authorisation[J]. Lancet Oncol, 2020, 21: e104-e116. DOI:10.1016/S1470-2045(19)30729-6 |
| [22] |
Titov A, Valiullina A, Zmievskaya E, et al. Advancing CAR T-cell therapy for solid tumors:lessons learned from lymphoma treatment[J]. Cancers (Basel), 2020, 12: E125. DOI:10.3390/cancers12010125 |
| [23] |
Hu Y, Tian ZG, Zhang C. Chimeric antigen receptor (CAR)-transduced natural killer cells in tumor immunotherapy[J]. Acta Pharmacol Sin, 2018, 39: 167-176. DOI:10.1038/aps.2017.125 |
| [24] |
Burger MC, Zhang C, Harter PN, et al. CAR-engineered NK cells for the treatment of glioblastoma:turning innate effectors into precision tools for cancer immunotherapy[J]. Front Immunol, 2019, 10: 2683. DOI:10.3389/fimmu.2019.02683 |
| [25] |
Liu E, Marin D, Banerjee P, et al. Use of CAR-transduced natural killer cells in CD19-positive lymphoid tumors[J]. N Engl J Med, 2020, 382: 545-553. DOI:10.1056/NEJMoa1910607 |
| [26] |
Dahlén E, Veitonméki N, Norlén P. Bispecific antibodies in cancer immunotherapy[J]. Ther Adv Vaccines Immunother, 2018, 6: 3-17. DOI:10.1177/2515135518763280 |
| [27] |
Yu L, Wang J. T cell-redirecting bispecific antibodies in cancer immunotherapy:recent advances[J]. J Cancer Res Clin Oncol, 2019, 145: 941-956. DOI:10.1007/s00432-019-02867-6 |
| [28] |
Cao R, Song W, Ye C, et al. Internal enhancement of DNA damage by a novel bispecific antibody-drug conjugate-like therapeutics via blockage of mTOR and PD-L1 signal pathways in pancreatic cancer[J]. Cancer Med, 2019, 8: 643-655. DOI:10.1002/cam4.1974 |
| [29] |
Vela M, Aris M, Llorente M, et al. Chemokine receptor-specific antibodies in cancer immunotherapy:achievements and challenges[J]. Front Immunol, 2015, 6: 12. |
| [30] |
Marrocco I, Romaniello D, Yarden Y. Cancer immunotherapy:the dawn of antibody cocktails[J]. Methods Mol Biol, 2019, 1904: 11-51. |
| [31] |
Teige I, Mårtensson L, Frendéus BL. Targeting the antibody checkpoints to enhance cancer immunotherapy-focus on FcγRIIB[J]. Front Immunol, 2019, 10: 481. DOI:10.3389/fimmu.2019.00481 |
 2020, Vol. 55
2020, Vol. 55


