2. 中国医学科学院、北京协和医学院医药生物技术研究所, 抗感染药物研究北京市重点实验室, 北京 100050
2. Beijing Key Laboratory of Anti-Infective Drugs, Institute of Medicinal Biotechnology, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100050, China
新型冠状病毒肺炎COVID-19 (corona virus disease 2019)在全球大规模暴发, 截至2020年3月12日, 全球累计逾12万人感染该病毒, 超过4 000人死亡, 至今疫情的起因尚不能确定[1, 2]。世界卫生组织(World Health Organization, WHO)宣布将新型冠状病毒肺炎疫情列为国际关注的突发公共卫生事件(PHEIC)[3]。全球范围内新冠病毒传播风险和影响风险的评估已上调至最高水平[4]。然而, 目前尚缺乏有效的COVID-19治疗策略。本文将从新型冠状病毒SARS-CoV-2 (severe acute respiratory syndrome coronavirus 2)的病毒学特性、相关分子机制及靶向病毒和宿主的潜力药物等多个角度进行综述, 为COVID-19的药物治疗提供借鉴。
1 SARS-CoV-2的病毒学特性既往已知感染人的冠状病毒有6种, 分别是人冠状病毒HCoV-229E、HCoV-OC43、HCoV-NL63和HCoV-HKU1, 以及严重急性呼吸系统综合征冠状病毒SARS-CoV和中东呼吸综合征冠状病毒MERS-CoV。SARS-CoV-2是目前已知的第7种可以感染人的冠状病毒[5]。SARS-CoV-2作为单股正链RNA病毒, 属于冠状病毒β属, 有包膜, 呈圆形或椭圆形, 直径60~140 nm[6]。仅从电镜图来看, SARS-CoV-2与MERS-CoV和SARS-CoV在形态上并无太大不同。它包含4种结构蛋白[表面刺突蛋白(S)、外壳蛋白(E)、膜蛋白(M)、核衣壳蛋白(N)]以及4种非结构性蛋白[3-胰凝乳蛋白酶样蛋白酶(3CLpro)即主蛋白酶(Mpro)、木瓜蛋白酶样蛋白酶(PLpro)、解旋酶(helicase)及RNA依赖性RNA聚合酶(RdRp)][7, 8]。目前病毒基因组全测序已经完成, 在整个基因组水平上, SARS-CoV-2与中华菊头蝠中的冠状病毒同源性高达96.2%, 推断新型冠状病毒或来源于蝙蝠[9]。华南农业大学等单位报道新冠病毒的中间宿主可能是穿山甲, 但是, 目前为止对于新冠病毒的来源尚不能确定[10]。
新冠病毒主要通过接触和呼吸道飞沫两种途径传播[11]。感染新冠病毒的重型和危重型患者在病程中表现为中低热, 甚至无明显发热。轻型患者表现为低热、轻微乏力和无肺炎症状[12, 13]。
2 SARS-CoV-2入侵和相关分子机制 2.1 SARS-CoV-2的入侵分子结构模拟结果显示, 与SARS-CoV病毒的感染原理一样, SARS-CoV-2也是通过与血管紧张素转换酶2 (angiotensin-convertion enzyme 2, ACE2)蛋白结合感染, 体外数据同样表明如果细胞缺失ACE2蛋白, 新冠病毒无法感染[9, 14]。S蛋白作为SARS-CoV-2入侵细胞的武器, 是一种有糖基化修饰的蛋白。它通过结合细胞表面的受体, 将病毒包膜与细胞膜融为一体, 从而将病毒内的遗传物质注入细胞, 这样的结合方式与SARS-CoV也十分相似[15]。已有的研究虽然对于SARS-CoV和SARS-CoV-2的S蛋白与ACE2之间亲和力的强弱还存在争议, 但毫无疑问, S蛋白与ACE2之间的相互作用是SARS-CoV-2入侵细胞的重要前提[16, 17]。目前利用hACE2转基因小鼠模型感染病毒, 在小鼠体内已经可以检测到体重减轻和病毒复制[18]。
2.2 SARS-CoV-2相关的分子机制尽管SARS-CoV-2具体的致病机制尚不清楚, 但是SARS-CoV-2感染引起的急性炎症反应所导致的器官损伤仍是导致重症的主要因素[13]。临床数据显示, 患者感染后肺部、肝脏和心脏中均显示出一定程度的病毒性细胞病变样改变(viral cytopathic-like changes)或炎症损伤, 外周血淋巴细胞数量显著减少, 但状态活跃。除此之外, SARS-CoV-2感染者体液中炎症细胞因子水平明显升高[19-22]。另外, 南京大学的研究人员[23]通过对临床患者的症状研究发现:器官受损的原因可能是病毒感染, 而非炎症反应, 相关表现在轻型患者中尤为明显。在此推测:无论是病毒感染还是感染后触发的炎症都是器官受损的原因, 但作为主导诱因的区别, 可能和患者的机体状态和所处的病程阶段有关。
针对SARS-CoV-2感染导致炎症反应的机制, 也有许多不同的理论。有研究显示, 在SARS-CoV-2感染早期, 病毒的大量复制会导致上皮和内皮细胞凋亡、血管通透性增加, 及大量促炎细胞因子和趋化因子的释放。此外, 巨噬细胞和淋巴细胞的焦亡也会诱发炎症反应[24]。和SARS-CoV一样, 有学者提出SARS-CoV-2也可能通过影响ACE2来诱导炎症反应[24-27]。另外, 研究表明在持续感染过程中, 病毒和anti-S-IgG的复合物也可能与单核/巨噬细胞上的FcR结合影响炎症反应加重肺损伤, 或者激活抗体依赖性细胞毒性反应(ADCC)导致细胞损伤[24, 28]。结合SARS-CoV-2的相关机制, 也涌现出许多抗击新冠病毒的潜力药物(图 1)。

|
Figure 1 Replication cycle of coronavirus and virus/host-based potential drugs for treating corona virus disease 2019 (COVID-19). ACE2: Angiotensin-convertion enzyme 2; E: Envolope protein; S: Spike glycoprotein; N: Nucleocapsid; M: Membrane protein; nsps: Nonstructural proteins; 3CLpro: 3C-like proteinase |
新药的开发周期漫长、过程复杂。现阶段潜力化合物的发掘主要还是针对现有化合物的筛选和老药新用。目前, 针对COVID-19尚没有确认有效的抗病毒治疗策略, 主要还是支持治疗和对症治疗为主。主流的直接抗病毒药物主要是3CLpro抑制剂和RdRp抑制剂两大类(图 2)。

|
Figure 2 Structure of direct antiviral drugs and their intermediate to treat COVID-19. A: 3CLpro inhibitors (generate immature or weakly infectious virus by inhibiting 3CLpro activity); B: RdRp inhibitors and related metabolites (inhibit viral nucleic acid synthesis by intervening RdRp); C: Arbidol (block virus entry by interfering with clathrin) |
3CLpro是一种半胱氨酸蛋白酶, 作为SARS-CoV-2主要的蛋白酶, 在病毒复制中发挥重要作用。3CLpro可以将病毒翻译出来的多蛋白体切割成多个活性蛋白结构。而3CLpro抑制剂的作用就是通过影响3CLpro的活性, 产生未成熟或者毒力弱的病毒。
3.1.1 洛匹那韦/利托那韦(克力芝)洛匹那韦(lopinavir)是一种人类免疫缺陷病毒(human immunodeficiency virus, HIV)蛋白酶抑制剂, 而利托那韦(ritonavir)是HIV-1和HIV-2天冬氨酰蛋白酶抑制剂。洛匹那韦/利托那韦(克力芝)是AbbVie研发的抗艾滋病药物, 在治疗过程中利托那韦可以通过作用于细胞色素P450 3A (CYP3A)来抑制洛匹那韦的代谢, 提高洛匹那韦的血药浓度[29]。研究发现克力芝是3CLpro抑制剂, 可以影响病毒RNA复制酶前体多聚蛋白pp1a与pp1ab的形成, 阻碍病毒聚合酶与解螺旋酶的释放从而达到抗病毒的效果, 其用于治疗SARS-CoV和MERS-CoV感染时均具有较好的抑制效果[30-36]。通过同源模建方法构建SARS-CoV-2内肽酶C30 (coronavirus endopeptidase C30, CEP_C30)和PLpro的结构模型, 研究人员发现洛匹那韦和利托那韦与CEP_C30的结合能力都很强, 推断克力芝可能通过抑制CEP_C30发挥抗病毒作用[37]。
考虑到新型冠状病毒与SARS-CoV、MERS-CoV具有相似性, 在病毒复制过程中可能具有相似的作用机制或者发挥同样的蛋白功能, 因此克力芝被用于治疗新型冠状病毒肺炎[38]。国家卫生健康委员会颁布的《新型冠状病毒感染的肺炎诊疗方案(试行第7版)》将其作为治疗COVID-19的临床用药, 可与利巴韦林联合使用[12]。不过临床结果显示该复方的效果不如预期理想, 在134例接受重组人干扰素α2b喷雾治疗以及对症支持治疗的患者中发现, 克力芝治疗组在改善临床症状和清除病毒方面均未表现出优于对照组的效果, 不良反应的发生率相对较高, 这可能与给药剂量、使用疗程以及给药时期有关[39]。韩国2例新冠肺炎患者在早期刚出现肺炎症状时就进行了克力芝治疗, 现已治愈, 说明在感染早期给予克力芝治疗可能起到很好的作用[40, 41]。国内目前针对克力芝治疗COVID-19的后续临床试验已经开始推进, 但其临床效果尚不清楚[42]。
3.1.2 达芦那韦/考比司他(普泽力)达芦那韦/考比司他(darunavir/cobicistat)是一种HIV治疗药物。与克力芝类似, 普泽力中的考比司他也可以抑制CYP3A介导的代谢, 从而提高达芦那韦的血药浓度。研究表明, 达芦那韦是SARS-CoV的3CLpro抑制剂, 而SARS-CoV-2和SARS-CoV的3CLpro蛋白相似性高, 计算机模拟结果显示达芦那韦可同样抑制SARS-CoV-2的3CLpro活性, 表明其可用于治疗新型冠状病毒的感染[43-45]。目前, 关于普泽力治疗新冠肺炎的临床试验已经注册开展, 对于其治疗效果还需进一步研究验证。
3.2 RdRp抑制剂RdRp以病毒mRNA为模板, 以核苷为底物合成互补RNA链, 但是RdRp无法区别核苷和核苷类似物。RdRp抑制剂就是基于该原理设计的抗病毒药物, RdRp抑制剂竞争性结合RdRp导致核苷的空间结合受阻, 从而影响病毒RNA的合成。
3.2.1 瑞德西韦瑞德西韦(remdesivir, GS-5734)是由美国吉利德(Gilead)公司研发的一种新型核苷类似物前药, 静脉注射给药后在体内代谢为GS-441542, 而GS-441542进一步被三磷酸化为具有药理学活性的三磷酸核苷(NTP)。病毒在进入细胞后, RdRp和细胞竞争性结合核苷。由于细胞的RNA聚合酶不能识别瑞德西韦这类核苷类似物, 因此不会受到影响。但是核苷类似物会和病毒的RdRp结合, 占据核苷结合空间使RNA的合成受阻, 从而发挥抗病毒作用。除此之外, 多数核苷类似物整合到病毒RNA时, 会被冠状病毒表达的非结构性蛋白nsp14外切酶(nonstructural protein nsp14 exoribonuclease, nsp14-ExoN)切除, 但是瑞德西韦对于nsp14-ExoN具有抗性, 这也是其优于其他核苷类似物的重要原因。瑞德西韦最初被用来治疗埃博拉病毒(Ebola virus, EBOV)感染, 已经完成了治疗埃博拉病毒的Ⅱ期临床试验[46]。研究发现, 瑞德西韦对于包含SARS-CoV和MERS-CoV在内的多种病毒均具有抑制效果, 可有效降低感染SARS-CoV小鼠的病毒载量以及感染MERS-CoV恒河猴的肺部病毒载量[47, 48]。研究表明, 在Vero E6细胞中, 瑞德西韦对于SARS-CoV-2的抑制效果显著, EC90和EC50分别为1.76 μmol·L-1和0.77 μmol·L-1, 治疗指数SI > 129.87。另外, 瑞德西韦还可以有效抑制Huh-7细胞中的SARS-CoV-2感染[49]。美国首例COVID-19患者的治疗过程中, 瑞德西韦因被作为“同情给药”后迅速改善了患者的相关症状而受到广泛关注[50]。但是, 美国接受瑞德西韦治疗的患者是重度患者, 而目前国内的患者以轻度和中度为主, 病理上存在很大的差异[51]。在SARS-CoV感染小鼠体内, 如果在病毒复制高峰和呼吸道上皮损伤之前进行瑞德西韦给药, 可以改善肺部功能, 减少病毒载量和减轻症状, 说明该药可能在病程前期发挥了作用, 因此其对于中度和轻度患者可能同样具有治疗效果[47]。目前, 瑞德西韦的Ⅲ期临床试验已经在国内启动, 采用随机、双盲、安慰剂对照的方法对瑞德西韦用于轻/中度SARS-CoV-2感染患者和重度感染患者的治疗效果和安全性进行评估[52, 53]。
3.2.2 法匹拉韦法匹拉韦(favipiravir, T-705)是由日本富山化工制药公司开发的一类抗流感药物, 具有较好的广谱抗病毒活性。法匹拉韦作为前药入血后被代谢为favipiravir-RTP, 通过影响RdRp发挥抗流感作用。除了有抗流感的效果, 法匹拉韦对埃博拉病毒、西罗尼病毒、肠道病毒和黄热病病毒等多种RNA病毒均具有体内或体外抑制效果[54]。作为上市药品, 它的安全性和有效性都有较好的保障[55]。由于法匹拉韦作用于RNA合成阶段, 可能对治疗新型冠状病毒有效。研究显示, 法匹拉韦体外对SARS-CoV-2抑制作用并不强, EC50为61.88 μmol·L-1[49]。但近期开展的包括试验组和对照组共80例患者入主的法匹拉韦针对COVID-19的临床研究初步结果显示:法匹拉韦治疗组尚未发现明显的不良反应, 不良反应明显低于克力芝组, 患者依从性好, 抗病毒疗效也优于克力芝组[56]。目前, 法拉匹韦治疗COVID-19的临床试验也在陆续开展。
3.2.3 利巴韦林利巴韦林(ribavirin)在研发之初主要被批准用来治疗呼吸道合胞病毒感染, 其后用于丙型肝炎病毒的治疗。作为一种广谱抗病毒药物, 利巴韦林对多种DNA和RNA病毒均有抑制效果, 也曾在烈性传染病拉沙热的治疗中发挥了重要作用[57]。利巴韦林作为在临床上与干扰素、克力芝常见的联用抗病毒药物, 主要是基于SARS-CoV期间研究:与单独使用利巴韦林的治疗方案相比, 利巴韦林联合克力芝给药可改善临床症状并降低死亡率, 对SARS患者有更好的治疗效果[58]。后续体外实验也显示, 在5种不同来源的动物和人类细胞中, 利巴韦林与Ⅰ型干扰素联用具有较强的协同抗SARS-CoV作用[59]。该药现阶段在治疗COVID-19方面仍主要作为联合用药使用。不过, 由于在SARS-CoV的治疗中, 就有部分患者出现溶血性出血和血红蛋白水平降低的现象, 有关利巴韦林大剂量使用的安全问题需要继续关注。
3.3 其他抗病毒药物除了3CLpro抑制剂和RdRp抑制剂外, 许多其他机制的直接抗病毒药物也颇具治疗潜力。其中阿比朵尔(arbidol)是一种非核苷类抗病毒药物, 具有广谱抗病毒活性, 通过干扰病毒脂膜和宿主脂膜的融合影响多种病毒感染[60-63]。该药在此次疫情中也被应用于COVID-19的临床治疗, 不过近期的一项临床结果显示其治疗效果并不理想[39]。阿比朵尔是否可以有效治疗COVID-19仍需后续临床试验证实。
4 针对宿主的治疗药物目前针对宿主的治疗药物主要通过调节免疫和炎症反应发挥作用, 或者通过影响细胞膜和病毒包膜的融合影响病毒的入侵发挥抗病毒效果(图 3)。
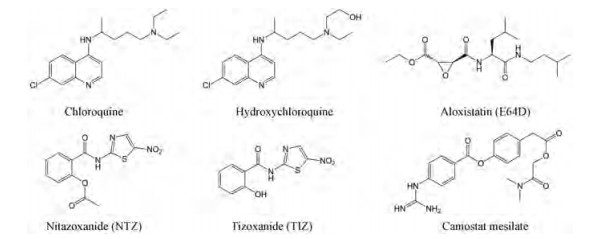
|
Figure 3 Structure of drugs acting on host to treat COVID-19 |
干扰素是机体感染病毒时, 宿主通过抗病毒反应产生的结构类似、功能相近的低分子糖蛋白。作为抗病毒感染最重要的一种免疫因子, 干扰素是临床上抗病毒治疗使用的主要药物[64]。目前临床治疗COVID-19试用α-干扰素雾化吸入, 多以联合给药治疗为主[12]。聚乙二醇干扰素α-2a (PegIFN-α2a)作为一种传统抗乙肝药物也被证实可有效治疗SARS-CoV和MES-CoV感染。此前的一项研究显示, 利巴韦林联合PegIFN-α2a治疗MERS-CoV感染, 可改善患者14天的生存率[38, 65]。Ⅰ型干扰素对特异性免疫有一定的抑制作用。传统乙肝治疗中使用该药就体现了降低T细胞数的效果。但在新冠病毒感染中T细胞数严重下降, 晚期T细胞数回升才有恢复的可能性。在晚期使用干扰素治疗是否会影响治疗效果仍需确证。在MA15 SARS-CoV小鼠感染模型中也发现:当IFN-I先于病毒滴度出现顶峰时可改善病毒导致的病理损伤, 但是延后出现的IFN-I反而会促进炎症因子释放和异常的T淋巴细胞免疫反应, 进一步说明干扰素在治疗冠状病毒感染时的给药阶段十分重要[66]。干扰素是否可以有效治疗COVID-19仍需临床试验证实。
4.2 糖皮质激素急性肺损伤和呼吸窘迫综合征多数是免疫反应引起的, 糖皮质激素可以抑制肺部的炎症。在2003年SARS-CoV流行期间, 糖皮质激素被广泛应用于重症患者的治疗, 一项回顾性研究结果显示糖皮质激素可降低患者的病死率和住院时间[67]。然而, 也有研究结果表明, 糖皮质激素可能增加SARS患者的病死率, 并延迟病毒的清除时间[68, 69]。在MERS-CoV患者中, 糖皮质激素的使用亦有争议[70, 71]。另外, 该类药物具有较强的不良反应, 短期治疗会出现高血压和血糖升高等症状。在SARS-CoV治疗中, 使用该药的部分患者在治愈后出现了骨坏死的症状。因此, 在新冠病毒肺炎的治疗中应尽量避免使用该类药物, 对于重症患者使用该药治疗也需要注意给药方式和剂量[72]。目前, 国内临床建议诊疗方案为综合患者呼吸困难程度和机体炎症反应等多个指标, 对于程度严重的患者酌情短期内使用糖皮质激素[12]。
4.3 氯喹和羟氯喹氯喹(chloroquine)作为一种口服抗疟药在临床上已经使用了70多年, 羟氯喹(hydroxychloroquine)也同样在1955年作为抗疟药被批准上市。研究表明, 二者不仅有抗疟的作用, 还具有广谱抗病毒活性, 以及很好的免疫调节作用[73, 74]。氯喹可以通过调节pH值, 影响宿主细胞的糖基转移酶或糖基修饰酶的活性, 干扰ACE2的正确糖基化, 阻断病毒与ACE2的结合来抑制病毒入侵。氯喹对pH的影响也会干预内吞体、高尔基体和内质网等胞内酸性细胞器功能, 影响病毒的胞内转运。氯喹对牛冠状病毒(bovine coronavirus, BCoV)和HCoV-OC43等在内的多种冠状病毒均具有较好的抑制效果[75, 76]。研究发现, 氯喹和羟氯喹对SARS-CoV和MERS-CoV均有很强的抑制作用, 且氯喹在感染前后给药均可以有效抑制SARS-CoV的复制[77, 78]。另外, 研究发现氯喹对SARS-CoV引发的小鼠体内高炎性反应有缓解效果, 但对病毒的复制影响甚微[79]。在Vero E6细胞中, 氯喹抑制SARS-CoV-2的EC90和EC50值分别为6.90 μmol·L-1和1.13 μmol·L-1, 可以有效阻断病毒感染[49]。目前在临床上, 氯喹被用于COVID-19的治疗, 毒副作用较小, 但是高剂量2~4 g给药也可能急性致死[12]。SARS-CoV-2和SARS-CoV的受体均为ACE2, 而氯喹干扰ACE2的正确糖基化而抑制病毒入侵, 因此氯喹可能具有预防SARS-CoV-2感染的作用。
4.4 其他作用于宿主的药物研究发现, SARS-CoV-2和SARS-CoV一样, 入侵细胞需要组织蛋白酶B和L (Cathepsins B and L, CatB/L)以及跨膜丝氨酸蛋白酶(transmembrane protease serines, TMPRSS2)。TMPRSS2抑制剂卡莫司他(camostat mesylate)以及CatB/L抑制剂E64D也因此具有重要的研究意义, 其中卡莫司他是一种已在日本获批上市的药物[80]。除此之外, 一些免疫调节剂, 如硝唑尼特(nitazoxanide, NTZ)可以抑制促炎性细胞因子的释放、干扰素α和干扰素β的产生, 并诱导宿主先天性免疫应答, 对多种病毒起到很好的抑制作用[81-83]。研究发现, NTZ在Vero E6细胞中抑制SARS-CoV-2的EC50为2.12 μmol·L-1, 是一种有潜力的新冠肺炎治疗药物[51]。
5 中药和天然产物 5.1 中药制剂和方剂临床研究发现, 中医药对患者的转归发挥了一定的作用。处于医学观察期的患者可以服用金花清感颗粒、连花清瘟胶囊和疏风解毒胶囊, 如伴随肠胃不适可以服用藿香正气胶囊。清肺排毒合剂(新冠1号)、银翘藿朴退热合剂(新冠2号)和荆防藿朴解毒合剂(新冠3号)目前也都在临床救治中调剂使用。此外, 喜炎平注射液、热毒宁注射液和痰热清注射液也可应用于重型和危重型患者的给药治疗[12]。中西医结合治疗在临床上已经显示了不错的治疗效果。
5.2 天然产物天然产物中, 甘草酸是一种从甘草的根茎中分离出来的三萜, 应用于多种疾病的治疗, 且是一种广谱抗病毒药物[84]。研究发现, 甘草酸可以显著抑制SARS-CoV的进入和复制, 是具有开发前景的抗冠状病毒先导化合物[85]。目前, 已经开展了甘草酸二铵联用维生素C治疗新型冠状病毒肺炎的临床试验[86]。除此之外, 紫草素作为一种天然产物, 已被证实具有抗炎抗菌的作用, 亦被发现对多种病毒均具有抑制效果[87]。中国科学院上海药物研究所和上海科技大学在筛选中发现紫草素可能具有抗SARS-CoV-2的潜力[88]。近期研究人员将计算机模拟和高通量筛选结合, 在筛选靶向COVID-19 3CLpro即主蛋白酶抑制剂时, 也发现紫草素在体外可以很好地抑制新冠病毒的Mpro, 但具体抗新冠病毒效果仍需进一步的实验验证[89]。
6 COVID-19药物研发的总结与展望上述新冠药物研发基本信息汇总如表 1所示。SARS-CoV-2这种新型冠状病毒诱发的COVID-19, 由于其高传染性, 在短期内给社会造成了极大的危害。对于该病毒的研究目前尚缺乏有效的治疗和预防措施。在2003年SARS-CoV暴发并控制后, 关于该类冠状病毒的研究没有持续深入, 以致于仍缺乏可以借鉴的经验和依据。
| Table 1 Information about drugs for COVID-19 treatment |
现阶段, 在各方的努力下, 细胞模型和动物模型的建立已经取得了初步的成效, 可以应用于药物的筛选和实验, 但是药物的开发仍面临巨大的挑战。由于一个确证有效的抗病毒药物需要满足体外和动物体内的活性, 同时保证临床的安全性和有效性, 因此现阶段的药物开发仍然是集中在老药新用上。就长远来看, 直接靶向病毒编码的成分(结构蛋白、非结构蛋白、病毒基因组)或干扰病毒和宿主受体的相互作用的药物(direct-acting antivirals, DAA)研发是非常必要的, 可以在疾病的早期或高病毒载量的情况下发挥抗病毒作用。靶向宿主的抗病毒药物(host-targeting antivirals, HTA)即通过抑制病毒复制所必需的宿主成分或激活宿主的抗病毒免疫反应发挥抗病毒作用, 在病原未知时可以作为应急治疗的主要手段, 且靶向宿主的抗病毒药物不易发生耐药, 抗病毒谱广, HTA可以作为病毒性疾病的单独治疗或者和DAA联合用药。因此, 对于COVID-19这种急性病毒性疾病的药物仍需加大研发力度, 形成技术和药物储备。针对现有的药物进行结构改造和优化, 针对新冠病毒的结构解析设计特异性药物是目前比较可行的方案。在机制尚不清晰明确的前提下, 不能过于期待单一药物的治愈效果, 要综合药物的作用机制, 针对不同的病程阶段, 精准用药, 提高联合用药的效果。同时也需要快速建立符合国际规范的研究标准和模型, 以应对新冠病毒可能与人类长期共存这一重大挑战。
| [1] |
World Health Organization: Coronavirus disease (COVID-2019) situation reports[EB/OL]. World Health Organization, 2020[2020-03-12]. https://www.who.int/emergencies/diseases/novel-coronavirus-2019/situation-reports/.
|
| [2] |
Yu WB, Tang GD, Zhang LC, et al. Decoding evolution and transmissions of novel pneumonia coronavirus using the whole genomic data[J]. ChinaXiv, 2020. DOI:10.12074/202002.00033 |
| [3] |
World Health Organization: Statement on the second meeting of the International Health Regulations (2005) Emergency Committee regarding the outbreak of novel coronavirus (2019-nCoV)[EB/OL]. World Health Organization, 2020[2020-02-12]. https://www.who.int/news-room/detail/30-01-2020-statement-on-the-second-meeting-of-the-international-health-regulations-(2005)-emergency-committee-regarding-the-outbreak-of-novel-coronavirus-(2019-ncov).
|
| [4] |
World Health Organization: WHO director-general's opening remarks at the media briefing on COVID-19-28 February 2020[EB/OL]. World Health Organization, 2020[2020-02-28]. https://www.who.int/dg/speeches/detail/who-director-general-s-opening-remarks-at-the-media-briefing-on-covid-19——28-february-2020.
|
| [5] |
Duan ZJ, Tan WJ, Lu FM. An overview of the novel coronavirus MERS-CoV[J]. Chin J Viral Dis (中国病毒病杂志), 2013, 3: 9-13. |
| [6] |
Zhu N, Zhang D, Wang W, et al. A novel coronavirus from patients with pneumonia in China, 2019[J]. N Engl J Med, 2020, 382: 727-733. DOI:10.1056/NEJMoa2001017 |
| [7] |
Official website of the National Institutes of Health (NIH): Images and B-roll related to the novel coronavirus (SARS-CoV-2, also known as 2019-nCoV) that causes COVID-19[EB/OL]. Flickr, 2020[2020-02-12]. https://www.flickr.com/photos/niaid/albums/72157712914621487.
|
| [8] |
Institute of Microbiology, Chinese Academy of Sciences: Genome sequencing analysis of 10 novel coronavirus samples[EB/OL]. National Microbiology Data Center, 2020[2020-01-24]. http://nmdc.cn/nCov/project?no=NMDC10013002.
|
| [9] |
Zhou P, Yang XL, Wang XG, et al. A pneumonia outbreak associated with a new coronavirus of probable bat origin[J]. Nature, 2020, 579: 270-273. DOI:10.1038/s41586-020-2012-7 |
| [10] |
Xiao KP, Zhai JQ, Feng YY, et al. Isolation and characterization of 2019-nCoV-like coronavirus from Malayan Pangolins[J]. BioRxiv, 2020. DOI:10.1101/2020.02.17.951335 |
| [11] |
Chen HJ, Guo JJ, Wang C, et al. Clinical characteristics and intrauterine vertical transmission potential of COVID-19 infection in nine pregnant women:a retrospective review of medical records[J]. Lancet, 2020. DOI:10.1016/s0140-6736(20)30360-3 |
| [12] |
National Health Commission of the People's Republic of China: Notice on printing and distributing the diagnosis and treatment plan of pneumonia with new coronavirus infection (trial version 7)[EB/OL]. Medical administration and hospital authority, 2020[2020-03-04]. http://www.nhc.gov.cn/yzygj/s7653p/202003/46c9294a7dfe4cef80dc7f5912eb1989.shtml.
|
| [13] |
Huang C, Wang Y, Li X, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China[J]. Lancet, 2020, 395: 948-949. DOI:10.1016/S0140-6736(20)30371-8 |
| [14] |
Michael L, Andrea M, Vincent M. Functional assessment of cell entry and receptor usage for SARS-CoV-2 and other lineage B betacoronaviruses[J]. Nat Microbiol, 2020, 5: 727-733. DOI:10.1038/s41564-020-0675-3 |
| [15] |
Wrapp D, Wang NS, Corbett KS, et al. Cryo-EM structure of the 2019-nCoV spike in the prefusion conformation[J]. Science, 2020, 367: 1260-1263. DOI:10.1126/science.abb2507 |
| [16] |
Xu XT, Chen P, Wang JF, et al. Evolution of the novel coronavirus from the ongoing Wuhan outbreak and modeling of its spike protein for risk of human transmission[J]. Sci China Life Sci, 2020, 63: 457-460. DOI:10.1007/s11427-020-1637-5 |
| [17] |
Zhou Q, Yan RH, Zhang YY, et al. Structure of dimeric full-length human ACE2 in complex with B0AT1[J]. BioRxiv, 2020. DOI:10.1101/2020.02.17.951848 |
| [18] |
Bao LL, Deng W, Huang BY, et al. The pathogenicity of 2019 novel coronavirus in hACE2 transgenic mice[J]. BioRxiv, 2020. DOI:10.1101/2020.02.07.939389 |
| [19] |
Xu Z, Shi L, Wang YJ, et al. Pathological findings of COVID-19 associated with acute respiratory distress syndrome[J]. Lancet Respir Med, 2020. DOI:10.1016/S2213-2600(20)30076-X |
| [20] |
Guan WJ, Ni ZY, Hu Y, et al. Clinical characteristics of 2019 novel coronavirus infection in China[J]. N Engl J Med, 2020. DOI:10.1056/NEJMoa2002032 |
| [21] |
Chen G, Wu D, Guo W, et al. Clinical and immunologic features in severe and moderate forms of coronavirus disease 2019[J]. MedRxiv, 2020. DOI:10.1101/2020.02.16.20023903 |
| [22] |
Liu J, Li SM, Liu J, et al. Longitudinal characteristics of lymphocyte responses and cytokine profiles in the peripheral blood of SARS-CoV-2 infected patients[J]. MedRxiv, 2020. DOI:10.1101/2020.02.16.20023671 |
| [23] |
Zheng YS, Huang Z, Ying GP, et al. Comparative study of the lymphocyte change between COVID-19 and non-COVID-19 pneumonia cases suggesting uncontrolled inflammation might not be the main reason of tissue injury[J]. MedRxiv, 2020. DOI:10.1101/2020.02.19.20024885 |
| [24] |
Fu YJ, Cheng YX, Wu YT, et al. Understanding SARS-CoV-2-mediated inflammatory responses:from mechanisms to potential therapeutic tools[J]. Virol Sin, 2020. DOI:10.1007/s12250-020-00207-4 |
| [25] |
Glowacka I, Bertram S, Herzog P, et al. Differential downregulation of ACE2 by the spike proteins of severe acute respiratory syndrome coronavirus and human coronavirus NL63[J]. J Virol, 2010, 84: 1198-1205. DOI:10.1128/JVI.01248-09 |
| [26] |
Jia HP, Look DC, Tan P, et al. Ectodomain shedding of angiotensin converting enzyme 2 in human airway epithelia[J]. Am J Physiol Lung Cell Mol Physiol, 2009, 297: 84-96. DOI:10.1152/ajplung.00071.2009 |
| [27] |
Imai Y, Kuba K, Penninger JM, et al. The discovery of angiotensin-converting enzyme 2 and its role in acute lung injury in mice[J]. Exp Physiol, 2008, 93: 543-548. DOI:10.1113/expphysiol.2007.040048 |
| [28] |
Liu L, Wei Q, Lin QQ, et al. Anti-spike IgG causes severe acute lung injury by skewing macrophage responses during acute SARS-CoV infection[J]. JCI Insight, 2019, 4: e123158. DOI:10.1172/jci.insight.123158 |
| [29] |
Croxtall JD, Perry CM. Lopinavir/ritonavir[J]. Drugs, 2010, 70: 1885-1915. DOI:10.2165/11204950-000000000-00000 |
| [30] |
Chu MC. Role of lopinavir/ritonavir in the treatment of SARS:initial virological and clinical findings[J]. Thorax, 2004, 59: 252-256. DOI:10.1136/thorax.2003.012658 |
| [31] |
Chen F, Chan KH, Jiang Y, et al. In vitro susceptibility of 10 clinical isolates of SARS coronavirus to selected antiviral compounds[J]. J Clin Virol, 2004, 31: 69-75. |
| [32] |
Stockman LJ, Bellamy R, Garner P. SARS:systematic review of treatment effects[J]. PLoS Med, 2006, 3: e343. DOI:10.1371/journal.pmed.0030343 |
| [33] |
De Wilde AH, Jochmans D, Posthuma CC, et al. Screening of an FDA-approved compound library identifies four small-molecule inhibitors of middle east respiratory syndrome coronavirus replication in cell culture[J]. Antimicrob Agents Chemother, 2014, 58: 4875-4884. DOI:10.1128/AAC.03011-14 |
| [34] |
Arabi YM, Alothman A, Balkhy HH, et al. Treatment of middle east respiratory syndrome with a combination of lopinavir-ritonavir and interferon-β1b (MIRACLE trial):study protocol for a randomized controlled trial[J]. Trials, 2018, 19: 81. DOI:10.1186/s13063-017-2427-0 |
| [35] |
Sheahan TP, Sims AC, Leist SR, et al. Comparative therapeutic efficacy of remdesivir and combination lopinavir, ritonavir, and interferon beta against MERS-CoV[J]. Nat Commun, 2020, 11: 222. DOI:10.1038/s41467-019-13940-6 |
| [36] |
Nukoolkarn V, Lee VS, Malaisree M, et al. Molecular dynamic simulations analysis of ritronavir and lopinavir as SARS-CoV 3CLpro inhibitors[J]. J Theor Biol, 2008, 254: 861-867. DOI:10.1016/j.jtbi.2008.07.030 |
| [37] |
Lin S, Shen RN, He JD, et al. Molecular modeling evaluation of the binding abilities of ritonavir and lopinavir to Wuhan pneumonia coronavirus proteases[J]. BioRxiv, 2020. DOI:10.1101/2020.01.31.929695 |
| [38] |
Li GD, Clercq ED. Therapeutic options for the 2019 novel coronavirus (2019-nCoV)[J]. Nat Rev Drug Discov, 2020, 19: 149-150. DOI:10.1038/d41573-020-00016-0 |
| [39] |
Chen J, Ling Y, Xi XH, et al. Efficacies of lopinavir/ritonavir and abidol in the treatment of novel coronavirus pneumonia[J]. J Infect Dis (中华传染病杂志), 2020, 38: 86-89. |
| [40] |
Kim JY, Choe PG, Oh Y, et al. The first case of 2019 novel coronavirus pneumonia imported into Korea from Wuhan, China:implication for infection prevention and control measures[J]. J Korean Med Sci, 2020, 35: e61. DOI:10.3346/jkms.2020.35.e61 |
| [41] |
Lim JY, Jeon SH, Shin HY, et al. Case of the index patient who caused tertiary transmission of coronavirus disease 2019 in Korea:the application of lopinavir/ritonavir for the treatment of COVID-19 pneumonia monitored by quantitative RT-PCR[J]. J Korean Med Sci, 2020, 35: e79. DOI:10.3346/jkms.2020.35.e79 |
| [42] |
Wang C, Horby PW, Hayden FG, et al. A novel coronavirus outbreak of global health concern[J]. Lancet, 2020, 395: 470-473. DOI:10.1016/S0140-6736(20)30185-9 |
| [43] |
Dayer MR, Taleb-Gassabi S, Dayer MS. Lopinavir; a potent drug against coronavirus infection:insight from molecular docking study[J]. Arch Clin Infect Dis, 2017, 12: e13823. |
| [44] |
Beck BR, Shin B, Choi Y, et al. Predicting commercially available antiviral drugs that may act on the novel coronavirus (2019-nCoV), Wuhan, China through a drug-target interaction deep learning model[J]. BioRxiv, 2020. DOI:10.1101/2020.01.31.929547 |
| [45] |
Ren LL, Wang YM, Wu ZQ, et al. Identification of a novel coronavirus causing severe pneumonia in human: a descriptive study[J/OL]. Chin Med J, 2020. DOI: 10.1097/CM9.0000000000000722.
|
| [46] |
Warren TK, Jordan R, Lo MK, et al. Therapeutic efficacy of the small molecule GS-5734 against Ebola virus in rhesus monkeys[J]. Nature, 2016, 531: 381-385. DOI:10.1038/nature17180 |
| [47] |
Sheahan TP, Sims AC, Graham RL, et al. Broad-spectrum antiviral GS-5734 inhibits both epidemic and zoonotic coronaviruses[J]. Sci Transl Med, 2017, 9: e3653. DOI:10.1126/scitranslmed.aal3653 |
| [48] |
Wit ED, Feldmann F, Cronin J, et al. Prophylactic and therapeutic remdesivir (GS-5734) treatment in the rhesus macaque model of MERS-CoV infection[J]. Proc Nat Acad Sci U S A, 2020, 117: 6771-6776. DOI:10.1073/pnas.1922083117 |
| [49] |
Wang ML, Cao RY, Zhang LK, et al. Remdesivir and chloroquine effectively inhibit the recently emerged novel coronavirus (2019-nCoV) in vitro[J]. Cell Res, 2020, 30: 269-271. DOI:10.1038/s41422-020-0282-0 |
| [50] |
Holshue ML, DeBolt C, Lindquist S, et al. First case of 2019 novel coronavirus in the United States[J]. New Engl J Med, 2020, 382: 929-936. DOI:10.1056/NEJMoa2001191 |
| [51] |
Liu QY, Wang XL. Strategies for the development of drugs targeting novel coronavirus 2019-nCoV[J]. Acta Pharm Sin (药学学报), 2020, 55: 181-188. |
| [52] |
A phase 3 randomized, double-blind, placebo-controlled, multicenter study to evaluate the efficacy and safety of remdesivir in hospitalized adult patients with severe 2019-nCoV respiratory disease[EB/OL]. ClinicalTrials.gov Identifier: NCT04257656. https://www.clinicaltrials.gov.
|
| [53] |
A phase 3 randomized, double-blind, placebo-controlled multicenter study to evaluate the efficacy and safety of remdesivir in hospitalized adult patients with mild and moderate 2019-nCoV respiratory disease[EB/OL]. ClinicalTrials.gov Identifier: NCT04252664. https://www.clinicaltrials.gov.
|
| [54] |
Delang L, Abdelnabi R, Neyts J. Favipiravir as a potential countermeasure against neglected and emerging RNA viruses[J]. Antivir Res, 2018, 153: 85-94. DOI:10.1016/j.antiviral.2018.03.003 |
| [55] |
Zumla A, Memish ZA, Maeurer M, et al. Emerging novel and antimicrobial-resistant respiratory tract infections:new drug development and therapeutic options[J]. Lancet Infect Dis, 2014, 14: 1136-1149. DOI:10.1016/S1473-3099(14)70828-X |
| [56] |
The Third People'S Hospital of Shenzhen: Clinical trial shows that the antiviral effect of fabiravir is better than that of LPV/r[EB/OL]. 2020[2020-02-14]. http://www.szdsyy.com/News/0a6c1e58-e3d0-4cd1-867a-d5524bc59cd6.html.
|
| [57] |
Ratti VL, Gratien MD, Jacques J, et al. Ribavirin:past, present and future[J]. World J Hepatol, 2016, 8: 123-130. DOI:10.4254/wjh.v8.i2.123 |
| [58] |
Koren G, King S, Knowles S, et al. Ribavirin in the treatment of SARS:a new trick for an old drug[J]. CMAJ, 2003, 168: 1289-1292. |
| [59] |
Morgenstern B, Michaelis M, Baer PC, et al. Ribavirin and interferon-β synergistically inhibit SARS-associated coronavirus replication in animal and human cell lines[J]. Biochem Biophys Res Commun, 2005, 326: 905-908. DOI:10.1016/j.bbrc.2004.11.128 |
| [60] |
Blaising J, Polyak SJ, Pécheur EI. Arbidol as a broad-spectrum antiviral:an update[J]. Antivir Res, 2014, 107: 84-94. DOI:10.1016/j.antiviral.2014.04.006 |
| [61] |
Blaising J, Lévy PL, Polyak SJ, et al. Arbidol inhibits viral entry by interfering with clathrin-dependent trafficking[J]. Antivir Res, 2013, 100: 215-219. DOI:10.1016/j.antiviral.2013.08.008 |
| [62] |
Wang H, Yang P, Liu K, et al. SARS coronavirus entry into host cells through a novel clathrin- and caveolae-independent endocytic pathway[J]. Cell Res, 2008, 18: 290-301. DOI:10.1038/cr.2008.15 |
| [63] |
Khamitov RA, Loginova SY, Shchukina VN, et al. Antiviral activity of arbidol and its derivatives against the pathogen of severe acute respiratory syndrome in the cell cultures[J]. Vopr Virusol, 2008, 53: 9-13. |
| [64] |
Teijaro JR. Type Ⅰ interferons in viral control and immune regulation[J]. Curr Opin Virol, 2016, 16: 31-40. DOI:10.1016/j.coviro.2016.01.001 |
| [65] |
Omrani AS, Saad MM, Baig K, et al. Ribavirin and interferon alfa-2a for severe Middle East respiratory syndrome coronavirus infection:a retrospective cohort study[J]. Lancet Infect Dis, 2014, 14: 1090-1095. DOI:10.1016/S1473-3099(14)70920-X |
| [66] |
Channappanavar R, Fehr A, Vijay R, et al. Dysregulated type Ⅰ interferon and inflammatory monocyte-macrophage responses cause lethal pneumonia in SARS-CoV-infected mice[J]. Cell Host Microbe, 2016, 19: 181-193. DOI:10.1016/j.chom.2016.01.007 |
| [67] |
Chen RC, Tang X, Tan SY, et al. Treatment of severe acute respiratory syndrome with glucosteroids:the Guangzhou experience[J]. Chest, 2006, 129: 1441-1452. DOI:10.1378/chest.129.6.1441 |
| [68] |
Boone SA, Gerba CP. The use of corticosteroid as treatment in SARS was associated with adverse outcomes:a retrospective cohort study[J]. J Infect, 2005, 51: 98-102. DOI:10.1016/j.jinf.2004.09.008 |
| [69] |
Lee N, Chan KCA, Hui DS, et al. Effects of early corticosteroid treatment on plasma SARS-associated coronavirus RNA concentrations in adult patients[J]. J Clin Virol, 2004, 31: 304-309. DOI:10.1016/j.jcv.2004.07.006 |
| [70] |
Arabi YM, Mandourah Y, Al-Hameed F, et al. Corticosteroid therapy for critically Ill patients with the Middle East respiratory syndrome[J]. Am J Resp Crit Care, 2017, 197: 757-767. |
| [71] |
Alfaraj SH, Al-Tawfiq JA, Assiri AY, et al. Clinical predictors of mortality of Middle East respiratory syndrome coronavirus (MERS-CoV) infection:a cohort study[J]. Travel Med Infect Dis, 2019, 29: 48-50. DOI:10.1016/j.tmaid.2019.03.004 |
| [72] |
Russell CD, Millar JE, Baillie JK. Clinical evidence does not support corticosteroid treatment for 2019-nCoV lung injury[J]. Lancet, 2020, 395: 473-475. DOI:10.1016/S0140-6736(20)30317-2 |
| [73] |
Van Vugt M, White NJ. The treatment of chloroquine-resistant malaria[J]. Trop Doct, 1999, 29: 176-179. DOI:10.1177/004947559902900321 |
| [74] |
Plantone D, Koudriavtseva T. Current and future use of chloroquine and hydroxychloroquine in infectious, immune, neoplastic, and neurological diseases:a mini-review[J]. Clin Drug Invest, 2018, 38: 653-671. DOI:10.1007/s40261-018-0656-y |
| [75] |
Keyaerts E, Li S, Vijgen L, et al. Antiviral activity of chloroquine against human coronavirus OC43 infection in newborn mice[J]. Antimicrob Agents Chemother, 2009, 53: 3416-3421. DOI:10.1128/AAC.01509-08 |
| [76] |
Payne HR, Storz J, Henk WG. Initial events in bovine coronavirus infection:analysis through immunogold probes and lysosomotropic inhibitors[J]. Arch Virol, 1990, 114: 175-189. DOI:10.1007/BF01310747 |
| [77] |
Vincent MJ, Bergeron E, Benjannet S, et al. Chloroquine is a potent inhibitor of SARS coronavirus infection and spread[J]. Virol J, 2005, 2: 69. DOI:10.1186/1743-422X-2-69 |
| [78] |
Dyall J, Coleman CM, Hart BJ, et al. Repurposing of clinically developed drugs for treatment of Middle East respiratory syndrome coronavirus infection[J]. Antimicrob Agents Chemother, 2014, 58: 4885-4893. DOI:10.1128/AAC.03036-14 |
| [79] |
Barnard DL, Day CW, Bailey K, et al. Evaluation of immunomodulators, interferons and known in vitro SARS-CoV inhibitors for inhibition of SARS-Cov replication in BALB/c mice[J]. Antivir Chem Chemother, 2006, 17: 275-284. DOI:10.1177/095632020601700505 |
| [80] |
Hoffmann M, Weber HK, Schroeder S, et al. SARS-CoV-2 cell entry depends on ACE2 and TMPRSS2 and is blocked by a clinically-proven protease inhibitor[J]. Cell, 2020. DOI:10.1016/j.cell.2020.02.052 |
| [81] |
Rossignol JF. Nitazoxanide:a first-in-class broad-spectrum antiviral agent[J]. Antivir Res, 2014, 110: 94-103. DOI:10.1016/j.antiviral.2014.07.014 |
| [82] |
Rossignol JF, La FS, Chiappa L, et al. Thiazolides, a new class of anti-influenza molecules targeting viral hemagglutinin at the post-translational level[J]. J Biol Chem, 2009, 284: 29798-29808. DOI:10.1074/jbc.M109.029470 |
| [83] |
Rossignol JF. Nitazoxanide, a new drug candidate for the treatment of Middle East respiratory syndrome coronavirus[J]. J Infect Public Health, 2016, 9: 227-230. DOI:10.1016/j.jiph.2016.04.001 |
| [84] |
Sun ZG, Zhao TT, Lu N, et al. Research progress of glycyrrhizic acid on antiviral activity[J]. Mini Rev Med Chem, 2019, 19: 826-832. DOI:10.2174/1389557519666190119111125 |
| [85] |
Cinatl J, Morgenstern B, Bauer G, et al. Glycyrrhizin, an active component of liquorice roots, and replication of SARS-associated coronavirus[J]. Lancet, 2003, 361: 2045-2046. DOI:10.1016/S0140-6736(03)13615-X |
| [86] |
A randomized, open, controlled trial for diammonium glycyrrhizinate enteric-coated capsules combined with vitamin C tablets in the treatment of common novel coronavirus pneumonia (COVID-19) in the basic of clinical standard antiviral treatmen to evaluate the safety and efficiency[EB/OL]. ClinicalTrials.gov Identifier: ChiCTR2000029768. http://www.chictr.org.cn/index.aspx.
|
| [87] |
Chen X, Yang L, Oppenheim JJ, et al. Cellular pharmacology studies of shikonin derivatives[J]. Phytother Res, 2002, 16: 199-209. DOI:10.1002/ptr.1100 |
| [88] |
Chinese Academy of Sciences Shanghai Institute of Materia Medica: A batch of old and traditional Chinese medicine that may have therapeutic effect on COVID-19[EB/OL]. Chinese Academy of Sciences Shanghai Institute of Materia Medica, 2020[2020-01-25]. http://www.simm.ac.cn/xwzx/kydt/202001/t20200125_5494417.html.
|
| [89] |
Jin ZM, Du XY, Xu YC, et al. Structure of Mpro from COVID-19 virus and discovery of its inhibitors[J]. BioRxiv, 2020. DOI:10.1101/2020.02.26.964882 |
 2020, Vol. 55
2020, Vol. 55

