2. 太湖县中医院检验科, 安徽 安庆 246400;
3. 上海交通大学医学院附属苏州九龙医院药剂科, 江苏 苏州 215021;
4. 复旦大学附属肿瘤医院药剂科, 上海 200032;
5. 复旦大学上海医学院肿瘤学系, 上海 200032
2. Clinical Laboratory, Taihu County Hospital of Traditional Chinese Medicine, Anqing 246400, China;
3. Department of Pharmacy, Suzhou Kowloon Hospital, School of Medicine, Shanghai Jiao Tong University, Suzhou 215021, China;
4. Department of Pharmacy, Shanghai Cancer Center, Fudan University, Shanghai 200032, China;
5. Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 200032, China
乳腺癌是女性最常见的恶性肿瘤, 目前主要的治疗手段涉及手术切除、放疗和化疗, 其中化疗是转移性肿瘤的主要治疗手段[1]。多西他赛(docetaxel, DTX)是乳腺癌化疗的一线药物, 但是由于单独用药产生的耐药性会导致肿瘤的复发, 并且二次治疗的反应效果较差[2]。肿瘤耐药(MDR)是以化疗抑制肿瘤能力降低为特征[3], 导致化疗失败、肿瘤复发的重要原因。P-糖蛋白(P-gp)是一种位于细胞膜上能量依赖性的跨膜蛋白-外排泵[4], 主要是消除外源物质(多以疏水性化疗药物为主, 如紫杉醇、多西他赛、多柔比星等[5]), 当药物进入细胞后, 位于细胞膜上的P-gp通过消耗ATP, 将其从细胞内泵出, 降低了肿瘤细胞内的药物浓度, 从而导致耐药性的产生[6]。维拉帕米(verapamil, VRP)是经典的P-gp抑制剂, 其可以穿过细胞膜与化疗药物竞争性结合P-gp, 减少或消除化疗药物的外排, 增加药物在细胞内的蓄积, 提高耐药细胞对化疗药物的敏感性[7], 延缓耐药性的产生。因此, 本研究拟将多西他赛联合维拉帕米治疗乳腺癌, 以期减缓耐药性的产生。但由于两种药物的理化性质与药物代谢存在差异, 在肿瘤部位很难达到最佳药物比例。因此, 本研究通过纳米药物递送系统—脂质体作为药物递送载体, 将维拉帕米和多西他赛分别包裹于脂质体的内核和外层, 形成双药给药载体(图 1)。这种载体具有以下优势: ①同时包封亲水性和疏水性药物, 使不同性质的药物可以在同一脂质体体系内组合; ②调控药物的物理性质, 如粒径和电位; ③延缓药物释放速率, 具有缓释效果; ④具有一定的靶向性; ⑤增大药物的载药量[8], 减少给药频率及降低毒性[9]; ⑥通过调整制备方法按比例包封与释放药物, 使其以受控的方式发挥作用。共载多西他赛-维拉帕米脂质体(docetaxel-verapamil liposomes, DTX-VRP LP)既可以克服DTX在临床上引起的过敏反应, 也可以延缓其耐药性的产生, 为临床研究奠定了一定的基础。
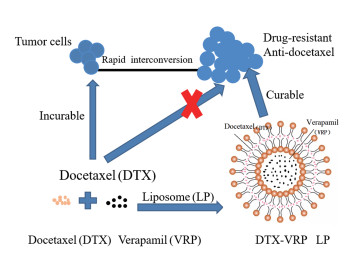
|
Figure 1 The mechanism of docetaxel - verapamil liposomes in the treatment of tumor |
仪器 Agilent 1200高效液相色谱仪(美国Agilent公司); Nano-ZS90型粒径分析仪(英国Malvern公司); SAF-680T酶标仪(美国Thermo Fisher公司)。
材料 DTX (批号: 17012, 上海蓓琅生物技术有限公司); VRP (批号: 170515, 苏州甫路生物科技有限公司); 多西他赛注射液(商品名:多帕菲, 规格: 20 mg/ 0.5 mL, 批号: 9F0045049, 齐鲁制药有限公司); 盐酸维拉帕米注射液(规格: 5 mg/2 mL, 批号: 5E12002, 上海禾丰制药有限公司); 氢化卵磷脂(批号: 170404, 南京添嘉生物科技有限公司); 胆固醇(批号: 170111, 徐州润和生物科技有限公司); 泊洛沙姆(批号: 170209, 湖北康宝泰精细化工有限公司); Cell Counting Kit-8 (CCK-8试剂盒, 货号: cck01, 上海博谷生物科技有限公司)。
细胞株与动物 人乳腺癌MCF-7细胞株及其经DTX诱导的耐药人乳腺癌细胞株(MCF-7/DTX, 上海博谷生物科技有限公司, 货号: BG010); BALB/c-nu雌性裸鼠25只(SPF级), 6~8周, 体质量(20 ± 2) g, 由北京维通利华实验动物技术有限公司提供, 动物许可证号为SCXK (京) 2016-0006, 动物合格证号为11400700303981。饲养条件为室温25℃, 相对湿度70 %, 自由进食与饮水。动物实验获得上海交通大学动物伦理委员会批准(批准号: 2019-06-172)。
多西他赛-维拉帕米脂质体(DTX-VRP LP)的制备 通过查阅大量相关文献和在预实验的基础上, 本实验DTX-VRP LP采取薄膜分散法制备[10], 其最优处方如下:称取DTX 10 mg、氢化卵磷脂82.5 mg、胆固醇7.5 mg共溶解于15 mL二氯甲烷溶液中, 恒温磁力搅拌1 h, 作为油相; 称取VPR 5 mg及泊洛沙姆150 mg溶于10 mL水中, 恒温磁力搅拌, 作为水相。再将油相于40 ℃水浴中, 减压旋蒸除去有机溶剂形成薄膜, 最后用水相进行水化1 h, 即得DTX-VRP LP。采取相同的方法制备多西他赛脂质体(DTX LP)、维拉帕米脂质体(VRP LP)及空白LP。
粒径和zeta电位的测定 采用动态光散射粒度仪测定脂质体的粒径及zeta电位。取新制备的DTX-VRP LP分散液0.5 mL, 用超纯水稀释至2.5 mL, 摇匀, 制得样品。将样品加入到样品池中, 设定仪器参数, 在室温25 ℃条件下进行测定。同样的方法测定空白LP、DTX LP及VRP LP。
包封率和载药量的测定 采用高效液相色谱法测定DTX-VRP LP中DTX和VRP的含量。取两份DTX-VRP LP各5 mL, 一份加甲醇稀释破乳, 离心, 取上清液进样, 测定并计算混悬液中药物总含量(Wtotal); 另一份超速离心, 取滤液并用甲醇稀释, 进样, 测定游离药物的含量(Wfree)。按以下公式计算包封率(EE)和载药量(DL)。同样的处理方法测定DTX LP、VRP LP中DTX和VRP含量。
| $ {{\rm{EE}}\left( \% \right) = \left[ {\left( {{W_{{\rm{total}}}} - {W_{{\rm{free}}}}} \right)/{W_{{\rm{add}}}}} \right] \times 100\% } $ | (1) |
| $ {\rm{DL}}\left( \% \right) = \left[ {\left( {{W_{{\rm{total}}}} - {W_{{\rm{free}}}}} \right)/{W_{\begin{array}{*{20}{l}} {{\rm{lipid}}} \end{array}}}} \right] \times 100\% $ | (2) |
其中, Wadd为DTX-VRP LP中DTX或VRP总药量; Wlipid为脂质材料和药物的总质量。
体外释放度的测定 本实验以pH 7.4和6.8磷酸盐缓冲溶液(PBS)模拟体内环境和肿瘤生长环境, 以市售多西他赛注射液和维拉帕米注射液为对照, 采用动态透析法[10]测定脂质体的体外释放度。取一定体积(药物浓度等量)的DTX-VRP LP置于透析中, 加入释放介质20 mL, 在(37 ± 0.5) ℃空气恒温振动器中以100 r·min-1振荡, 分别于5、10、15、30 min和1、2、4、6、8、12、24 h吸取释放介质2 mL, 再添加新的释放介质2 mL。采用HPLC法测定释放介质中DTX和VRP的浓度, 按以下公式计算每个时间点药物的累积释放率(Qn)。同法考察DTX LP和VRP LP的体外释放度。
| $ {Q_n}\left( \% \right) = \left( {{C_t}{V_0} + \sum {C_i}{V_i}} \right)/W \times 100\% $ | (3) |
其中, Ct和Ci分别表示t次和第i次取样的浓度, V0和Vi分别表示释放介质体积和第i次的取样体积(V0 = 20 mL、Vi = 2 mL), W为所含总药量。
体外药效学研究
溶液配制 取适量DTX, 用DMSO溶解, 配成10 μmol·L-1 DTX储备液。将此溶液浓度梯度稀释为10、3.33、1.11、0.37、0.12、0.041、0.014、4.6×10-3、1.5×10-3和5.1×10-4 μmol·L-1。同样, 空白LP、DTX LP、VRP LP及DTX-VRP LP分别用无菌生理盐水配制以上10个浓度, 于4 ℃下保存待用。
细胞实验 取对数期生长状态良好的MCF-7和MCF-7/DTX细胞株经胰酶消化后, 用计数板进行计数, 按每孔4×103个细胞数接种到96孔板, 每孔200 μL。培养24 h后弃去旧的培养液, 实验组分别加入10个不同浓度的DTX-VRP LP的细胞培养液和相应浓度的空白LP、DTX LP和VRP LP的细胞培养液, 同时设置空白溶剂对照组, 每一浓度均为4个平行孔。置于培养箱继续培养72 h后, 每孔加入10 μL CCK-8, 继续培养2 h后, 用酶标仪测定每孔的吸光度值(A)。计算细胞生长抑制率, 绘制生长曲线并求算IC50值。
| $ I{C_{{\rm{50}}}} = \left( {{A_{对照组}} - {A_{实验组}}} \right)/{A_{对照组}} $ | (4) |
肿瘤体积的测量及抑瘤率的计算 取生长状态良好的对数生长期MCF-7/DTX细胞株, 用DMEM培养基稀释至细胞数为每毫升3×107个, 每只BALB/C裸鼠按6×106个细胞接种于其右侧接近腋下部, 共接种30只。正常喂食并随时观察小鼠健康状况, 待肿瘤体积为150 mm3即可开始实验。挑选出肿瘤体积约为150 mm3的荷瘤小鼠25只, 随机分成6组:生理盐水组(NS组)、空白LP组、DTX溶液组(DTX SOL组)、DTX LP组、VRP LP组及DTX-VRP LP组, 每组按15 mg·kg-1剂量尾静脉注射, 隔日1次, 每组3只。每天称量小鼠体重及游标卡尺测量肿瘤大小。3周实验结束后, 取出小鼠体内的肿瘤, 称重并计算肿瘤体积(V, mm3)和抑瘤率(IR)。
| $ V = {\rm{ }}1/2a \times {b^2} $ | (5) |
| $ {\rm{IR}}\left( \% \right) = \left( {1 - {W_{治疗组}}/{W_{阴性对照组}}} \right) \times 100\% $ | (6) |
其中, a为肿瘤最大直径(mm); b为最小直径(mm); W为平均瘤重。
肿瘤组织病理学检测 取剥离的新鲜肿瘤组织, 切成5 mm×5 mm×2 mm大小瘤组织小块, 投入到4%中性多聚甲醛溶液中固定24 h, 将固定好的组织以流动的自来水冲洗过夜, 经不同质量分数的乙醇脱水, 透明处理后包埋于石蜡中, 经切片机切片, 切片厚度以4~6 μm为宜。再经贴片和烤片, H & E染色, 中性树脂封片等即得到肿瘤组织切片, 于显微镜下观察肿瘤组织的病理学形态变化。
统计学分析 所有数据均以x ± s表示, 统计分析使用GraphPad 5.0软件分析处理, 各组比较采用方差分析, P < 0.05被认为具有统计学差异。
结果 1 粒径和zeta电位动态光散射粒度仪测定DTX-VRP LP平均粒径约为140.9 nm, 多分散系数(polydispersity index, PDI)为0.19, 平均zeta电位为-28.7 mV (图 2), 同样的方法测得空白LP、DTX LP及VRP LP粒径和zeta电位分别是108.6 ± 8.2 nm、-27.5 ± 6.7 mV; 115.4 ± 6.7 nm、-21.1 ± 2.7 mV; 140.1 ± 2.1 nm、-25.2 ± 4.6 mV。一般PDI < 0.5时被认为脂质体的粒径分布均匀。zeta电位可反映带同种电荷脂质体间斥力和引力达相对平衡时能态的高低, zeta电位太高或太低都不利于其体系的稳定, zeta电位的绝对值在20~30 mV有利于脂质体体系的稳定, 因此初步判定DTX-VRP LP是相对稳定的胶体分散体系。综上, 采用薄膜分散法制备的脂质体粒径均相对较小, 脂质体较稳定。

|
Figure 2 The characterization of DTX-VRP liposome (DTX-VRP LP). A: Particle size of DTX-VRP LP; B: Zeta potential of DTX-VRP LP |
采用高效液相色谱法测定不同脂质体中DTX和VPR的含量, 结果见表 1。由表中可知, DTX-VRP LP中DTX和VRP的包封率分别是(81.7 ± 3.9) %和(59.6 ± 0.6) %, 结合DTX LP和VRP LP中DTX和VRP的包封率, 由此可以推测脂质体对脂溶性药物的载药量较高, 其原因可能是水溶性药物易从脂质体中泄漏出来。
| Table 1 The entrapment efficiency (EE) and drug loading (DL) of different groups of liposomes. n = 3, x ±s |
模拟体内血液环境和肿瘤微环境, 考察在pH 7.4和6.8溶液中脂质体的体外释放行为。以药物累积释放率对考察时间作图, 得释放曲线(图 3)。由图 3A可知, 在pH 7.4 PBS中, 0~4 h内DTX SOL组累积释放率约90%, 几乎释放完全; DTX LP组累计释放率约50%; DTX-VRP LP组释放约40%, 12 h内达平台期。相比之下, 在pH 6.8 PBS中, 0~4 h内DTX SOL组、DTX LP组和DTX-VRP LP组药物累积释放率分别约为90%、80%和70%, 8 h内所有脂质体组达平台期。由此可见, 所有脂质体组在pH 7.4 PBS溶液中释放较pH 6.8中缓慢, 说明脂质体在中性条件下(pH 7.4)比较稳定。在两组PBS溶液中, DTX-VRP LP组药物累积释放率均低于DTX LP组, 推测可能的原因是脂质体膜通透性是固定的, 在一定时间内药物的释放有限。在药物释放过程中, DTX-VRP LP组中DTX和VRP同时竞争从脂质体中释放, 释放速率受到了脂质体膜通透性的限制。由图 3B可知, 在pH 7.4 PBS中, 在0~4 h内VRP SOL组累计释放率约90%, 几乎完全释放; VRP LP组释放约80%; DTX-VRP LP释放约60%, 12 h后VRP释放完全, VRP属于水溶性药物, 相较于DTX, 更易从脂质体中释放出来。

|
Figure 3 The release curve of DTX-VRP LP in different pH phosphoric acid buffer solution in vitro (n = 3). A: In vitro release curve of DTX from DTX-VRP LP in pH 7.4 and pH 6.8 phosphate buffer solutions. B: In vitro release curve of VRP from DTX-VRP LP in pH 7.4 phosphate buffer solution. DTX SOL: DTX solution; VRP SOL: VRP solusion |
在显微镜下观察发现, DMSO组、空白LP组及VRP LP组在各浓度下的MCF-7细胞均生长旺盛、细胞数密集, 而DTX SOL、DTX LP和DTX-VRP LP组随着DTX浓度的增大, 细胞凋亡的数目增多。不同实验组对MCF-7细胞活性实验结果见图 4A所示。DTX-VRP LP组、DTX LP组和DTX SOL组对MCF-7的半数抑制浓度(IC50)值分别是1.12 ± 0.33、1.46 ± 0.48和3.19 ± 0.6 μmol·L-1, 而DMSO组、空白LP和VRP LP组的IC50值均大于10 μmol·L-1, 表明这3组对MCF-7细胞没有抑制作用, 细胞仍生长旺盛。图 4B显示, DMSO组、空白LP组、DTX SOL组、DTX LP组及VRP LP组MCF-7/DTX细胞均生长旺盛密集, 而DTX-VRP LP组随着药物浓度的增加, 细胞凋亡的数目逐渐增多。DMSO组、空白LP组、DTX SOL组、DTX LP组及VRP LP组对MCF-7/DTX的IC50值均大于10 μmol·L-1, DTX-VRP LP组IC50是7.4 ± 2.86 μmol·L-1。结果表明, 与其他实验组相比, DTX-VRP LP在一定程度上能够抑制MCF-7/DTX细胞的生长。
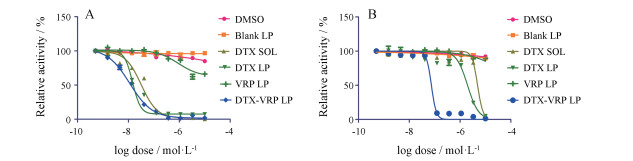
|
Figure 4 The activity effect of DTX SOL, DTX LP, VRP LP and DTX-VRP LP on the growth of MCF-7 (A) and MCF-7/DTX (B) after 72 h treatment with CCK-8 kit |
在整个实验过程中, 无小鼠死亡现象。每天称量小鼠的体重及测量小鼠的肿瘤大小, 并绘制曲线, 如图 5所示。由图 5A可知, 空白对照组与实验组小鼠体重变化不大, 属于药物安全范围内, 无统计学差异。由图 5B、C可知, 生理盐水组、空白LP组、DTX SOL组、DTX LP组及VRP LP组小鼠肿瘤增长较快, 各组之间无明显差异, 而DTX-VRP LP组小鼠肿瘤增加较缓慢, 与其他实验组比较, 具有统计学显著差异, 说明DTX-VRP LP对肿瘤有较好的杀伤效果, 可能是因为脂质体到达肿瘤部位, 不断缓慢释放DTX对肿瘤有杀伤作用, 同时释放VRP, 抑制肿瘤内过表达的P-糖蛋白, 从而阻止了DTX被排出胞外, 增加了细胞内药物的浓度, 延缓了耐药性的产生。

|
Figure 5 The results of pharmacodynamics in mice. A: The curves of weight change in mice; B: The curves of tumor change in mice; C: The morphology of MCF-7/DTX cells solid tumor; D: The tumor inhibition rate in groups. NS: Normal saline. n = 3, x± s. ***P < 0.001 vs blank LP group, DTX SOL group, DTX LP group and VRP LP group, respectively |
抑瘤率能直观反映各实验组对肿瘤的抑制效果。如图 5D可知, DTX SOL组、DTX LP组和VRP LP组与空白对照组无明显差异, DTX-VRP LP组抑瘤率为(61.07 ± 3.23) %, 与其他实验组存在显著差异, DTX-VRP脂质体组有很好的抑瘤效果。
5.3 肿瘤组织病理学检测各组小鼠肿瘤组织切片H & E染色图见图 6。NS组、空白LP组、VRP LP组、DTX SOL组和DTX LP组的肿瘤细胞生长旺盛, 排列紧密, 细胞核完整, 数量多, 核深染, 个别细胞出现坏死, 但坏死区域较小; DTX-VRP LP组肿瘤细胞数量减少, 排列稀疏, 细胞间距增大, 瘤内组织坏死区域明显增多, 肿瘤细胞核固缩, 甚至出现核结构不清及核溶解现象, 部分结构组织模糊不清。由此说明, DTX-VRP LP对肿瘤具有明显的治疗效果, 而其他组对肿瘤无效。

|
Figure 6 Histological assessments of tumor tissues with H & E stain in mice (×200). A: NS; B: Blank LP; C: VRP LP; D: DTX SOL; E: DTX LP; F: DTX-VRP LP |
临床上, 肿瘤治疗失败的主要原因之一是肿瘤细胞的耐药性[11], 根据其耐药性产生的时间可分为先天性和后天获得性, 其中后天获得性耐药是导致肿瘤难以治疗或愈后效果差的一大难题。后天获得性耐药是指肿瘤细胞的耐药性是由化疗药物诱导产生, 即肿瘤细胞在化疗药物使用前对其敏感, 但在使用的过程中产生了耐药[12], 临床上诸多抗肿瘤药物, 如紫杉醇、多西他赛和长春碱等极易发生多药耐药[13]。有研究表明[14, 15], 肿瘤细胞的多药耐药性是由于细胞膜上过度表达外排抗肿瘤药物的蛋白(P-gp)引起的, 可减少抗肿瘤药物的吸收、增加药物的外排等最终使细胞内药物浓度减少, 达不到药物有效浓度, 最终产生耐药。维拉帕米是经典的P-gp抑制剂, 其可以拮抗P-gp的过度表达, 减少或消除细胞内化疗药物的外排, 增加细胞内药物的蓄积, 提高耐药细胞对化疗药物的敏感性[16]。
本实验研究发现, 在MCF-7细胞上, DTX SOL组、DTX LP组及DTX-VRP LP组均显示出较强的细胞毒性, 而在MCF-7/DTX细胞上, DTX SOL组和DTX LP组未能抑制MCF-7/DTX细胞的生长, DTX-VRP LP组对MCF-7/DTX能够很好地抑制细胞生长, 具有相对较强的细胞毒性。
在BALB/c-nu裸鼠耐DTX乳腺癌体内药效学实验研究表明, DTX SOL组、DTX LP组小鼠肿瘤增长快速, 与空白对照组几乎无差别, 对肿瘤无抑制效果, 而DXT-VRP LP组小鼠肿瘤增长较慢, 其抑瘤率达61%左右, 能较好地抑制肿瘤的生长。
以上研究表明, DTX-VRP LP对MCF-7/DTX细胞具有良好的抑制效果, 其原因是DTX-VRP LP进入血液后, 脂质体被动靶向肿瘤细胞, 再缓慢释放DTX, 同时也释放VRP, 在DTX进入肿瘤细胞过程中, VRP抑制肿瘤细胞膜表面P-gp, 最终减少对DTX外排, 增加细胞内药物浓度, 从而提高了肿瘤细胞对DTX的敏感性, 延缓了肿瘤细胞对DTX耐药性。综上, DTX-VRP LP在一定程度上可以提高肿瘤细胞对DTX的敏感性, 延缓DTX耐药性的产生, 为临床应用提供较好的研究价值。
致谢: 上海交通大学医学院附属苏州九龙医院提供实验平台。
| [1] |
Wei C, Ning D, Xing T. Study on the pharmacokinetics of gemcitabine/cisplatin double-loaded liposome in rats[J]. Chin Pharm J (中国药学杂志), 2019, 54: 251-258. |
| [2] |
Poon C, Duan X, Chan C, et al. Nanoscale coordination polymers codeliver carboplatin and gemcitabine for highly effective treatment of platinum-resistant ovarian cancer[J]. Mol Pharm, 2016, 13: 3665-3675. DOI:10.1021/acs.molpharmaceut.6b00466 |
| [3] |
Mo LH, Pospichalova V, Huang ZQ, et al. Ascites increases expression/function of multidrug resistance proteins in ovarian cancer cells[J]. PLoS One, 2015, 7: 1-15. |
| [4] |
Zhang JC, Wang BM, Chang ZH, et al. Advancement of multidrug resistance induced by ABC transporters[J]. Biotech Lett, 2014, 25: 862-866. |
| [5] |
Teng YN, Sheu MJ, Hsieh YW, et al. β-carotene reverses multidrug resistant cancer cells by selectively modulating human P-glycoprotein function[J]. Phytomedicine, 2016, 23: 316-323. DOI:10.1016/j.phymed.2016.01.008 |
| [6] |
Szakacs G, Hall MD, Gottesman MM, et al. Targeting the achilles heel of multidrug-resistant cancer by exploiting the fitness cost of resistance[J]. Chem Rev, 2014, 114: 5753-5774. DOI:10.1021/cr4006236 |
| [7] |
Lakshmikanthcharan S, Hisham M, Chaitanya Juluri SK, et al. Verapamil as an adjuvant treatment for drug-resistant epilepsy[J]. Indian J Crit Care Med, 2018, 22: 680-682. DOI:10.4103/ijccm.IJCCM_250_18 |
| [8] |
Bhaskar S, Tian F, Stoeger T, et al. Multifunctional nanocarriers for diagnostics, drug delivery and targeted treatment across blood-brain barrier:perspectives on tracking and neuroimaging[J]. Part Fibre Toxicol, 2010, 7: 3-28. DOI:10.1186/1743-8977-7-3 |
| [9] |
Su H, Wang Y, Gu Y, et al. Potential applications and human biosafety of nanomaterials used in nanomedicine[J]. J Appl Toxicol, 2017, 38: 3-24. |
| [10] |
Fu XD, Wang SS, Chen HH. Evaluation of in vitro release profile and local retention of estradiol vaginal thermosensitive gel[J]. Chin Pharm J (中国药学杂志), 2017, 52: 852-856. |
| [11] |
Wang JX, Li N, Cao L, et al. DOX-loaded peptide dendritic copolymer nanoparticles for combating multidrug resistance by regulating the lysosomal pathway of apoptosis in breast cancer cells[J]. J Mater Chem B, 2020. DOI:10.1039/c9tb02130b |
| [12] |
Wang B. Discovery and Mechanism Research of Novel Pyrimidine-Based Derivatives as Reversal Agents Against ABCB1-Mediated MDR (新型嘧啶类耐药逆转剂及其逆转ABCB1介导的MDR的机制研究)[D]. Zhengzhou: Zhengzhou University, 2019.
|
| [13] |
de Fernando A, Adrián L. Simultaneous determination of cytochrome P450 oxidation capacity in humans:a review on the phenotyping cocktail approach[J]. Curr Pharm Biotechnol, 2016, 17: 1159-1180. DOI:10.2174/1389201017666160926150117 |
| [14] |
Chen KG, Sikic BI. Molecular pathways:regulation and therapeutic implications of multidrug resistance[J]. Clin Cancer Res, 2012, 18: 1863-1869. DOI:10.1158/1078-0432.CCR-11-1590 |
| [15] |
Su RN, Liu TF, Zhu XM, et al. Application of TPGS-based nano-drug delivery system in reversing P-gp mediated multidrug resistance[J]. Acta Pharm Sin (药学学报), 2018, 53: 1797-1807. |
| [16] |
Nobili S, Landini I, Mazzei T, et al. Overcoming tumor multidrug resistance using drugs able to evade P-glycoprotein or to exploit its expression[J]. Med Res Rev, 2012, 32: 1220-1262. DOI:10.1002/med.20239 |
 2020, Vol. 55
2020, Vol. 55


