2. 中国科学院上海药物研究所, 上海 201203;
3. 汤臣倍健股份有限公司, 广东 珠海 519040
2. Shanghai Institute of Materia Medica, Chinese Academy of Sciences, Shanghai 201203, China;
3. By-Health Co., Ltd., Zhuhai 519040, China
软胶囊是将挥发性或对囊材无溶解作用的药物溶液或混悬液等定量密封于囊内, 具有生物利用度高、掩盖不良气味、保护内容物免受外界氧气和光的影响、填充均匀和安全性高等优点。由于多数软胶囊的囊壁加有遮光剂, 以微粒析出、相互迁移为主的物理稳定性和囊壁结构变化等方面缺少研究。直接剖开囊壁的粗糙方法难以获得原研制剂的逆向工程研究方面重要信息, 且会破坏内部微粒结构及其相互空间关系。此外, 在储存期间, 软胶囊的囊壁和内容物可能会发生化学作用和动态的物理迁移, 从而影响软胶囊的质量[1, 2]。上市软胶囊制剂的质量评价往往会忽视内部的微粒及其分布, 比如非均相的疏水药物(格列齐特、氯雷他定等)软胶囊会加入一定的稀释剂[3, 4], 在加速条件下, 稀释剂的吸水性可能将囊壁水分迁移至内容物中, 使药物结晶沉淀。目前软胶囊结构表征方法较粗放(显微镜观测法[5, 6])、间接(光谱学信息[6, 7]与热分析[8, 9]), 仅对表面结构、各成分相互作用及结构变化进行描述, 难以定量描述软胶囊内部微粒在空间上的分布和复杂的析出分层现象。因此, 有必要建立软胶囊立体结构的原位、无损伤的分析方法, 以评价软胶囊的物理稳定性。
同步辐射光源X-射线显微成像(synchrotron radiation X-ray micro computed tomography, SR-μCT)作为新一代内部结构定量表征技术, 与常规计算机断层扫描成像(micro computed tomography, μCT)技术相比, 具有高准直性、高光通量、高偏振性及宽频谱范围等特性, 可实现在微米和亚微米尺度上高分辨率、高区分度地对制剂内部结构进行原位、无损伤的检测。采用三维重构、分形维度的定量分析方法, 与药物释放机制相结合, 可揭示制剂内部的丰富结构信息和阐明影响药物释放特征的结构因素, 进而突破立体结构特异性评价的难点[10-13]。
本文以长期试验与加速试验后蜂胶软胶囊为研究对象, 使用SR-μCT表征软胶囊内部精细结构, 获得一系列Slice图和三维重建图, 以微粒体积、空间分布及囊壁厚度等为基本评价指标, 分别对内部微粒和囊壁进行定量分析, 以期可视化地揭示长期与加速试验后软胶囊在结构及微粒分布上的差异, 为软胶囊结构表征及稳定性评价提供新方法。
材料与方法仪器 SR-μCT (上海光源BL13W1线站); 高分辨CCD探测器(pco. 2000, 德国PCO公司); 相位恢复及切片重构软件: X-TRACT SSRF CWSx64 (澳大利亚联邦科学与工业研究组织, http://www.ts-imaging.net/Default.aspx); 三维数据分析软件: VGStudio Max (Version 2.1, 德国Volume Graphics GmbH公司); Image Pro Analyzer 3D (Version 7.0, 美国Media Cybernetics公司)。
材料 蜂胶软胶囊(批号20160201, 一款用于工艺研究的自制实验样品, 与市售包装相当)。蜂胶软胶囊由胶皮(囊材)和内容物压制而成, 内容物由植物油和蜂胶混合而成, 囊材由明胶、甘油与水按一定比例混合配制, 内容物和囊材经加热成型、冷却压丸制备软胶囊。
稳定性试验 将同一批蜂胶软胶囊分为两组, 一组在温度(25 ± 2) ℃、相对湿度(60 ± 10) %下进行长期试验(简称为“CQ”); 另一组样品在温度(40 ± 2) ℃、相对湿度(75 ± 5) %的加速环境下储存(简称为“JS”), 两组样品均储存6个月。
SR-μCT图像采集 首先采集蜂胶软胶囊的二维投影图。将蜂胶软胶囊固定在样品台上, 确保在样品台旋转过程中, 软胶囊不会振动。基于预实验, 优化和调整成像参数, X-射线的能量选为13.0 keV, 样品和探测器之间的距离为6 cm, 曝光时间为1 s, 图像的有效分辨率为5.2 μm。样品台旋转180°即完成一次CT图像采集, 每个样品采集900张投影图, 同时采集白场图像(X-射线光束照射路径上没有样品的背景图像)与暗场图像(关闭X-射线照射后采集的图像)。
图像重构与定量分析 使用X-TRACT SSRF CWSx64软件对投影图进行同轴成像相位恢复, 图像经背景校正、重构处理, 获得Slice图, 使用软件VGStudio Max和Image Pro Analyzer 3D分析渲染三维立体结构, 通过分割、提取处理获取定量数据, 包括微粒体积、空间分布及囊壁厚度等。
结果与讨论 1 长期和加速试验条件下软胶囊的崩解长期条件下的蜂胶软胶囊在40 min内可完全崩解, 而加速条件下的蜂胶软胶囊到达60 min仍不能完全崩解, 呈果冻状或在筛板上黏结部分胶皮。
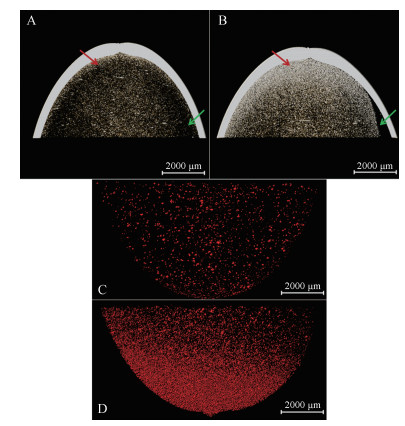
2 蜂胶软胶囊Slice图常规的显微成像法需要对软胶囊进行破坏处理, 只能提供二维结构数据; 且由于软胶囊内部为混悬油状黏稠液体, 切割分离出来的囊壁内侧表面受内容物“污染”, 难以观测囊壁的真实结构。而一般的水分测定体现的是软胶囊整体结构信息, 不能原位揭示制剂内部微细结构的变化。基于胶囊壳、内容物与空气对X-射线的吸收差异, 可对CQ和JS蜂胶软胶囊的囊壁与内容物的结构进行识别(图 1)。样品对X-射线的吸收越弱, 灰度值越低, 不同结构之间对比明显。对比CQ与JS, 两者囊壁与内容物具有较好的区分度, 囊壁比内容物具有更强的X-射线吸收, 压缝结构清晰可见。在本研究的分辨率下, 囊壁结构未呈现明显差异, 但CQ与JS胶囊内部结构显著不同。CQ与JS内容物中均可见大量结晶性微粒析出, 且相比于CQ, JS中部分微粒的密度接近囊材的密度。CQ的内容物颗粒分布相对较均匀, 高密度微粒数量较少(图 1A, 红色箭头); 相同区域处JS的内容物含有较多致密、呈强X-射线吸收性微粒(图 1B, 红色箭头)。值得注意的是, JS中有明显可见的空腔, 即分层结构(图 1B, 绿色箭头), 推测加速环境下析出微粒会向一侧迁移, 导致存在较大空腔结构。

|
Figure 1 Slices of propolis soft capsules. A: Propolis soft capsules under common storage condition for 6 months, referred to as CQ; B: Propolis soft capsules under accelerated environment for 6 months, referred to as JS |
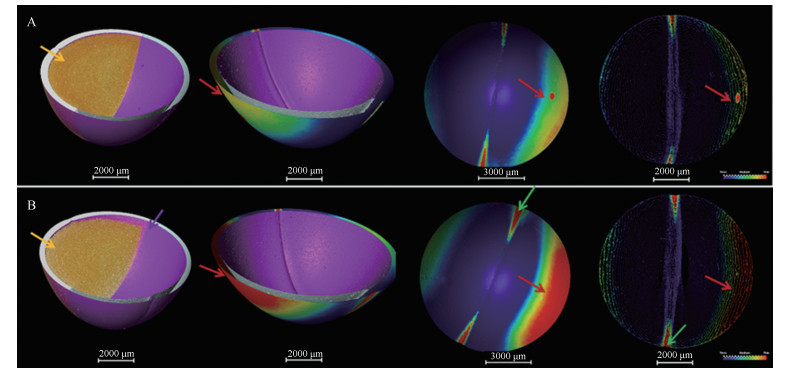
采用三维渲染图可视化分析CQ (图 2A)与JS (图 2B)软胶囊的立体精细结构差异, 结果显示两者均具有光滑的内外壁, 压缝结构清晰可见且呈相对较强X-射线吸收。软胶囊三维结构图表明, CQ内容物分布均匀、无大量微粒(红色箭头)、无分层现象(绿色箭头) (图 2A、C); 在同等部位处, JS内容物分层, 即空腔区域(绿色箭头), 且存在较多致密、高亮度微粒(红色箭头) (图 2B、D)。

|
Figure 2 Three-dimensional structure of propolis soft capsules. A and C: One-half and one-quarter three-dimensional reconstruction images of CQ; B and D: One-half and one-quarter three-dimensional reconstruction images of JS |
相比于片剂, 密封软胶囊内的难溶性药物在吸收部位呈溶液或混悬液状态, 可改善其生物利用度。据文献[14]报道, 软胶囊在加速环境中会使药物结晶而析出微粒, 使其失去改善药物生物利用度的基础。鉴于软胶囊内部微粒的复杂性, 为直观、清晰地分析微粒几何特征与空间分布, 依据灰度值差异对软胶囊中的不同结构进行分离提取(图 3), JS比CQ中析出物微粒明显数量多、密集分布在囊壁附近(红色箭头)、分层形成空腔结构(绿色箭头) (图 3A、B)。进一步将胶囊内微粒提取(图 3C、D, 红色微粒), 计算得CQ与JS中微粒的总体积分别为7.3×107和6.0×108 μm3、数量分别为2 539和36 234个, 单微粒平均体积分别为2.9×104和1.7×104 μm3。虽然软胶囊在储存期间处于相对静止状态, 但加速环境下析出较多微粒, 其也可能会受重力牵引向囊壁处沉积, 形成空腔结构(分层现象)。
|
Figure 3 Three-dimensional extraction of particles in propolis soft capsules. A and C: CG; B and D: JS |
囊壁的质量对软胶囊的稳定性至关重要。基于灰度值着色(图 4, 颜色刻度条从蓝色到红色代表囊壁由厚变薄), 结合形态学滤波分割, 实现囊壁结构的提取、分离。结果可知, JS组与CQ组在囊壁厚度分布有较大差异, 主要表现在JS中较大部分囊壁较薄(图 4, 红色区域), 特别在胶囊压缝处(图 4, 绿色箭头), JS组囊壁较薄区域更大。
|
Figure 4 Three-dimensional extraction of propolis soft capsule walls. A: CG; B: JS |
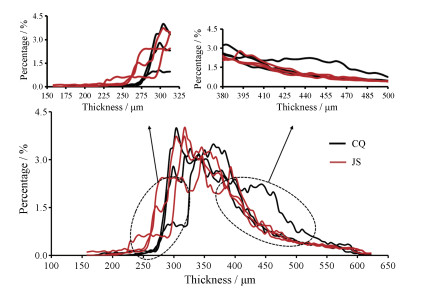
定量分析CQ与JS (n = 3)中的囊壁厚度分布(图 5), 可见两者囊壁厚度主要分布在200~600 μm, 在厚度低值区域(225~275 μm), JS所占百分比更高; 在厚度高值区域(350~500 μm), CQ总体百分比更高。
|
Figure 5 Thickness distributions of propolis soft capsules walls (n = 3) |
软胶囊内容物和囊壁的相互作用, 一定程度会造成储存期间各组分的迁移及崩解时间延长等现象[15-17]。由于软胶囊中微粒分散体系为热力学不稳定体系, 在加速环境中, 组分间相互影响, 不可避免发生诸如粒径变化、析出和分层等物理稳定性变化, 进而影响药效的发挥。故有必要基于立体结构特异性与空间分布差异全方面表征囊壁、内部微粒的结构, 以阐明软胶囊的内在质量, 保证稳定性与治疗效果。
为分析加速试验后软胶囊囊壁变薄区域与微粒析出分层区域间的联系, 将JS中析出微粒分布图与囊壁厚度分布图进行叠加(图 6), 可见囊壁变薄区域(红色区域)就是微粒出现分层的区域(空腔区域)。本研究对软胶囊囊壁的结构定量分析表明加速试验下蜂胶软胶囊的一侧囊壁、特别是压缝局部的囊壁变薄, 并且囊壁变薄区域与微粒析出迁移分层区域相对应(箭头所指处), 可能加速环境下囊壁中水分动态地向内容物迁移, 使囊壁降低强度和可塑性等特性, 延长崩解时间。

|
Figure 6 Corresponding diagram of the shell area getting thinner and precipitated particle layer area in JS |
软胶囊中非均相内容物及囊壁的原位检测是该类制剂逆向工程的一个难题, 软胶囊内部结构与内容物中微粒的空间分布是表征其质量、物理稳定性的关键。本研究采用先进科学设施, 在软胶囊的结构研究、内容物微粒的空间分布研究上, 实现原位、无损伤的三维定量分析, 反映长期和加速环境储存下软胶囊内部结构的精细变化, 为软胶囊制剂的逆向工程研究和质量评价提供新方法, 对难溶性药物的混悬型软胶囊的逆向工程研究具有一定的方法学意义。本研究提示研究者应加强对软胶囊内容物中微粒的分析和评价, 在产品质量研究阶段引入SR-μCT技术将有助于软胶囊的质量控制。
| [1] |
Hakata T, Sato H, Watanabe Y, et al. Effect of storage temperature on the physicochemical properties of soft gelatin capsules[J]. Chem Pharm Bull, 1994, 42: 1496-1500. DOI:10.1248/cpb.42.1496 |
| [2] |
Gullapalli P. Soft gelatin capsules (softgels)[J]. J Pharm Sci, 2010, 99: 4107-4148. DOI:10.1002/jps.22151 |
| [3] |
Hong SS, Lee SH, Lee YJ, et al. Accelerated oral absorption of gliclazide in human subjects from a soft gelatin capsule containing a PEG 400 suspension of gliclazide[J]. J Control Release, 1998, 51: 185-192. DOI:10.1016/S0168-3659(97)00167-3 |
| [4] |
Hung T. Antihistamine formulations for soft capsule dosage forms: WO, 03007920[P]. 2003-01-30.
|
| [5] |
Maciejewski B, Strom A, Larsson A, et al. Soft gelatin films modified with cellulose acetate phthalate pseudolatex dispersion-structure and permeability[J]. Polymers, 2018, 10: 981. DOI:10.3390/polym10090981 |
| [6] |
Yang FF, Ma JL, Ni R, et al. Progress of preventive measures and evaluation methods of cross-linking in soft gelatin capsule shells[J]. Chin J Pharm (中国医药工业杂志), 2017, 48: 442-448. |
| [7] |
Shimokawa Y, Hayakawa E, Takahashi K, et al. Pharmaceutical formulation analysis of gelatin-based soft capsule film sheets using near-infrared spectroscopy[J]. J Drug Deliv Sci Tec, 2018, 48: 174-182. DOI:10.1016/j.jddst.2018.09.012 |
| [8] |
Liu JP, Ma X, Zhu JB. Evaluation of correlation between gelation crosslinking indicators and influence factors[J]. Acta Pharm Sin (药学学报), 2005, 40: 279-284. |
| [9] |
Nazzal S, Wang Y. Characterization of soft gelatin capsules by thermal analysis[J]. Int J Pharm, 2001, 230: 35-45. DOI:10.1016/S0378-5173(01)00856-0 |
| [10] |
Yang S, Yin XZ, Li HY, et al. Research progress on architecture of dosage forms using synchrotron radiation X-ray microtomography[J]. Acta Pharm Sin (药学学报), 2013, 28: 794-802. |
| [11] |
Duan XH, Wu L, Li X, et al. Three-dimensional structure of beads self-assembled by cyclodextrin using synchrotron radiation X-ray microcomputed tomography[J]. Acta Pharm Sin (药学学报), 2018, 53: 291-296. |
| [12] |
Liu CB, Guo Z, Li B, et al. Investigation of microstructures of freeze-dried orally disintegrating tablets by synchrotron radiation X-ray computed microtomography[J]. J China Pharm Univ (中国药科大学学报), 2014, 45: 48-53. |
| [13] |
Lu XL, Zheng Q, Yin XZ, et al. Quantitative structure characteristics and fractal dimension of Chinese medicine granules measured by synchrotron radiation X-ray computed micro tomography[J]. Acta Pharm Sin (药学学报), 2015, 50: 767-774. |
| [14] |
Serajuddin ATM, Sheen PC, Augustine MA. Water migration from soft gelatin capsule shell to fill material and its effect on drug solubility[J]. J Pharm Sci, 1986, 75: 62-64. DOI:10.1002/jps.2600750114 |
| [15] |
Rodrigues GT, Sundararajan MR, Beke P, et al. Methods and compositions for preparing soft gelatin capsules having shells resistant to permeation by fill materials: WO, 9640083[P]. 1996-12-19.
|
| [16] |
Zheng WJ, Liu JP, Chen HD. An overview on soft capsule shell compositions[J]. Prog Pharm Sci (药学进展), 2007, 31: 491-495. |
| [17] |
Seager H. Soft gelatin capsules:a solution to many tableting problems[J]. Pharm Technol, 1985, 9: 84-104. |
 2020, Vol. 55
2020, Vol. 55


