迄今为止, 国外共上市3个抗PD-1单抗和3个抗PD-L1单抗, 分别为pembrolizumab (Keytruda)、nivolumab (Opdivo)、cemiplimab (Libtayo)和atezolizumab (Tecentriq)、avelumab (Bavencio)、duvalumab (Imfinzi)[1]; 国内共上市2个进口和3个国产抗PD-1单抗, 分别为帕博利珠单抗(可瑞达)、纳武利尤单抗(欧狄沃)和特瑞普利单抗(拓益)、信迪利单抗(达伯舒)、卡瑞丽珠单抗(艾瑞卡)。抗PD-1/PD-L1单抗已经获批近20个肿瘤适应症, 尤其值得注意的是, 所获批的微卫星不稳定性实体瘤并不区分肿瘤类型[2]。
抗PD-1/PD-L1单抗的主要作用机制为与T细胞表面的PD-1或者肿瘤细胞表面的PD-L1结合, 阻断PD-1和PD-L1的相互作用, 从而逆转肿瘤细胞对效应型T细胞的抑制, 激活T细胞产生对肿瘤细胞的杀伤效应[3]。生物学活性对抗PD-1/PD-L1单抗的药物筛选、表征、放行以及稳定性研究都至关重要, 而理想的生物学活性应反映药物的作用机制, 线性、准确性、精密度、耐用性良好, 具有较好的可操作性和稳定指示性等。早期的研发采用混合淋巴细胞反应检测IFN-γ浓度反映抗PD-1/PD-L1单抗的体外活性[4], 由于采用原代细胞及实验周期较长导致变异较大, 准确性和精密度较差, 虽然具有较强的机制相关性, 但很难检测出其高级结构变化所导致的活性改变, 无法满足常规生物学活性测定的要求; T细胞增殖法[5]、细胞毒[6]或者粘附实验[7]等一般在基础研究时采用, 同样无法满足质量控制中的测活需求。抗PD-1/PD-L1单抗新药临床试验申请(IND)时, 绝大部分企业采用竞争酶联免疫吸附实验(ELISA)来评价抗体的活性[8], 一般来说, 只需要结合作用作为作用机制的单抗可以采用结合实验作为生物学活性测定方法(膜结合激活型单抗除外), 但需证明单抗结合膜抗原和板上包被抗原的亲和能力相似, 另外需和细胞学实验进行桥接以证明其可以指示影响活性的高级结构的变化。所以选择结合实验作为生物学活性测定应基于对单抗的作用机制及分子本身的充分表征和认知, 而对于研发中的新单抗或者上市时间较短的单抗, 一般来说此类信息较为缺乏, 需建立相应的基于细胞的生物学活性测定法[9]。
为此本文研发了报告基因法, 构建稳定表达PD-L1分子和抗CD3单链抗体(ScFv)的CHO-PD-L1-CD3L细胞以及稳定表达PD-1分子和NFAT报告基因的Jurkat-PD-1-NFAT细胞。当两种细胞共同孵育时, CHO细胞表面抗CD3ScFv和Jurkat细胞的膜CD3分子结合, 向内传递活化信号, 而CHO细胞表面PD-L1和Jurkat细胞表面的PD-1分子结合, 抑制活化信号的传递, 荧光素酶报告基因不能表达。用这两种细胞模拟了T细胞激活受到PD-1信号通路抑制的机制, 当加入抗PD-1/PD-L1抗体时, 阻断PD-1和PD-L1的结合, 使CHO细胞表面抗CD3ScFv和Jurkat细胞的膜CD3分子结合传递活化信号, NFAT驱动的荧光素酶报告基因得以表达。对此方法进行优化和验证后证明, 该方法特异性、线性、准确性、精密度和传代稳定性均良好, 可用于抗PD-1/PD-L1单抗的生物学活性测定[10]。
鉴于在研的抗PD-1/PD-L1单抗数量颇多, 有必要进行实验室间的联合验证, 进一步评价该方法实验室间的线性、准确度和精密度, 使该方法更能良好的应用于抗PD-1/PD-L1单抗的质控[11]。
材料与方法药品及试剂 DMEM/F12培养基(货号11330-032)、1640培养基(货号11875-093)、FBS (货号10099-141)、NEAA (货号11140-050)、青链霉素(货号15140148)和Puromycin (货号A11138-03)均购自Gibco公司; Flu-Uni试剂盒(货号FU-1000T)来自北京锐金斯生物科技有限公司; 白色96孔板(货号3917)购自Corning公司。所有抗PD-1单抗均为本室检验留样, 其中样品1作为参比品(Reference), 样品2作为对照品(Control), 样品3作为供试品(Sample), 均为10 mg·L-1, 样品4为参与实验室自制抗PD-1单抗(In-house); 样品1, 2和3为同一抗PD-1单抗, 为IgG4/κ型, 分子质量为149 kD左右, 等电点为6.8~6.9, 样品1和2为同一批次, 而样品3则为另一批次; 4个样品均用于第1组实验, 其中样品1和2还用于第2组实验。
细胞培养 配制CHO-PD-L1-CD3L细胞完全培养基, 在1 L的DMEM/F12基础培养基中加入FBS 100 mL、NEAA10 mL、青链霉素溶液10 mL、Hygromycin B (50 mg·L-1) 4 mL和Puromycin (10 mg·L-1) 800 μL, 每2天进行细胞传代培养至对数生长期。配制Jurkat-PD-1-NFAT细胞完全培养基, 在1640基础培养基1 L中加入FBS 100 mL、NEAA10 mL、10 mL的青链霉素溶液、Hygromycin B (50 mg·L-1) 8 mL和Puromycin (10 mg·L-1) 400 μL, 每2天进行细胞传代培养至对数生长期。
实验步骤 消化并离心CHO-PD-L1-CD3L细胞, 用分析培养基(1640基础培养基+2% FBS)重悬细胞至5×105个·mL-1, 每孔100 μL加入到白底96孔板中, 于37 ± 2 ℃、(5 ± 1) % CO2培养箱中孵育16 ± 2 h。将抗PD-1单抗预稀释至60 μg·mL-1, 再进行1:3倍梯度稀释。在96孔板第3~11中分别加入分析培养基180 μL, 第2列加入60 μg·mL-1抗体270 μL, 然后用多通道移液枪从第2列中取样品90 μL, 分别加入第3列中, 用枪吹打混匀10次左右, 然后依次向下稀释, 直至第11列。将细胞培养板取出, 吸取上清液弃掉, 每孔加入抗体稀释液50 μL。取出Jurkat细胞, 离心计数后, 用分析培养基将其密度调整至2×106个·mL-1。每孔50 μL的Jurkat细胞悬液加入到上述培养板中, 于培养箱中孵育6 h。提前1 h取出Flu-Uni试剂, 室温放置。每孔100 μL加入到细胞板, 室温避光孵育2~3 min后用酶标仪进行读数。
验证方案设计 方案一:每个实验室按照表 1所示重复3轮实验, 每轮实验不同天; 方案二:每个实验室按照表 2所示重复3轮实验, 每轮实验不同天, 其中样品1、2、3、4、5分别为预稀释浓度为30、45、60、75和90 μg·mL-1的样品。
| Table 1 Study design of scheme 1 |
| Table 2 Study design of scheme 2 |
统计学分析 采用四参数曲线(4-PL)方程以拟合样品的剂量反应曲线, 所采用的软件为GraphPad Prism 5。所拟合的方程为Y = (A-D)/(1+(X/C)^B)+D, 其中Y为化学发光值、X为样品浓度、A为曲线的上平台值、D为曲线的下平台值、C为半数最大效应浓度(EC50)、B值为EC50点处的曲线斜率。其中参比品与样品的EC50值的比值作为样品的相对生物学效价。95%可置信区间的分析同样采用GraphPad Prism 5软件进行。
结果 1 方案一的联合验证数据及精密度对于方案一, 每个实验室进行3轮实验(不同天), 其中每轮实验均包含4块板(表 1)。其中对于每轮实验中的第4块板, 其目的为比较不同厂家不同一级结构的抗PD-1单抗相对生物学活性, 并不代表该单抗的实际临床效果, 且不纳入后续的统计学分析中。
采用四参数方程对数据进行曲线拟合, 符合下列标准的被采用为有效数据, 并纳入后续的统计分析中: ①每块培养板上参考品、对照品和供试品剂量反应曲线的R2≥0.98; ②参比品与对照品斜率之比(斜率为四参数方程中的“b”)应在(80~120) %之间, 参比品与供试品的斜率之比应在(80~120) %之间; ③对照品的相对活性结果应为(80~120) %。对于符合系统适用性要求的数据被采用为有效数据。利用四参数方程拟合的剂量反应曲线如图 1B示例所示。
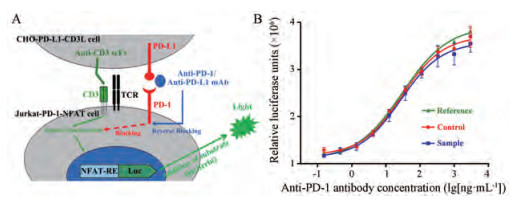
|
Figure 1 The mechanism of cell based reporter gene assay to determine the bioactivity of anti-PD-1/anti-PD-L1 antibodies (A) and the represented dose-response curve induced by the serially diluted anti-PD-1 antibodies (B) |
图 2A表示方案一中每个实验室每轮实验的前3块板, 共3轮实验5个实验室的样品相对效价的数值。
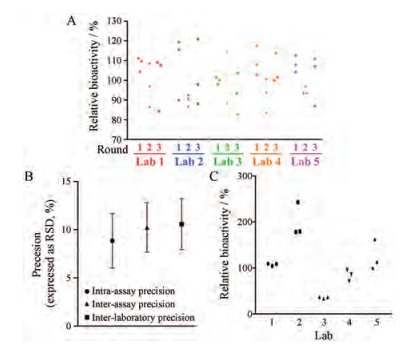
|
Figure 2 Overview of relative bioactivity of the anti-PD-1 antibody sample against the reference obtained from 3 plates per round, 3 rounds per lab, and totally 5 labs (A), 95% confidence interval of intra-assay, inter-assay and inter-laboratory precision of the relative bioactivity of anti-PD-1 antibody sample, as raw data in Figure 2A (B), and the relative bioactivity of in-house anti-PD-1 antibodies from different manufactures (C) |
对于多实验室协作验证, 采用相对标准差评估实验的精密度, 包含实验室内(intra-laboratory)精密度和实验室间(inter-laboratory)精密度, 其中实验室内精密度又包括检测内(intra-assay)精密度和检测间(inter-assay)精密度[12]。检测内精密度用每个实验室每轮实验的3块板子所计算的相对效价的相对标准偏差表示, 每个实验室进行3轮检测可得到3个检测内精密度, 5个实验室共计算得15个检测内精密度。检测间精密度则用每个实验室不同轮次实验中相同布局板子所测得相对效价计算得到的相对标准偏差表示, 5个实验室3种布局, 共计算得15个检测间精密度。而实验室间精密度则用每个实验室3轮实验共9块板子所得到的相对效价的相对标准偏差表示, 所以共计算得5个实验室间精密度。3种精密度的均值及95%可置信区间如图 2B所示, 3种精密度的95%置信区间均小于15%, 表明本实验的精密度良好。
图 2C则表示方案一中每个实验室每轮实验的第4块板, 共3轮实验5个实验室的样品相对效价的数值, 5个不同的抗PD-1单抗均处于临床实验的不同阶段, 可以看出不同的抗PD-1单抗其活性差异较大。
2 方案二的联合验证数据及准确性对于方案二, 每个实验室进行3轮实验(不同天), 其中每轮实验均包含3块板(表 2)。符合系统适用性的数据纳入后续统计, 系统适用性要求同方案一。每轮实验的3块板包含一次有效数据, 涵盖了理论效价为50%、75%、100%、125%和150%的实测效价。理论效价和实测效价的线性拟合如图 3A所示, 拟合方程如表 3所示, 可以看出5个实验室的线性拟合均良好, 其R2值均大于0.98。另外每个实验室3轮实验对于每个效价水平的实测值偏差很小, 表示对于(50~150)%效价水平的测定精密度良好。
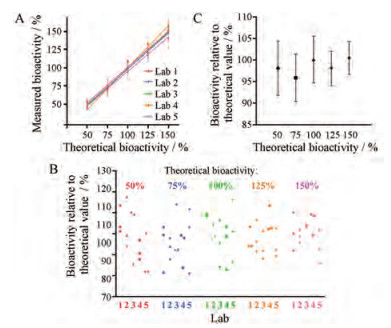
|
Figure 3 The correlation between theoretical and measured bioactivity (A), the accuracy of different samples with different bioactivity levels (i.e., 50%, 75%, 100%, 125% and 150%) as demonstrated with the relative measured bioactivity against theoretical bioactivity (B) and the 95% confidence interval of the accuracy of different bioactivity level as indicated (C) |
| Table 3 The correlation of theoretical and measured bioactivity values of anti-PD-1 antibodies from five labs |
用每个实验室每轮实验每个效价水平实测值与理论值的比值表示其准确性, 结果如3B所示, 可以看出每个效价水平的准确性均位于(80~120) %内。另外由图 3C所示, 50%效价水平的样品其实测效价准确性的95%可置信区间为(91.83~104.40) %, 75%为(90.40~101.40) %, 100%为(94.71~105.60) %, 125%为(94.00~102.00) %, 150%为(96.73~104.30) %。总结来说, 从(50~150) %效价水平其实测效价准确性的95%可置信区间位于90%~110%内, 可以认为实验的准确性良好。
讨论对于大分子药物, 虽然理化分析手段随着时代发展越来越先进, 但是即使再详尽也往往不能确定其高级结构, 而需从产品生物学活性加以推论, 足见生物学活性分析的重要性。生物学活性的评价是确定产品全面特征的重要步骤, 为反映其生物学性质的重要方法, 同时可表示产品产生特定生物学效应的具体量值。各国监管机构都期望生物学活性分析应基于药物的作用机制, 所以基于细胞的生物学活性方法在生物大分子药物的放行及稳定性分析中被广泛应用[13]。
抗PD-1单抗的研发掀开了肿瘤免疫治疗的新篇章, 其优秀的临床疗效吸引着很多生物医药企业对其进行研发[14]。据统计, 国内共有数十个的抗PD-1/PD-L1单抗处于研发的不同阶段。为对抗PD-1单抗的生物学活性进行有效的质量控制, 作者研发了相应的基于报告基因的细胞生物学活性测定方法, 并已对国内十余家相关企业进行了技术转移和培训。细胞生物学活性测定方法相对比较复杂, 实验条件的变化和操作人员的不同都可能会影响实验结果。作为一种可以测定不同抗PD-1单抗活性的平台方法, 不仅实验室内部的方法学验证是必需的, 实验室间的联合验证对于方法的适用性而言其重要性也不言而喻。
本研究采用了两种实验方案进行了实验室间的联合验证。在方案一中, 采用一个批次的抗PD-1单抗作为参比品, 另外一个批次的相同抗PD-1单抗作为供试品, 5个实验室分别进行了3轮实验以及每轮实验3块板的策略, 对供试品的相对生物学活性的检测内、检测间和实验室间的精密度进行了研究, 结果表明, 3种精密度均较好。在方案二中, 利用一个批次的抗PD-1单抗作为参比品, 板上首浓度分别为50%、75%、100%、125%和150%的同批次抗PD-1单抗作为供试品, 5个实验室分别进行了3轮实验的策略, 证明方法的线性和准确性均良好。
另外在方案一中, 加入了不同实验室自研抗PD-1单抗相对于统一分发提供的抗PD-1单抗参比品的效价, 可以看到不同的抗PD-1单抗其相对生物学活性范围约为30%~250%。生物学活性测定方法一般用于放行、批间一致性的指示以及稳定性评价等, 所得到相对生物学活性一般是指样品相对于参比品的相对活性, 样品和参比品的剂量反应曲线应具有相似性, 前提为样品和参比品应为同一物质, 所以不同药物之间的相对生物学活性一般不会进行比较。例如第5家实验室的自研抗PD-1单抗不能满足系统适用性要求中的斜率比要求, 所以针对不同抗PD-1的相对生物学效价只是要说明不同单抗之间的大概剂量反应曲线范围, 而不是真正体现其相对统一分发提供的抗PD-1单抗参比品的效价, 另外也说明不同的抗PD-1单抗对其进行测活时, 需要对本研究所提供的具体方法进行微调才能满足要求。
本联合验证研究证明所研发的基于报告基因法的细胞生物学测活法的稳健性和可转移性, 可用于抗PD-1单抗研发企业的放行以及稳定性研究中。
| [1] |
Lee HT, Lee SH, Heo YS. Molecular interactions of antibody drugs targeting PD-1, PD-L1, and CTLA-4 in immuno-oncology[J]. Molecules, 2019, 24: 1190. DOI:10.3390/molecules24061190 |
| [2] |
Marcus L, Lemery SJ, Keegan P, et al. FDA approval summary:pembrolizumab for the treatment of microsatellite instability-high solid tumors[J]. Clin Cancer Res, 2019, 25: 3753-3758. DOI:10.1158/1078-0432.CCR-18-4070 |
| [3] |
Balar AV, Weber JS. PD-1 and PD-L1 antibodies in cancer:current status and future directions[J]. Cancer Immunol Immunother, 2017, 66: 551-564. DOI:10.1007/s00262-017-1954-6 |
| [4] |
Topalian SL, Drake CG, Pardoll DM. Immune checkpoint blockade:a common denominator approach to cancer therapy[J]. Cancer Cell, 2015, 27: 450-461. DOI:10.1016/j.ccell.2015.03.001 |
| [5] |
Wei F, Zhong S, Ma Z, et al. Strength of PD-1 signaling differentially affects T-celleffector functions[J]. Proc Natl Acad Sci U S A, 2013, 110: E2480-2489. DOI:10.1073/pnas.1305394110 |
| [6] |
Wong RM, Scotland RR, Lau RL, et al. Programmed death-1 blockade enhances expansion and functional capacity of human melanoma antigen-specific CTLs[J]. Int Immunol, 2007, 19: 1223-1234. DOI:10.1093/intimm/dxm091 |
| [7] |
Saunders PA, Hendrycks VR, Lidinsky WA, et al. PD-L2:PD-1 involvement in T cell proliferation, cytokine production, and integrin-mediated adhesion[J]. Eur J Immunol, 2005, 35: 3561-3569. DOI:10.1002/eji.200526347 |
| [8] |
Stewart R, Morrow M, Hammond SA, et al. Identification and characterization of MEDI4736, an antagonistic anti-PD-L1 monoclonal antibody[J]. Cancer Immunol Res, 2015, 3: 1052-1062. DOI:10.1158/2326-6066.CIR-14-0191 |
| [9] |
Noel R, Hélène GS, Gazzano S, et al. The roles of bioactivity assays in lot release and stability testing[J]. BioProcess Int, 2010, 6: 33-42. |
| [10] |
Wang L, Yu C, Yang Y, et al. Development of a robust reporter gene assay to measure the bioactivity of anti-PD-1/anti-PD-L1 therapeutic antibodies[J]. J Pharm Biomed Anal, 2017, 145: 447-453. DOI:10.1016/j.jpba.2017.05.011 |
| [11] |
Rao C, Pei D, Yu L, et al. Evaluation of a reporter gene assay for bioactivity determination therapeutic interferons through a collaborative Study[J]. Curr Pharm Anal, 2016, 12: 129-136. DOI:10.2174/1573412911666150729231115 |
| [12] |
ICH. Validation of Analytical Procedures: Text and Methodology Q2(R1)[S/OL]. 2005. https://database.ich.org/sites/default/files/Q2_R1__Guideline.pdf.
|
| [13] |
ICH. Specifications: Test Procedures and Acceptance Criteria for Biotechnological/Biological Products Q6B[S/OL]. 1999. https://database.ich.org/sites/default/files/Q6B_Guideline.pdf.
|
| [14] |
Sanmamed MF, Chen L. A paradigm shift in cancer immunotherapy:from enhancement to normalization[J]. Cell, 2018, 175: 313-326. DOI:10.1016/j.cell.2018.09.035 |
 2020, Vol. 55
2020, Vol. 55


