2. 安徽中医药大学第一附属医院, 安徽 合肥 230031;
3. 沃特世科技 (上海) 有限公司, 上海 201206
2. The First Affiliated Hospital of Anhui University of Chinese Medicine, Hefei 230031, China;
3. Waters Corporation(China), Shanghai 201206, China
肝豆状核变性(hepatolenticular degeneration, HLD)又称Wilson病(Wilson disease, WD), 是常染色体隐性遗传的铜代谢障碍性疾病。其病因是患者体内缺少铜蓝蛋白后不能清除体内多余的铜, 导致铜在体内大量蓄积, 进而严重损伤组织器官[1]。青霉胺等铜离子络合剂驱铜是目前HLD基本治疗方法, 该类药物可在体内与Cu2+配位形成配合物, 再经尿液排出体外, 从而达到治疗目的, 但由于该类药物不良反应严重患者不能长期服用[2, 3]。肝豆汤(Gandou decoction, GDD)由“大黄、黄连、姜黄、金钱草、泽泻、三七”六味中药组成, 具有清热解毒、利尿通淋的功效。由于临床疗效确切, 该方被《肝豆状核变性诊断与治疗指南》推荐为治疗HLD的基本方[4]。临床研究表明肝豆汤可显著提高HLD患者尿液中铜含量, 通过促进尿液排铜改善患者临床症状和生活质量[5, 6]。课题组前期研究发现肝豆汤可有效促进铜负荷HLD模型大鼠尿液排铜[7], 但是该方促进尿液排铜的化学成分及其代谢产物尚不明确, 分析鉴定肝豆汤在大鼠尿液中的原形成分和及其代谢产物有助于阐明该方排铜作用物质基础。
超高效液相色谱-四级杆飞行时间质谱(UPLC-Q-TOF-MS)是中药代谢产物分析鉴定工作有力工具, 具有分析速度快、高分辨率、高灵敏度等优势[8, 9]。UPLC-Q-TOF-MS鉴定代谢产物时通常先设定目标原形成分结构, 再根据原形成分裂解规律设定可能的中性丢失碎片, 选择可能发生Ⅰ相和Ⅱ相的代谢途径来筛选代谢产物, 但由于生物基质背景复杂及代谢物响应低, 该方法可能造成代谢物遗漏[10]。UPLC-Q-TOF-MS结合外源性代谢组学方法可以从全局角度分析生物样本中所有的代谢物轮廓, 结合主成分分析(principal component analysis, PCA), 正交偏最小二乘法判别分析(orthogonal partial least-squares discriminant analysis, OPLS-DA)等化学计量学方法可找出差异性外源性物质, 整体辨识生物体中外源性成分, 目前已成功应用于单体化合物外源性代谢物的鉴定[11, 12], 但该方法用于鉴定中药复方外源性代谢产物研究鲜有报道。前期研究采用UPLC-Q-TOF-MSE技术鉴别了肝豆汤中96种化学成分, 并对该方主要成分肠吸收特征进行了考察[13, 14]。为探究该方促尿液排铜作用物质基础, 本实验采用UPLC-Q-TOF-MSE技术结合外源性代谢组学方法对正常大鼠和铜负荷HLD模型大鼠口服豆汤后尿液中的原形成分与代谢产物进行了系统研究, 结果表明该方法简便快捷, 可全面了解肝豆汤在大鼠尿液中的主要存在形式, 为肝豆汤促尿液排铜药效物质的阐明提供了参考。
材料与方法仪器 Waters Acquity UPLC超高效液相色谱系统, Waters Xevo G2 Q-TOF高分辨率飞行时间质谱仪, 配有电喷雾离子源(ESI) (美国Waters公司); Milli-Q Gradient A10超纯水器(美国Millipore公司); HP-5016SY氮吹仪(上海济成分析仪器有限公司)。
试剂 对照品盐酸小檗碱(批号: 110713-201212)、大黄素甲醚(批号: 110758-201415)、大黄素(批号: 110756-201512)、23-乙酰泽泻醇B (批号: 111846-201504)、三七皂苷R1 (批号: 110745-201318)、槲皮素(批号: 100081-200406)、姜黄素(批号: 110823-201404)均购于中国食品药品检定研究院; 大黄酸(批号: 150904, 纯度: 99.3%)、大黄酚(批号: 151028, 纯度大于98%)、芦荟大黄素(批号: 150730, 纯度大于97%)、山柰素(批号: 150122, 纯度大于98%)均购于北京北纳创联生物技术研究院, 色谱纯乙腈(TIEDA公司); 色谱纯甲酸(天津市光复精细化工研究所), 其他试剂均为分析纯。
实验动物 清洁级Wistar雄性大鼠, 体重(220 ± 20) g, 由扬州大学比较医学中心提供, 许可证号: SCXK (苏) 2017-0007。饲养室温度25 ± 2 ℃, 湿度50% ± 10%, 12 h人工昼夜交替。动物实验经安徽中医药大学动物实验伦理委员会批准(批准号: 2019025)。
肝豆汤冻干粉的制备 大黄(Rheum palmatum L.)、黄连(Coptis chinensis Franch.)、姜黄(Curcuma longa L.)、金钱草(Lysimachia christinae Hance.)、泽泻(Alisma orientale (Sam.) Juzep.)和三七(Parmx notoginseng (Burk.) F.H.Chen)均购于合肥市同仁堂大药房, 经安徽中医药大学刘先华鉴定为合格药材。参照课题组前期方法[7]制备肝豆汤冻干粉, 经HPLC多成分定量分析冻干粉中主要成分含量, 符合课题组对肝豆汤冻干粉的质量控制要求。
对照品溶液的配制 精密称取盐酸小檗碱6.90 mg、大黄素甲醚5.74 mg、大黄素8.94 mg、23-乙酰泽泻醇B 4.12 mg、三七皂苷R1 9.78 mg、槲皮素6.27 mg、大黄酸5.79 mg、大黄酚6.15 mg、芦荟大黄素4.68 mg和山柰素5.21 mg的对照品置于5 mL量瓶中, 甲醇定容, 精密移取1.0 mL置于25 mL量瓶中, 甲醇定容, 经0.22 µm滤膜滤过作为对照品试液。
实验动物分组 Wistar雄性大鼠24只适应性饲养1周后, 随机分为4组:正常对照组、正常给药组、模型对照组、模型给药组, 每组6只。按照课题组前期方法[7]复制铜负荷HLD大鼠模型, 临用前将肝豆汤冻干粉溶于0.5% CMC-Na溶液中配置成1.2 g·mL-1冻干粉溶液, 正常给药组和模型给药组分别按11.5 g·kg-1 (相当于生药量80 g·kg-1)给药, 每天1次, 连续灌胃给药3天, 其余2组灌胃给予等体积的CMC-Na溶液。
样品采集与处理 末次给药前禁食12 h, 自由饮水, 待给药后将大鼠置于代谢笼中, 收集合并0~24 h尿液, 16 000 ×g离心5 min取上清液, 置于-80 ℃储存备用。检测前将尿液于4 ℃复融, 精密吸取样品1.0 mL加入4倍量甲醇, 涡旋混匀2 min, 离心15 min, 取上清液于EP管中, 30 ℃条件下氮气吹干, 0.5 mL甲醇复溶, 0.22 μm微孔滤膜过滤后进样分析。
色谱检测条件 色谱柱Agilent Eclipse Plus C18 (2.1 mm×100 mm, 1.8 μm); 柱温30 ℃; 流动相: 0.1%甲酸水(A)-乙腈(B); 梯度洗脱: 0~1 min, 10% B; 1~4 min, 10%~20% B; 4~10 min, 20%~30% B; 10~15 min, 30%~40% B; 15~18 min, 40%~50% B; 18~23 min, 50%~75% B; 23~25 min, 75%~85% B; 25~27 min, 85%~100% B。流速0.3 mL·min-1; 进样体积1 μL。
质谱检测条件 电喷雾离子源(ESI)正、负离子模式分别进行MSE扫描; 低碰撞电压: 6 V; 高碰撞电压: 20~80 V; 离子源温度: 120 ℃ (ESI+)和110 ℃ (ESI-); 锥孔电压: 40 V; 锥孔气流量: 50 L·h-1; 电喷雾电压: 3.0 kV (ESI+)与2.5 kV (ESI-); 雾化气体积流量: 600 L·h-1; 脱溶剂气温度: 350 ℃; 扫描范围: m/z 50~1 200;亮氨酸脑啡肽实时校准质量数。
外源性代谢组学技术分析原形及代谢物策略 ① Progenesis QI V2.0软件将各组质谱数据进行峰对齐、峰识别, 提取特征峰离子强度, 获得序号、保留时间、质荷比及对应离子强度的三维数据集; ②将三维数据集导入EZinfo 3.0软件中进行主成分分析(PCA)无监督数据分析, 聚类各组数据提出离群样本; ③使用正交偏最小二乘法判别分析(OPLS-DA)进行有监督的数据分析, 得到S-plot载荷图筛选得到差异离子; ④结合化学成分库和裂解规律, 对差异离子一级质谱信息、二级碎片信息、相关的特征丢失碎片信息进行分析鉴定原形成分和外源性代谢物。
结果 1 肝豆汤原形及代谢产物的识别与鉴定采用有监督的OPLS-DA模型分别对正、负离子数据集进行分析, 得到的OPLS-DA得分图由交叉验证参数R2X和Q2描述, 正常对照组和正常给药组在正离子模式下, R2X和Q2分别为0.98和0.95, 负离子模式下, 分别为0.99和0.97。模型对照组和模型给药组在正离子模式下, R2X和Q2分别为0.99和0.98, 负离子模式下, 分别为0.99和0.98, 均接近1, 远大于0.5, 提示模型具有很好的稳定性和预测能力。图 1和图 2分别为正负离子模式下空白组与给药组(正常给药组、模型给药组) PCA得分图, 结合OPLS-DA中S-plot载荷图(图 3、4, VIP > 1)筛选给药组中对分类起主要作用的离子, S-plot载荷图中离原点越远, 对应VIP值越大, 对分类影响也就越大, 这些差异较大离子为肝豆汤原形成分或者代谢物, 也有可能是浓度差异大的内源性成分, 剔除内源性成分, 再将原形成分和代谢物提取得到提取离子流图(EICs), 见图 5。
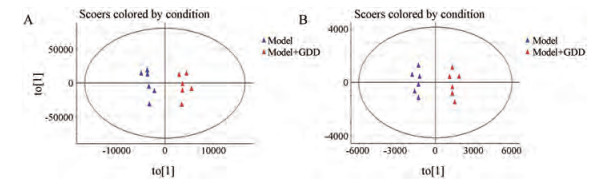
|
Figure 1 The PCA score plot of rat urine data from model Gandou decoction (GDD)-dosed group versus model control group in negative-ion mode (A) and in positive-ion mode (B) |

|
Figure 2 The PCA score plot of rat urine data from normal GDD-dosed group versus normal control group in negative-ion mode (A) and in positive-ion mode (B) |
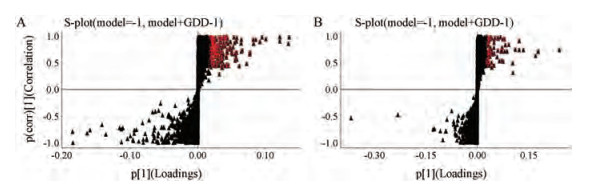
|
Figure 3 S-plot of OPLS-DA model for model GDD-dosed group versus model control group in negative-ion mode (A) and in positive-ion mode (B) |

|
Figure 4 S-plot of OPLS-DA model for normal GDD-dosed group versus normal control group in negative-ion mode (A) and in positive-ion mode (B) |

|
Figure 5 The extracted ion current chromatograms (EICs) of GDD-dosed rat urine in negative ion mode (A) and positive ion mode (B). The number of peak 1-77 in this figure was consistent with that in Table 1 |
将上述提取得到的差异性离子导入Masslynx V4.1软件分别对各个组别尿液样品的UPLC-Q-TOF-MS数据进行分析。参照上述“外源性代谢组学技术分析原形及代谢物策略”最终从大鼠尿液样品中筛选出45个潜在的原形成分和32个潜在的代谢产物, 结果见表 1。
| Table 1 Characterization of xenobiotics and metabolites in rat urine after oral administration of GDD by UPLC-Q-TOF-MS. Glc: Glucose; GluA: Glucuronidates; SO3: Sulfates; Xyl: Xylose; aPrototypes of GDD; bIdentifications confirmed with standard compound; M1-M32: Metabolites of GDD; C: Detected in control group; MG: Detected in model group |
肝豆汤尿液共筛选出45个原形成分(蒽醌类10个、生物碱类6个、原萜烷型三萜类10个、黄酮类6个、姜黄素类3个、皂苷类4个、鞣质类5个、有机酸类1个), 其中10个化学成分经标准品进一步确证。原形成分提取离子峰、质谱信息和碎片信息见图 5和表 1。
图 5和表 1中看出正常和模型大鼠尿液样本中共计检测出10个蒽醌类原形成分, 分别为峰16、19、46、52、55、57、60、61、68和71, 其中峰60、61、68和71经对照品归属分别为芦荟大黄素、大黄酸、大黄素和大黄酚。大黄素的分子离子峰为m/z 269.045 4 [M-H]-, 在高能量MS/MS中逐级失去CO碎片得到m/z 241.050 5 [M-H-CO]-, 并且出现m/z 225.055 7 [M-H-CO2]-的CO2中性丢失。在裂解过程中, 大黄酸会出现连续的CO丢失, 在负离子模式下, 形成m/z 283.024 9、m/z 239.034 9、m/z 211.040 8、m/z 183.035 6的主要碎片离子。尿液样本中检测到6个生物碱类原形成分, 分别为峰10、13、31、38、40和62, 其中峰38经对照品归属为小檗碱。正离子模式下, 小檗碱分子离子峰为m/z 336.123 0 [M]+, MS/MS显示主要碎片为m/z 321.098 4、m/z 320.091 6、m/z 306.076 3、m/z 292.096 7、m/z 278.081 4等。峰59、63、69、70、72~77为三萜类成分, 以峰74为例, tR=23.79 min, 正离子模式下, 其母核结构稳定但其支链容易发生脱水断链, m/z 473.363 1 [M+H]+脱去一分子H2O形成m/z 455.353 5 [M+H-H2O]+的碎片离子, 接着失去一分子H2O形成m/z 437.352 8 [M+H-2H2O]+的碎片离子, 结合对照品保留时间和质谱信息, 鉴定该化合物为泽泻醇B。峰34、39、54和56为皂苷类成分, 其中峰34经对照品归属为三七皂苷R1。负离子模式下, 三七皂苷R1的m/z 977.540 0 [M-H+HCOO]-和m/z 931.529 6 [M-H]-的基峰, 高能量时碎片离子m/z 799.485 4、m/z 637.431 2、m/z 475.378 4分别代表[M-H-Xyl]-、[M-H-Xyl-Glu]-以及[M-H-Xyl-2Glu]-。峰65~67为姜黄素类成分, 该类成分负离子响应较好, 峰65和峰66的保留时间分别为17.46和17.93 min, 低能量时分别得到m/z 307.097 3和m/z 337.107 6的分子离子峰, 高能量下得到相应的碎片离子, 可推测峰65和峰66分别为双去甲氧基姜黄素和去甲氧基姜黄素。峰23、30、44、45、49和64为黄酮类成分, 其中峰45和64分别为槲皮素和山柰素。
2.2 肝豆汤大鼠尿液中代谢产物鉴定结合原形产物及其相应的裂解规律, 从大鼠尿液中共检测到32个代谢产物(表 1中M1~32), 经质谱鉴定主要为生物碱类代谢物和蒽醌类代谢物。以M5为例, M5分子离子峰为m/z 512.155 7 [M]+, 分子式为C26H25NO5, 在高能量质谱图中, 特征丢失葡萄糖醛酸分子(176 Da), 同时也产生小檗碱的特征离子, 推测M5为小檗碱Ⅱ相葡萄糖醛酸化的产物。M4的分子离子峰[M]+为m/z 514.172 3, 低能量下有m/z 388.137 7的产物离子, 表明其具有GluA单元连接到苷元部分, 推测M4为药根碱的葡萄糖醛酸化产物, 然而葡萄糖醛酸化的具体位置不能被确认。根据类似的方法对其他生物碱类代谢物进行鉴别, 其中M1、M2、M3分别是木兰花碱的葡萄糖醛酸化产物、去甲基后产物和羟基化产物; M8和M14分别为葡萄糖醛酸化的去亚甲基小檗碱和去甲基小檗碱, M10为小檗碱的羟基化产物; M17为硫酸化的去甲基小檗碱; M9、M19和M20分别为硫酸化小檗碱、去亚甲基小檗碱和去甲基小檗碱; M4、M18、M26分别为药根碱的葡萄糖醛酸化产物、药根碱羟基化和羟基化后葡萄糖醛酸结合物; M16为巴马汀的葡萄糖醛酸结合物。16个生物碱代谢物中, M2、M3、M10、M18~M20为Ⅰ相代谢产物, 其他为硫酸化和葡萄糖醛酸化的Ⅱ相代谢产物。
鉴定出的16个蒽醌类代谢产物均为硫酸化和葡萄糖醛酸化的Ⅱ相代谢产物。如M15的分子离子峰为m/z 445.077 0 [M-H]-, 在高能量下, 特征丢失葡萄糖醛酸分子(176 Da), 产生m/z 269.045 4子离子, 同时也产生m/z 241.050 6和m/z 225.054 9等一系列大黄素的特征离子。M6、M27与M15的分子离子峰相同, 采用类似的方法进行鉴别, 推测M6、M15、M27为大黄素的葡萄糖醛酸化产物。M22的分子离子峰为m/z 349.001 8 [M-H]-, 在高能量质谱图中, 特征丢失硫酸化分子(80 Da), 产生m/z 269.045 9的子离子, 同时也产生m/z 241.044 2大黄素的特征离子。按照类似方法对其他蒽醌类代谢物进行了推测, 推测M22、M25、M32为大黄素硫酸化结合物; M7、M31为大黄酸葡萄糖醛酸化结合物, M11、M13为大黄酸硫酸化结合物; M24、M28为大黄酚葡萄糖醛酸化结合物, M21、M23、M29为大黄酚硫酸化结合物; M30为6-甲基大黄酸硫酸化结合物。模型给药组大鼠与正常给药组在药物的吸收代谢稍有差异, 课题组前期对铜负荷大鼠病理切片可清晰看出模型大鼠存在一定的肝损伤[7], 可能影响到代谢酶水平。
3 肝豆汤大鼠尿液代谢轮廓分析从上述结果中可看出, 蒽醌类、生物碱类化合物的原形成分及其相关的代谢物为肝豆汤主要原形及代谢物, 这些成分能经尿液代谢排至体外, 在尿液样品中共计检测到22个生物碱类成分, 葡萄糖醛酸化和硫酸化、去甲基化、羟基化等代谢途径是生物碱类成分的重要的代谢方式。在尿液中共计检测到26个蒽醌类成分, 葡萄糖醛酸化和硫酸化为蒽醌类化合物的主要代谢途径。除此之外, 共检测到10种原萜烷型萜类原形成分、4种皂苷原形成分和3种姜黄素类原形成分。
讨论全面有效地检测和鉴定中药复方代谢产物目前仍然存在较大技术挑战[15, 16], 本研究使用UPLC-Q-TOF-MSE技术结合外源性代谢组学技术可快速全面有效筛选出大鼠尿液中原形成分和代谢产物。通过比较直接质谱检测分析发现一些质谱响应较低的峰, 尤其是代谢产物很难进行鉴定, 在直接采用质谱检测时同样因为峰度太低造成遗漏。外源性代谢组学结合UPLC-Q-TOF-MS方法能去除内源性干扰离子, 数据分析过程更加准确便捷, 简化了化合物解析过程, 可作为筛选鉴定体内微量代谢成分的有效工具。
文献报道中药(复方)可以通过配位金属离子促进重金属排出体外, 发挥驱铅、驱铜、排结石等作用。本研究从尿液中检测得到的45个原形成分主要为蒽醌类、黄酮类、生物碱类和原萜烷型萜类化合物, 这几类化合物含有酚羟基、羰基、氨基等配位基团, 能提供一对或多对孤对电子与含有空轨道的金属元素离子发生配位, 如黄酮类化合物槲皮素中的3位羟基和4位羰基与Cu2+络合形成络合物[17], 蒽醌类化合物大黄素[18]、大黄酚[19]、大黄素甲醚[20]均可以与Cu2+发生络合, 生成不同类型的络合物。研究结果表明, 肝豆汤在正常和模型大鼠尿液中的黄酮和蒽醌类化合物可能是其发挥尿液排铜的药效物质基础。
| [1] |
Schilsky ML. A century for progress in the diagnosis of Wilson disease[J]. J Trace Elem Med Biol, 2014, 28: 492-494. DOI:10.1016/j.jtemb.2014.06.016 |
| [2] |
Liu J, Luan J, Zhou X, et al. Epidemiology, diagnosis, and treatment of Wilson's disease[J]. Intractable Rare Dis Res, 2017, 6: 249-255. DOI:10.5582/irdr.2017.01057 |
| [3] |
Wang XP, Yang RM, You Z F, et al. Current drug managements of Wilson's disease:from west to east[J]. Curr Neuropharmacol, 2016, 14: 322-325. DOI:10.2174/1570159X14666151130222427 |
| [4] |
Chinese Medical Association Neurology Branch Parkinson's Disease and Movement Disorders Group, Neurology Group of Neurology Branch of Chinese Medical Association. Guidelines for diagnosis and treatment of Wilson's disease[J]. Chin J Neurol (中华神经科杂志), 2008, 41: 566-569. |
| [5] |
Xue BC, Yang RM, Hu JY. Effect of Gandou Decoction Ⅳ combined with short-term decoppering therapy with sodium dimercapto-sulphonate on serum indexes of hepatic fibrosis in patients with Wilson's disease[J]. Chin J Integr Tradit West Med (中国中西医结合杂志), 2007, 27: 785. |
| [6] |
Li WJ, Wang JF, Wang XP. Wilson's disease:update on integrated Chinese and Western medicine[J]. Chin J Integr Med, 2013, 19: 233-240. DOI:10.1007/s11655-012-1089-8 |
| [7] |
Cheng MM, Wu H, Wu HF, et al. Metabolic profiling of copper-laden hepatolenticular degeneration model rats and the interventional effects of Gandou decoction using UPLC-Q-TOF/MS[J]. J Pharm Biomed Anal, 2019, 164: 187-195. DOI:10.1016/j.jpba.2018.10.041 |
| [8] |
Chen Y, Zhang SH, Wei SS, et al. Identification and analysis of components in Shen-Fu-Shu granule extract and in rat plasma after oral administration by UPLC-ESI/Q-TOF-MS[J]. J Pharm Biomed Anal, 2019, 169: 159-169. DOI:10.1016/j.jpba.2019.03.009 |
| [9] |
Qiao S, Xu HS, Shi XW, et al. Identification of major bioactive components and their metabolites in rat plasma after oral administration of Zhikebao tablet by UHPLC-QTOF-MS[J]. Acta Pharm Sin (药学学报), 2018, 53: 1536-1544. |
| [10] |
Shi PY, Lin XH, Yao H. A comprehensive review of recent studies on pharmacokinetics of traditional Chinese medicines (2014-2017) and perspectives[J]. Drug Metab Rev, 2018, 50: 161-192. DOI:10.1080/03602532.2017.1417424 |
| [11] |
Bonnefille B, Arpin-Pont L, Gomez E, et al. Metabolic profiling identification of metabolites formed in Mediterranean mussels (Mytilus galloprovincialis) after diclofenac exposure[J]. Sci Total Environ, 2017, 583: 257-268. DOI:10.1016/j.scitotenv.2017.01.063 |
| [12] |
Jeong ES, Kim G, Yim D, et al. Identification and characterization of amiodarone metabolites in rats using UPLC-ESI-QTOFMS-based untargeted metabolomics approach[J]. J Toxicol Environ Health A, 2018, 81: 481-492. DOI:10.1080/15287394.2018.1460783 |
| [13] |
Xu Li, Liu Y, Wu HF, et al. Rapid identification of chemical profile in Gandou decoction by UPLC-Q-TOF-MSE coupled with novel informatics UNIFI platform[J]. J Pharm Anal, 2019. DOI:10.1016/j.jpha.2019.05.003 |
| [14] |
Liu Y, Cheng MM, Dong JJ, et al. Intestinal absorptive characteristics of ingredients from ethanol extracts of Gandou decoction by rat everted intestinal sac models[J]. China J Chin Mater Med (中国中药杂志), 2017, 42: 2571-2576. |
| [15] |
Qiao S, Xu HS, Shi XW, et al. Identification of major bioactive components and their metabolites in rat plasma after oral administration of Zhikebao tablet by UHPLC-QTOF-MS[J]. Acta Pharm Sin (药学学报), 2018, 53: 154-162. |
| [16] |
Cheng YX, Chen LM, Wang ZM, et al. Analysis of major bioactive components and their metabolites in rats' plasma, urine and feces after oral administration of the aqueous extract of Euodiae Fructus by UHPLC-QTOF-MS[J]. Acta Pharm Sin (药学学报), 2017, 52: 145-152. |
| [17] |
Zhang LL, Liu YC, Wang YM, et al. UV-Vis spectroscopy combined with chemometric study on the interactions of three dietary flavonoids with copper ions[J]. Food Chem, 2018, 263: 208-215. DOI:10.1016/j.foodchem.2018.05.009 |
| [18] |
Mandal B, Singha S, Dey SK, et al. Cu II complex of emodin with improved anticancer activity as demonstrated by its performance on HeLa and HepG2 cells[J]. RSC Adv, 2017, 7: 41403-41418. DOI:10.1039/C7RA06696A |
| [19] |
Qiao CY, Bi SY, Sun Y, et al. Study of interactions of anthraquinones with DNA using ethidium bromide as a fluorescence probe[J]. Spectrochim Acta A Mol Biomol Spectrosc, 2008, 70: 136-143. DOI:10.1016/j.saa.2007.07.038 |
| [20] |
Barik A, Mishra B, Kunwar A, et al. Comparative study of copper (Ⅱ)-curcumin complexes as superoxide dismutase mimics and free radical scavengers[J]. Eur J Med Chem, 2007, 42: 431-439. DOI:10.1016/j.ejmech.2006.11.012 |
 2020, Vol. 55
2020, Vol. 55


