2. 山西大学化学化工学院, 山西 太原 030006;
3. 中国医学科学院药物研究所, 北京 100050
2. College of Chemistry and Chemical Engineering, Shanxi University, Taiyuan 030006, China;
3. Institute of Materia Medica, Chinese Academy of Medical Sciences, Beijing 100050, China
抑郁症是一种普遍的精神疾病。根据世界卫生组织发表的一份报告, 到2020年, 抑郁症将成为危害人类身心健康的第二大疾病, 排在心血管疾病之后[1]。全球疾病负担研究结果显示, 到2030年, 抑郁症将成为世界残疾的主要原因[2]。目前, 多数关于抑郁症的研究主要集中在海马、额叶皮质和纹状体等中枢神经系统[3, 4], 对其他器官的研究较少。然而, 肝脏是机体物质代谢和能量代谢的中心。此外, 中医理论认为抑郁由“肝气郁结”引起, 缓解“肝气郁结”被认为是治疗抑郁的有效疗法[5]。最近的研究也表明, 慢性不可预知温和应激抑郁(chronic unpredictable mild stress, CUMS)造模会导致肝组织代谢轮廓和基因表达的一系列改变, 这可能是抑郁症发病的一个潜在作用机制[6, 7]。因此, 补充、加强抑郁症在肝脏组织的研究对于解释抑郁症的发病机制至关重要。
柴胡-白芍是疏肝解郁、调畅情志最基本的配伍药对, 为多个“疏肝解郁”名方如《太平惠明和剂局方》中逍遥散、《景岳全书》中柴胡疏肝散、《伤寒论》中四逆散等的基础药物, 方中柴胡为君药, 白芍为臣药。从中医理论来讲, 柴胡轻清辛散, 透表泄热, 疏肝解郁; 白芍酸寒收敛, 敛津液而护营血, 养血以柔肝, 两者同归肝经[8]。两药伍用以白芍之酸敛, 制柴胡之辛散; 用柴胡之辛散, 又佐白芍之酸敛, 是“疏肝解郁”方中的最佳配伍。近年来, 柴胡-白芍的抗抑郁作用也有众多的文献支持: Zhu等[9]运用代谢组学技术证明了柴胡-白芍药对在逍遥散抗抑郁方面中的核心地位; Luo等[10]发现柴胡-白芍药对能通过cAMP-CREB-BDNF通路发挥抗抑郁作用; Wang等[11]发现柴胡-白芍药对对利血平拮抗模型小鼠中单胺能神经递质系统有显著的调节功能, 具有极好的抗抑郁样作用。但作为“疏肝解郁”方中核心药对-柴胡-白芍药对对肝组织代谢轮廓的调节作用尚没有文献报道。
代谢组学是系统生物学的重要平台, 主要研究内源性小分子代谢物在机体整体水平的代谢状况, 这为同样强调整体性调节的中药复方研究提供了新思路[12]。在抑郁症的研究方面, 代谢组学为抑郁症的病理学研究提供了新的见解, 包括潜在诊断指标[13, 14]、疾病潜在生物标志物[15]和药物潜在作用机制[16]等的发现。CUMS模型是抑郁症研究中最常用、最可靠、最有效的模型, 也是最接近人类抑郁自然发病过程的啮齿动物模型[17], 关于CUMS抑郁模型的代谢组学研究主要集中在尿液、血清、海马和心脏, 这为抑郁的发病机制和药物治疗机制提供了宝贵的意见, 然而针对肝组织的研究相对较少[6, 7]。本研究结合抑郁症的传统药效学和LC-MS肝组织代谢组学技术, 阐述柴胡-白芍药对对CUMS抑郁大鼠的治疗作用和对肝组织代谢轮廓的调节作用, 以揭示柴胡-白芍药对“疏肝解郁”的潜在作用机制。
材料与方法仪器及试剂 超高效液相色谱-质谱联用仪(Thermo-Fisher Dionex UltiMate 3000 UHPLC-Q Exactive Orbitrap-MS)、Xcalibur工作站(美国Thermo公司); 色谱柱: ACQUITY UPLC HSS T3 (2.1 mm×100 mm, 1.8 μm) (美国Waters公司); Legend Micro 17R高速台式冷冻离心机(美国Thermo公司); 氮吹浓缩仪、冷冻干燥机(上海屹尧仪器科技发展有限公司); 旋转蒸发仪(德国IKA集团); 蔗糖(天津市风船化学试剂科技有限公司); HPLC级乙腈、HPLC级甲酸、HPLC级甲醇(美国Thermo公司)。
药物 柴胡(批号: 1708255131, 产地河北)、白芍(批号: 1710436111, 产地安徽)药材均购于山西和仁堂中药饮片有限公司; 盐酸文拉法辛胶囊(规格: 25 mg/粒, 批号: 130101, 厂家:成都康弘药业集团股份有限公司)。
动物 雄性SPF级SD大鼠(180 ± 20 g)购于北京维通利华实验动物技术有限公司, 许可证号: SCXK(京) 2016-0006。实验期间饲养环境温度为(24 ± 1) ℃, 湿度为(50 ± 5) %, 12 h明暗交替光照, 动物保持自由饮水和进食。实验前适应性饲养1周。动物实验获得山西大学伦理委员会的批准(批准号: SXULL2016036)。
药物制备 将柴胡-白芍药对(1:1)在10倍量70%乙醇中浸泡1 h, 然后回流提取2次, 每次1.5 h, 合并提取液, 静置过滤后将滤液旋转浓缩, 冷冻干燥, 并制成粉末备用, 称量所得粉末质量, 计算产率(柴胡-白芍药对提取物的浸膏率为13.60%), 4 ℃冰箱低温保存备用。
分组与给药 将50只大鼠随机分为5组(n = 10), 即正常对照组(Control), CUMS模型组(CUMS), 文拉法辛阳性药组(VLF, 盐酸文拉法辛35 mg·kg-1), 柴胡-白芍药对高、低剂量组(H-BP、L-BP生药量15、7.5 g·kg-1) (给药量依据课题组前期研究基础[9])。各给药组按照10 mL·kg-1对大鼠进行灌胃给药, 正常对照组、模型组给予同等体积的蒸馏水, 连续28天。
CUMS抑郁模型的复制 CUMS抑郁模型的建立如先前报道中所述[2]。正常对照组大鼠正常饲养, 不接受任何刺激。CUMS模型组和各给药组大鼠每天随机暴露于各种慢性不可预知性轻度刺激, 主要包括4 ℃冰水游泳(5 min)、45 ℃热刺激(10 min)、60分贝超声刺激(3 h)、夹尾(2 min)、昼夜颠倒(12 h/12 h)、足底电击(电压为32 V, 每隔10 s电击一次, 每次持续2 s, 共10次)、禁水(24 h)、禁食(24 h)和空瓶束缚(2 h)。适应性饲养1周后, 进行28天CUMS造模程序和药物治疗。
行为学检测糖水偏爱实验(SPT) 如先前研究所述[18], 在实验之前, 给予每只大鼠1%蔗水溶液和日常饮用水用于糖水偏爱训练实验。每只大鼠(单笼饲养)饲养笼放置2个水瓶。首先, 在最初的24 h内给予两瓶1%蔗糖溶液。其次, 在第2个24 h内给予一瓶1%蔗糖水溶液和另一瓶日常饮用水以训练所有大鼠。在训练结束后, 所有大鼠禁食禁水24 h, 之后在12 h内测定糖水消耗量, 在测试期间大鼠可自由选择1%蔗糖水溶液或水。在第0天进行糖水偏爱率的基线测定, 在第28天进行糖水偏爱实验。测量实验前后水瓶的重量以计算大鼠的糖水偏爱率。糖水偏爱率=消耗的蔗糖水溶液的重量/(消耗的蔗糖水溶液的重量+消耗日常饮用水的重量)。
旷场实验(OFT) 如先前研究所述[18], 旷场实验装置的底部(100 cm×100 cm×40 cm)被等分成25个正方形, 并保证在相对安静的环境里(≤60分贝)从上午8:00至中午12:00进行旷场实验测试。测试在实验进行中的第0、7、14、21、28天。首先, 将大鼠置于旷场实验装置中1 min以适应环境。观察大鼠穿越格数(至少3只爪子跨过网格线)和直立次数(两前肢距离地面至少1 cm)。适应环境1 min后, 记录4 min内的大鼠的穿越格数和直立次数。同时记录所有大鼠的体重。
强迫游泳实验(FST) 如先前所述进行强迫游泳实验[18], 实验装置为高50 cm, 直径20 cm的圆柱形有机玻璃容器, 温度25 ± 1 ℃, 水深30 cm。在实验后的第28天, 每只大鼠接受15 min的强迫游泳训练, 并在第29天进行强迫游泳实验。每只大鼠进行强迫游泳实验6 min, 在最后4 min记录不动时间。大鼠保持头部悬浮在水面上并且无明显挣扎的时间定义为不动时间。
肝组织样本的收集 在最后一次给药24 h后, 麻醉大鼠后进行腹主动脉取血。收集肝组织并立刻置于液氮中, 并在-80 ℃冰箱冷冻保存直至LC-MS分析。
LC-MS代谢组学数据收集LC-MS肝组织样本的制备 将肝组织样本从-80 ℃冰箱取出, 于4 ℃下解冻。借鉴Ioanna's[19]肝组织代谢组学样本制备的方法处理样本。简言之, 将80 mg肝组织样品在预冷的甲醇/水(1:1, 300 µL)中匀浆1 min, 涡旋2 min, 并在4 ℃下以13 000 r·min-1离心15 min, 取上清液并转移至1.5 mL Eppendorf管中。以相同方式再次提取沉淀物, 将两次提取的上清液合并在一起, 混合上清液在氮气下吹干。进样分析前将吹干后的提取物于300 µL甲醇-水(4:1)中复溶, 涡旋5 min, 并在4 ℃下以13 000 r·min-1离心15 min, 取250 µL上清液待进样分析。另取上述测试样品上清液各10 µL并充分混合, 用于质量控制(QC)样品。进样时每5个样品插入一个QC样品, 以检查仪器的稳定性和性能。
LC-MS分析液相条件 流动相: A (含1%的甲酸水溶液), B (含1%的甲酸乙腈溶液); 流动相梯度: 0~0.5 min, 1% B; 0.5~3.5 min, 1% B~53% B; 3.5~7.5 min, 53% B~70% B; 7.5~9 min, 70% B~90% B; 9~13 min, 90% B; 13~14 min, 90%~1% B; 14~16 min, 1% B。流速0.3 mL·min-1, 进样量5 µL, 柱温35 ℃, 色谱柱: ACQUITY UPLC HSS T3 (2.1 mm×100 mm, 1.8 μm)。
LC-MS分析质谱条件 采用加热电喷雾电离(HESI)方法; 正负离子切换采集模式, 扫描模式: Full Scan/dd-MS2; 喷雾电压正负极分别为3.5 kV、2.5 kV; 毛细管温度, 320 ℃; 鞘气流速: 35 arb, 辅助气流速: 10 arb; m/z采集范围100~1 500 Da。
LC-MS数据处理 将获得的LC-MS/MS原始数据导入Compound Discoverer 2.0软件(Thermo公司, 美国)以获得匹配和对齐的峰值数据。主要参数为:质量范围100~1 500 Da; 质量偏差5 ppm; 信噪比阈值3。将从Compound Discoverer 2.0软件导出的数据在Excel 2007中进行总峰面积归一化处理, 并将归一化后的数据导入SIMCA-P 14.1软件(Umetrics公司, 瑞典)进行主成分分析(PCA), 偏最小二乘法判别分析(PLS-DA)和正交偏最小二乘法判别分析(OPLS-DA)。结合S-plot图中VIP > 1及t检验(P < 0.05)筛选正常对照组与模型组之间显著改变的差异变量。根据在线数据库并结合二级碎片离子对筛选出的差异变量进行指认鉴定: Metlin (http://metlin.scripps.edu), HMDB (http://www.hmdb.ca), Massbank (http://www.massbank.jp), Pubchem (https://pubchem.ncbi.nlm.nih.gov/), Lipid Maps (http://www.silvermaps.org)。使用Met PA (http://metpa.metabolomics.ca)进行代谢通路富集分析, 并使用KEGG (http://www.kegg.jp)及相关文献报道对生物标志物所涉及的代谢通路进行分析。
统计学分析 采用SPSS 16.0软件进行统计分析, 各组实验数据均用x±s表示。通过t检验比较两组之间的统计学差异, 并通过one-way ANOVA比较多组之间的统计学差异。P < 0.05被认为数据之间存在显著性差异。
结果 1 行为学检测 1.1 体重实验第0天, 各组别之间没有明显的差异。第28天, 与正常对照组相比, CUMS模型组大鼠体重显著减轻(P < 0.01);给药治疗后, 与CUMS模型组相比, 柴胡-白芍药对高、低剂量组(P < 0.01, P < 0.01), 文拉法辛组大鼠体重均显著性增加(图 1B)。表明柴胡-白芍药对能有效逆转CUMS造模引起的体重减轻。
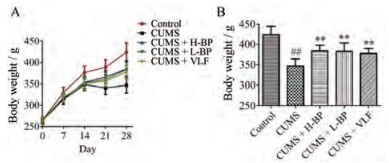
|
Figure 1 Effects of H-BP, L-BP, VLF on body weight; Trend of body weight in 28 days (A) and body weight of rat on 28 day (B). n = 8, x± s. ##P < 0.01 vs Control; **P < 0.01 vs CUMS. CUMS: Chronic unpredictable mild stress; H-BP: High-dose Radix Bupleuri-Radix Paeoniae Alba herb pair group; L-BP: Low-dose Radix Bupleuri-Radix Paeoniae Alba herb pair group; VLF: Venlafaxine-treated group |
第28天, 与正常对照组相比, CUMS模型组大鼠的穿越格数, 直立次数显著减少(P < 0.01, P < 0.01), 表明CUMS模型成功复制; 给予药物后, 与CUMS模型组大鼠相比, 柴胡-白芍药对高、低剂量组(P < 0.01, P < 0.05)、文拉法辛组(P < 0.01)穿越格数均显著性增加(图 2A); 同样, 给予药物后, 与CUMS模型组大鼠相比, 柴胡-白芍药对高、低剂量组(P < 0.01, P < 0.05)、文拉法辛组(P < 0.01)直立次数亦均显著性增加(图 2B)。结果说明, 柴胡-白芍药对能显著改善抑郁大鼠的旷场活动情况, 且高剂量组效果较优。

|
Figure 2 Effects of H-BP, L-BP and VLF on crossing (A) and rearing (B) in open field test. n = 8, x± s. ##P < 0.01 vs Control; *P < 0.05, **P < 0.01 vs CUMS |
第28天, 与正常对照组相比, CUMS模型组大鼠糖水偏爱率显著性降低(P < 0.01)。给予药物后, 与CUMS模型组大鼠相比, 柴胡-白芍药对高、低剂量组(P < 0.01, P < 0.01)、文拉法辛组(P < 0.01)糖水偏爱率均显著性升高(图 3A)。结果表明, 柴胡-白芍药对能显著逆转抑郁大鼠的快感缺失现象。

|
Figure 3 Effects of H-BP, L-BP and VLF in the sucrose preference test (A) and the forced swimming test (FST, B). n = 8, x± s. ##P < 0.01 vs Control; **P < 0.01 vs CUMS |
第28天, 与正常对照组相比, CUMS模型组大鼠强迫游泳不动时间显著性延长(P < 0.01);给予药物后, 与CUMS模型组相比, 柴胡-白芍药对高、低剂量组(P < 0.01, P < 0.01)、文拉法辛组(P < 0.01)强迫游泳不动时间显著性降低(图 3B)。结果说明柴胡-白芍药对能显著逆转抑郁大鼠的行为绝望现象, 柴胡-白芍药对具有显著的抗抑郁作用。
2 LC-MS代谢组学 2.1 仪器系统稳定性监测通过UPLC-MS/MS正、负离子模式获得的大鼠肝组织样品基峰离子流色谱图如图 4所示。此外, 在批量进样时每进5针样品插入一针QC样品, 以检查仪器的稳定性和性能。采用无监督的PCA方法对QC样品进行聚类分析, 并从8针QC样品中随机提取10个离子, 通过计算10个离子保留时间(tR)、相对峰面积(relative peak area)的RSD值来考察仪器系统稳定性。结果显示, 在PCA得分图中, 所有QC样品较密集的聚集在一起(图 5A), 此外, 10个提取离子tR, 相对峰面积的RSD分别为0.03%~0.55%, 1.94%~9.17% (表 1), 结果表明, 所建立的分析方法稳定可靠, 能满足大批量样本进样的分析要求。
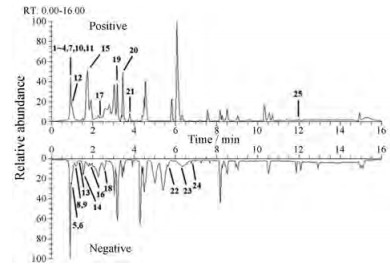
|
Figure 4 UPLC-MS/MS base peak chromatograms of liver tissue samples. Differential metabolites between CUMS group and Control group were labeled by numbers. The differential metabolites represented by the numbers in the figure are consistent with the differential metabolites represented by the numbers in Table 2 |
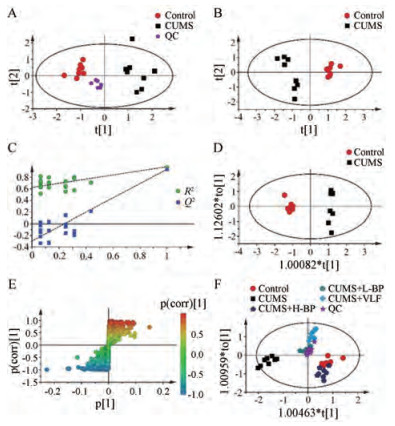
|
Figure 5 Multivariate data analysis from UPLC-MS/MS. A: PCA score plots from control group, CUMS group and QC samples; B: PCA score plots from control group and CUMS group; C: PLS-DA model validation diagram; D: OPLS-DA score plots from control group and CUMS group; E: S-plot of OPLS-DA; F: OPLS-DA score plots from control group, CUMS group, CUMS + H-BP group, CUMS + L-BP group and CUMS + VLF group |
| Table 1 The stability of UHPLC-MS method using QC sample. n = 8 |
首先应用无监督的PCA模式, 从得分散点图可以看出正常对照组和CUMS模型组可明显分开(图 5B), 表明抑郁症疾病对机体肝组织内源性代谢轮廓产生影响; 构建PLS-DA模型验证实验(图 5C), 通过参数R2X、R2Y、Q2分析模型的可靠性和过度拟合程度。PLS-DA模型的R2X = 0.431, R2Y= 0.984, Q2 = 0.915, 表明模型稳健良好, 不存在过拟合现象; 对正常对照组和CUMS模型组进行有监督的OPLS-DA分析, 以筛选出与抑郁症相关的差异变量。OPLS-DA得分图显示正常对照组和CUMS模型组可明显分开(图 5D), 并结合S-plot图(图 5E)中VIP > 1, 及t检验(P < 0.05)筛选正常对照组与CUMS模型组之间显著改变的差异变量。对正常对照组、CUMS模型组、柴胡-白芍高低剂量组、文拉法辛组、QC样本进行OPLS-DA分析, 图 5F中可以看出QC样本聚类良好, 说明本次实验数据稳定可靠, 同时正常对照组、CUMS模型组和各给药组之间能清楚的分离, 同组间样本可紧密聚集成簇, 提示各给药组调节肝组织内源性代谢物的种类、程度可能不同。
2.3 差异代谢物分析根据质荷比, 保留时间, 分子式, 二级碎片离子并结合在线数据库(如Metlin, HMDB, Massbank, Pubchem, Lipid Maps), 对正常对照组与CUMS模型组之间显著改变的差异变量进行鉴定指认, 共鉴定指认出25个与抑郁症相关的潜在生物标志物(表 2)。与正常对照组相比, CUMS模型组大鼠肝脏中肌酸、抗坏血酸、富马酸、柠檬酸、4-香豆酸、谷氨酸、尿嘧啶、4-氧代脯氨酸、L-正亮氨酸、酪氨酸、3'-腺苷、色氨酸、牛磺酸脱氧胆酸、花生四烯酸14种代谢物含量显著升高; 鸟氨酸、赖氨酸、2-己烯基肉碱、氨基甲酰磷酸、α-酮戊二酸、烟酰胺、精氨酸、L-谷胱甘肽、泛酸、甘氨酸、甘油脱氧胆酸11种代谢物含量显著降低。与模型组比较, 柴胡-白芍药对高剂量组能显著回调16种代谢物, 包括鸟氨酸、赖氨酸、2-己烯基肉碱、抗坏血酸、氨基甲酰磷酸、α-酮戊二酸、烟酰胺、谷氨酸、尿嘧啶、精氨酸、L-谷胱甘肽、3'-腺苷、泛酸、色氨酸、牛磺酸脱氧胆酸、花生四烯酸(图 6); 柴胡-白芍药对低剂量组能显著回调其中的11种代谢物, 包括鸟氨酸、赖氨酸、2-己烯基肉碱、氨基甲酰磷酸、谷氨酸、尿嘧啶、L-谷胱甘肽、3'-腺苷、色氨酸、牛磺酸脱氧胆酸、花生四烯酸。
| Table 2 Differential metabolites associated with depression were detected by UPLC-MS/MS. CUMS/Control: CUMS group compared with Control group; *P < 0.05, **P < 0.01 vs Control; "↓" or "↑" means the metabolite significantly decreased or increased in CUMS group compared with control group; VIP: Variable importance value |
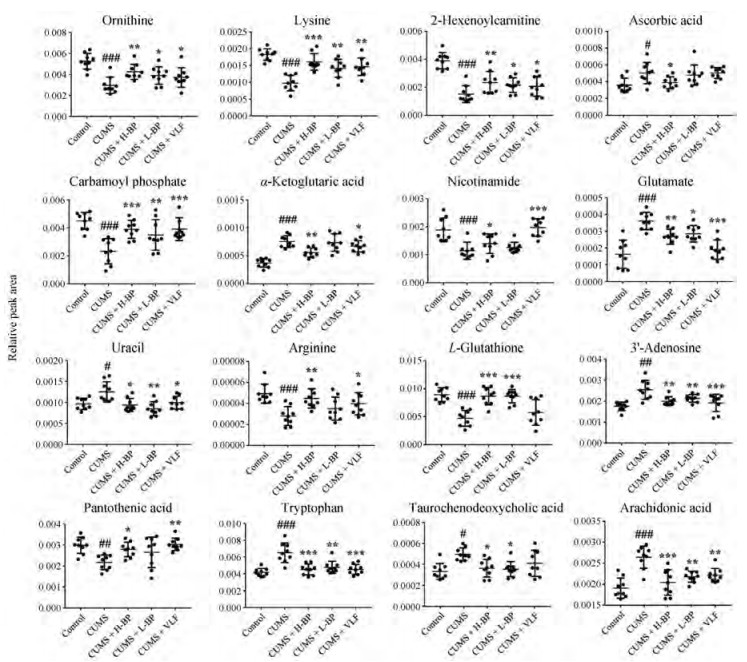
|
Figure 6 Comparison of relative peak areas of the potential biomarkers in UPLC-MS/MS associated with BP treatment. n = 8, ± s. #P < 0.05, ##P < 0.01, ###P < 0.001 vs Control; *P < 0.05, **P < 0.01, ***P < 0.001 vs CUMS |
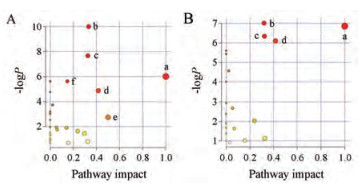
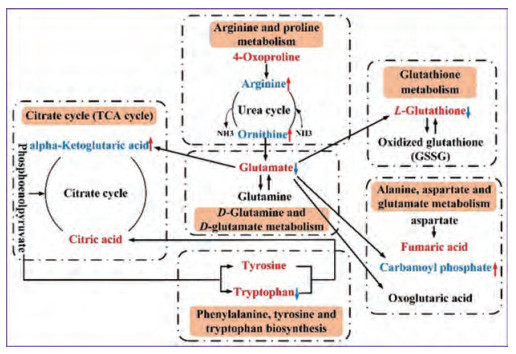
将通过LC-MS/MS代谢组学技术找到的25个与抑郁症相关的潜在生物标志物以及柴胡-白芍药对显著回调的16种生物标志物导入Metabo analyst数据库中进行代谢通路分析。代谢通路影响值(impact value) > 0.1以及代谢通路的显著性水平(-logP) > 2的通路被视为贡献值最大的代谢通路。共筛选得到6条与抑郁显著相关的代谢通路(图 7A), 主要包括D-谷氨酰胺和D-谷氨酸代谢; 精氨酸和脯氨酸代谢; 丙氨酸、天冬氨酸和谷氨酸代谢; 谷胱甘肽代谢; 苯丙氨酸、酪氨酸和色氨酸生物合成; 三羧酸循环。在CUMS模型影响的6条代谢通路中, 柴胡-白芍药对能调节其中的4条(图 7B), 主要包括D-谷氨酰胺和D-谷氨酸代谢; 精氨酸和脯氨酸代谢; 丙氨酸、天冬氨酸和谷氨酸代谢; 谷胱甘肽代谢。利用KEGG数据库对与抑郁症相关的6条代谢通路及所涉及的生物标志物进行关联分析(图 8), 以探讨生物标志物之间的相关性。可见各种代谢通路与生物标志物之间相互关联, 证明了抑郁症发病机制的复杂性及柴胡-白芍药对整体性调节的特点。
|
Figure 7 Summary diagram of pathway analysis with Met-PA. A: The metabolic pathways associated with depression; B: Regulation of metabolic pathway of BP. a: D-Glutamine and D-glutamate metabolism; b: Arginine and proline metabolism; c: Alanine, aspartate and glutamate metabolism; d: Glutathione metabolism; e: Phenylalanine, tyrosine and tryptophan biosynthesis; f: Citrate cycle (TCA cycle) |
|
Figure 8 The metabolic network involved in 6 metabolic pathways associated with depression; red fonts represent up-regulated metabolites, and blue fonts represent down-regulated metabolites in CUMS group vs control group; "↓" or "↑" means the metabolite significantly decreased or increased in BP group vs CUMS group |
柴胡、白芍配伍使用始载于汉代张仲景的《伤寒论》中, 为众多“疏肝解郁”组方中最基本的配伍药对。本研究以CUMS模型大鼠为研究对象, 探讨柴胡-白芍药对抗抑郁的作用机制。利用大鼠体重变化、穿越格数和直立次数、糖水偏爱率、强迫游泳不动时间等抑郁症常规指标对柴胡-白芍药对进行药效学评价, 同时运用代谢组学技术对大鼠肝组织样本进行代谢轮廓分析, 阐述柴胡-白芍药对“疏肝解郁”的潜在药理机制。通过代谢组学技术共鉴定了25种与抑郁相关的肝脏生物标志物, 柴胡-白芍药对干预后能显著回调其中的16种。通过代谢通路富集分析, 柴胡-白芍药对主要通过改善D-谷氨酰胺和D-谷氨酸代谢, 精氨酸和脯氨酸代谢, 丙氨酸、天冬氨酸和谷氨酸代谢, 谷胱甘肽代谢发挥抗抑郁作用。
谷氨酸是一种重要的兴奋性神经递质, 而谷氨酸含量的异常升高会诱发神经毒性[20]。在抑郁症患者中, 常观察到谷氨酸水平的升高[21], 此外, 也有研究证实, 机体中谷氨酸水平与抑郁症的严重程度成正相关性[22]。而谷氨酰胺可通过谷氨酰胺酶的作用下生成谷氨酸, 丙氨酸也可通过丙氨酸转氨酶的作用下转化为谷氨酸, 本研究发现CUMS抑郁模型大鼠中谷氨酸含量升高, 代谢通路分析结果也表明CUMS造模可引起大鼠体内D-谷氨酰胺和D-谷氨酸代谢及丙氨酸、天冬氨酸和谷氨酸代谢通路紊乱。谷氨酸含量的升高和上述两种代谢通路的紊乱都可被柴胡-白芍药对所逆转, 提示柴胡-白芍药对可能通过调节D-谷氨酰胺和D-谷氨酸代谢及丙氨酸、天冬氨酸和谷氨酸代谢来抑制谷氨酸介导的神经毒性发挥抗抑郁作用。
在肝脏中, 精氨酸能加强尿素循环中氨的解毒能力, 加速机体血氨转化为尿素, 维持体内氨平衡, 以抑制肝性脑病的发生[23]。有研究表明, 肝性脑病患者与抑郁相关症状之间存在着统计学显著相关, 肝性脑病可能是诱发抑郁症的一个潜在因素[24]。此外, 也有研究证实, 肝性脑病会损害星形胶质细胞功能并降低大鼠海马中的BDNF[25], 而BDNF是一种与抑郁症显著相关的神经营养因子[26]。本研究发现CUMS模型可扰乱大鼠体内精氨酸和脯氨酸代谢, 使精氨酸含量降低, 这与先前文献报道一致[27, 28], 当给予抑郁大鼠柴胡-白芍药对后, 大鼠体内精氨酸含量显著回调, 提示柴胡-白芍药对通过调节精氨酸和脯氨酸代谢发挥抗抑郁作用。
谷胱甘肽是一种含巯基小分子化合物, 由半胱氨酸、谷氨酸和甘氨酸三种氨基酸组成, 不仅参与抵御氧化应激, 维持机体氧化还原平衡, 还参与调节细胞增生、免疫应答以及在神经系统中充当神经递质的作用等[29]。本研究发现CUMS模型可引起大鼠体内谷胱甘肽含量的下降, 说明CUMS造模程序削弱了大鼠肝组织中抵御氧化应激的能力, 大鼠体内氧化还原平衡被打破。当给予抑郁大鼠柴胡-白芍药对后, 大鼠体内谷胱甘肽的含量显著性提高。提示柴胡-白芍药对通过调节谷胱甘肽代谢增强体内抗氧化能力发挥抗抑郁作用。
综上所述, 柴胡-白芍药对对CUMS诱导的抑郁症有明显的改善作用, 其发挥抗抑郁作用的潜在机制涉及抑制谷氨酸介导的神经毒性、增强解毒氨的能力以预防肝性脑病的发生和增强体内抗氧化能力。
| [1] |
Ramos M, Berrogain C, Concha J, et al. Pharmacogenetic studies:a tool to improve antidepressant therapy[J]. Drug Metab Pers Ther, 2016, 31: 197-204. DOI:10.1515/dmpt-2016-0019 |
| [2] |
Smith K. Mental health:a world of depression[J]. Nature, 2014, 515: 180-181. DOI:10.1038/515180a |
| [3] |
Macmaster FP, Carrey N, Langevin LM, et al. Disorder-specific volumetric brain difference in adolescent major depressive disorder and bipolar depression[J]. Brain Imaging Behav, 2014, 8: 119-127. DOI:10.1007/s11682-013-9264-x |
| [4] |
Che Y, Zhou Z, Shu Y, et al. Chronic unpredictable stress impairs endogenous antioxidant defense in rat brain[J]. Neurosci Lett, 2015, 584: 208-213. DOI:10.1016/j.neulet.2014.10.031 |
| [5] |
Scheid V. Depression, constraint, and the liver:(Dis) assembling the treatment of emotion-related disorders in Chinese medicine[J]. Cult Med Psychiatry, 2013, 37: 30-58. DOI:10.1007/s11013-012-9290-y |
| [6] |
Jia HM, Li Q, Zhou C, et al. Chronic unpredictive mild stress leads to altered hepatic metabolic profile and gene expression[J]. Sci Rep, 2016, 6: 23441. DOI:10.1038/srep23441 |
| [7] |
Jia HM, Yu M, Ma LY, et al. Chaihu-Shu-Gan-San regulates phospholipids and bile acid metabolism against hepatic injury induced by chronic unpredictable stress in rat[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2017, 1064: 14-21. DOI:10.1016/j.jchromb.2017.08.003 |
| [8] |
Chen SL, Chen DX. Clinical application of combined use of Radix Bupleuri and Radix Paeoniae Alba[J]. Shanghai J Tradit Chin Med (上海中医药杂志), 2007, 41: 71-74. |
| [9] |
Zhu SW, Gong WX, Chen CC, et al. The contribution of Radix Bupleuri-Radix Paeoniae Alba herb Pair to Xiaoyaosan based on 1H NMR metabolomics[J]. Acta Pharm Sin (药学学报), 2019, 54: 720-728. |
| [10] |
Luo MC, Liang R, Gao SM, et al. Based on cAMP-CREB-BDNF pathway to explore mechanism of antidepressant effect of Bupleuri Radix and Paeoniae Alba Radix drug pair[J]. Chin Tradit Herb Drugs (中草药), 2018, 49: 4093-4098. |
| [11] |
Wang Y, Gao SM, Li R, et al. Antidepressant-like effects of the Radix Bupleuri and Radix Paeoniae Alba drug pair[J]. Neurosci Lett, 2016, 633: 14-20. DOI:10.1016/j.neulet.2016.09.001 |
| [12] |
Wu G, Zhang W, Li H. Application of metabolomics for unveiling the therapeutic role of traditional Chinese medicine in metabolic diseases[J]. J Ethnopharmacol, 2019, 242: 112057. DOI:10.1016/j.jep.2019.112057 |
| [13] |
Zheng P, Gao HC, Li Q, et al. Plasma metabonomics as a novel diagnostic approach for major depressive disorder[J]. J Proteome Res, 2012, 11: 1741-1748. DOI:10.1021/pr2010082 |
| [14] |
Kaddurah-Daouk R, Boyle SH, Matson W, et al. Pretreatment metabotype as a predictor of response to sertraline or placebo in depressed outpatients:a proof of concept[J]. Transl Psychiatry, 2011, 1: e26. DOI:10.1038/tp.2011.22 |
| [15] |
Willner P, Towell A, Sampson D, et al. Reduction of sucrose preference by chronic unpredictable mild stress, and its restoration by a tricyclic antidepressant[J]. Psychopharmacology, 1987, 93: 358-364. DOI:10.1007/BF00187257 |
| [16] |
Kaddurah-Daouk R, Yuan P, Boyle SH, et al. Cerebrospinal fluid metabolome in mood disorders-remission state has a unique metabolic profile[J]. Sci Rep, 2012, 2: 667. DOI:10.1038/srep00667 |
| [17] |
Antoniuk S, Bijata M, Ponimaskin E, et al. Chronic unpredictable mild stress for modeling depression in rodents:meta-analysis of model reliability[J]. Neurosci Biobehav Rev, 2019, 99: 101-116. DOI:10.1016/j.neubiorev.2018.12.002 |
| [18] |
Gong WX, Zhu SW, Chen CC, et al. The anti-depression effect of Angelicae Sinensis Radix is related to the pharmacological activity of modulating the hematological anomalies[J]. Front Pharmacol, 2019, 10: 192. DOI:10.3389/fphar.2019.00192 |
| [19] |
Dagla I, Benaki D, Baira E, et al. Alteration in the liver metabolome of rats with metabolic syndrome after treatment with Hydroxytyrosol. A mass spectrometry and nuclear magnetic resonance-based metabolomics study[J]. Talanta, 2017, 178: 246-257. |
| [20] |
Gonçalves-Ribeiro J, Pina CC, Sebastião AM, et al. Glutamate transporters in hippocampal LTD/LTP:not just prevention of excitotoxicity[J]. Front Cell Neurosci, 2019, 13: 357. |
| [21] |
Levine J, Panchalingam K, Rapoport A, et al. Increased cerebrospinal Fluid glutamine levels in depressed patients[J]. Biol Psychiatry, 2000, 47: 586-593. DOI:10.1016/S0006-3223(99)00284-X |
| [22] |
Mitani H, Shirayama Y, Yamada T, et al. Correlation between plasma levels of glutamate, alanine and serine with severity of depression[J]. Prog Neuropsychopharmacol Biol Psychiatry, 2006, 30: 1155-1158. DOI:10.1016/j.pnpbp.2006.03.036 |
| [23] |
Wijdicks EF. Hepatic encephalopathy[J]. N Engl J Med, 2016, 375: 1660-1670. DOI:10.1056/NEJMra1600561 |
| [24] |
Telles-Correia D, João Freire M, Mega I, et al. Anxiety and depression symptoms in hepatic encephalopathy:are they psychiatric or organic?[J]. Transplant Proc, 2015, 47: 1005-1007. DOI:10.1016/j.transproceed.2015.03.011 |
| [25] |
Galland F, Negri E, Da Ré C, et al. Hyperammonemia compromises glutamate metabolism and reduces BDNF in the rat hippocampus[J]. Neurotoxicology, 2017, 62: 46-55. DOI:10.1016/j.neuro.2017.05.006 |
| [26] |
Oh H, Piantadosi SC, Rocco BR, et al. The role of dendritic brain-derived neurotrophic factor transcripts on altered inhibitory circuitry in depression[J]. Biol Psychiatry, 2019, 85: 517-526. DOI:10.1016/j.biopsych.2018.09.026 |
| [27] |
Hess S, Baker G, Gyenes G, et al. Decreased serum L-arginine and L-citrulline levels in major depression[J]. Psychopharmacology, 2017, 234: 3241-3247. DOI:10.1007/s00213-017-4712-8 |
| [28] |
Ali-Sisto T, Tolmunen T, Viinamäki H, et al. Global arginine bioavailability ratio is decreased in patients with major depressive disorder[J]. J Affect Disord, 2018, 229: 145-151. DOI:10.1016/j.jad.2017.12.030 |
| [29] |
Forman HJ, Zhang H, Rinna A. Glutathione:overview of its protective roles, measurement, and biosynthesis[J]. Mol Aspects Med, 2009, 30: 1-12. DOI:10.1016/j.mam.2008.08.006 |
 2020, Vol. 55
2020, Vol. 55


