2. 山西中医药大学基础医学院, 山西 晋中 030619
2. College of Basic Medicine, Shanxi University of Chinese Medicine, Jinzhong 030619, China
黄芪是临床常用中药, 为豆科植物蒙古黄芪Astragalus membranaceus (Fisch.) Bge. var. mongholicus (Bge.) Hsiao或膜荚黄芪Astragalus membranaceus (Fisch.) Bge.的干燥根, 具有补气升阳, 固表止汗, 利水消肿, 生津养血, 行滞通痹, 托毒排脓, 敛疮生肌的功效。黄芪主要含有皂苷类、黄酮类、多糖类成分。其中的黄酮类成分具有抗氧化、抗衰老、抗炎、心肌保护、抗肿瘤、增强免疫等作用[1]。肺癌作为世界上发病率和致死率高的癌症, 通常的治疗方法包括化疗、放疗、手术治疗。其中药物治疗使用的化疗药物包括顺铂、环磷酰胺、5-氟尿嘧啶等。化疗药物在杀伤癌细胞的同时也会产生很多不良反应, 如呕吐、骨髓移植、肾毒性、肝毒性等。近年来研究表明中药与化疗药联用一方面有增效作用, 另一方面还具有减毒作用[2]。
网络药理学以系统生物学、多向药理学、计算机等多学科理论为基础, 运用各种组学、高通量筛选、网络可视化和网络分析等多种技术, 可揭示“药物-基因-靶点-疾病”之间复杂的网络关系, 从多维度视角阐述疾病的分子基础, 预测药物的药理学机制[3, 4]。网络药理学技术已在中医药作用机制研究中广泛应用, 如葛根解热作用机制研究[5]、黄精抗糖尿病作用机制研究[6]、杜仲抗骨质疏松的分子机制研究[7]等。代谢组学可分析外因或内因引起机体内源性代谢产物的变化, 并通过阐释代谢途径及代谢网络的整体变化来映射机体内生化和机能变化的过程。在研究中药及其复方对疾病的药效作用时, 可采用代谢组学技术筛选出特异的生物标志物, 然后用生物信息学方法阐释这些标志性代谢产物的功能, 进而分析中药及其复方治疗疾病的机制[8]。目前代谢组学在中药药效研究中应用广泛, 如黄连治疗Ⅱ型糖尿病的机制探索[9]、水栀子对原发性高血压的研究[10]、雷公藤红素对大鼠糖尿病溃疡促愈合作用机制[11]等。
本课题组前期研究表明, 黄芪总黄酮对环磷酰胺所致的白细胞降低具有明显的保护作用, 提示对环磷酰胺具有减毒作用。本研究拟采用网络药理学技术、代谢组学技术进一步分析黄芪总黄酮联合顺铂对Lewis肺癌小鼠抗癌作用及机制, 为进一步的肿瘤药物研发奠定基础。
材料与方法样本 浑源仿野生黄芪(生长年限6年, 购自山西北岳神耆生物科技有限公司), 经山西大学秦雪梅教授鉴定为豆科植物蒙古黄芪Astragalus membranaceus (Fisch.) Bge. var. mongholicus (Bge.) Hsiao的根, 标本保存在山西大学中医药现代研究中心。
实验动物和细胞株 SPF级C57BL/6小鼠60只, 雄性, 体重18~22 g, 购自北京维通利华实验动物技术有限公司, 许可证号为SCKX (京) 2016-0006。Lewis鼠源性肺腺癌细胞株(Lewis lung carcinoma cells, LLC), 购自中国科学院细胞库。
试剂 DMEM培养基、5X Loading buffer (批号为E626DA0002)、SDS-PAGE试剂盒(批号为F117DA0007)、甘氨酸(批号为F115BA0005)、脱脂奶粉、氯化钠(批号为E730BA0002)、SDS、Tris-base (批号为E528BA0039)、改良型BCA蛋白浓度测定试剂盒(批号为DA18DA0001)、苯甲基磺酰氟(PMSF, 批号为1810152587), 均购于生工生物工程股份有限公司; RIPA裂解液(强)购自于碧云天生物技术有限公司; 胎牛血清购自浙江天杭生物科技股份有限公司; 1:250胰蛋白酶、100X青链霉素混合溶液和吐温20购自北京索莱宝科技有限公司; DMSO购自美国Sigma公司; 注射用顺铂(冻干型)购自齐鲁制药有限公司; 毛蕊异黄酮葡萄糖苷、芒柄花苷、(6aR, 11aR)-9, 10-二甲氧基紫檀烷-3-O-β-D-葡萄糖苷、7-2'-二羟基-3', 4'-二甲氧基异黄烷-7- O-β-D-葡萄糖苷、毛蕊异黄酮、芒柄花素、(6aR, 11aR)-9, 10-二甲氧基紫檀烷和7-2'-二羟基-3', 4'-二甲氧基异黄烷对照品购自上海永恒生物科技有限公司(批号依次为20150408、20150425、20150318、20150328、20150321、20140526、20150625、20150712); AB-8大孔吸附树脂购自天津市光复精细化工研究所(批号为2016年6月18日); 95%乙醇购自河北瑞康医药科技有限公司(批号20181101);蛋白Marker购自美国Thermo公司(批号为10253-2-AP); 小鼠白介素-6 (IL-6) ELISA试剂盒购自上海西唐生物科技有限公司; PVDF膜购于美国Millipore公司(0.45 μm批号为R7NA153D); STAT3抗体(稀释比例为1:1 000, 批号为00063991)、p53抗体(稀释比例为1:1 000, 批号为00072438)和β-actin内参抗体(稀释比例为1:5 000, 批号为00070175)购自武汉Proteintech有限公司; 荧光二抗(Irdye 800cw, 稀释比例为1:20 000, 货号为C80718-15)购自美国Li-Cor公司。
仪器 HF90二氧化碳细胞培养箱、Neofuge1600R台式高速离心机、HFsafe1800生物安全柜和ROP纯水仪(力康生物医疗科技控股有限公司), IX71倒置荧光显微镜(Olympus公司)。旋转蒸发器RE-52A (上海亚荣生化仪器厂), HH数显恒温水浴锅(常州国字仪器制造有限公司), HC SDS-PAGE电泳设备和Mini-PROTEAN电转设备(Bio-Rad, 美国)、Odclyssey CLX双色红外荧光扫描仪(Gene公司, 美国), ELX800UV酶标仪(Bio-TEK公司), 离心浓缩机(Eppendorf, 德国); Thermo Fisher U3000超高效液相色谱仪, 配置在线脱气机、四元梯度泵、柱温箱、自动进样器和Thermo ScientificTMQ Exactive Orbitrap质谱仪(美国Thermo Fisher Scientific公司)。
黄芪总黄酮的制备及含量测定 参照课题组之前报道的黄芪总黄酮制备方法[12]及含量测定方法[13]。
Lewis小鼠肺癌模型的构建 参照文献[14, 15]报道方法造模, 将冻存于液氮中的LLC细胞复苏后, 使LLC细胞在含10%胎牛血清的DMEM培养基中培养(温度37 ℃、湿度5%), 取对数生长期的LLC细胞, 采用胰酶消化后, 1 500 r·min-1离心5 min, 用细胞计数板计数后, 用PBS配制成每毫升1×106个的单细胞悬浮液。在无菌环境下对C57BL/6小鼠进行皮下接种LLC细胞, 待被接种的小鼠的皮下出现直径大于5 mm3的结节后, 证明LLC肺癌小鼠模型建立成功。动物实验经过山西大学伦理委员会批准。
动物分组及给药 将未接种LLC细胞的10只C57BL/6小鼠设定为空白组(C组, 不造模, 不给药)。将40只造模成功且肿瘤体积大小均匀的荷瘤小鼠分为5组, 每组8只, 分别为模型组(M组)、阳性组(P组, 顺铂剂量为5 mg·kg-1)、联合给药低剂量组(PL组, 腹腔注射顺铂和TFA, 顺铂剂量为5 mg·kg-1, TFA剂量为12 mg·kg-1)、联合给药中剂量组(PM组, 腹腔注射顺铂和TFA, 顺铂剂量为5 mg·kg-1, TFA剂量为24 mg·kg-1)、联合给药高剂量组(PH组, 腹腔注射顺铂和TFA, 顺铂剂量为5 mg·kg-1, TFA剂量为48 mg·kg-1), 其中顺铂每周给药两次, 共给药4次; TFA每天给药1次, 共14天。
药效学指标 给药期间每隔两天用游标卡尺称量肿瘤的长(L)和宽(W), 肿瘤体积按V = L×W2/2计算, 绘制肿瘤体积生长曲线; 给药14天后进行眼眶采血, 使用高速离心机在13 000 r·min-1、4 ℃的条件下离心取上层血清, 分装并冻存于-80 ℃冰箱备用。然后解剖并完整剥离心、肝、脾、肺、肾、胸腺、肿瘤。精密称定心、肝、脾、肺、肾、胸腺后计算心指数、肝指数、脾指数、肺指数、肾指数、胸腺指数等脏器指数; 精密称定所有荷瘤组的肿瘤重量, 用GraphPad Prism 5.01软件做出荷瘤组肿瘤重量的柱状图, 并计算抑瘤率, 抑瘤率(%) = (1-实验组平均瘤重/对照组平均瘤重)×100%;所有样本冻存于-80 ℃冰箱备用。
网络药理学分析靶点筛选 根据课题组前期[13]研究, 制备的黄芪总黄酮除了含有8种黄酮类成分外, 还含有微量的皂苷类成分, 皂苷类的代表成分为黄芪甲苷。采用Phammapper数据库, 在submit file内输入黄芪总黄酮8个黄酮和黄芪甲苷的sdf格式化学结构, 设置Pharmacophore Models Whose Pkd ≥ 6.0, 将匹配的靶点数目设置为300, 得到黄芪每个黄酮成分对应的得分排名前300的靶点。将筛选得到的靶点导入UniProt数据库后校正为官方名称, 经过检索和转化操作得到黄芪总黄酮中8种成分和黄芪甲苷有关的靶点信息。
通路分析 将上述筛选得到靶点导入DAVID数据库(https://david.ncifcrf.gov/), 将靶点名称的列表输入并限定物种为小鼠, 将select identifier设定为official gene symbol, list type设定为genelist, 对黄芪总黄酮作用靶点进行KEGG通路分析, 剔除P > 0.05的通路, 根据靶点数目进行排序, 然后用GraphPad Prism 5.01软件绘图, 进行KEGG通路的富集分析。
黄芪总黄酮-成分-靶点-通路-疾病网络构建 根据黄芪总黄酮潜在作用靶点的预测结果, 采用Cytoscape 3.7.1软件的关联(merge)功能构建黄芪总黄酮-成分-靶点-通路-疾病的网络模型。成分、靶点、通路以及疾病用网络中的节点(node)表示, 化合物的潜在作用靶点用边(edge)相连。通过network analyzer功能分析网络的度(degree)、中介度(betweenness centrality)、网络集中化(network centralization)和网络异质性(network heterogeneity)参数。
药物蛋白-疾病蛋白相互作用网络的构建 将这些交叉靶点导入String数据库, 物种限定为小鼠, 得到蛋白与蛋白相互作用网络, 下载TSV格式的结果, 将结果中的节点1 (node 1)、节点2 (node 2)及结合率评分(combined score)导入Cytoscape3.7.1软件, 得到degree和betweenness centrality两个参数结果, 然后经过Cytoscape中的generate style from statistics工具构建蛋白与蛋白的网络图。
ELISA检测小鼠血清IL-6含量 取各组小鼠血清, 参照IL-6ELISA试剂盒说明书方法和步骤, 测定血清中IL-6的含量。
Western blot法检测STAT3、p53蛋白的表达 将肿瘤组织置于研钵内加液氮充分研磨至粉末状, 每100 mg组织加入RIPA裂解液(RIPA:PMSF = 100:1)500 μL进行充分裂解后, 在12 000×g、4 ℃条件下离心10 min, 吸取上清, 采用BCA法测定蛋白浓度。先经SDS-PAGE电泳, 再转膜2 h, 之后用含5%脱脂奶粉37 ℃摇床封闭2 h, TBST洗涤PVDF膜3次, 加入一抗STAT3 (1:1 000)、p53 (1:1 000)、β-actin (1:5 000)孵育过夜。TBST洗涤PVDF膜3次, 加入荧光二抗(1:20 000), 37 ℃摇床孵育2 h。TBST洗涤PVDF膜3次, 用Odclyssey CLX双色红外荧光扫描仪扫描, 采用Image studio软件分析条带表达水平。
基于UPLC-MS的血清代谢组学分析样本制备及UPLC-MS分析 取血清100 μL, 加入乙腈400 μL沉淀蛋白, 涡旋振荡后在4 ℃下离心20 min (13 000 r·min-1), 取上清450 μL离心浓缩干燥。然后加入80%的乙腈-水100 μL复溶后进行UPLC-MS分析。液相条件参照本课题组之前建立的方法[16]并进行适当修改:流动相A, 含0.1%甲酸的乙腈; 流动相B, 含0.1%甲酸的水。梯度洗脱: 0~2 min, 1% A; 2~3 min, 1% A~35% A; 3~28 min, 35% B~99% A; 28~30 min, 99% A; 30~32 min, 99% A~1%A; 32~34 min, 1% A。进样量: 5 μL; 流速, 0.2 mL·min-1; 柱温: 35 ℃; Waters Acquity UPLC HSST3色谱柱(2.1 mm×100 mm, 1.8 μm)。质谱条件:采用HESI离子化方式; 喷雾电压:正极, 3.5 kV; 负极, 2.5 kV。毛细管温度320 ℃; 加热器温度300 ℃; 鞘气流速: 35 arb, 辅助气流速: 10 arb; 扫描模式为Full Scan/dd-MS2, 采集范围为m/z 100~1 500, 正负离子切换采集模式; 分辨率采用MS full scan 35000 FWHM, MS/MS 17500 FWHM, NCE为12.5、25和37.5 eV。
潜在生物标志物的确定及代谢通路分析 将所有样本的UPLC-MS图谱导入Compound discover 3.0软件提取各个峰的峰面积、分子式、保留时间、质荷比等信息。将数据归一化后导入SIMCA-P 13.0进行多元统计分析, 通过S-plot分析、VIP值(VIP > 1)来筛选差异代谢物。采用Grad Prism 5.01软件分析差异代谢物在各组的相对含量, 将筛选出的差异代谢物导入MetaboAnalyst数据库(https://www.metaboanalyst.ca)进行MetaPA代谢通路分析。
结果 1 黄芪总黄酮含量测定所制备的黄芪总黄酮中毛蕊异黄酮葡萄糖苷含量为9.82%、芒柄花苷含量为8.62%、(6aR, 11aR)-9, 10-二甲氧基紫檀烷-3-O-β-D-葡萄糖苷含量为11.24%、7-2'-二羟基-3', 4'-二甲氧基异黄烷-7-O-β-D-葡萄糖苷含量为3.71%、毛蕊异黄酮含量为0.54%、芒柄花素含量为0.02%、(6aR, 11aR)-9, 10-二甲氧基紫檀烷含量为0.02%、7-2'-二羟基-3', 4'-二甲氧基异黄烷含量为0.01%等, 8种黄芪黄酮的总含量为33.98%。
2 药效学各组小鼠的肿瘤组织如图 1所示, 其中模型组的肿瘤体积最大, 阳性药小鼠的肿瘤减小, 联合给药可使肿瘤进一步缩小, 从直观分析来看抑制肿瘤生长效果最好的是联合给药高剂量组。图 1为肿瘤体积生长曲线, 造模后1天各组肿瘤体积没有显著性差异; 此后, 模型组的肿瘤体积增长幅度最大; 从第4天开始, 黄芪总黄酮联合给药高剂量组、中剂量组的增长幅度显著减小; 给药13天后, 顺铂组和联合给药组肿瘤体积均显著减小。其中联合给药组的疗效均优于单独阳性药组, 其中联合给药高剂量组效果最佳。
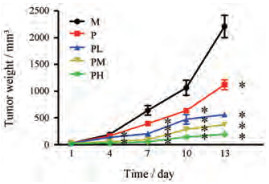
|
Figure 1 The growth curve of tumor volume in M (model group), P (positive drug group), PL (low-dose combination group), PM (medium-dose combination group) and PH (high-dose combination group). n = 8, x±s. *P < 0.001 vs M |
图 2A为肿瘤重量, 从小到大顺序依次是:联合给药高剂量组 < 联合给药中剂量组 < 联合给药低剂量组 < 阳性药组。与模型组相比, 所有给药组肿瘤重量均有显著性减小(P < 0.001)。与阳性药组相比, 联合给予黄芪总黄酮后肿瘤重量可进一步降低, 其中联合给药中剂量组、联合给药高剂量组的肿瘤均比阳性药组显著降低(P < 0.05), 联合给药低剂量组的肿瘤重量与阳性药虽无统计学差异, 但仍然可以看到肿瘤重量有减小的趋势。表 1为各给药组的抑瘤率, 联合给药高、中、低剂量组的抑瘤率均大于阳性药组, 各给药组抗肿瘤的效果由强到弱依次为:联合给药高剂量组 > 联合给药中剂量组 > 联合给药低剂量组 > 阳性药组。说明黄芪总黄酮能够增强顺铂的抗肿瘤作用, 即黄芪总黄酮对顺铂具有增效作用。

|
Figure 2 The tumor weight of M, P, PL, PM, PH (A) and the heart index (B), liver index (C), spleen index (D), lung index (E), kidney index (F), thymus index (G) of the groups. **P < 0.01, ***P < 0.001 vs C; ΔΔP < 0.01, ΔΔΔP < 0.001 vs M; #P < 0.05, ###P < 0.001 vs P |
| Table 1 Tumor inhibition rates of P, PL, PM and PH in four groups. ***P < 0.001 vs M; ΔP < 0.05, ΔΔΔP < 0.001 vs P |
由图 2B~2G各组脏器指数可知, 空白组(C)、模型组(M)、阳性药组(P)、联合给药低剂量组(PL)、联合给药中剂量组(PM)、联合给药高剂量组(PH) 6个组的心指数、肺指数、肾指数均没有显著性差异。与模型组相比, 顺铂治疗组脾指数、肝脏指数、胸腺指数均有降低, 其中脾脏指数和胸腺指数变化最明显。给予低、中、高3个剂量黄芪总黄酮后胸腺指数可显著回调, 其中联合给药高剂量组胸腺指数回调最为明显。但黄芪总黄酮联合给药对肝脏指数和脾脏指数无显著影响。说明黄芪总黄酮可以减轻顺铂对免疫系统的不良反应, 即黄芪总黄酮对顺铂化疗具有减毒作用, 其中联合给药高剂量效果最好。
3 网络药理学分析 3.1 生物通路分析将黄芪总黄酮的8种黄酮成分导入Pharmmapper数据库, 得到成分靶点243个, 涉及毛蕊异黄酮、毛蕊异黄酮葡萄糖苷、紫檀烷、紫檀烷苷、异黄烷苷、黄芪甲苷。从Home-Gene-NCBI数据库与Genecard数据库得到肺癌靶点, 将成分靶点与肺癌靶点取交集共得到黄芪总黄酮与肺癌的相关靶点46个(表 2)。将这46个靶点导入DAVID数据库进行KEGG通路分析, 由KEGG通路富集图(图 3)可知, 上述46个靶点主要与PI3K-Akt、HIF-1、PPAR、Thyroid hormone等26条信号通路有关, 说明黄芪总黄酮对肺癌的作用具有多靶点、多通路的特点。
| Table 2 Degree and betweenness of target proteins of total flavonoids of Astragalus in the treatment of lung cancer |

|
Figure 3 KEGG pathway enrichment map of potential anti-lung cancer targets in main active components of total flavonoids of Astragalus membranaceus |
采用Cytoscape 3.7.1软件构建黄芪总黄酮的成分-靶点-通路-疾病的网络模型(图 4)。该网络有79个节点(包括6个成分、46个靶点、26条通路、1个疾病)和247条边, 其中绿色节点代表黄芪总黄酮、黄色节点代表黄芪总黄酮的每一个黄酮成分、红色节点代表靶点、紫色节点代表代谢通路、蓝色代表疾病, 边代表相互作用关系。然后对网络模型进行网络拓扑属性分析, 其network centralization和network heterogeneity参数分别是0.260和0.734。网络分析图中一个节点与其他节点相连的数目用degree表示, 一个节点的degree值越大, 则说明与该节点相连的节点数越多。中介度(betweenness)是指通过该节点的最短路径占全部路径的比例。degree值和betweenness值越大, 说明该节点越重要。6个成分的参数如下:毛蕊异黄酮(degree: 13; betweenness: 0.056 901 29)、毛蕊异黄酮葡萄糖苷(degree: 17; betweenness: 0.147 561 22)、(6aR, 11aR)-9, 10-二甲氧基紫檀烷(degree: 15; betweenness: 0.115 001 52)、(6aR, 11aR)-9, 10-二甲氧基紫檀烷-3-O-β-D-葡萄糖苷(degree: 13; betweenness: 0.079 520 6)、7-2'-二羟基-3', 4'-二甲氧基异黄烷-7-O-β-D-葡萄糖苷(degree: 12; betweenness: 0.068 552 35)、黄芪甲苷(degree: 11; betweenness: 0.087 869 96), 由此可知, 毛蕊异黄酮葡萄糖苷的degree值和betweenness值最大, 说明毛蕊异黄酮葡萄糖苷可能是抑制肺癌的主要活性成分。TRP53 (degree: 20; betweenness: 0.097 804 29)、RAC1 (degree: 12; betweenness: 0.070 717 33)、ERBB2 (degree: 12; betweenness: 0.042 288 92)、VEGFA (degree: 10; betweenness: 0.024 952 81)、STAT3 (degree: 9; betweenness: 0.026 901 42)等靶点的degree值和betweenness值相对比较高, 说明这些靶点可能为发挥抗癌作用的关键靶点。

|
Figure 4 Total flavonoids-components-targets-pathways-disease network of Astragalus membranaceus. Compound A-F: Calycosin (A), calycosin-7-O-β-D-glucoside (B), (6aR, 11aR)-9, 10-dimethoxypterocarpan (C), (6aR, 11aR)-9, 10-dimethoxypterocarpan-3-O-β-D-glucoside (D), 7, 2'-dihydroxy-3', 4'-dimethoxyisoflavan-7-O-β-D-glucoside (E), astragaloside Ⅳ (F) |
蛋白与蛋白相互作用网络见图 5, 黄芪总黄酮治疗肺癌的靶点蛋白的degree和betweenness如表 2所示。该网络图包含46个节点、177条边, 平均节点度为7.652, 平均局部聚类系数为0.460。其中节点大小及颜色用来表示degree的大小, degree值越大, 颜色由蓝变红所对应的degree值也越大; 而边的粗细和颜色用来表示节之间的关联度点, 边越粗表示节点之间的关联度越大; betweenness指介度, 某一蛋白的degree和betweenness越大, 说明该蛋白比较重要。如TP53与CDK2、ESR1、APC连接的线比较粗, 说明它们的关联度比较大; TRP53、RAC1、ERBBA2、VEGFA、STAT3等的degree和betweenness值较大, 说明这些靶点可能是发挥抗癌作用的关键靶点。由蛋白相互作用网络图可知, 黄芪总黄酮发挥抗癌作用的靶点不是单独起作用, 而是一个复杂的网络。
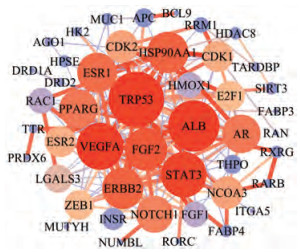
|
Figure 5 Protein interaction network diagram. TRP53: Cellular tumor antigen p53; ALB: Serum albumin; VEGFA: Vascular endothelial growth factor A; STAT3: Signal transducer and activator of transcription 3; FGF2: Fibroblast growth factor 2; ERBB2: Receptor tyrosine-protein kinase erbB-2; HSP90AA1: Heat shock protein HSP 90-alpha; ESR1: Estrogen receptor; PPARG: Peroxisome proliferator-activated receptor gamma; AR: Androgen receptor; NOTCH1: Neurogenic locus notch homolog protein 1; NCOA3: Nuclear receptor coactivator 3; CDK2: Cyclin-dependent kinase 2; ESR2: Estrogen receptor beta; CDK1: Cyclin-dependent kinase 1; ZEB1: Zinc finger E-box-binding homeobox 1; E2F1: Transcription factor E2F1; LGALS3: Galectin-3; HMOX1: Heme oxygenase 1; RAC1: Ras-related C3 botulinum toxin substrate 1; FGF1: Fibroblast growth factor 1; INSR: Insulin receptor; THPO: Thrombopoietin; APC: Adenomatous polyposis coli protein; RRM1: Ribonucleoside-diphosphate reductase large subunit; HPSE: Heparanase; MUC1: Mucin-1; HDAC8: Histone deacetylase 8; SIRT3: NAD-dependent protein deacetylase sirtuin-3; FABP4: Fatty acid-binding protein 4; RXRG: Retinoic acid receptor RXR-gamma; AGO1: Protein argonaute-1; DRD2: Dopamine D2 receptor; TARDBP: TAR DNA-binding protein 43; HK2: Hexokinase-2; TTR: Transthyretin; RARB: Retinoic acid receptor beta; ITGA5: Integrin alpha-5; DRD1A: Dopamine D1 receptor; RAN: GTP-binding nuclear protein Ran; FABP3: Fatty acid-binding protein 3; MUTYH: Adenine DNA glycosylase; RORC: Nuclear receptor ROR-gamma; PRDX6: Peroxiredoxin-6; BCL9: B-cell lymphoma 9-like protein; NUMBL: Numb-like protein |
如图 6所示, 模型组的IL-6水平较空白组显著升高(P < 0.05), 给予顺铂后IL-6的含量有所降低, 但无显著性差异; 黄芪总黄酮联合顺铂给药后, 与模型组相比, 联合给药高剂量组、中剂量组IL-6均显著降低, 其中联合给药高剂量组降低最为显著。

|
Figure 6 Column diagram of IL-6 content in serum of C, M, P, PL, PM and PH. n = 8, x± s. *P < 0.05, ***P < 0.001vs C; ΔP < 0.05, ΔΔP < 0.01 vs M |
由于STAT3、TRP53表达的蛋白分别为STAT3、p53, 下一步采用Western blot法验证两个蛋白的表达水平。由图 7可知, 模型组肿瘤组织中STAT3水平最高, 与模型组相比, 给予阳性药顺铂后有所降低, 但无统计学差异。联合给药高剂量组、中剂量组、低剂量组均可显著降低STAT3水平, 其中联合给药高剂量组效果最好, 联合给药中剂量组次之。说明单独给予顺铂并不能有效降低STAT3蛋白表达量, 但联合黄芪总黄酮后可显著降低STAT3的蛋白表达水平。此外, 与模型组相比, 各给药组p53含量均没有显著性差异, 说明顺铂和黄芪总黄酮对p53蛋白没有明显调节作用。
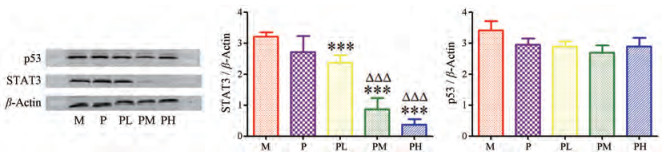
|
Figure 7 Comparison of the expression of STAT3 protein and p53 protein in M, P, PL, PM and PH. n = 8, ± s. ***P < 0.001 vs M; ΔΔΔP < 0.001 vs P |
首先对空白组和模型组两组血清质谱数据进行多元统计分析, 筛选与肺癌模型相关差异代谢物。图 8A为主成分分析图, 可见空白组和模型组有明显的差异。然后进行有监督的PLS-DA分析, 并通过外部模型验证方法排列实验来验证模型是否有效, R2在排列实验中表示对数据的解释程度, Q2在排列实验中表示对模型的预测能力, 假如回归线与纵轴的截距越小, 并且回归线的斜率较大, 说明该模型的预测能力也比较好[17]。由图 8B可知, 左端任何一次随机排列产生的R2、Q2均小于右端, 说明模型有效。在判别模型有效的前提下, 进一步通过OPLS-DA (图 8C)和S-plot散点图(图 8D), 结合VIP值(> 1), 和t检验(P < 0.05)筛选得到与肺癌模型相关差异代谢物。通过与HMDB数据库和METIN数据库, 最终指认出30个内源性差异代谢物(表 3)。
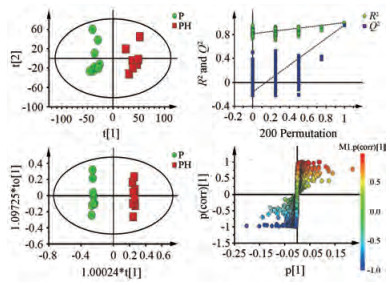
|
Figure 8 Multivariate statistical analysis of C and M (A: PCA diagram; B: Model validation diagram; C: OPLS-DA scatter plot; D: S-Plot diagram) |
| Table 3 Identification of differential metabolites between C and M. *P < 0.05, **P < 0.01, ***P < 0.001 vs M. P: Positive ions mode, N: Negative ions mode |
通过给药后差异代谢物的回调程度进一步比较各给药组的药效作用(图 9)。在空白和模型组的30个差异代谢物中, 顺铂可以回调的代谢物有19个, 分别为植物鞘氨醇、溶血磷脂酰乙醇胺(0:0/20:4 (8Z, 11Z, 14Z, 17Z))、二氢鞘氨醇、溶血磷脂酰胆碱(15:0)、十二烷二酸、溶血磷脂酰乙醇胺(22:6 (4Z, 7Z, 10Z, 13Z, 16Z, 19Z)/0:0)、2-羟基十六烷基肉碱、溶血磷脂酰胆碱(20:1 (11Z))、溶血磷脂酰胆碱(20:5 (5Z, 8Z, 11Z, 14Z, 17Z))、左旋棕榈酰肉碱、4-羟基壬醛、十四烷基肉碱、α-生育三烯醇、MG (18:2 (9Z, 12Z)/0:0/0:0)、硬脂酰肉碱、脯氨酸甜菜碱、反式十六烷基-2-烯醇肉碱、油酰胺、七烷酸。黄芪总黄酮联合给药后回调作用更好的代谢物有5个, 包括MG (18:1 (9Z)/0:0/0:0)、溶血磷脂酰乙醇胺(0:0/20:4 (8Z, 11Z, 14Z, 17Z))、MG (18:2 (9Z, 12Z)/0:0/0:0)、硬脂酰肉碱、溶血磷脂酰乙醇胺(22:6 (4Z, 7Z, 10Z, 13Z, 16Z, 19Z)/0:0)。单独顺铂不能回调, 但联合黄芪总黄酮能回调的代谢物有4个, 分别为棕榈酰胺、溶血磷脂酰乙醇胺(22:6 (4Z, 7Z, 10Z, 13Z, 16Z, 19Z))、溶血磷脂酰胆碱(22:4 (7Z, 10Z, 13Z, 16Z))、牛磺胆酸。

|
Figure 9 Comparison of endogenous serum metabolites in C, M, P, PL, PM and PH. Longitudinal coordinates represent the relative content of metabolites. n = 8, ± s. *P < 0.05, **P < 0.01, ***P < 0.001 vs C; ΔP < 0.05, ΔΔP < 0.01, ΔΔΔP < 0.001 vs M |
将空白组和模型组的差异代谢物名称导入MetaboAnalyst数据库, 将物种设定为小鼠, 进行MetaPA代谢通路分析, 然后筛选出影响值大于0.01的代谢通路作为潜在的相关代谢通路。最终得到四条与Lewis肺癌模型相关的代谢通路(图 10)即鞘脂代谢通路(sphingolipid metabolism)、视黄醇代谢通路(retinol metabolism)、甘油磷酸代谢通路(glycerophospholipid metabolism)、原代胆汁酸生物合成通路(primary bile acid biosynthesis)。

|
Figure 10 MetPA analysis of the metabolic pathway |
由上述分析结果可见, 黄芪总黄酮起到回调作用的代谢物为溶血磷脂酰乙醇胺(0:0/20:4 (8Z, 11Z, 14Z, 17Z))、棕榈酰胺、牛磺胆酸、溶血磷脂酰乙醇胺(22:6 (4Z, 7Z, 10Z, 13Z, 16Z, 19Z)/0:0)、MG (18:2 (9Z, 12Z)/0:0/0:0)、硬脂酰肉碱、MG (18:1 (9Z)/0:0/0:0)、溶血磷脂酰乙醇胺(22:6 (4Z, 7Z, 10Z, 13Z, 16Z, 19Z))、溶血磷脂酰胆碱(22:4 (7Z, 10Z, 13Z, 16Z)), 这些代谢物涉及的代谢通路为原代胆汁酸生物合成通路, 说明黄芪总黄酮可能通过调节原代胆汁酸生物合成通路来达到增效减毒目的。
讨论本研究建立了LLC小鼠肺癌模型, 通过肿瘤体积、肿瘤生长曲线、肿瘤重量, 发现联合给药组的效果好于阳性药组, 说明黄芪总黄酮能够增强顺铂的抗癌作用; 通过脏器指数分析显示黄芪总黄酮能减轻顺铂的免疫抑制作用。药效学结果显示黄芪总黄酮不仅能够增强顺铂的抗癌作用, 也能降低顺铂的毒副作用, 即黄芪总黄酮联合顺铂对Lewis肺癌小鼠具有显著的增效减毒作用。
采用网络药理学预测了黄芪总黄酮抗肺癌的46个作用靶点, 进行KEGG通路分析后进一步构建了成分-靶点-通路-疾病网络, 以及蛋白-蛋白互作网络。结果显示黄芪总黄酮抗肺癌具有多靶点、多通路的特点。毛蕊异黄酮、毛蕊异黄酮葡萄糖苷、(6aR, 11aR)-9, 10-二甲氧基紫檀烷、(6aR, 11aR)-9, 10-二甲氧基紫檀烷-3-O-β-D-葡萄糖苷、7-2'-二羟基-3', 4'-二甲氧基异黄烷-7-O-β-D-葡萄糖苷、黄芪甲苷均可能为活性成分, 其中毛蕊异黄酮葡萄糖苷与活性的相关性可能最大。由蛋白-蛋白互助作用网络也进一步显示TRP53、RAC1、ERBBA2、VEGFA、STAT3等可能是发挥抗癌作用的关键靶点, 黄芪总黄酮发挥抗癌作用的靶点是一个复杂的网络。
研究表明, IL-6/STAT3信号通路与肿瘤的形成、发展有关。信号转导及转录激活因子3 (STAT3)是STAT家族蛋白之一, 能够响应包括白细胞介素-6 (IL-6)在内的多个细胞因子。IL-6是一种促炎性因子, 在炎症和许多疾病致病机制中发挥重要主要, IL-6能够介导STAT3蛋白激活[18, 19]。联合给药高、中剂量组的IL-6水平与模型组相比显著降低, 接近空白组水平。说明联合黄芪总黄酮给药可以下调模型组和阳性药组的IL-6水平, 且具有剂量依赖性。此外, 联合给药高、中剂量组的STAT3蛋白水平低于阳性药组, 说明黄芪总黄酮可以下调STAT3水平, 且具有剂量依赖性。由此可推断黄芪总黄酮可能通过下调IL-6水平以诱导STAT3蛋白表达水平降低发挥作用, 即黄芪总黄酮可能通过IL-6/STAT3通路发挥协同作用进而抑制肿瘤生长。P53是一种抑癌基因, p53的失活对于肿瘤形成有很重要的作用[20]。联合黄芪总黄酮后p53蛋白的表达水平均没有显著性差异, 说明黄芪总黄酮可能不是通过调节p53蛋白水平发挥抗癌作用。
采用多元统计分析确定肺癌模型相关的差异代谢物30个, 其中黄芪总黄酮联合给药后可以更好的回调其中的5个代谢物, 而且联合黄芪总黄酮后还能回调单独顺铂不能回调的4个代谢物, 说明这些差异代谢物可能与黄芪总黄酮对化疗药的增效减毒作用有关。MetaPA代谢通路分析结果显示, 在4条与Lewis肺癌模型相关的代谢通路中, 黄芪总黄酮可能通过调节原代胆汁酸生物合成通路来达到增效减毒目的。
本研究结果表明, 黄芪总黄酮起到回调作用的代谢物中, 已有文献报道硬脂酰肉碱、棕榈酰胺、牛磺胆酸与癌症具有一定相关性。
硬脂酰肉碱是一种脂质类成分, 据文献[21]报道, 硬脂酰肉碱与肺癌有一定关系。有研究采用UPLC-QTOF/MS血浆代谢组学技术分析了Lewis肺癌模型组小鼠的差异代谢物, 发现硬脂酰肉碱是与肺癌相关的差异代谢物之一。本研究发现肺癌小鼠模型中的硬脂酰肉碱水平升高, 顺铂可以降低肺癌小鼠模型中升高的硬脂酰肉碱水平, 而联合给予黄芪总黄酮能够进一步降低硬脂酰肉碱水平。文献[22]报道棕榈酰胺(palmitic amide)为结直肠癌患者血液的内源性代谢物之一, 结直肠癌患者血清中的棕榈酰胺水平降低。本研究中肺癌小鼠模型中的棕榈酰胺水平比正常小鼠亦有所降低, 给予顺铂后棕榈酰胺水平升高, 联合给予黄芪总黄酮后棕榈酰胺回调更加明显。牛磺胆酸是一种结合型胆汁酸, 胆汁中的结合型胆汁酸谱可作为早期诊断胆管癌的潜在的生物学指标。结合型胆汁酸可刺激胆管癌细胞的生长, 研究表明结合型胆汁酸可能是通过激活ERK1/2和AKT信号通路从而刺激胆管癌细胞侵袭性生长[23, 24]。另有研究表明牛磺胆酸能够介导胆管癌的增殖、迁移和侵袭[25]。此外, 牛磺胆酸相关的原代胆汁酸生物合成通路为肺癌恶性胸腔积液(MPE)相关的代谢通路之一, 恶性胸腔积液不仅是癌症的并发症之一, 也是晚期肺癌的重要特征[26]。本研究表明黄芪总黄酮能够回调肺癌模型小鼠中升高的牛磺胆酸水平, 并通过调节原代胆汁酸生物合成通路来发挥增效减毒作用。
| [1] |
Chen JZ, Lv GY, Ye L, et al. Advances in chemical constituents and pharmacological activities of flavonoids from Astragalus membranaceus[J]. Her Med (医药导报), 2009, 28: 1314-1316. |
| [2] |
Li SY. The Application of Chinese Medicine Supplements in Relieving the Sides Effects of Lung Cancer Chemotherapy (中医补益法在肺癌化疗不良反应治疗中的运用)[D]. Nanjing: Nanjing University of Chinese Medicine, 2013.
|
| [3] |
Xing XR, Lv DY, Chai YF, et al. Advances in the mechanism of traditional Chinese medicine by network pharmacology method[J]. J Pharm Pract (药学实践杂志), 2018, 36: 97-102. |
| [4] |
Dong HY, Du WX, Zhang FG, et al. Network pharmacology and its research progress in the field of TCM[J]. Guid J Tradit Chin Med Pharm (中医药导报), 2016, 22: 67-70. |
| [5] |
Li BT, Zhai XY, Li J, et al. Network pharmacology-based study on mechanisms of antipyretic action of Pueraria Radix[J]. Acta Pharm Sin (药学学报), 2019, 54: 1409-1416. |
| [6] |
Xu F, Chen T, Wang ZH, et al. Study on the anti-diabetes mechanism of Polygonati Rhizoma based on network pharmacology[J]. J Dali Univ (大理大学学报), 2019, 4: 21-26. |
| [7] |
Li JC, Xu B, Li G, Yan BZ, et al. Study on molecular mechanism of osteoporosis treated by Eucommia ulmoides based on network pharmacology[J]. Mod Chin Med (中国现代中药), 2018, 20: 936-942. |
| [8] |
Tang DD, Yuan SJ, Zhang N, et al. Research progress of pharmacodynamics and toxicity of traditional Chinese medicine based on urinary metabolomics[J]. Chin J Pharm Anal (药物分析杂志), 2016, 36: 1-8. |
| [9] |
Wang J, Yuan ZM, Kong HW, et al. Exploring the mechanism of Rhizoma Coptidis in treating type Ⅱ diabetes mellitus based on metabolomics by gas chromatography-mass spectrometry[J]. Chin J Chromatogr (色谱), 2012, 30: 8-13. DOI:10.3724/SP.J.1123.2011.08039 |
| [10] |
Feng WS, Liu T, Zhou N, et al. Metabolomics study of effects of Gardenia jasminoides var. Radicans fruit on blood pressure in spontaneously hypertensive rats[J]. Chin Pharm J (中国药学杂志), 2019, 28: 670-676. |
| [11] |
Hu YS, Xu PT, Ye SJ, et al. Effects of celastrol on accelerated healing of skin wounds of diabetic ulceration in rats and mechanism revealed by nuclear magnetic resonance-based metabonomics[J]. Chin J Anal Chem (分析化学), 2018, 46: 170-177. |
| [12] |
Zhang WN, Li AP, Qi YS, et al. Metabolomics coupled with system pharmacology reveal the protective effect of total flavonoids of Astragali Radix against adriamycin-induced rat nephropathy model[J]. J Pharm Biomed Anal, 158: 128-136.
|
| [13] |
Qu TL. Study on the Effective Ingredients and Mechanism on Leucopenia of Huangqi Injection (黄芪注射液升白药效成分及作用机制研究)[D]. Taiyuan: Shanxi University, 2017.
|
| [14] |
Zhou LJ, Long TT, Zhou X, et al. Immunomodulatory effects of Acanthopanax senticosus polysaccharides on Lewis tumor-bearing mice through TLR4 signaling pathway[J]. Chin J Immun (中国免疫学杂志), 2017, 33: 849-854. |
| [15] |
Xu BY, Pang XG, Chen CB, et al. Effects of curcumin on VEGF and endostatin expression of Lewis lung carcinoma[J]. Chin J Clin Pharm Ther (中国临床药理学与治疗学), 2017, 20: 151-154. |
| [16] |
Liu CC. Plasma Metabolomics Studies on the Clinical Antidepressant Effect of Xiaoyaosan (逍遥散临床治疗抑郁症的血浆代谢组学研究)[D]. Taiyuan: Shanxi University, 2016.
|
| [17] |
Li J, Zhang S, Qin XM, et al. Comparison on chemical constituents in raw and honey baked Farfarae Flos by NMR-based metabolomic approach[J]. Chin Tradit Herb Drugs (中草药), 2015, 46: 3009-3016. DOI:10.7501/j.issn.0253-2670.2015.20.008 |
| [18] |
Yang X, Zhang R. Research progress on the relationship between IL-6/STAT3 pathway and inflammatory-associated colon cancer[J]. Oncol Prog (癌症进展), 2018, 16: 1068-1071. |
| [19] |
Ji J, Chen YY. Effect of Huangqin Decoction on IL-6, JAK-STAT3 signal pathway and HMGB-1 expression in rats with ulcerative colitis[J]. China J Chin Med (中医学报), 2018, 33: 1297-1301. |
| [20] |
Zhang BY, Yu QX. Research progress in p53 as potential biomarker and therapeutic target for breast cancer[J]. Med Rev (医学综述), 2019, 25: 2366-2371. |
| [21] |
Wu H, Chen Y, Li ZG, et al. Untargeted metabolomics profiles delineate metabolic alterations in mouse plasma during lung carcinoma development using UPLCQTOF/MS in MSE mode[J]. R Soc Open Sci, 2018, 5: 1-13. |
| [22] |
Yang Y, Wang ZP, Gao SH, et al. Research advances of discovery of tumor markers in colorectal cancer based on metabolomics[J]. Chin J Pharm Anal (药物分析杂志), 2018, 38: 915-926. |
| [23] |
Zhang L, Fan ZJ, Kang H, et al. High-performance liquid chromatography-mass spectrometry-based serum metabolic profiling in patients with HBV-related hepatocellular carcinoma[J]. J South Med Univ (南方医科大学学报), 2019, 39: 49-56. |
| [24] |
Wang WJ, Zheng D, Liu B. The value of analysis on conjugated bile acids in biliary tract cancer[J]. J Zunyi Med Univ (遵义医学院学报), 2016, 36: 403-405. |
| [25] |
Liu RP, Li XJY, Qiang XY, et al. Taurocholate induces cyclooxygenase-2 expression via the sphingosine 1-phosphate receptor 2 in a human cholangiocarcinoma cell line[J]. J Biol Chem, 2015, 290: 30988-31002. DOI:10.1074/jbc.M115.668277 |
| [26] |
Wang WJ. Lactate Acid Up-Regulate M2 Macrophage in MPE Tumor Microenvironment (MPE中乳酸调控巨噬细胞M2极化促进肺癌侵袭的初步研究)[D]. Zhengzhou: Zhengzhou University, 2015.
|
 2020, Vol. 55
2020, Vol. 55


