肝脏是机体重要的器官, 在调节机体代谢平衡方面起着关键作用[1]。许多生理、病理或外源物因素可导致肝脏增大。从组织学的角度, 肝增大可从肝脏器官、肝脏组织和肝细胞结构等方面定义。从毒理学的角度, 肝增大则主要表现为肝脏器官的增重、肝细胞尺寸的变大、肝细胞的增殖以及肝脏酶活性的诱导[2]。肝增大可分为生理性肝增大和病理性肝增大。病理性肝增大, 是指肝增大过程中伴有病理损伤, 比如四氯化碳和氯仿等化学物质诱导肝增大的同时具有明显的肝细胞毒性[3, 4]; 芳香烃受体(aryl hydrocarbon receptor, AhR)激动剂二噁英引起的肝增大会造成脂肪变性和肝细胞坏死[5]。而雄甾烷受体(constitutive androstane receptor, CAR)激动剂巴比妥类药物、孕烷X受体(pregnane X receptor, PXR)激动剂利福平以及过氧化物酶体激活受体α (peroxisome activated receptor alpha, PPARα)激动剂贝特类药物等促进肝增大并不引起肝细胞损伤, 属于生理性肝增大[6-8]。肝增大可以用组织-体重比的指标来衡量, 避免体重变化对组织器官的重量造成影响[2]。
脂质是脂肪和类脂的总称, 是一类难溶于水而易溶于非极性有机溶剂的生物分子, 参与调节多种生命活动, 包括生物膜组成、细胞发育与分化、细胞凋亡、能量转换、物质运输以及信息识别与传递等[9]。脂质组学是对生物体的所有脂质进行全面分析鉴定的一种研究方法, 能通过识别关键的差异脂质和代谢网络, 揭示脂质与机体生理或病理变化的关系[10, 11]。脂代谢稳态的维持有赖于脂质摄取、合成、分泌和代谢等关键环节的有机协调, 脂代谢稳态对肝脏生理和病理状态有重要影响。研究表明, 肝细胞增殖及肝增大起始阶段, 肝细胞中会储存大量由甘油三酯、胆固醇酯和脂肪酸组成的脂滴, 以满足后期细胞分裂的需要, 表明脂质累积与肝细胞增殖活动关系密切[12, 13]。同时也有研究发现肝切除术后抑制肝细胞脂质生成, 可进一步抑制肝细胞增殖, 延缓肝再生进程, 说明脂质生成对肝再生至关重要[14]。而脂质累积过量或者降解受到抑制时, 会诱导脂毒性物质产生, 造成肝细胞损伤, 并可能发展为脂肪性肝病甚至肝硬化[15]。这些研究表明脂质代谢稳态与肝细胞增殖、肝增大、肝再生等生理病理过程密切相关。
五味子醇乙是传统中药五味子的活性成分之一[16]。研究表明五味子具有护肝、降压、抗炎等多种功效[17]。南五味子醇提取物能显著提高小鼠的肝重比, 但机制尚不清楚[18]。也有研究发现五味子的另外一种活性单体五味子乙素(schisandrin B, SinB)在急性口服给药时, 具有促进小鼠肝增大的作用[19]。作者前期研究发现, 五味子醇乙通过激活核因子红细胞系相关因子-2 (nuclear factor erythroid 2-related factor 2, NRF2)和抗氧化反应元件(antioxidative response element, ARE)通路抗氧化应激和促进肝再生等机制抵抗对乙酰氨基酚(acetaminophen, APAP)所致的小鼠急性肝损伤[20, 21]; 并证明五味子醇乙通过激动PXR及促进肝再生, 从而抵抗石胆酸(lithocholic acid, LCA)造成的小鼠胆汁淤积性肝损伤[22]。研究中发现SolB发挥保护作用的同时具有促进小鼠肝增大的作用, 而导致这种肝增大过程中内源物质如脂质的变化尚不清楚, 其作用机制仍有待探索。
因此, 本研究拟通过脂质组学检测和分析, 研究SolB所致小鼠肝增大过程中的脂质组变化, 以期发现SolB促进肝增大分子机制的潜在线索。
材料和方法药品与试剂 五味子醇乙(纯度≥98%, 货号: 090927), 上海融禾医药科技有限公司; 玉米油(药用级), 上海阿拉丁公司; 甲醇(色谱纯), 甲基叔丁基醚(MTBE, 色谱纯), 乙腈(色谱纯), 甲酸(色谱纯)和异丙醇(色谱纯), 美国TEDIA公司; 甲酸铵(色谱纯), 广州化学试剂厂; 4%多聚甲醛, 苏木素-伊红染液和油红O染液, 谷歌生物技术有限公司; 甘油三酯试剂盒(货号: A110-1), 南京建成生物工程研究所; Trizol细胞裂解液, PrimeScript RT reagent Kit with gDNA Eraser (货号: RR047)和TB Green Premix Ex Taq Ⅱ (货号: RR820), 日本Takara公司。
仪器与耗材 Q Exactive高性能台式四极杆-轨道阱UHPLC-MS/MS系统、Multiscan Go酶标仪(美国Thermo公司); 5417-R低温高速离心机、普通梯度PCR仪、微量移液器(德国Eppendorf公司); AE260电子天平(美国Mettler公司); Precellys 24生物样品均质器(法国Bertin公司); 超纯水仪(美国Millipore公司); AB7500实时荧光定量PCR仪(美国Applied Biosystems公司); 氮吹仪(上海泉岛公司); Ascentis Express C18 2.7 μm色谱柱(2.1 mm×100 mm) (美国Sigma公司)。
实验动物 SPF级6~8周雄性C57BL/6小鼠, 22~25 g, 购买于广东省医学实验动物中心, 动物生产许可证号和使用许可证号分别为SCXK (粤) 2018-0002、SYXK (粤) 2018-0002, 并饲养于中山大学(东校区)实验动物中心SPF级环境。饲养条件:温度20~25 ℃, 湿度55%~70%, 昼夜明暗交替各12 h, 换气次数为每小时10~20次, 饲料为SPF级大小鼠饲料(广东省医学实验动物中心提供), 自由摄取水和食物。本动物实验经中山大学动物伦理委员会批准(批准号:东-C2019-000054XS)。
动物分组与给药 小鼠随机分为两组, 每组5只, 分为空白对照组和SolB组。精密称取SolB 100 mg, 加玉米油10 mL后, 充分涡旋后, 超声处理20 min, 制成10 mg·mL-1 SolB注射液(腹腔注射体积为0.01 mL·g-1体重, 剂量为100 mg·kg-1·d-1)。空白对照组腹腔注射给予相应体积的玉米油, SolB组腹腔注射SolB。连续给药5天后, 最后一次给药24 h后摘取眼球取血后颈椎脱臼处死小鼠, 收集肝脏。
组织病理学检测 肝脏组织在4%多聚甲醛中固定24 h以上, 脱水后进行石蜡包埋。RM2016病理切片机(上海徕卡仪器有限公司)切片, 片厚3 μm, 烘片后脱蜡, 伊红、苏木素染色, 脱水封片。DMI 3000B倒置显微镜(日本Olympus公司)下观察。
血清生化指标检测 血液于3 000 ×g、4 ℃离心10 min后取得血清, 送样至广东省医学实验动物中心生化检测室, 利用URIT-8021A全自动生化分析仪(桂林优利特医疗电子有限公司)检测。
油红O染色 制作肝脏组织冰冻切片, 冰冻切片室温放置10 min后, 4%多聚甲醛固定15 min, 使用PBS缓冲液清洗切片。油红O工作液染色1 min, 清洗后苏木素染液染色, 封片。显微镜下观察。
甘油三酯含量检测 根据试剂盒说明书, 使用GPO-PAP酶法对肝脏组织中的甘油三酯含量进行检测。
实时荧光定量PCR检测 使用Trizol试剂提取小鼠肝脏组织的总RNA。根据逆转录试剂盒说明书进行基因组DNA的去除反应和逆转录反应, 根据定量PCR试剂盒说明书进行定量PCR反应。引物序列见表 1。
| Table 1 Primer sequences of inflammation related genes and lipid metabolism genes |
样品前处理 称取肝脏组织20 mg于匀浆管中, 加入PBS缓冲液200 μL后进行匀浆。转移匀浆液150 μL至1.5 mL EP管中, 加入预冷的脂质提取溶剂甲醇-MTBE-水(4:5:5) 1.2 mL, 涡旋混匀, 冰上放置1 h, 每隔15 min涡旋混匀一次, 2 000 r·min-1、4 ℃离心5 min, 转移脂质层100 μL至新的EP管中, 氮气流干燥。进样前加入甲醇-异丙醇(1:1) 1 mL复溶, 涡旋混匀, 16 000 r·min-1、4 ℃离心5 min, 吸取上清液120 μL转移至进样瓶中。
质控(QC)样品分析 从复溶后的所有样品中各取10 μL至EP管中充分涡旋混合均匀, 转移至进样瓶中用作QC样品。系统对所有样品进行检测前后, 进样QC样品, 并在样品检测过程中, 再进样一次QC样品。对QC样品中相关离子强度的精密度进行分析, 证明仪器和分析系统的稳定性良好。
色谱条件 使用Thermo Scientific Dionx Ultimate 3000超高效液相系统, Ascentis Express C18 2.7 μm色谱柱(2.1 mm×100 mm); 流动相A: 50%乙腈+50%水+5 mmol·L-1甲酸铵+0.1%甲酸; 流动相B: 95%异丙醇+5%乙腈+5 mmol·L-1甲酸铵+0.1%甲酸; 梯度洗脱方法为: 0~0.5 min, 80% A等度; 0.5~7.5 min, 上升至50% B线性梯度; 7.5~10 min, 上升至80% B线性梯度; 10~20 min, 上升至100% B线性梯度; 20~21.9 min, 100% B等度; 21.9~22 min, 80% A线性梯度; 22~25 min, 80% A等度。进样时, 色谱柱温度为45 ℃, 流速为0.3 mL·min-1, 自动进样盘温度设为15 ℃。
质谱条件 采用电喷雾(ESI)正负离子模式, 正离子模式下电喷雾电压设定为3 500 V, 负离子模式下设定为2 500 V; 离子传输管温度设定为300 ℃; 鞘气(N2: 60 arb)和辅气(N2: 20 arb); 一级质谱分辨率设定为70 000, 二级质谱设定为17 500, 归一化碰撞能量正离子模式25、35 eV, 负离子模式20、30、40 eV; 扫描范围为m/z 200~2 000。方法、序列编辑以及图谱数据采集等由Xcalibur 2.0软件(Thermo Fisher Scientific Inc., USA)完成。
多变量分析 将检测原始数据导入LipidSearch脂质组学分析软件(Thermo Fisher Scientific Inc., USA), 首先根据一级精确质量数及二级特征碎片离子信息与脂质质谱数据库进行自动匹配, 解析样本中所有的脂质成分并对色谱峰进行积分。之后, Alignment初步分析各组别中相对含量具有差异的脂质。将预处理数据导入SIMCA-P 13.0软件(Umetrics, Kinnelon, NJ), 采用主成分分析法(principal component analysis, PCA)进行无监督的数据分析, 考察各组数据的聚类情况。为了最大化组间分离, 采用正交偏最小二乘判别分析法(orthogonal partial least-discriminant analysis, OPLS-DA)进行有监督的数据分析。在S-Plot图中选择具有高相关性和高协方差的变量, 观察变量的变量权重重要性排序值(variable importance in projection, VIP), 筛选VIP值> 1的潜在生物标志物。
数据统计 本研究所有数据均以mean ± SD表示, 使用统计学软件SPSS和GraphPad Prism 8.0软件对数据进行统计分析及绘图, 采用unpaired Student's t test检验比较空白对照组与SolB组的组间差异, P < 0.05具有统计学意义。
结果 1 五味子醇乙促进小鼠良性肝增大连续给予小鼠SolB 5天后, 从形态学可以观察到小鼠肝脏大小显著增加(图 1A), 肝-体重比从4.80%增加至5.83% (P < 0.01, 图 1B)。血清转氨酶(ALT、AST)和碱性磷酸酶(ALP)是反映肝脏损伤的标志性指标。与对照组相比, SolB组的ALT、AST和ALP水平均无显著变化(图 1D)。炎症因子Infγ、Tnfα和Il6的表达可以在一定程度上反映肝脏的炎症反应。在给予SolB促进肝增大后, 小鼠的这些炎症因子指标亦无显著性变化(图 1E)。HE染色也表明给予SolB后小鼠肝细胞未出现病理变化(图 1C)。这些结果提示SolB能够促进小鼠的正常肝脏增大, 且这种肝增大不是肝脏损伤或者炎症造成的。

|
Figure 1 SolB induces liver enlargement in mice. A: Morphological photographs of representative livers; B: Liver-to-body-weight ratios; C: Representative H & E-stained liver sections; D: Serum ALT, AST and ALP levels in the vehicle and SolB group; E: qRT-PCR analysis of Infγ, Tnfα and Il6 mRNA levels after SolB treatment. Data are expressed as means ± SD (n = 5). **P < 0.01 vs the vehicle group |
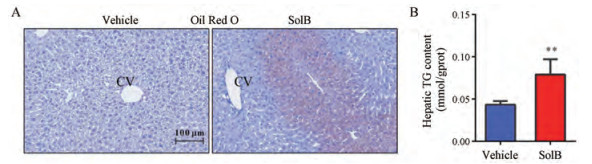
使用油红O染色法检测小鼠肝脏组织中的脂质含量, 发现给予SolB后, 肝细胞内红色脂滴增加(图 2A)。进一步检测肝脏组织的TG含量, 发现SolB组TG含量显著升高(图 2B)。结果提示, SolB能够引起小鼠肝细胞内的脂质累积。
|
Figure 2 SolB induces lipid accumulation in mice. A: Oil Red O staining in the vehicle and SolB group; B: Hepatic triglyceride content. Data are expressed as means ± SD (n = 5). **P < 0.01 vs the vehicle group |
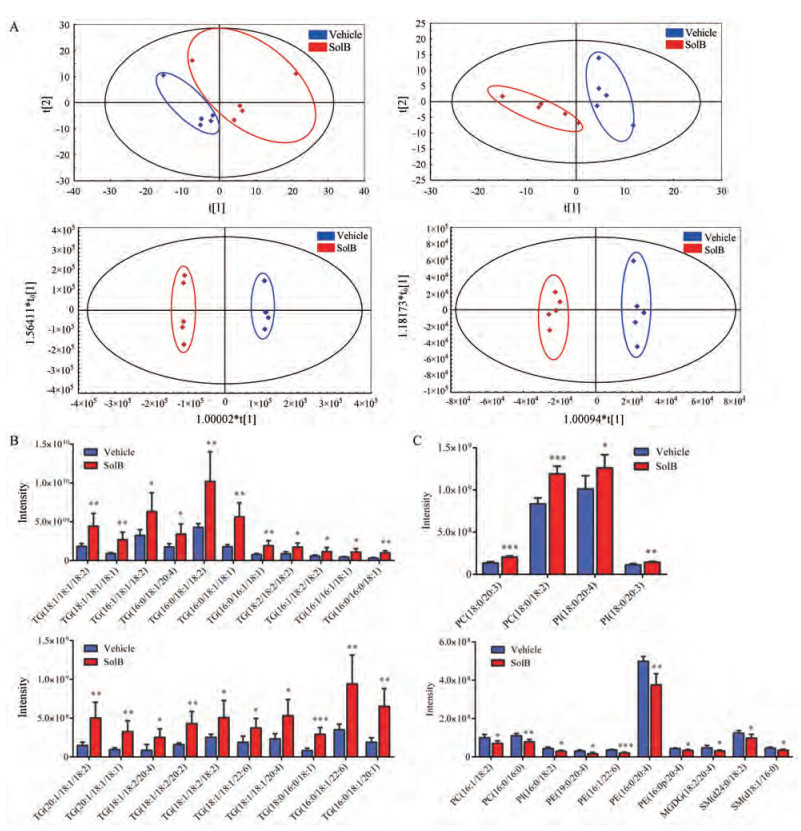
在正、负离子模式下对SolB组和对照组肝脏样本的脂质组数据进行无监督的主成分分析(PCA), 发现对照组和SolB组两组数据分布于不同象限, 具有明显分离趋势, 两组组内数据聚类良好, 无离群值(图 3A), 表明对照组和SolB组间存在显著的脂质组差异。为了使组间分离达到最大化, 排除样本分类以外的干扰, 使用有监督的正交偏最小方差判别分析(OPLS-DA), 发现两组数据完全分开, 提示对照组与SolB组脂质代谢轮廓差异显著。
|
Figure 3 Lipidomic analysis on the vehicle and SolB group under positive and negative ion modes. A: Principal component analysis (PCA) and orthogonal partial least-discriminant analysis (OPLS-DA) score plots of lipidomic profiles obtained from LC-MS/MS, n = 5/group. B-C: Comparison of the changed hepatic lipids. Data are expressed as means ± SD (n = 5). *P < 0.05, **P < 0.01, ***P < 0.001 vs the vehicle group |
进一步使用LipidSearch鉴定不同脂质以及提取相应峰面积, 筛选VIP值> 1的潜在标志脂质小分子, 正离子模式下21个, 负离子模式下14个; 分类比较发现甘油三酯(triglyceride, TG) 21个, 分别为TG (18:1/18:1/18:2)、TG (18:1/18:1/18:1)、TG (16:1/18:1/18:2)、TG (16:0/18:1/20:4)、TG (16:0/18:1/18:2)等; 磷脂酰胆碱(phosphatidylcholine, PC) 4个, 分别为PC (18:0/20:3)、PC (18:0/18:2)、PC (16:1/18:2)、PC (16:0/16:0);磷脂酰肌醇(phosphatidylinositol, PI) 3个, 分别为PI (18:0/20:4)、PI (18:0/20:3)、PI (16:0/18:2);磷脂酰乙醇胺(phosphatidylethanolamine, PE) 4个, 分别为PE (19:0/20:4)、PE (16:1/22:6)、PE (16:0/20:4)、PE (16:0p/20:4);鞘磷脂(sphingomyelin, SM) 2个, 是SM (d24:0/18:2)、SM (d18:1/16:0);单半乳糖甘油二酯(monogalactosyl diglyceride, MGDG) 1个, 是MGDG (18:2/20:4)。各类差异脂质的变化情况和具体信息见图 3B-C及表 2。其中, 这些差异脂质主要以TG类为主, 并且不同碳链以及不同脂肪酸链的TG含量均显著增加, 不同脂肪酸链的PE均显著减少。
| Table 2 Identification of the changed hepatic lipids after SolB treatment. aChange trend of SolB group versus the vehicle group (*P < 0.05, **P < 0.01, ***P < 0.001). TG: Triglyceride; PC: Phosphatidylcholine; PI: Phosphatidylinositol; PE: Phosphatidylethanolamine; MGDG: Monogalactosyl diglyceride; SM: Sphingomyelin |
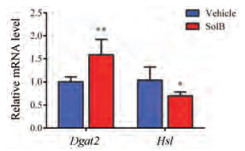
通过脂质组学的方法发现SolB显著改变肝细胞脂质组后, 进一步检测给予SolB后肝细胞脂质代谢相关基因的mRNA水平变化。结果显示, TG合成相关基因Dgat2的表达显著增加, TG水解相关基因Hsl的表达显著降低(图 4)。
|
Figure 4 Effect of SolB on the mRNA expression of genes related to TG homeostasis. Data are expressed as means ± SD (n = 5). *P < 0.05, **P < 0.01 vs the vehicle group |
本研究发现SolB能够促进小鼠肝增大, 且未造成肝脏的损伤和炎症(血清ALT、AST和ALP水平无显著性变化, 炎症因子Infγ、Tnfα以及Il-6的表达亦无显著变化)。以上结果表明SolB所致肝增大是生理性/良性肝增大。
肝脏是机体脂质代谢的主要器官, 在调控能量代谢方面发挥重要作用[23]。本研究发现, 小鼠在给予SolB后肝细胞内橘红色和红色脂滴增加, 并且肝脏组织中TG含量升高, 提示肝细胞TG合成增加。脂质组学结果也表明, 在脂质组学分析发现的35个差异代谢物中, TG类物质有21个, 并且表现为不同碳链以及脂肪酸链的TG含量均显著增加, 这进一步说明了SolB导致小鼠肝脏TG含量升高。有文献[24]资料显示, PXR特异性激动剂PCN能够通过上调硬脂酰辅酶A去饱和酶1 (stearoyl-CoA desaturase 1, SCD1, 参与TG生成), 和下调肉碱棕榈酰转移酶1A (carnitine palmitoyltransferase, CPT1A, 参与脂肪酸β氧化), 促进肝脏TG的累积。与此同时, 作者[22]前期也报道了SolB对PXR具有显著的激动作用, 提示SolB可能通过激动PXR造成肝脏TG的累积。TG是一种有效的能量供体, 已有研究发现在肝再生早期, 肝细胞会出现短暂的脂质累积, 为肝再生过程提供能量, 利于肝细胞增殖[14, 25]。给予SolB后小鼠肝脏TG含量增加, 说明SolB增加了肝脏的能量合成。
二酰基甘油转移酶(diacylglycerol acyltransferase, DGAT)负责甘油二酯(diglyceride, DG)向TG转化, 是TG酯化过程的关键调节酶[26]。研究表明Dgat2敲除小鼠出生不久后死亡, 体内TG含量仅为野生型小鼠的10%, 肝细胞TG含量几乎检测不到, 说明DGAT2介导的TG合成对肝脏能量代谢至关重要[27]。激素敏感性脂肪酶(hormone-sensitive lipase, HSL)参与调控TG的分解代谢, 是经典的脂肪分解限速酶[28]。给予SolB后, 肝脏组织的Dgat2表达增加, Hsl表达降低, 说明SolB通过影响Dgat2和Hsl促进了TG合成并抑制其水解, 从而显著升高肝脏中TG含量, 增加肝脏的能量合成。
PC和PE是细胞膜重要的磷脂组成成分, 两者在细胞膜上的分布是细胞膜完整性和物质跨膜运输的重要调节因素[29]。PC/PE比值下降会增加细胞膜通透性, 导致肝细胞内容物渗出, 进而激活炎症因子介导的肝损伤[30]。本研究中, PC (18:0/20:3)和PC (18:0/18:2)含量增加, 而PC (16:1/18:2)和PC (16:0/16:0)含量减少, 说明PC含量处于动态平衡状态。此外, 虽然PE (19:0/20:4)、PE (16:1/22:6)、PE (16:0/20:4)以及PE (16:0p/20:4)含量均降低, 但变化幅度不大, 这进一步说明PC/PE比值维持在正常比值范围内。这些脂质的变化与前述ALT、AST、ALP及炎症因子的结果相一致, 说明SolB所致肝增大没有激活炎症因子和造成肝损伤。
综上所述, SolB可促进小鼠良性肝增大。脂质组学分析表明SolB所致肝增大过程中TG含量显著升高, 说明给予SolB增加了肝细胞的能量合成和利用, 提示肝细胞能量代谢增强。本研究阐明了SolB促进肝增大过程中的脂质变化, 为进一步研究SolB促进肝增大的分子机制提供潜在线索。
| [1] |
Trefts E, Gannon M, Wasserman DH. The liver[J]. Curr Biol, 2017, 27: 1147-1151. DOI:10.1016/j.cub.2017.09.019 |
| [2] |
Hall AP, Elcombe CR, Foster JR, et al. Liver hypertrophy:a review of adaptive (adverse and non-adverse) changes‒conclusions from the 3rd International ESTP Expert Workshop[J]. Toxicol Pathol, 2012, 40: 971-994. DOI:10.1177/0192623312448935 |
| [3] |
Edwards JE, Dalton AJ. Induction of cirrhosis of the liver and of hepatomas in mice with carbon tetrachloride[J]. J Natl Cancer Inst, 1942, 3: 19-41. |
| [4] |
Eschenbrenner AB, Miller E. Induction of hepatomas in mice by repeated oral administration of chloroform, with observations on sex differences[J]. J Natl Cancer Inst, 1945, 5: 251-255. |
| [5] |
Bock KW, Kohle C. Ah receptor- and TCDD-mediated liver tumor promotion:clonal selection and expansion of cells evading growth arrest and apoptosis[J]. Biochem Pharmacol, 2005, 69: 1403-1408. DOI:10.1016/j.bcp.2005.02.004 |
| [6] |
Huang W, Zhang J, Washington M, et al. Xenobiotic stress induces hepatomegaly and liver tumors via the nuclear receptor constitutive androstane receptor[J]. Mol Endocrinol, 2005, 19: 1646-1653. DOI:10.1210/me.2004-0520 |
| [7] |
Jiang YM, Feng DC, Ma XC, et al. Pregnane X receptor regulates liver size and liver cell fate by yes-associated protein activation in mice[J]. Hepatology, 2019, 69: 343-358. DOI:10.1002/hep.30131 |
| [8] |
Price SC, Hinton RH, Mitchell FE, et al. Time and dose study on the response of rats to the hypolipidaemic drug fenofibrate[J]. Toxicology, 1986, 41: 169-191. DOI:10.1016/0300-483X(86)90198-8 |
| [9] |
Masoro EJ. Lipids and lipid metabolism[J]. Annu Rev Physiol, 1977, 39: 301-321. DOI:10.1146/annurev.ph.39.030177.001505 |
| [10] |
Fahy E, Cotter D, Sud M, et al. Lipid classification, structures and tools[J]. Biochim Biophys Acta, 2011, 1811: 637-647. DOI:10.1016/j.bbalip.2011.06.009 |
| [11] |
Zhang SM, Qi DM, Cao YM, et al. Lipidomics study on intervention by Uncaria on hepatic metabolic disorder in spontaneously hypertensive rats[J]. Acta Pharm Sin (药学学报), 2019, 54: 1636-1644. |
| [12] |
Schofield PS, Sugden MC, Corstorphine CG, et al. Altered interactions between lipogenesis and fatty acid oxidation in regenerating rat liver[J]. Biochem J, 1987, 241: 469-474. DOI:10.1042/bj2410469 |
| [13] |
Tijburg LB, Nyathi CB, Meijer GW, et al. Biosynthesis and secretion of triacylglycerol in rat liver after partial hepatectomy[J]. Biochem J, 1991, 277: 723-728. DOI:10.1042/bj2770723 |
| [14] |
Shteyer E, Liao Y, Muglia LJ, et al. Disruption of hepatic adipogenesis is associated with impaired liver regeneration in mice[J]. Hepatology, 2004, 40: 1322-1332. DOI:10.1002/hep.20462 |
| [15] |
Friedman SL, Neuschwander-Tetri BA, Rinella M, et al. Mechanisms of NAFLD development and therapeutic strategies[J]. Nat Med, 2018, 24: 908-922. DOI:10.1038/s41591-018-0104-9 |
| [16] |
Wei H, Sun L, Tai Z, et al. A simple and sensitive HPLC method for the simultaneous determination of eight bioactive components and fingerprint analysis of Schisandra sphenanthera[J]. Anal Chim Acta, 2010, 662: 97-104. DOI:10.1016/j.aca.2009.12.039 |
| [17] |
Ma YX, Huang YX, Zhou HC, et al. Advances in modern pharmacological and clinical studies on Schisandra chinensis[J]. Inf Tradit Chin Med (中医药信息), 2014, 31: 125-126. |
| [18] |
Yu Q. Effect of Different Extracts of Schisandra chinensis on Lipid Metabolism in Mice (南/北五味子不同提取物对小鼠脂质代谢的影响初探)[D]. Beijing: Beijing University of Chinese Medicine, 2013.
|
| [19] |
Zhang Y, Zhao J, Zhou SF, et al. Biochemical mechanism underlying hypertriglyceridemia and hepatic steatosis/hepatomegaly induced by acute schisandrin B treatment in mice[J]. Lipids Health Dis, 2017, 16: 8. DOI:10.1186/s12944-017-0406-9 |
| [20] |
Jiang YM, Fan XM, Wang Y, et al. Schisandrol B protects against acetaminophen-induced hepatotoxicity by inhibition of CYP-mediated bioactivation and regulation of liver regeneration[J]. Toxicol Sci, 2015, 143: 107-115. DOI:10.1093/toxsci/kfu216 |
| [21] |
Jiang YM, Wang Y, Tan HS, et al. Schisandrol B protects against acetaminophen-induced acute hepatotoxicity in mice via activation of the NRF2/ARE signaling pathway[J]. Acta Pharmacol Sin, 2016, 37: 382-389. DOI:10.1038/aps.2015.120 |
| [22] |
Zeng H, Jiang Y, Chen P, et al. Schisandrol B protects against cholestatic liver injury through pregnane X receptor[J]. Br J Pharmacol, 2017, 174: 672-688. DOI:10.1111/bph.13729 |
| [23] |
Alves-Bezerra M, Cohen DE. Triglyceride metabolism in the liver[J]. Compr Physiol, 2017, 8: 1-8. |
| [24] |
Nakamura K, Moore R, Negishi M, et al. Nuclear pregnane X receptor cross-talk with FoxA2 to mediate drug-induced regulation of lipid metabolism in fasting mouse liver[J]. J of Biol Chem, 2007, 282: 9768-9776. DOI:10.1074/jbc.M610072200 |
| [25] |
Farrell GC. Probing Prometheus:fat fueling the fire?[J]. Hepatology, 2004, 40: 1252-1255. DOI:10.1002/hep.20522 |
| [26] |
Yen CL, Stone SJ, Koliwad S, et al. Thematic review series:glycerolipids. DGAT enzymes and triacylglycerol biosynthesis[J]. J Lipid Res, 2008, 49: 2283-2301. DOI:10.1194/jlr.R800018-JLR200 |
| [27] |
Stone SJ, Myers HM, Watkins SM, et al. Lipopenia and skin barrier abnormalities in DGAT2-deficient mice[J]. J Biol Chem, 2004, 279: 11767-11776. DOI:10.1074/jbc.M311000200 |
| [28] |
Schweiger M, Schreiber R, Haemmerle G, et al. Adipose triglyceride lipase and hormone-sensitive lipase are the major enzymes in adipose tissue triacylglycerol catabolism[J]. J Biol Chem, 2006, 281: 40236-40241. DOI:10.1074/jbc.M608048200 |
| [29] |
Fuentes NR, Salinas ML, Kim E, et al. Emerging role of chemoprotective agents in the dynamic shaping of plasma membrane organization[J]. Biochim Biophys Acta, 2017, 1859: 1668-1678. DOI:10.1016/j.bbamem.2017.03.014 |
| [30] |
Fajardo VA, Mcmeekin L, Leblanc PJ. Influence of phospholipid species on membrane fluidity:a meta-analysis for a novel phospholipid fluidity index[J]. J Membr Biol, 2011, 244: 97-103. DOI:10.1007/s00232-011-9401-7 |
 2020, Vol. 55
2020, Vol. 55


