脑卒中是一种以脑血管闭塞或破裂为特征的脑血管循环障碍性疾病, 其分为缺血性脑卒中和出血性脑卒中, 具有致残率高、死亡率高、复发率高和并发症多的特点[1]。其中, 缺血性脑卒中约占所有脑卒中的85%, 出血性脑卒中约占脑卒中的15%, 这极大地损害了人类健康[2]。在世界范围内, 脑卒中是导致死亡的第二大原因和长期残疾的主要原因[3]。尽管近年来医疗技术的进步和脑卒中死亡率的下降, 但脑卒中仍然是最严重和致命的疾病之一。脑卒中起病急, 变化快, 但也是一个不断积累的过程。研究表明, 中老年患者在发病前大多存在气血失调的现象, 而且多数人会发生脑部细微血栓, 并伴随少许脑卒中前兆症状[4]。从侧面反映了对脑卒中预防的重要性。现代研究表明, 桃核承气汤在预防和治疗脑卒中上发挥着作用。桃核承气汤对大鼠的血管具有保护作用, 其能有效改善血液流变的状态, 并抑制凋亡对脑出血后神经元的损伤。桃核承气汤源自张仲景的《伤寒论》, 方中桃仁破血行瘀, 大黄泻热逐瘀, 桂枝活血通络, 甘草甘平和缓, 诸药合用, 共奏破血下瘀之效。桃核承气汤近年来已广泛用于脑血管疾病的治疗。研究表明, 桃核承气汤对脑出血后的继发性神经元损伤有保护作用[5]。由于中药复方的复杂性, 桃核承气汤的药效机制仍不清楚。
网络药理学在2007年由Hopkins提出, 被认为是药物发现的下一个范例[6]。基于网络药理学的研究策略已被广泛用于中药、中药药对和复方研究中[7, 8]。本研究基于网络药理学方法, 结合药物吸收(absorption)、分布(distribution)、代谢(metabolism)和排泄(excretion) (ADME)筛选, ADME代表了药物进入机体后机体对药物的处置过程, 得到桃核承气汤的活性成分, 随后进行靶点的预测和筛选, 中药-成分-靶点-疾病网络图和蛋白互作网络图的构建, 然后进行功能富集分析。最后, 应用Gene Expression Omnibus (GEO)数据库的验证技术和分子对接技术对桃核承气汤防治脑卒中的关键靶点进行分析, 旨在阐释桃核承气汤防治脑卒中双向调节分子网络机制。
材料与方法桃核承气汤中活性成分的数据库建立 桃核承气汤由大黄、桃仁、桂枝、甘草和芒硝组成, 其中芒硝是一种矿物药, 故此处不做研究。在Traditional Chinese Medicines Systems Pharmacology Database (TCMSP, http://tcmspw.com/)、Integrative Pharmacology-based Research Platform of Traditional Chinese Medicine (TCMIP, http://www.tcmip.cn/)、a Bioinformatics Analysis Tool for Molecular Mechanism of Traditional Chinese Medicine (BATMAN-TCM, http://bionet.ncpsb.org/batman-tcm/)和Traditional Chinese Medicine Integrated Database (TCMID, http://www.megabionet.org/tcmid/)数据库, 以及PubMed、Springer Link和CNKI数据库查找桃核承气汤中4种植物药的成分。通过PubChem (https://pubchem.ncbi.nlm.nih.gov/)数据库下载上述获得的成分的结构, 对于数据库中未收录结构的成分, 用ChemBioDraw Ultra 12.0软件进行绘制, 构建小分子数据库。
活性成分的筛选 使用ADME对桃核承气汤中的活性成分进行筛选。ADME是用来描述桃核承气汤中成分的一系列药代动力学参数, 包含口服生物利用度(OB)和药物相似性(DL)。OB通常用于确定口服给药的药物, 并提示ADME过程的趋同。DL是用于药物设计的定性原理, 可准确预测化合物的“药物样”状态。在本项研究中, OB ≥ 30%, DL ≥ 0.18。
桃核承气汤靶点的预测与筛选 通过PharmMapper在线分析平台(http://www.lilab-ecust.cn/pharmmapper/)、TCMSP数据库和BATMAN-TCM数据库预测上述小分子的靶点。将预测的靶点导入UniProt数据库(https://www.uniprot.org/), 在UniProtKB搜索页面中输入靶点的名称, 并将该物种限定为“Human”, 搜索其官方名称。将上述获得的靶点与GeneCards (https://www.genecards.org/)、OMIM (https://omim.org/)和TTD (http://bidd.nus.edu.sg/group/cjttd/)数据库中与脑卒中相关的靶点进行比对, 最终筛选出桃核承气汤防治脑卒中的靶点。
分子网络分析 使用Cytoscape 3.7.1软件构建中药-成分-靶标-疾病网络。组成网络节点的实体是桃核承气汤的4种植物药、它们相关联的活性化合物、相关靶点和疾病; 将桃核承气汤防治脑卒中的靶点导入到String数据库(https://string-db.org/)中, 以获得靶点之间的相互作用关系。将String数据库分析所得的蛋白相互作用关系表导入Cytoscape3.7.1来构建蛋白-蛋白相互作用(PPI)网络。同时, 使用Cytoscape插件计算degree值, 取所有靶点的“degree”值的中位数2倍数作为临界值, 来获得桃核承气汤防治脑卒中的关键靶点。随后将关键靶点在DisGeNET (http://www.disgenet.org/)数据库中进行靶点作用归属; 为系统分析桃核承气汤防治脑卒中的生物学过程和通路, 利用R语言程序包clusterProfiler (http://bioconductor.org/packages/release/bioc/html/clusterProfiler.html)进行GO富集分析和KEGG通路分析(P < 0.05时具有统计学意义), 进一步验证核桃承气汤防治脑卒中的靶点。利用ClueGo + CluePedia插件, 获得KEGG通路富集图。
GEO数据对关键靶点的验证 GEO数据库是一个国际高通量实验数据的公共存储库, 接受许多类别的高通量功能基因组数据, 包括所有基于阵列的应用程序和一些高通量测序数据。它可存档和免费分发研究团体提交的微阵列、高通量测序、NanoString、RT-PCR和传统SAGE数据。从GEO数据库(Affymetrix GPL570平台、Affymetrix人类基因组U133 Plus 2.0阵列)下载GSE58294数据集。GSE58294数据集包含23个对照样本和69个脑卒中样本。GEO2R (http://www.ncbi.nlm.nih.gov/geo/geo2r)的统计分析用于微阵列数据的预处理和基因差异表达分析。使用GEO2R筛选GSE58294数据集中脑卒中和非脑卒中样本之间的差异表达基因(diferentially expressed genes, DEGs)。在GSE58294数据集中, 将上述桃核承气汤防治脑卒中的关键靶点定位到上述筛选出的差异基因上, 得到了相应的上下调关系, 间接揭示了桃核承气汤防治脑卒中的分子机制。
分子对接对关键靶点的验证 为验证桃核承气汤防治脑卒中的关键靶点与其对应活性成分之间的结合活性, 运用SYBYL-X 2.0软件将上述得到的关键靶点与其对应活性成分进行对接, 分析对接结果。
结果 1 桃核承气汤的活性成分的筛选在TCMSP、TCMIP、BATMAN-TCM和TCMID数据库, 以及PubMed、Springer Link和CNKI数据库查找到桃核承气汤成分658个。再以ADME参数“OB ≥ 30%”和“DL ≥ 0.18”[9, 10]为筛选条件, 最终得到, 大黄(DH) 18个、桃仁(TR) 14个、桂枝(GZ) 5个和甘草(GC) 18个[其中(+)-catechin为大黄和桂枝的共有成分, kaempferol为大黄和甘草的共有成分, beta-sitosterol为大黄、桃仁和桂枝的共有成分]。
2 桃核承气汤靶点的预测与筛选通过PharmMapper、TCMSP、BATMAN-TCM数据库获得桃核承气汤的靶点365个, 采用GeneCards、OMIM和TTD数据库获得与脑卒中相关的靶点5 503个, 将这365个靶点与脑卒中相关的靶点进行了匹配, 得到154个重叠基因(图 1)。

|
Figure 1 The Veen diagram of Taohechengqi decoction targets related to stroke in GeneCards, OMIM and TTD databases. THCQD: Taohechengqi decoction |
为进一步探索桃核承气汤在脑卒中防治中的分子机制, 建立了桃核承气汤的中药-成分-靶标-疾病网络图(图 2)。

|
Figure 2 Medicine-component-target-disease network diagram of Taohechengqi decoction. The purple octagon in the picture is the medicine of Taohechengqi decoction, the orange diamond is the corresponding ingredient of Taohechengqi decoction, the pink diamond is the common ingredient of Rhei Radix et Rhizoma, Persicae Semen and Cinnamomi Ramulus, the yellow diamond is the common ingredient of Rhei Radix et Rhizoma and Cinnamomi Ramulus, and the blue diamond is the common ingredient of Rhei Radix et Rhizoma and Licorice, the green V shape is the corresponding target of the component, the red square is disease |
通过对筛选到的靶点分析, 可以看出桃核承气汤在脑卒中的预防和治疗中发挥着双向调节作用。保护血管和抑制血栓形成可能是桃核承气汤发挥预防脑卒中的主要机制之一, 其涉及的靶点主要为雌激素受体1 (ESR1)、内皮型一氧化氮合酶(NOS3)和血清白蛋白(ALB)。NOS3主要在内皮细胞中表达, 并维持血管舒张和控制血压。此外, 其催化NO的能力可以促进血管平滑肌细胞的定向, 并抑制血小板在血管内皮表面的黏附和聚集。作为从血管内皮细胞合成一氧化氮的关键酶, NOS3可以拮抗ROS的产生并保护血管内皮[11]; ESR1主要在内皮细胞、血管平滑肌细胞和巨噬细胞中表达, 并在血管壁的生理和功能中发挥重要作用。ESR1基因的突变可能导致脑梗死[12]; ALB是形成血栓的成分之一, 其构象的变化与血栓形成有重要的关联。
抑制血小板聚集、保护神经、抗炎、抗氧化和细胞凋亡可能也是桃核承气汤发挥治疗脑卒中的主要机制之一, 其涉及的靶点主要为基质金属蛋白酶9 (MMP9)、丝裂原活化蛋白激酶14 (MAPK14)、过氧化物酶体增生激活受体γ (PPARG)、环加氧酶2 (PTGS2)、细胞间黏附分子1 (ICAM1)、白细胞介素1β (IL1B)、髓过氧化物酶(MPO)、原癌基因酪氨酸蛋白激酶Src (SRC)、胱天蛋白酶8 (CASP8)、雄激素受体(AR)和转录因子p65 (RELA)。炎症反应贯穿于脑卒中发生发展的全过程。炎症反应在缺血性脑损伤后的血脑屏障破坏中起关键作用[13]。PPARG可以抗炎[14]; PTGS2可催化花生四烯酸向前列腺素的转化, 前列腺素是炎症的关键介质[15]; MMP9的表达在人类脑卒中时显著增加。MMP9水平的升高与神经元损伤、细胞凋亡、脑水肿、出血和转化有关[16]; MAPK14是一种细胞凋亡促进蛋白, 可协调细胞对压力和炎症的反应并在脑卒中后介导神经元凋亡[17]; 研究表明ICAM1在脑梗死大鼠的脑组织中高表达, 故抑制ICAM1在脑组织中的表达可能发挥对脑组织的保护作用[18]; IL1B水平的降低是急性脑卒中期患者的主要症状[19]; MPO为血红素过氧化物酶超家族的成员, 研究表明MPO与心血管疾病、脑卒中和静脉血栓形成有关, MPO升高导致低度炎症和氧化应激增加, 其可能使心血管疾病(CVD)风险增加[20]。
4 蛋白-蛋白相互作用网络的构建及关键靶点的筛选为进一步阐明桃核承气汤的脑卒中靶点和靶点之间的相互作用, 构建了脑卒中相关靶点的PPI网络(图 3)。PPI关系网络有150个节点和1 411条边(COA7、CA12、P4HA2、LYZL6与其他蛋白没有相互作用)。使用String工具确定150个靶点的相互作用关系, 这里选择的标准为combined score > 0.4。利用degree值筛选PPI网络中的关键靶点。经过计算, 取所有靶点“degree”值的中位数2倍数15作为临界值, 共筛选到26个关键靶点。靶点作用归属表明, 桃核承气汤在防治脑卒中时有转录因子、信号分子酶调节剂、酶(水解酶、蛋白酶、转移酶、激酶氧化还原酶)、核酸结合和伴侣分子等物质参与。

|
Figure 3 Protein-protein interaction (PPI) network diagram of Taohechengqi decoction with stroke-related targets. The degree value is reflected by the size and color of the node. The larger the node, the larger the degree value, indicating that the node is more important in the network. The thickness of the edge is related to the combined score. The thicker the edge, the larger the combined score, indicating a stronger protein-protein interaction |
使用R语言程序包clusterProfiler对上述筛选得到的26个关键靶点进行了GO富集分析和KEGG通路富集分析。根据GO富集的结果, 生物学进程主要为活性氧代谢过程、凋亡信号通路的调节、对氧化应激的响应、对营养水平的响应、炎症反应的调节、对细胞外刺激的响应、凋亡信号通路的负调节、细胞对生物刺激的反应、外源性凋亡信号通路和对活性氧的反应等(图 4)。GO富集分析表明, 上述靶点主要在调节氧化应激、炎症反应和细胞凋亡等生物过程中起作用。

|
Figure 4 GO enrichment analysis of key targets related to stroke in Taohechengqi decoction |
此外, KEGG通路分析共得到141条通路, 此处选择了具有统计学意义的(P < 0.05) 20条, 见图 5。KEGG通路分析表明, 靶点主要参与的通路有肿瘤坏死因子信号通路、雌激素信号通路、丝裂原活化蛋白激酶信号通路、磷酯酰肌醇-3激酶-苏氨酸激酶信号通路、血小板活化、核因子κB信号通路和血管内皮生长因子信号通路等。通路分析表明, 桃核承气汤可能通过雌激素信号通路、血管内皮生长因子信号通路发挥预防脑卒中的作用, 对应靶点为ESR1、NOS3;通过肿瘤坏死因子信号通路、丝裂原活化蛋白激酶信号通路、磷酯酰肌醇-3激酶-苏氨酸激酶信号通路、血小板活化和核因子κB信号通路发挥治疗脑卒中的作用, 对应靶点为ICAM1、IL1B、MAPK14、MMP9、PPARG、PTGS2、TP53、RELA和SRC。

|
Figure 5 Enrichment analysis of KEGG pathway in key targets related to stroke in Taohechengqi decoction |
为验证桃核承气汤防治脑卒中的关键靶点, 从GEO数据库下载了GSE58294数据集。用GEO2R对GSE58294数据集进行基因差异表达分析, 随后将桃核承气汤防治脑卒中的关键靶点定位到已分析好的GSE58294数据集, 得到15个DEGs (P < 0.05), 其中10个上调基因, 5个下调基因(图 6)。由图可知, 桃核承气汤防治脑卒中的关键靶点AR、CASP8、ICAM1、IL1B、MAPK14、MMP9、MPO、PPARG、PTGS2和TP53是上调基因; ALB、ESR1、NOS3、RELA和SRC为下调基因。GEO分析说明, 桃核承气汤可能通过下调ESR1、NOS3来预防脑卒中; 通过上调ICAM1、IL1B、MAPK14、MMP9、PPARG、PTGS2、TP53, 下调RELA、SRC来治疗脑卒中。由此可见, 桃核承气汤在防治脑卒中时发挥着双向调节作用, 可能是通过使上调的基因下调或下调的基因上调来达到一个动态平衡。
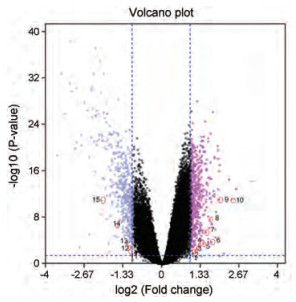
|
Figure 6 The volcano plot of differentially expressed genes (DEGs). The purple part shows the downregulated genes, the pink part indicates the upregulated genes, and the black part represents the stable genes. The red circle in the figure represents the key targets for prevention and treatment of stroke by Taohechengqi decoction, where 1-15 respectively represents cellular tumor antigen p53 (TP53), intercellular adhesion molecule 1 (ICAM1), interleukin-1 beta (IL1B), androgen receptor (AR), peroxisome proliferator-activated receptor gamma (PPARG), caspase-8 (CASP8), myeloperoxidase (MPO), prostaglandin G/H synthase 2 (PTGS2), matrix metalloproteinase-9 (MMP9), mitogen-activated protein kinase 14 (MAPK14), serum albumin (ALB), proto-oncogene tyrosine-protein kinase Src (SRC), transcription factor p65 (RELA), nitric oxide synthase, endothelial (NOS3), estrogen receptor (ESR1) |
通过SYBYL对接软件对上述研究得到的桃核承气汤防治脑卒中的15个关键靶点和对应的桃核承气汤中4种植物药的主要成分进行对接, 并结合阳性对照实验, 即应用桃核承气汤防治脑卒中的15个关键靶点各自相应的原配体作为阳性配体和对应的15个靶点进行对接来验证桃核承气汤防治脑卒中的关键靶点和对应成分之间的结合活性。对接得分结果见表 1、2。
| Table 1 Docking results of key targets and corresponding components of Taohechengqi decoction in the prevention and treatment of stroke |
| Table 2 Target protein docking results with positive ligands. NAG: N-Acetyl-D-glucosamine; MPD: (4S)-2-Methyl-2, 4-pentanediol; ACT: Acetate ion; PGO: S-1, 2-Propanediol; BCN: Bicine; BOG: B-Octylglucoside; DAO: Lauric acid; DMS: Dimethyl sulfoxide; ZN: Zinc ion |
利用SYBYL-X 2.0软件中的total score打分函数对靶蛋白和小分子的结合作用进行分析。Total score打分函数综合考虑了极性作用、疏水作用、焓和溶剂化等因素, 该值越大, 对接复合物越稳定, 说明小分子化合物与大分子蛋白质的匹配结合作用越好[21]。本研究通过total score的高低对化合物与靶点的结合活性进行评价。将靶蛋白与对接成功化合物的total score与阳性配体的total score比较, 若靶蛋白与化合物的total score比与阳性配体的total score高, 则说明该靶蛋白与化合物的匹配度较高或相近。由表 1可知, 桃核承气汤防治脑卒中的15个关键靶点和对应的桃核承气汤中的主要成分进行对接后, 有10个关键靶点与桃核承气汤的17个主要成分有较好的相互作用, 其中得分大于8.0的有1个(2.85%); 在8.0~5.0的有17个(48.58%); 在5.0~3.0的有14个(40%); 小于3.0的有3个(8.57%)。且阳性对照实验(表 2)发现桃核承气汤防治脑卒中的关键靶点与对应活性小分子的对接得分均大于它们与阳性配体的对接得分。由此可知, 桃核承气汤中防治脑卒中的关键靶点和对应成分之间均具有一定的结合活性, 且结合活性较好。
讨论大黄可通过抑制氧化应激和细胞凋亡发挥神经保护作用, 其中大黄的蒽醌类成分对缺血性脑卒中具有良好的神经保护作用[22]。大黄酸能降低缺血再灌注损伤大鼠caspase-9、Bax和caspase-3的表达从而减少梗死面积[22]。芦荟大黄素具有清除氧自由基, 降低血压的作用, 此外, 其对大鼠脑缺血具有保护作用[23]。Procyanidin B1对抗氧化活性有积极的作用[24]; 桃仁中hederagenin对PD模型小鼠发生的运动障碍具有改善作用, 体现了其神经保护作用[25], Choi等[26]通过实验证实了hederagenin的抗炎作用。Campesterol可抗血管生成; 桂枝中taxifolin通过抑制脂质过氧化和抗炎来达到保护大鼠脑缺血/再灌注(CI/R)损伤[27]; 甘草中liquiritin有神经保护作用。Glycyrol具有抗氧化、抗血管生成和抗炎的特性; 大黄和桂枝的共有成分(+)-catechin具有神经保护和抗氧化等作用[28]。大黄和甘草的共同成分kaempferol具有抗氧化、抗炎和保护神经等作用[29]。大黄、桃仁和桂枝的共同成分beta-sitosterol药理活性较广, 主要有抗炎、抗氧化和抑制血小板聚集等作用[30]。
现代研究表明, 肿瘤坏死因子信号通路中, TNF信号的病理或治疗干扰会影响微血管张力和全身血液动力学。在缺血性脑卒中中肿瘤坏死因子水平明显升高, 其在缺血性脑卒中的发病机制中发挥重要作用[31]。通路上的靶点caspase-3、caspase-8水平升高与缺血性脑卒中的发生率增加有关[32]。靶点RELA介导了脑缺血中自噬的激活[33]; 血管内皮生长因子信号通路对血管稳态具有重要意义[34], 其参与血管新生整个过程, 发挥着重要的作用, VEGFs促进脑卒中后缺血灶局部血管新生, 其在损伤和缺氧刺激下, 对缺血半暗带内残存毛细血管内皮细胞的增殖发挥作用, 从而促进血管新生[35]。靶点SRC调节局灶性脑缺血再灌注后血管生成因子和血管通透性[36]。
通路分析还发现, 糖尿病并发症中的糖基化终产物及其受体信号通路和Ⅰ型糖尿病通路与糖尿病有关, 阿尔茨海默病通路与阿尔茨海默病有关。这说明桃核承气汤在防治脑卒中的同时可能也参与了糖尿病和阿尔茨海默病的进程, 充分体现了桃核承气汤的老方新用, 异病同治。
综上所述, 本研究以中医药理论为指导, 以临床数据为依据, 通过网络药理学、GEO分析和分子对接方法, 建立中药-成分-靶点-疾病网络和PPI网络, 结合功能富集分析来探索桃核承气汤防治脑卒中的分子机制, 可能与肿瘤坏死因子信号通路和血管内皮生长因子信号通路介导的疗效相关, 为脑卒中预防提供了一种新的策略, 为后期进一步开展桃核承气汤防治脑卒中的药效作用机制研究提供了依据, 为中药复方的临床应用提供理论基础。
| [1] |
Cao HQ, Chen G, Dong ED. Ten-year review of cerebrovascular disease research funded by the National Natural Science Foundation of China[J]. Chin J Neurosurg (中华神经外科杂志), 2013, 29: 541-542. |
| [2] |
Han SY, Zhao YM. Function of N-methyl-D-aspartic acid receptors in cerebral stroke[J]. Chin Pharm J (中国药学杂志), 2017, 52: 1483-1487. |
| [3] |
Huo Y, Li J, Qin X, et al. Efficacy of folic acid therapy in primary prevention of stroke among adults with hypertension in China:the CSPPT randomized clinical trial[J]. J Am Med Associ, 2015, 313: 1325-1335. DOI:10.1001/jama.2015.2274 |
| [4] |
Guo L, Lv R, Wang XW, et al. Study on the dynamic evolution of body state before the onset of stroke[J]. J Beijing Univ Tradit Chin Med (北京中医药大学学报), 2004, 27: 19-23. |
| [5] |
Wei HY, Wang ZY. Research survey of Taohe Chengqi Tang[J]. Chin J Exp Tradit Med Formul (中国实验方剂学杂志), 2011, 17: 281-283. |
| [6] |
Hopkins AL. Network pharmacology:the next paradigm in drug discovery[J]. Nat Chem Biol, 2008, 4: 682-690. DOI:10.1038/nchembio.118 |
| [7] |
Shen X, Ren D, Gao J, et al. The molecular mechanism of stroke treatment by Fufang Longmai Ningfang based on network pharmacology[J]. Acta Pharm Sin (药学学报), 2019, 54: 1588-1596. |
| [8] |
Shen X, Xu RR, Pei LS, et al. Molecular mechanism of heat-clearing and detoxifying efficacy of Forsythia suspensa based on network[J]. Acta Pharm Sin (药学学报), 2018, 53: 1834-1842. |
| [9] |
Tao W, Xu X, Wang X, et al. Network pharmacology-based prediction of the active ingredients and potential targets of Chinese herbal Radix Curcumae formula for application to cardiovascular disease[J]. J Ethnopharmacol, 2013, 145: 1-10. DOI:10.1016/j.jep.2012.09.051 |
| [10] |
Xu X, Zhang W, Huang C, et al. A novel chemometric method for the prediction of human oral bioavailability[J]. Int J Mol Sci, 2012, 13: 6964-6982. DOI:10.3390/ijms13066964 |
| [11] |
Forstermann U, Sessa WC. Nitric oxide synthases:regulation and function[J]. Eur Heart J, 2012, 33: 829-837. DOI:10.1093/eurheartj/ehr304 |
| [12] |
Gao HH, Gao LB, Wen JM. Genetic polymorphisms in the ESR1 gene and cerebral infarction risk:a meta-analysis[J]. DNA Cell Biol, 2014, 33: 605-615. DOI:10.1089/dna.2013.2270 |
| [13] |
Liu PY, Zhang Z, Liu Y. TMEM16A inhibition preserves blood-brain barrier integrity after ischemic stroke[J]. Front Cell Neurosci, 2019, 13: 1-13. DOI:10.3389/fncel.2019.00360 |
| [14] |
Wang F, Jiang J, Xia L, et al. 4i, a novel PPARγ ligand, inhibits the production of inflammatory cytokines in murine macrophages by blocking NF-κB and MAPK pathway[J]. Chin J Cell Mol Immunol (细胞与分子免疫学杂志), 2018, 34: 499-504. |
| [15] |
Zhao J, Lv C, Wu Q, et al. Computational systems pharmacology reveals an antiplatelet and neuroprotective mechanism of Deng-Zhan-Xi-Xin injection in the treatment of ischemic stroke[J]. Pharmacol Res, 2019, 147: 104365. DOI:10.1016/j.phrs.2019.104365 |
| [16] |
Chaturvedi M, Kaczmarek L. MMP-9 inhibition:a therapeutic strategy in ischemic stroke[J]. Mol Neurobiol, 2014, 49: 563-573. DOI:10.1007/s12035-013-8538-z |
| [17] |
Mao G, Ren P, Wang G, et al. MicroRNA-128-3p protects mouse against cerebral ischemia through reducing p38α mitogen-activated protein kinase activity[J]. J Mol Neurosci, 2017, 61: 152-158. DOI:10.1007/s12031-016-0871-z |
| [18] |
Tang L, Gao Y, Sun SL. Correlation between progression of the TCM syndromes and expression of the biomarkers in acute phase of ischemic stroke:based on the theory combining disease and syndrome[J]. Global Tradit Chin Med, 2018, 11: 44-48. |
| [19] |
Hovhannesyan RA, Hovhannisyan IG. Platelet aggregation and interleukins indicators impacting the outcomes of ischemic stroke[J]. J Stroke Cerebrovasc Dis, 2019, 28: 2038-2044. DOI:10.1016/j.jstrokecerebrovasdis.2019.02.023 |
| [20] |
Ndrepepa G. Myeloperoxidase-a bridge linking inflammation and oxidative stress with cardiovascular disease[J]. Clin Chim Acta, 2019, 493: 36-51. DOI:10.1016/j.cca.2019.02.022 |
| [21] |
Cavasotto CN, Abagyan RA. Protein flexibility in ligand docking and virtual screening to protein kinases[J]. J Mol Biol, 2004, 337: 209-225. DOI:10.1016/j.jmb.2004.01.003 |
| [22] |
Li X, Chu S, Liu Y, et al. Neuroprotective effects of anthraquinones from Rhubarb in central nervous system diseases[J]. Evid Based Complement Alternat Med, 2019, 2019: 3790728. DOI:10.1155/2019/3790728 |
| [23] |
Li M, Du ZM. Research progress on pharmacological effects of aloe-emodin[J]. Chin J Clin Pharmacol (中国临床药理学杂志), 2015, 31: 765-768. |
| [24] |
Zuriarrain A, Zuriarrain J, Puertas AI, et al. Polyphenolic profile in cider and antioxidant power[J]. J Sci Food Agric, 2014, 95: 2931-2943. DOI:10.1002/jsfa.7036 |
| [25] |
Xing Y, Nan ML, Wang X, et al. Research progress of hederagenin[J]. Chin J Exp Tradit Med Formul (中国实验方剂学杂志), 2017, 23: 234-242. |
| [26] |
Choi JM, Lee EO, Lee HJ, et al. Identification of campesterol from Chrysanthemum coronarium L. and its antiangiogenic activities[J]. Phytother Res, 2007, 21: 954-959. DOI:10.1002/ptr.2189 |
| [27] |
Yan F, Hu Y, Dong Z, et al. Protective effect of Taxifolin on cerebral ischemia/reperfusion injury in rats[J]. Med Front, 2013, 5: 76-77. |
| [28] |
Syed Hussein SS, Alfarizal Kamarudin MN, Kadir HA. (+)-Catechin attenuates NF-κB activation through regulation of Akt, MAPK, and AMPK signaling pathways in LPS-induced BV-2 microglial cells[J]. Am J Chin Med, 2015, 43: 927-952. DOI:10.1142/S0192415X15500548 |
| [29] |
Choi JH, Park SE, Kim SJ, et al. Kaempferol inhibits thrombosis and platelet activation[J]. Biochimie, 2015, 115: 177-186. DOI:10.1016/j.biochi.2015.06.001 |
| [30] |
Zhao JL, Tang SL, Chen GM, et al. Therapeutic mechanism of Gegen Qinlian Tang based on systematic pharmacology in treatment of type 2 diabetes[J]. Chin J Exp Tradit Med Formul (中国实验方剂学杂志), 2018, 24: 199-209. |
| [31] |
Wu J, Zhang X, Wang J, et al. Gene polymorphisms and circulating levels of the TNF-alpha are associated with ischemic stroke:a meta-analysis based on 19873 individuals[J]. Int Immunopharmacol, 2019, 75: 105827. DOI:10.1016/j.intimp.2019.105827 |
| [32] |
Muhammad IF, Borné Y, Melander O, et al. FADD (Fas-associated protein with death domain), caspase-3, and caspase-8 and incidence of ischemic stroke[J]. Stroke, 2018, 49: 2224-2226. DOI:10.1161/STROKEAHA.118.022063 |
| [33] |
Liang K, Zhu L, Tan JY. Identification of autophagy signaling network that contributes to stroke in the ischemic rodent brain via gene expression[J]. Neurosci Bull, 2015, 31: 480-490. DOI:10.1007/s12264-015-1547-3 |
| [34] |
Kofler NM, Simons M. Angiogenesis versus arteriogenesis:neuropilin 1 modulation of VEGF signaling[J]. F1000Prime Rep, 2015, 7: 26. DOI:10.12703/P7-26 |
| [35] |
Xiang BX, Liu TT, Sun FL, et al. Advances in research on VEGF related signaling pathways in angiogenesis[J]. Chin J Comp Med (中国比较医学杂志), 2015, 25: 81-86. |
| [36] |
Zan L, Zhang X, Xi Y, et al. Src regulates angiogenic factors and vascular permeability after focal cerebral ischemia-reperfusion[J]. Neuroscience, 2014, 262: 118-128. DOI:10.1016/j.neuroscience.2013.12.060 |
 2020, Vol. 55
2020, Vol. 55


