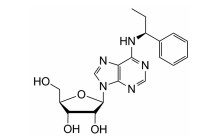
传统的镇静催眠药物作用在γ-氨基丁酸A型(GABAA)受体上, 通过增加氯离子通道开放频率或延长开放时间, 进而增加氯离子内流, 导致皮层神经元超极化从而发挥镇静催眠作用, 但临床上常见停药反跳、耐受和依赖成瘾等不良反应[1]。YZG-331是中国医学科学院药物研究所以临床疗效确切的安神中药天麻为起点, 通过药物化学和药理学紧密结合研究, 深入追踪发掘天麻中的微量有效成分, 经过进一步结构修饰得到的新型腺苷类衍生物, 结构见图 1。前期本实验室研究发现, 灌胃给予YZG-331 (1.25~40 mg·kg-1)可剂量依赖性地抑制小鼠的自主活动, 显著延长阈上剂量戊巴比妥钠诱导的小鼠睡眠时间、缩短入睡潜伏期及增加阈下剂量戊巴比妥诱导的小鼠入睡率, 且GABAA受体拮抗剂氟马西尼和荷包牡丹碱均不能拮抗YZG-331的镇静催眠作用[2], 提示YZG-331有较强的镇静催眠作用和有别于传统镇静催眠药物的作用靶点。因此, 阐明其作用机制对研发新型镇静催眠药物具有重大意义。
|
图 1 Chemical structure of YZG-331 |
基于YZG-331是腺苷类衍生物, 本实验室前期探究了YZG-331是否通过腺苷受体发挥作用。开场实验结果表明腺苷A2a受体拮抗剂SCH-58261不能拮抗YZG-331的镇静催眠作用, 腺苷A1受体拮抗剂8-环戊基-1, 3-二丙基黄嘌呤(8-cyclopentyl-1, 3-dipropylxanthine, DPCPX)可以部分拮抗YZG-331对小鼠自主活动的抑制作用。体外受体配体结合实验表明, YZG-331与腺苷A1受体的Ki值为2.15 μmol·L-1。以上结果提示, YZG-331可能是多靶点镇静催眠类化合物, 可以通过腺苷A1受体发挥一定作用, 但其作用靶点不仅仅是腺苷A1受体。谷氨酸(glutamate, Glu)作为脑内含量最高、分布最广、作用最重要的兴奋性神经递质, 在睡眠觉醒中的核心作用是在清醒和快动眼睡眠时维持皮层的兴奋状态[3, 4]。N-甲基-D-天冬氨酸受体(N-methyl-D-aspartate receptor, NMDAR)是一种重要的离子型Glu受体, 当Glu与膜上的NMDAR结合时会兴奋神经元, 已有研究表明某些NMDAR拮抗剂具有镇静麻醉作用, 如Ketamine[5]。故本研究探究了YZG-331对小鼠额叶皮层Glu含量及对其受体NMDAR的影响。
材料与方法 动物SPF级ICR小鼠, 雄性, 体重18~22 g, 购于北京斯贝福实验动物技术有限公司, 动物许可证号: SCXK (京) 2016-0002。动物在实验环境中适应3天, 环境温度25 ℃, 相对湿度40%~70%, 自由饮水和进食。动物实验均获得中国医学科学院药物研究所伦理委员会批准。
仪器微透析套管和探针(MD-2211, 美国BASi公司); 高效液相色谱泵(LC-10A, 日本岛津公司); 电化学检测器(LC-4C, BSA公司); 色谱柱(Diamonsil C18, 150 mm×4.6 mm, 5 μm, 北京迪马科技有限公司); 酶标仪(MQX200型, 美国Bio-Tek公司); DYY-7C型电泳仪(北京六一厂); ECL发光仪(Image Quant LAS 4000型, 美国GE公司); 磁力架(自制)。
药品和试剂化合物YZG-331 [N6-(4-hydroxybenzyl) adenosine riboside]由中国医学科学院药物研究所植化室提供(批号: 201110718);邻苯二甲醛(OPA, Sigma公司); MinuteTM质膜蛋白和细胞组分分离试剂盒SM005、MinuteTM内体和细胞组分分离试剂盒ED-028和MinuteTM变性蛋白溶解液WA-009 [英文特生物技术(北京)有限公司]; Protein A Magnetic Beads (Millipore Sigma公司); RIPA裂解液(强) (碧云天生物技术研究所); BCA蛋白浓度检测试剂盒(康为世纪生物技术有限公司); 5×蛋白上样缓冲液、蛋白磷酸酶抑制剂混合物、四甲基乙二胺(TEMED) (北京普利莱基因技术有限公司); 三羟甲基氨基甲烷、甘氨酸、过硫酸铵、蛋白酶抑制剂、十二烷基苯磺酸钠(SDS) (美国Amresco公司); 苯甲基磺酰氟(PMSF, 德国默克公司); 30%丙烯酰胺(北京兰博利德商贸有限公司); 化学发光ECL液(上海天能科技有限公司); 抗N-甲基-D-天冬氨酸受体(NMDAR) (GluN1)抗体(D65B7) (Cell Signaling Technology公司); 抗NMDAR2B (phospho S1303)抗体(ab81271)、抗NMDAR2B抗体(ab65783) (Abcam公司); 抗PSD95抗体(48638)、抗EEA1抗体(21601) (Signalway Antibody公司); 兔IgG (A7061) (碧云天试剂公司); 抗β-tubulin抗体(ab1017t) [博奥瑞京(北京)科技发展有限公司]; 抗Na/K ATPase抗体(14418-1-AP) (Proteintech公司)。其他试剂均为国产分析纯, 购于北京化工试剂公司。
高效液相-电化学法检测脑组织中Glu含量ICR小鼠随机分为2组, 溶剂对照组和YZG-331 (40 mg·kg-1)组, 每组8只。灌胃给予0.5%羧甲基纤维素钠溶液或化合物YZG-331。将其置于安静环境中, 给药15 min后脱颈取脑, 冰上分离前额叶皮层, 称重。组织样品称重后按1:10 (w/v)比例向组织中加入预冷的0.6 mol·L-1高氯酸溶液, 利用超声破碎, 功率250 W, 3 s/次, 间隔10 s, 反复2~3次, 在4 ℃条件下10 000 ×g离心20 min。取上清液与其1/2体积的缓冲溶液(柠檬酸钾20 mmol·L-1、EDTA·2Na 2 mmol·L-1、磷酸氢二钾300 mmol·L-1)混合均匀, 4 ℃条件下10 000 ×g离心20 min。取上清液, 按1:2比例加入OPA衍生化试剂, 冰上反应2 min后进样检测。根据标准品计算组织内Glu含量, 得到YZG-331相对于溶剂对照组引起的Glu含量变化。检测条件:流速1.2 mL·min-1、检测灵敏度500 nA和电化学检测器工作电压0.6 V。
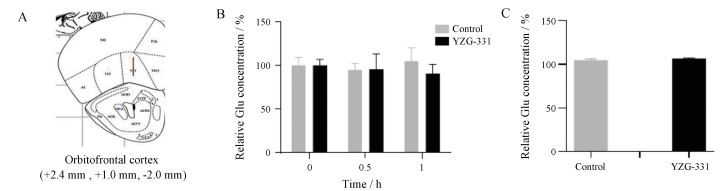
微透析法测皮层细胞外液Glu含量腹腔注射5%水合氯醛(0.07 mL·g-1)麻醉动物, 放在立体定向仪上, 准备手术。头顶局部剃毛后, 用75%酒精消毒颅骨上方皮肤, 切开颅骨上方皮肤, 暴露颅骨顶部。用含3% H2O2棉花棒从颅骨上刮下结缔组织, 以前囟为零点按坐标钻一个小孔下套管:前囟+2.4 mm, 中缝+1 mm, 颅骨平面-2 mm (图 2A)。恢复饲养1周后, 下探针以1 μL·min-1速度进行微量透析。每30分钟收集1管透析液, 2 h后给予YZG-331, 此时作为0点, 此前30 min内收集的透析液作为基准。收集灌胃给予溶剂的连续2管透析液作为对照, 然后给予YZG-331 (40 mg·kg-1, ig), 连续收集2管透析液, 将透析液按照1:1比例加入OPA衍生化试剂, 冰上反应2 min后进样检测。根据标准品计算透析液中Glu含量, 得到YZG-331引起组织间隙Glu含量变化率。检测条件:流速1 mL·min-1、检测灵敏度10 nA和电化学检测器工作站电压0.6 V。
|
图 2 Effect of YZG-331 (40 mg·kg-1, ig) on the content of glutamate (Glu) in mouse frontal cortex. A: The location of the probe; B: Glu content in extracellular fluid; C: Glu content in frontal cortex homogenate. n = 8, |
ICR小鼠随机分为两组:溶剂对照组和YZG-331组, 每组4只, 灌胃给予溶剂或化合物YZG-331 (40 mg·kg-1)后将其置于安静环境中, 15 min后脱颈取脑, 冰上分离前额叶皮层, 称重。RIPA裂解液中加入1×蛋白酶抑制剂、1×磷酸酶抑制剂混合物和1×PMSF混合放入冰中备用, 样品称重后按1:10 (w/v)比例向组织中加入相应体积的RIPA裂解液, 在冰浴条件下超声破碎, 功率250 W, 3 s/次, 间隔10 s, 反复2~3次, 之后置于冰上10 min使蛋白充分裂解, 在4 ℃条件下12 000 ×g离心20 min, 离心后取蛋白上清液。
膜蛋白提取将适量冷冻的组织放置于预冷的离心管柱上。加入200 μL缓冲液A (含1×蛋白酶抑制剂、1×磷酸酶抑制剂混合物、1 mmol·L-1 PMSF), 于冰上用塑料棒反复扭转研磨组织1 min, 再加入300 μL缓冲液A, 用吸头吹打几次后, 开盖冰上孵育5 min。盖上盖子, 16 000 ×g离心1 min (使用10 s内达到离心力的台式离心机), 弃去离心管柱, 涡旋大力震荡10 s重悬细胞, 700 ×g离心1 min (沉淀是完整的细胞核)。将上清转移到新的1.5 mL离心管中, 在4 ℃下16 000 ×g离心30 min, 弃去上清(胞浆组分), 保存沉淀(总膜蛋白组分包括细胞器和质膜)。加入200 μL缓冲液B, 用吸头反复吹打并涡旋震荡重悬总膜蛋白组分, 4 ℃、7 800 ×g离心5 min, 沉淀部分为细胞器。将上清液小心转移到2 mL离心管中, 加入1.6 mL预冷的PBS混匀几次, 16 000 ×g离心30 min。弃去上清液, 保存沉淀(质膜蛋白), 沉淀加入MinuteTM变性蛋白溶解液50 μL, 使样品充分溶解。
内体蛋白提取将10~30 mg冰冻组织样品放置于离心管柱上, 加200 μL缓冲液A, 用塑料棒反复挤压扭转研磨1 min。再加入300 μL缓冲液A到离心柱里, 用移液器上下吹打几次, 开盖冰上孵育5 min。盖上盖子, 16 000 ×g离心30 s, 弃去离心管柱, 将收集管的液体涡旋振荡混匀10 s, 700 ×g离心2 min (沉淀为完整的细胞核和一些未破裂的细胞)。将上清转移至1.5 mL离心管中, 4 ℃、16 000 ×g离心60 min。离心后, 再次将上清转移至离心管中(沉淀为大的细胞器和质膜)。估算管中溶液体积, 加入一半体积的缓冲液B, 振荡混匀, 4 ℃孵育过夜。4 ℃、10 000 ×g离心30 min, 弃掉上清(胞浆组分), 沉淀即是内体。加入MinuteTM变性蛋白溶解液50 μL, 震荡, 使样品充分溶解。
蛋白质免疫印迹使用BCA法测定待检测蛋白浓度, 加入SDS-PAGE蛋白上样缓冲液后沸水浴5 min, 采用等量上样进行聚丙烯酰胺凝胶电泳分离, 转膜, 用5%脱脂牛奶在室温下封闭膜1 h后, TBST洗涤2次, 每次5 min; 将膜放于TBST稀释的一抗中, 4 ℃孵育过夜; 回收一抗, TBST洗涤3次, 每次5 min; 将膜放于TBST稀释的二抗中(二抗按1:5 000稀释), 室温震荡孵育2 h, TBST洗3次, 每次5 min; 在PVDF膜中滴加配好的ECL发光液, 利用化学发光成像系统采集化学发光图像。用Quantity One软件处理目的蛋白条带。
蛋白质免疫共沉淀将分离好的脑皮质组织加入适量预冷的细胞裂解缓冲液, 并加入蛋白酶抑制剂, 冰上裂解30 min, 12 000 ×g离心10 min, 取上清。留取少量上清液作为Input对照, 再取上清液500 μL, 加入2 μg一抗进行免疫沉淀, 4 ℃缓慢摇晃, 孵育过夜。取Protein A Magnetic Beads 50 μL, 用裂解液洗3次, 每次摇晃混匀5 min, 用磁力架收集磁珠, 将与抗体孵育过夜的组织上清裂解液加入, 4 ℃缓慢摇晃5 h, 使磁珠与抗体充分结合, 进行免疫沉淀反应。反应后弃磁珠, 免疫沉淀复合物存留, 待Western blot检测。
数据统计和分析结果以
采用在体微透析技术结合高效液相色谱检测技术对小鼠额叶皮层组织中Glu含量进行检测。如图 2B、C所示, 相比于溶剂对照组, 灌胃给予YZG-331 (40 mg·kg-1)后的0~0.5 h和0.5~1 h两个时间段的透析液中Glu含量变化均无统计学差异。灌胃给予YZG-331 (40 mg·kg-1) 15 min后小鼠额叶皮层组织匀浆中Glu含量也无明显变化。
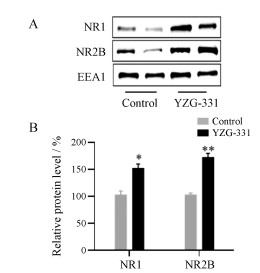
2 YZG-331下调小鼠额叶皮层细胞膜上NMDAR表达量采用Western blot法对灌胃给予YZG-331 (40 mg·kg-1) 15 min后小鼠额叶皮层细胞膜上NR1和NR2B的表达量进行检测。如图 3所示, 与溶剂对照组相比, YZG-331组小鼠额叶皮层细胞膜上NR1和NR2B的表达量均下调, 且NR2B的表达量降低具有统计学意义(P < 0.05)。

|
图 3 Effect of YZG-331 (40 mg·kg-1, ig) on the expressions of the N-methyl-D-aspartate receptor (NMDAR) subunit NR1 and NR2B in mouse frontal cortex cytomembrane. A: Expressions of NR1 and NR2B in mouse frontal cortex cytomembrane were detected by Western blot; B: Quantification of the NMDAR subunits NR1 and NR2B expression levels in mouse frontal cortex cytomembrane. n = 4, |
采用Western blot法对灌胃给予YZG-331 (40 mg·kg-1) 15 min后小鼠额叶皮层内体中NR1和NR2B的表达量进行检测。如图 4所示, YZG-331使小鼠额叶皮层内体中NR1和NR2B蛋白表达量均显著增加(P < 0.05, P < 0.01)。
|
图 4 Effect of YZG-331(40 mg·kg-1, ig) on the expressions of NR1 and NR2B in mouse frontal cortex endosome. A: Expressions of NR1 and NR2B in mouse frontal cortex endosome were detected by Western blot; B: Quantification of the NMDAR subunits NR1 and NR2B levels in mouse frontal cortex endosome. n = 4, |
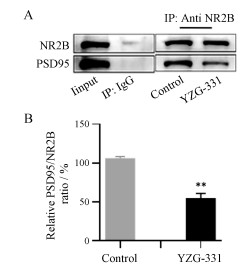
使用NR2B作为诱饵蛋白, 采用蛋白质免疫共沉淀法对小鼠额叶皮层中NR2B和PSD95沉淀复合物中PSD95的表达量进行检测。如图 5所示, 与溶剂对照组相比, 给予YZG-331 (40 mg·kg-1) 15 min后免疫沉淀复合物中PSD95蛋白含量显著降低(P < 0.01)。
|
图 5 Effect of YZG-331(40 mg·kg-1, ig) on the expression of PSD95 in the immunoprecipitation complex. A: The interaction between PSD95 and NR2B in mouse frontal cortex was detected by co-immunoprecipitation; B: Quantification of the PSD95 level in the immunoprecipitation complex. n = 6, |
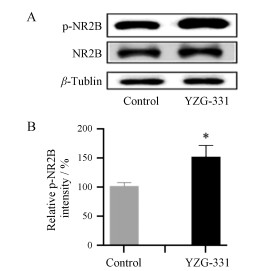
采用Western blot法对灌胃给予YZG-331 (40 mg·kg-1) 15 min后小鼠额叶皮层组织中NR2B磷酸化水平进行检测。如图 6所示, YZG-331组小鼠额叶皮层p-NR2B的表达量显著高于溶剂对照组(P < 0.05)。
|
图 6 Effect of YZG-331 (40 mg·kg-1, ig) on the phosphorylation of NR2B in mouse frontal cortex. A: Expressions of NR2B and phosphorylated NR2B (p-NR2B) at Ser-1303 site in mouse frontal cortex were detected by Western blot; B: Quantification of p-NR2B and NR2B levels in mouse frontal cortex. n = 6, |
失眠是人体睡眠-觉醒节律失常所致, 失眠患者常存在着不同程度的中枢神经递质传递紊乱情况。大脑皮层不但是睡眠觉醒系统的最终作用靶点, 它本身也参与睡眠觉醒的调节。目前有研究表明, 大脑皮层神经元主要接受来自基底前脑和丘脑的神经传入, 来自基底前脑的胆碱能神经元、GABA能神经元和谷氨酸能神经元都可以投射到前额叶皮层的谷氨酸能神经元, 以一种弥散的方式影响皮层神经元兴奋性[6, 7]。在体微透析是一种在活体动物中利用透析原理对微透析探针所在部位的细胞外液中的目的物质进行动态微量取样的技术[8]。故本研究除用高效液相色谱检测技术对小鼠额叶皮层组织匀浆中Glu含量进行检测外, 还结合在体微透析取样技术对小鼠额叶皮层细胞外液中的Glu含量进行了检测。在实验过程中, 为保证分析结果的准确性, 每30分钟收集1管样品, 利用高效液相进行检测。药代动力学研究表明小鼠灌胃给予YZG-331 (10 mg·kg-1)的Tmax为18 min[9], 故其余组织样品均在给予YZG-331 15 min后进行取材和后续检测。本实验室前期自主活动实验表明化合物YZG-331在1.25~40 mg·kg-1内剂量依赖性地抑制小鼠自主活动, 故本次药理机制研究选取了药效最为明显剂量40 mg·kg-1。检测结果发现, 给予YZG-331 15 min后额叶皮层匀浆中Glu含量未发生明显变化, 给予YZG-331后0~0.5 h和0.5~1 h两个时间段的透析液中的Glu含量与给药前相比也没有明显变化, 表明YZG-331不是通过影响额叶皮层Glu含量发挥作用的。
NMDAR是中枢神经系统最重要的兴奋性神经递质受体之一, 功能性的NMDAR是由NR1和NR2 (A~D)组成的一种异四聚体, 其中的NR1亚基是构成离子通道的基本亚单位, NR2 (A~D)是调节亚单位, 不同的NR2亚基决定NMDAR的突触定位和功能[10]。含有NR2B的NMDAR (NR2B-NMDAR)主要分布在海马和皮层组织中, 与其他类型的NMDAR相比, NR2B-NMDAR的表达和调节更易受外界的影响, 对脑功能的调节作用也更强[11]。NMDAR在细胞膜上的表达并不是固定不变的, 而是在神经元活动时在细胞膜和胞质间快速往返, 从而维持细胞膜表面受体的动态平衡, 这是通过受体内吞途径实现的。当NMDAR内吞进细胞后降低了膜表面NMDAR的表达, 不能发挥介导Glu兴奋神经元的作用[12, 13]。本实验采用MinuteTM质膜蛋白和细胞组分分离试剂盒提取了小鼠额叶皮层细胞膜上和内体中的蛋白, 探究YZG-331对额叶皮层细胞膜上及内体中NMDAR含量的影响。Western blot实验结果表明, YZG-331显著降低了NMDAR亚基NR1和NR2B在额叶皮质神经元细胞表面的表达, 增加了内体中NR1和NR2B的表达量。以上结果提示, YZG-331促进了额叶皮层细胞膜上的兴奋性神经递质Glu的离子型受体NMDAR内吞, 导致细胞兴奋性信号传导活性下调, 进而降低了大脑皮层神经元的兴奋性, 发挥其镇静催眠作用。
蛋白质的结构域是研究蛋白质相互作用的重要位点, PSD95是一种支架蛋白, 可在突触后膜通过PDZ结构域与NMDAR的NR2B亚基结合形成NMDAR/PSD95复合物, 从而起到稳定NMDAR在细胞膜表面表达的作用[14, 15]。在NR2B亚基中存在一个Ser-1303磷酸化位点, 当它被蛋白激酶CaMKII磷酸化后可以减弱PDZ结构域中NR2B与PSD95的结合进而驱动NMDAR发生内吞, 降低细胞膜表面NMDAR的表达[16-18]。网格蛋白调控的受体内吞已经被证明是受体从细胞膜进入细胞质的主要形式, 已有研究表明NR2B-NMDAR内吞依赖于网格蛋白的调控。在受体发生内吞时, 其胞质面附着的网格蛋白提供拖拽力使受体脱离细胞膜形成内体进入细胞内, 从而导致相关的细胞信号传导活性降低[19]。为了探究YZG-331引起的额叶皮层NMDAR内吞的具体驱动机制, 本实验采用Western blot方法检测了灌胃给予YZG-331 15 min后小鼠额叶皮层中NR2B Ser-1303磷酸化水平以及通过蛋白质免疫共沉淀法检测了NR2B与PSD95的相互作用强度, 考察化合物YZG-331是否通过干扰NMDAR/PSD95复合物的形成促进了NMDAR的内吞作用。实验结果显示, YZG-331可使额叶皮层中NR2B Ser-1303磷酸化水平显著增加, 使NR2B与PSD95的相互作用减弱。以上结果表明, YZG-331通过阻断NR2B与PSD95复合物的形成, 介导NMDAR的内吞增加。
综上所述, 化合物YZG-331上调了NMDAR的NR2B Ser-1303磷酸化水平, 导致NR2B与PSD95的相互作用减弱, 从而降低了NMDAR的膜稳定性, 使NMDAR内吞增多, 减少其膜表面数量, 降低NMDAR介导的皮层神经元兴奋性, 可能是其发挥镇静催眠作用的机制之一。
| [1] |
Buysse DJ. Insomnia[J]. JAMA, 2013, 309: 706-716. DOI:10.1001/jama.2013.193 |
| [2] |
Yang WQ, Jia SB, Li XL, et al. The inhibitory effects of YZG-330/YZG-331 on central nervous system[J]. Chin Pharmacol Bull (中国药理学通报), 2018, 34: 785-789. |
| [3] |
Jiang XJ, Xu ZG, Liu J. The GABA changes of encephalofluetuograph in intrinsic in somniacs[J]. Chin J Clin Neuro Sci (中国临床神经科学), 2005, 13: 236-238. |
| [4] |
Shi YF, Yu YQ. The roles of glutamate in sleep and wakefulness[J]. J Zhejiang Univ Med Sci (浙江大学学报医学版), 2013, 42: 583-590. |
| [5] |
Vadivelu N, Schermer E, Kodumudi V, et al. Role of ketamine for analgesia in adults and children[J]. Anaesthesiol Clin Pharmacol, 2016, 32: 298-306. DOI:10.4103/0970-9185.168149 |
| [6] |
Sun Q, Li X, Ren M, et al. A whole-brain map of long-range inputs to GABAergic interneurons in the mouse medial prefrontal cortex[J]. Nat Neurosci, 2019, 22: 1357-1370. DOI:10.1038/s41593-019-0429-9 |
| [7] |
Groenewegen HJ, Wright CI, Uylings HBM. The anatomical relationships of the prefrontal cortex with limbic structures and the basal ganglia[J]. J Psychopharmacol, 1997, 11: 99-106. DOI:10.1177/026988119701100202 |
| [8] |
Ji LY, Yang ZH, Sun XB. Application of microdialysis in brain pharmacokinetics and cerebral ischemia studies[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2012, 18: 303-307. |
| [9] |
Liu ZH, Sheng L, Li Y. Determination of YZG-331 in mouse plasma using liquid chromatography-tandem mass spectrometry[J]. J Chromatogr B, 2014, 944: 6-10. DOI:10.1016/j.jchromb.2013.10.041 |
| [10] |
Paoletti P, Bellone C, Zhou Q. NMDA receptor subunit diversity:impact on receptor properties, synaptic plasticity and disease[J]. Nat Rev Neurosci, 2013, 14: 383. DOI:10.1038/nrn3504 |
| [11] |
Loftis JM, Janowsky A. The N-methyl-D-aspartate receptor subunit NR2B:localization, functional properties, regulation, and clinical implications[J]. Pharmacol Ther, 2003, 97: 55-85. DOI:10.1016/S0163-7258(02)00302-9 |
| [12] |
MacDougall G, Anderton RS, Edwards AB, et al. The neuroprotective peptide poly- arginine-12(R12) reduces cell surface levels of NMDA NR2B receptor subunit in cortical neurons; investigation into the involvement of endocytic mechanisms[J]. J Mol Neurosci, 2017, 61: 235-246. DOI:10.1007/s12031-016-0861-1 |
| [13] |
Wu Y, Chen C, Yang Q, et al. Endocytosis of GluN2B-containing NMDA receptors mediates NMDA-induced excitotoxicity[J]. Mol Pain, 2017, 13: 1-13. |
| [14] |
Zhang L, Zhou HM, Li XY, et al. Establishment of a screening model for compounds uncoupling the interaction of nNOS with PSD-95[J]. Acta Pharm Sin (药学学报), 2019, 54: 638-644. |
| [15] |
Kornau HC, Schenker LT, Kennedy MB, et al. Domain interaction between NMDA receptor subunits and the postsynaptic density protein PSD-95[J]. Science, 1995, 269: 1737-1740. DOI:10.1126/science.7569905 |
| [16] |
Omkumar RV, Kiely MJ, Rosenstein AJ, et al. Identification of a phosphorylation site for calcium/calmodulin dependent protein kinase II in the NR2B subunit of the N-methyl-D-aspartate receptor[J]. J Biol Chem, 1996, 271: 31670-31678. DOI:10.1074/jbc.271.49.31670 |
| [17] |
Chung HJ, Huang YH, Lau LF, et al. Regulation of the NMDA receptor complex and trafficking by activity-dependent phosphorylation of the NR2B subunit PDZ ligand[J]. J Neurosci, 2004, 24: 10248-10259. DOI:10.1523/JNEUROSCI.0546-04.2004 |
| [18] |
Mao LM, Jin DZ, Xue B, et al. Phosphorylation and regulation of glutamate receptors by CaMKII[J]. Acta Physiol Sin (生理学报), 2014, 66: 365-372. |
| [19] |
Nong Y, Huang YQ, Salter MW. NMDA receptors are movin' in[J]. Curr Opin Neurobiol, 2004, 14: 353-361. DOI:10.1016/j.conb.2004.05.001 |
 2020, Vol. 55
2020, Vol. 55


