特发性肺纤维化(idiopathic pulmonary fibrosis, IPF)是一种常见的慢性、渐进性呼吸系统疾病, 其发病原因不明, 多发于老年人群, 肺泡组织重构及纤维化导致的呼吸衰竭是其主要致死原因[1, 2]。目前FDA批准了吡非尼酮(pirfenidone, Pirf)及尼达尼布(nintedanib, Nint)两个药物用于轻到中度IPF的治疗[3]。尽管相对于先前的疗法, Pirf和Nint能够改善患者的临床预后, 但是它们并不能完全阻止肺功能的下降, 或者逆转纤维化的病理改变, 而只是起到了延缓疾病进展作用[4]。因此, 分析研究Pirf和Nint在肺纤维化疾病中的作用机制对了解肺纤维化的疾病进程及转归机制具有重要意义。
肺泡是肺呼吸系统的基本功能单元, 是氧气、二氧化碳的交换场所。它们是由介导气体交换的肺泡I型上皮细胞(AEC I)及分泌表面活性物质的肺泡II型上皮细胞(AEC II)组成[5]。AEC II除了分泌表面活性物质外, 还行使肺泡局部干细胞的作用[6, 7]。肺损伤时, AEC I会大量死亡, 为了维持肺泡的正常结构及功能, 机体会进行肺泡再生, 肺泡再生时, 行使干细胞功能的AEC II增殖分化补充缺失的AEC I, 维持正常的肺泡结构及功能, 这个过程与Wnt/β-catenin信号通路密切相关[8]。反复损伤的肺泡上皮细胞是肺纤维化的关键驱动因素, 肺上皮损伤主要表现为肺泡上皮细胞的死亡增加或者存活的上皮细胞表型改变; 缺乏有效的肺泡再生也加重了许多肺部疾病的疾病进程[9, 10]。虽然目前对于肺泡再生的机制研究取得了较深入的进展, 但是关于临床药物对肺泡再生影响的研究却十分有限。
小鼠气管滴注单次剂量的博莱霉素诱发肺纤维化(single bleomycin, sBLM)是目前最常见的制备肺纤维化模型的实验方法, 虽然这个方法具有成模率高、操作简单等优势, 但是存在明显的局限性[11]。该模型的疾病发展时间与IPF患者不同。在IPF患者中, 随着上皮细胞的反复损伤刺激及不完全的损伤后修复, 局部肺组织持续处于慢性炎症的环境中, 导致不可逆的病理改变, 而sBLM模型在21天后, 小鼠的肺纤维化表型就会开始逐渐减弱[12-15]。对比sBLM模型, 多次博莱霉素滴注诱导的小鼠肺纤维化模型(multiple bleomycin, mBLM)采用低剂量反复损伤的形式来进行造模, 更能够反映临床IPF患者呈现的肺损伤及病理改变。这可能是由于mBLM模型会导致肺部组织持续暴露在慢性炎症环境所致, 这与IPF发病机制有类似之处。IPF患者的肺纤维化病灶往往伴随上皮细胞的异常增生, 上皮细胞的增生很可能与AEC II细胞的干性及肺泡再生具有密切关系。
本研究通过对比Pirf和Nint两种药物在sBLM和mBLM两种不同模型中的药效作用, 评价其对肺泡再生的调控作用。同时通过体外AEC II细胞3D培养, 分析Pirf和Nint对AEC II细胞干性影响, 并对其机制进行初步探索, 从而明确Pirf和Nint两种药物是否通过调控肺泡再生途径影响肺纤维化疾病进程。
材料与方法 试剂博莱霉素(bleomycin, BLM)购自日本化药株式会社, Pirf购自大连美仑生物技术有限公司, Nint由勃林格殷格翰制药公司生产; TGF-β1因子购自PeproTech公司, 羟脯氨酸检测试剂盒购自南京建成生物工程技术有限公司; 兔抗小鼠β-catenin、Axin2、c-Myc和Cyclin D1均购自Cell Signaling Technology公司, 低生长因子Matrigel (354230)购自美国康宁试剂公司, 3D培养小室购自Millipore公司。HE染色及Masson三色染色试剂盒购自上海碧云天生物技术有限公司。
动物雄性C57BL/6J小鼠, SPF级别, 体重20 g左右, 6~8周龄, 购自斯贝福(北京)生物技术有限公司(实验动物许可证号002802)。本实验所有动物实验均通过中国医学科学院药物研究所伦理审查委员会审查。
肺纤维化动物模型sBLM模型:小鼠隔夜禁食, 使用三溴乙醇麻醉小鼠, 气管内注射BLM (剂量: 3 U·kg-1)。具体操作:将麻醉后小鼠上颚放置于弯曲的铁丝上, 在镊子及手术灯的辅助下, 观察到气管口的位置, 使用导丝将套管针引导至气管后, 取回导丝, 将小鼠垂直固定于操作板上。使用微量注射器向气管内注入BLM 50 μL, 并迅速旋转操作板, 使BLM能够均匀进入肺叶, 而后直立放置5 min。mBLM模型:给药方式与单次的相同, BLM的剂量调整为1 U·kg-1, 2周给1次, 总共6次给药。治疗方案:造模后的小鼠随机分组, sBLM组在造模10天后开始给药, Pirf (2 mg·kg-1)组1天3次, Nint (1 mg·kg-1)组1天1次, 从第10天开始给药至第21天。mBLM组从最后一次造模后的第10天开始给药, Pirf组1天3次, Nint组1天1次, 总共给药30天。Sham组为不造模的正常对照, PBS组为采用PBS替代药物的对照组。到达时间点后麻醉, 取材称重。肺重指数=小鼠肺重(mg) /小鼠体重(g)。左侧肺叶结扎后, 灌入多聚甲醛, 取右肺用于形态学检测。左肺用于羟脯氨酸含量及蛋白检测。
肺功能检测小鼠禁食麻醉后进行气管插管, 使用flexiVent小动物肺功能分析仪检测小鼠的吸气、呼气气道阻力和肺顺应性等数据, 并进行数据分析, 具体步骤参考仪器使用说明书。
血氧饱和度检测小鼠禁食麻醉后, 使用kent scientific小动物脉搏血氧仪检测小鼠尾静脉的脉搏血氧, 具体操作参考仪器使用说明书。
形态学检测及评分取材后的小鼠肺组织, 经4%多聚甲醛固定之后, 脱水后石蜡包埋, 切成4 μm厚度的肺切片。进行HE及Masson三色染色。200倍镜下观察并进行图像采集, 使用图像分析软件Image-Pro Plus进行图像分析, 并做炎症评分, 得分越高, 说明炎症损伤程度越大。Ashcroft评分标准: 0分:正常肺组织; 1分:肺泡或支气管壁轻微增厚; 3分:肺泡或支气管壁中度增厚, 但不伴有明显的肺泡结构紊乱; 5分:肺泡结构受到破坏, 条索状纤维带或小范围纤维灶形成; 7分:肺泡结构被严重破坏, 广泛的纤维灶形成, 蜂窝状肺可归于此级; 8分:全视野纤维化病变, 2、4、6分介于相应的分数之间。
羟脯氨酸含量检测称量小鼠左肺湿重, 匀浆后取200 μL上清, 在玻璃试管中加入水解液550 μL, 混匀后在120 ℃、0.1 kPa的条件下水解45 min。调节pH值后定容, 使用活性炭处理后, 离心取上清。按照试剂盒说明书进行操作, 测各管的吸光度值, 使用吸光度值计算羟脯氨酸的含量, 详见南京建成羟脯氨酸测定试剂盒。
Western blotting将处理后的细胞提取蛋白后定量, 进行SDS-PAGE电泳, 湿转至PVDF膜上, 5%脱脂牛奶室温封闭30 min, 加入相应一抗, 4 ℃过夜孵育, 二抗室温孵育2 h, 洗膜后曝光。
AEC II细胞3D培养根据参考文献[16]报道方法, 将小鼠AEC II细胞分离之后, 按照6 000个AEC II细胞: 90 000个Mlg小鼠成纤维细胞的比例, 按照培养基:基质胶= 1:1的比例, 将混合物接种于成球用的小室中, 外室加完全培养基, 37 ℃、CO2培养箱中培养, 每隔2天进行换液处理。使用倒置显微镜观察并记录AEC II细胞的成球情况。
GSEA分析从GEO数据库中下载数据, 项目号为: GSE120679, 提取该项目中Pirf及Nint治疗纤维化的数据, 重新分组后, 使用GSEA软件进行GSEA分析, 选择与肺泡再生相关的Wnt/β-catenin信号通路来观察两种药物在转录组水平对肺泡再生的影响。
统计学分析除炎症评分外, 文中的结果采用均值±标准差(
对sBLM造模小鼠给予药物治疗后进行分析, 造模及给药流程图如图 1A所示。造模后第21天小鼠病理及功能检测结果显示, 与对照组相比, BLM损伤后, 小鼠肺脏出现了明显的纤维化、胶原沉积和炎性细胞浸润等病理改变(图 1B), 肺纤维化小鼠肺重指数升高, 提示可能出现肺水肿。与此同时, 肺纤维化小鼠血氧饱和度下降, 肺功能下降, 羟脯氨酸的含量增加, 而Pirf和Nint给药组小鼠的肺重指数显著降低(图 1C), 血氧饱和度显著回升(图 1D), 肺功能得到了明显改善(图 1E), 炎症评分显著降低(图 1B和F左), 并且羟脯氨酸的含量同样显著下降(图 1F右)。这说明Pirf和Nint可以有效治疗sBLM所诱导的小鼠肺纤维化。

|
图 1 Pirfenidone (Pirf) or nintedanib (Nint) attenuates lung fibrosis in single dosage of bleomycin (sBLM) group. A: Schematic diagram of modeling and drug-delivering in the sBLM mice model. After 10 days of administration of a single dosage of bleomycin (3 U·kg-1), the mice were treated with Pirf (2 mg·kg-1) or Nint (1 mg·kg-1) for 10 days. Masson staining (B), lung index (C), SpO2 level (D), lung function (E), inflammatory score, and hydroxyproline (F) were evaluated at 21 days after bleomycin-challenged. **P < 0.01 vs sham group; △P < 0.05, △△P < 0.01 vs PBS-treated group. IC: Inspiratory capacity; Crs: Compliance of the respiratory system |
对mBLM造模小鼠给予药物治疗后进行分析, 造模及给药流程图如图 2A所示。造模后40天的病理及功能检测结果显示, 与对照组相比, 多次博莱霉素损伤后40天, 小鼠肺部出现明显纤维化病理改变(图 2B), 肺重指数显著升高(图 2C), 血氧饱和度明显降低(图 2D)。同时小鼠肺功能显著受损(图 2E), 肺部存在明显炎症和胶原沉积(图 2F)。mBLM所致小鼠肺纤维化病理改变与sBLM比有较大不同, mBLM所致肺纤维化小鼠肺部胶原沉积更为明显, 炎性细胞浸润数量较sBLM组少, 但羟脯氨酸含量更高。Pirf和Nint治疗40天后炎性细胞浸润的水平并没有得到恢复, 小鼠的肺重指数无明显下降(图 2C), 血氧饱和度无显著回升(图 2D), 肺功能无显著提高(图 2E), 炎症评分及羟脯氨酸含量均无显著改变(图 2B和F)。这说明Pirf和Nint均不能改善mBLM所致小鼠肺纤维化。
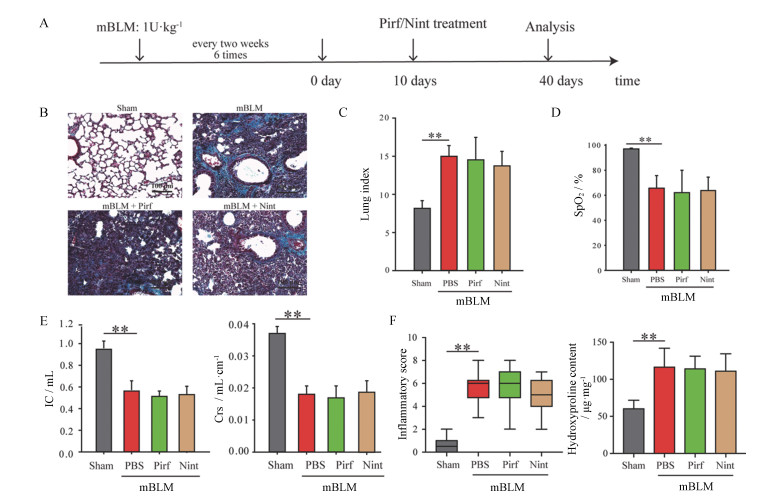
|
图 2 Pirf or Nint shows limited anti-fibrosis effects in multiple dosages of bleomycin (mBLM) group. A: Schematic diagram of modeling and drug-delivery in the mBLM mice model. Mice were intratracheally instilled bleomycin (1 U·kg-1) every two weeks for a total of 6 times. The mice were treated with Pirf (2 mg·kg-1) or Nint (1 mg·kg-1) 30 days after completing the last administration. Masson staining (B), lung index (C), SpO2 level (D), lung function (E), inflammatory score, and hydroxyproline (F) were evaluated at 30 days after drug-delivering. **P < 0.01 vs sham group |
AEC II细胞在特定的3D培养体系下可以通过其细胞干性成球。为了探究Pirf和Nint对于小鼠AEC II细胞干性的影响, 本研究对分离后的小鼠原代AEC II细胞进行3D培养, 通过AEC II细胞干性成球的大小及数量来评价Pirf (1 mmol·L-1)和Nint (1 μmol·L-1)对于AEC II细胞干性影响。实验发现, 与对照组相比, 在给予Pirf或者Nint刺激之后AEC II细胞成球能力明显降低, 所形成细胞球体大小显著下降(图 3A和B), 对小室中成球的数目进行统计后发现, 与对照组相比, 给药组所成的球数目显著减少(图 3C)。
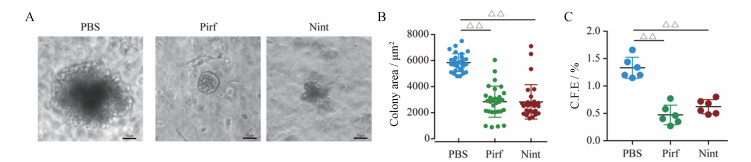
|
图 3 Pirf or Nint inhibits the stemness of AEC II cell. Mouse AEC II cells were cultured in 50% Matrigel with fibroblasts, the exchange medium contained Pirf (1 mmol·L-1) or Nint (1 μmol·L-1), the cells were cultured for 30 days. Spheres images were collected with a microscope (A), and the colony area (B) and colony forming efficiency (C.F.E, C) were calculated. △△P < 0.01 vs PBS group |
Wnt/β-catenin信号通路是介导AEC II细胞自我更新及分化的重要信号通路, 为了探究Pirf和Nint抑制AEC II细胞干性的机制, 本研究对A549细胞系进行TGF-β1刺激诱导Wnt/β-catenin信号通路活化, 而后给予Pirf或Nint。经文献调研[17, 18]及前期实验(数据未给出), 确定浓度为Pirf: 1 mmol·L-1, Nint: 1 μmol·L-1; 检测与肺泡再生相关的Wnt/β-catenin信号通路的蛋白水平改变。结果表明, 除24 h外, TGF-β1刺激后的A549细胞内β-catenin蛋白的表达呈上升趋势, 其下游靶蛋白Axin2、c-Myc及Cyclin D1均呈现上升趋势, 而给予Pirf或者Nint共同孵育之后, β-catenin及其靶蛋白的表达呈下降趋势(图 4A~D)。通过对GSE120679芯片进行GSEA分析发现, 与TGF-β1刺激的对照模型组比较, Pirf及Nint的药物治疗均不能显著激活Wnt/β-catenin通路(图 4E和F)。
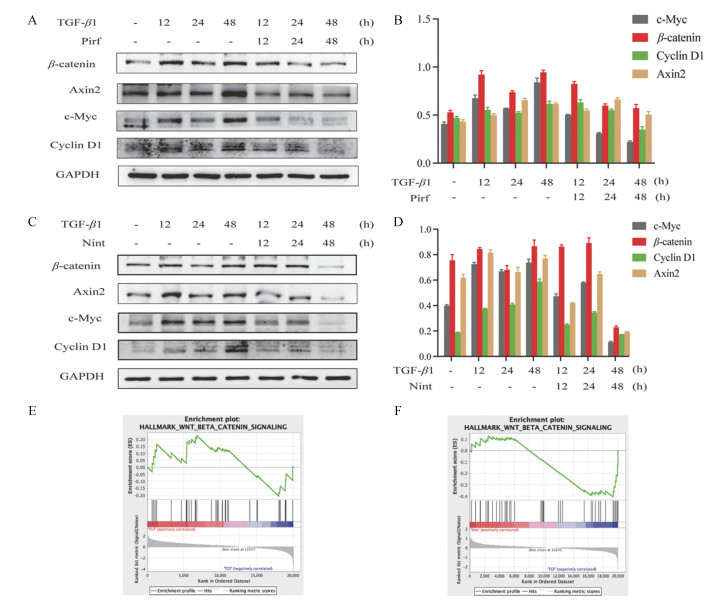
|
图 4 Pirf or Nint inhibits Wnt/β-catenin pathway. A549 cells were incubated with TGF-β1 (10 ng·mL-1), with or without Pirf (1 mmol·L-1) for 48 h. The expression of β-catenin, Axin2, c-Myc, and Cyclin D1 were analyzed with Western blotting (A, B). The relationship between Pirf treatment and Wnt/β-catenin pathway was evaluated with GSEA analysis (E). A549 cells were incubated with TGF-β1 (10 ng·mL-1), with or without Nint (1 μmol·L-1) for 48 h. The expression of β-catenin, Axin2, c-Myc, and Cyclin D1 were analyzed with Western blotting (C, D). The relationship between Nint treatment and Wnt/β-catenin pathway was evaluated with GSEA analysis (F) |
因此如图 5所示, Pirf和Nint虽然均能改善sBLM造模的肺纤维化表型, 但在mBLM刺激的小鼠模型中, Pirf和Nint治疗失败的原因可能是由于Pirf及Nint抑制了mBLM小鼠肺泡再生重要信号Wnt/β-catenin通路, 进而抑制AEC II细胞干性造成的。
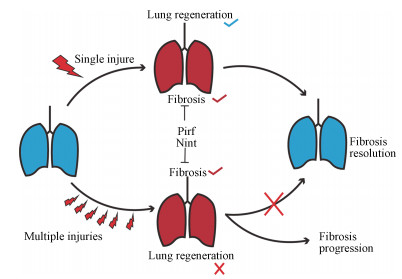
|
图 5 Schematic diagram of the difference between Pirf or Nint treatment in sBLM or mBLM animal model. After sBLM injury, the lung still has the ability to regenerate, but after mBLM injuries, the lung loses the ability to regenerate. Pirf or Nint not only has anti-fibrotic effects but also inhibits the lung regeneration ability |
本研究发现, Pirf和Nint均能够改善sBLM所致的小鼠肺纤维化。但是在mBLM诱导的小鼠肺纤维化模型中, Pirf和Nint均不能显著改善小鼠的肺纤维化表型。sBLM是研究肺纤维化的经典模型, 它具有成模率高、成模时间短等优点, 许多基础研究及药物研发平台都采取了这种造模方式。然而研究发现, sBLM中BLM诱导的损伤初始阶段主要是急性肺损伤模型, 伴随着单核细胞和中性粒细胞的浸润, 进而转变为急性肺纤维化[11]。而在IPF患者的肺组织中并不会出现高度的炎症反应, 而是持续存在的慢性炎症[19]。这就导致很多基于sBLM模型所筛选的药物最终在临床研究中的治疗效果并不尽如人意。Degryse等[19]研究发现, 在mBLM的模型中, 中性粒细胞炎症在模型的初期出现, 而在中晚期逐渐下降, 且与sBLM模型相比, mBLM模型的纤维化程度更加严重, 这与IPF患者有着类似的特征[19, 20]。
IPF患者肺组织的显著特征是上皮细胞数量的增多以及上皮细胞完整性的破坏, 它存在着几种不同的表现形式, 如AEC II细胞的过度增生; 过度反应体型增大的上皮细胞; 晚期蜂窝状病变的支气管扩张; 覆盖在成纤维细胞上的扁平及减薄的上皮细胞, 支气管型上皮及增生的上皮灶鳞状化生位于扩大的蜂窝状病变区域, 这种情况使得上皮细胞的再生受到干扰[9, 21]。sBLM中很难观察到上皮细胞的增生, 而在mBLM却有明显的AEC II细胞的增生现象。mBLM与sBLM中, 上皮细胞的状态差异, 可能是两种抗肺纤维化药物在不同模型中治疗存在差异的一个重要原因。因此对比于sBLM模型, mBLM模型更加适合抗肺纤维化药物筛选。
通过体外分离小鼠AEC II细胞, 在与小鼠成纤维细胞Mlg细胞进行3D共培养后可以发现, Pirf和Nint均能够显著抑制小鼠AEC II细胞成球的体积以及数量。这个结果提示, Pirf和Nint能够抑制AEC II细胞的干性。AEC II细胞具有干细胞的特性, 损伤后能够自我更新并且分化形成AEC I细胞。sBLM与mBLM两个动物模型的上皮状态具有明显差异, mBLM模型中的AEC II细胞异常增生, 可能是AEC II细胞维持干细胞的能力降低, 大量增殖, 分化所造成的。而Pirf和Nint进一步抑制了AEC II细胞的干性特点, 使AEC II的特性发生了改变。
进一步观察显示, Pirf和Nint可以抑制Wnt/β-catenin信号通路, GSEA数据分析也同时发现, Pirf和Nint也具有抑制Wnt/β-catenin信号通路的趋势。Nabhan等[8]发现Wnt/β-catenin信号通路是AEC II行使干细胞功能的关键, 即Axin2阳性的AEC II细胞Wnt信号通路活跃, 离开Wnt微环境的子细胞会分化为AEC I, 而受损的AEC II可以自己激活Wnt信号通路, 使得干细胞增多或者使原来的AEC II细胞具备干细胞功能; 维持Wnt信号通路可以抑制分化, 抑制则促进AEC II分化。本研究发现, Pirf和Nint可降低β-catenin、Axin2、c-Myc、Cyclin D1的蛋白表达, 而这4种蛋白与AEC II细胞的干性密切相关。虽然Pirf与Nint的抗肺纤维化机制不同, 但两者均可能是通过抑制Wnt/β-catenin通路来影响了AEC II细胞干性。因此, 在IPF发病过程中修复异常增殖的AEC II细胞并使其行使正常干细胞功能是IPF治疗中的关键点。这也可能是Pirf和Nint仅能治疗轻到中度的肺纤维化患者的主要原因。
本研究发现, Pirf和Nint两种药物在sBLM、mBLM两种肺纤维化小鼠模型中的治疗效果存在差异。在mBLM模型中两种药物并不能起到良好的治疗作用, 这可能与mBLM模型中Pirf和Nint对AEC II细胞的异常增殖及修复机制的作用相关。Pirf和Nint能够抑制AEC II细胞的干性, 并且这种抑制作用可能是通过妨碍Wnt/β-catenin信号通路活化所致。目前关于IPF疾病进程中AEC II细胞的异常状态及修复机制的相关研究较少, 开展Pirf和Nint在IPF进程中对上皮细胞功能及表型影响的研究具有重要的意义。
| [1] |
Blackwell TS, Tager AM, Borok Z, et al. Future directions in idiopathic pulmonary fibrosis research. An NHLBI workshop report[J]. Am J Respir Crit Care Med, 2014, 189: 214-222. DOI:10.1164/rccm.201306-1141WS |
| [2] |
Gross TJ, Hunninghake GW. Idiopathic pulmonary fibrosis[J]. N Engl J Med, 2001, 345: 517-525. DOI:10.1056/NEJMra003200 |
| [3] |
Raghu G, Rochwerg B, Zhang Y, et al. An official ATS/ERS/JRS/ALAT clinical practice guideline:treatment of idiopathic pulmonary fibrosis. An update of the 2011 clinical practice guideline[J]. Am J Respir Crit Care Med, 2015, 192: e3-e19. DOI:10.1164/rccm.201506-1063ST |
| [4] |
Saito S, Alkhatib A, Kolls JK, et al. Pharmacotherapy and adjunctive treatment for idiopathic pulmonary fibrosis (IPF)[J]. J Thorac Dis, 2019, 11: S1740-S1754. DOI:10.21037/jtd.2019.04.62 |
| [5] |
Whitsett JA, Wert SE, Weaver TE. Alveolar surfactant homeostasis and the pathogenesis of pulmonary disease[J]. Annu Rev Med, 2010, 61: 105-119. DOI:10.1146/annurev.med.60.041807.123500 |
| [6] |
Desai TJ, Brownfield DG, Krasnow MA. Alveolar progenitor and stem cells in lung development, renewal and cancer[J]. Nature, 2014, 507: 190-194. DOI:10.1038/nature12930 |
| [7] |
Barkauskas CE, Cronce MJ, Rackley CR, et al. Type 2 alveolar cells are stem cells in adult lung[J]. J Clin Invest, 2013, 123: 3025-3036. DOI:10.1172/JCI68782 |
| [8] |
Nabhan AN, Brownfield DG, Harbury PB, et al. Single-cell Wnt signaling niches maintain stemness of alveolar type 2 cells[J]. Science, 2018, 359: 1118-1123. DOI:10.1126/science.aam6603 |
| [9] |
Selman M, Pardo A. Role of epithelial cells in idiopathic pulmonary fibrosis:from innocent targets to serial killers[J]. Proc Am Thorac Soc, 2006, 3: 364-372. DOI:10.1513/pats.200601-003TK |
| [10] |
Sakai N, Tager AM. Fibrosis of two:epithelial cell-fibroblast interactions in pulmonary fibrosis[J]. Biochim Biophys Acta, 2013, 1832: 911-921. DOI:10.1016/j.bbadis.2013.03.001 |
| [11] |
Moore BB, Hogaboam CM. Murine models of pulmonary fibrosis[J]. Am J Physiol Lung Cell Mol Physiol, 2008, 294: L152-L160. DOI:10.1152/ajplung.00313.2007 |
| [12] |
Chung MP, Monick MM, Hamzeh NY, et al. Role of repeated lung injury and genetic background in bleomycin-induced fibrosis[J]. Am J Respir Cell Mol Biol, 2003, 29: 375-380. DOI:10.1165/rcmb.2003-0029OC |
| [13] |
Mi S, Li Z, Yang HZ, et al. Blocking IL-17A promotes the resolution of pulmonary inflammation and fibrosis via TGF-beta1-dependent and -independent mechanisms[J]. J Immunol, 2011, 187: 3003-3014. DOI:10.4049/jimmunol.1004081 |
| [14] |
Yang HZ, Wang JP, Mi S, et al. TLR4 activity is required in the resolution of pulmonary inflammation and fibrosis after acute and chronic lung injury[J]. Am J Pathol, 2012, 180: 275-292. DOI:10.1016/j.ajpath.2011.09.019 |
| [15] |
Yang HZ, Cui B, Liu HZ, et al. Targeting TLR2 attenuates pulmonary inflammation and fibrosis by reversion of suppressive immune microenvironment[J]. J Immunol, 2009, 182: 692-702. DOI:10.4049/jimmunol.182.1.692 |
| [16] |
Sinha M, Lowell CA. Isolation of highly pure primary mouse alveolar epithelial type II cells by flow cytometric cell sorting[J]. Bio Protoc, 2016. DOI:10.21769/BioProtoc.2013 |
| [17] |
Rangarajan S, Kurundkar A, Kurundkar D, et al. Novel mechanisms for the antifibrotic action of nintedanib[J]. Am J Respir Cell Mol Biol, 2016, 54: 51-59. DOI:10.1165/rcmb.2014-0445OC |
| [18] |
Jin J, Togo S, Kadoya K, et al. Pirfenidone attenuates lung fibrotic fibroblast responses to transforming growth factor-beta1[J]. Respir Res, 2019, 20: 119. DOI:10.1186/s12931-019-1093-z |
| [19] |
Degryse AL, Tanjore H, Xu XC, et al. Repetitive intratracheal bleomycin models several features of idiopathic pulmonary fibrosis[J]. Am J Physiol Lung Cell Mol Physiol, 2010, 299: L442-L452. DOI:10.1152/ajplung.00026.2010 |
| [20] |
Aburto M, Herraez I, Iturbe D, et al. Diagnosis of idiopathic pulmonary fibrosis:differential diagnosis[J]. Med Sci (Basel), 2018, 6: 73. |
| [21] |
Sirianni FE, Chu FS, Walker DC. Human alveolar wall fibroblasts directly link epithelial type 2 cells to capillary endothelium[J]. Am J Respir Crit Care Med, 2003, 168: 1532-1537. DOI:10.1164/rccm.200303-371OC |
 2020, Vol. 55
2020, Vol. 55


