“代谢重编程” (metabolic reprogramming)是癌症发生的基本特征, 指在原癌基因和抑癌基因的介导下, 肿瘤细胞能量的供应和代谢方式发生改变, 以满足生物大分子合成和肿瘤细胞快速增殖的需要[1]。越来越多的研究发现, 肿瘤细胞对谷氨酰胺(glutamine, Gln)的需求较正常细胞显著提高。作为人体内含量最丰富的非必需氨基酸[2], Gln可经细胞内谷氨酰胺合成酶(glutamine synthetase, GS)催化合成, 满足机体需求。在剧烈运动、受伤、感染等应激情况下, Gln需要量大大增加, 机体通过生物催化反应将其他氨基酸转化为Gln[3]。但对于肿瘤细胞来说, 自身合成的Gln无法满足其快速增殖的要求, 必须从外界大量摄入。因此, Gln对于肿瘤细胞来说, 则是“条件性必需氨基酸”。Mohit等发现肿瘤细胞所消耗的所有氨基酸中, Gln的需求量最大[4]。Gln可以通过细胞膜上的丙氨酸—丝氨酸—半胱氨酸转运蛋白2 (alanine-serine-cysteine transporter 2, ASCT2)从胞外转移至胞内[5], 或通过胞饮的方式进入细胞[6]。Gln进入细胞后最先经谷氨酰胺酶(glutaminase, GLS)催化分解为谷氨酸(glutamic acid, Glu)和铵离子[7], 作为能量供应和生物合成的原料。Gln还参与胞内谷胱甘肽(glutathione, GSH)的合成, 清除活性氧(reactive oxygen species, ROS), 维持胞内氧化还原稳态[8]。
此外, 有研究者构建了3D组织模型, 结合代谢组学和蛋白质组学的相关技术, 发现Gln代谢产物Glu在增殖期和静止期细胞中的利用存在显著性差异[9]。相对于静止期的细胞, 处于增殖期的细胞通过谷草转氨酶(glutamic oxalacetic transaminase, GOT)或者谷丙转氨酶(glutamic pyruvic transaminase, GPT)催化更多的Glu生成α-酮戊二酸(α-ketoglutarate, α-KG), 参与三羧酸循环(tricarboxylic acid cycle, TCA cycle)。高度增殖的肿瘤细胞大多高表达上述转氨酶, 这表明Gln的大量消耗与癌细胞的能量供应和生物合成密切相关, 对Gln代谢的调节将影响肿瘤细胞的增殖过程。因此, Gln作为肿瘤细胞中物质、能量和稳态维持的重要物质, 其代谢过程与肿瘤发生[10]、发展[11]和转移[12]之间存在密切联系, 与Gln代谢相关的途径和分子有可能成为肿瘤治疗的新靶点(图 1)。
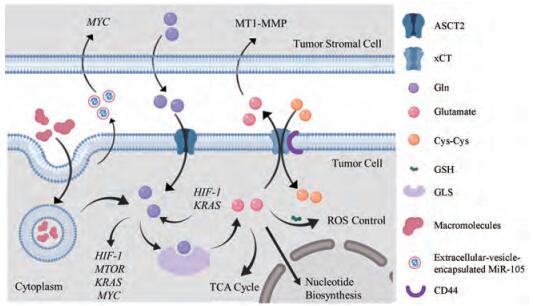
|
Figure 1 Major target in glutamine metabolism. Gln: Glutamine; ASCT2: Alanine-serine-cysteine transporter 2; GLS: Glutaminase; GSH: Glutathione; xCT: Cystine/glutamate antiporter; HIF-1: Hypoxia inducible factor-1; MTOR: Mammalian target of rapamycin; KRAS: V-Ki-ras2 Kirsten rat sarcoma viral oncogene homolog; MYC: Cellular-myelocytomatosis proto-oncogene; MT1-MMP: Membrane-type 1 matrix metalloproteinases; ROS: Reactive oxygen species; TCA Cycle: Tricarboxylic acid cycle |
当正常细胞中的原癌基因突变为致癌基因后, 诱导细胞癌变。某些致癌基因将通过增加Gln的代谢维持肿瘤细胞生长和信号传递。反之, Gln代谢的提升也会对致癌基因的表达产生显著的影响。其中缺氧诱导因子(hypoxia inducible factor-1, HIF-1)、哺乳动物雷帕霉素(mammalian target of rapamycin, MTOR)、鼠类肉瘤病毒癌基因(V-Ki-ras2 Kirsten rat sarcoma viral oncogene homolog, KRAS)和细胞骨髓细胞瘤病原癌基因(cellular-myelocytomatosis proto-oncogene, MYC)等关键基因所表达的蛋白, 通过参与调节Gln代谢诱导肿瘤的发生。
1.1 HIF-1HIF-1是一种调节细胞内与氧气稳态过程相关的转录因子[13]。一方面, 经表达的HIF-1蛋白诱导肿瘤细胞将Gln作为脂肪酸合成的主要原料, 促进肿瘤生长[14]。线粒体酶复合物酮戊二酸脱氢酶(mitochondrial enzyme complex a ketoglutarate dehydrogenase, αKGDH)是一种Gln氧化分解酶, 在细胞内快速消耗Gln。在肿瘤细胞中, HIF-1蛋白抑制αKGDH的表达量, 减少Gln的氧化分解, 促进以Gln为原料的脂质合成, 从而为肿瘤细胞提供适宜生长的脂质和能量。敲除HIF-1基因后, αKGDH表达增多, 导致结肠癌细胞HT29脂质代谢紊乱, 提升治疗效果[15]。另一方面, 若Gln的氧化分解被抑制, 将降低HIF-1蛋白的表达, 抑制肿瘤生长。Hulea等[16]研究发现, 当使用与糖酵解过程相关的激酶抑制剂(kinase inhibitors, KIs)和双胍类药物协同治疗癌症时, 可以通过干扰Gln的代谢, 抑制HIF-1蛋白的活性, 有效抑制小鼠乳腺癌NMuMG细胞的生长。此外, 肝激酶B1 (liver kinase B1, LKB1)是一种丝氨酸—苏氨酸激酶, 可通过使细胞增殖停留在G1期而减缓肿瘤生长, 但其体内活性易被HIF-1蛋白抑制。从肺癌细胞A549体外实验发现, 通过干扰Gln的代谢过程可削弱HIF-1蛋白对LKB1的抑制作用, 从而提高癌症治疗效果[17]。
1.2 MTOR由MTOR基因编码的MTOR蛋白是一种激酶, 在调节蛋白质翻译、细胞生长和自噬过程中发挥关键作用[18]。激活后的MTOR蛋白可以刺激真核细胞翻译起始因子4E结合蛋白1 (eIF4E-binding protein 1, 4E-BP1)等信号分子, 促进肿瘤的发生。因此, MTOR是肿瘤治疗的重要靶点[19]。已有报道指出, MTOR蛋白激活过程必须有氨基酸参与, 其中细胞内Gln的含量是MTOR蛋白激活的决定因素。在白血病小鼠模型中, 通过抑制细胞膜上Gln转运蛋白ASCT2的活力, 减少胞内Gln含量, 可阻碍MTOR蛋白的激活, 进而降低肿瘤细胞的翻译和自噬, 干扰癌细胞的能量供应和增殖, 最终达到治疗肿瘤的目的[20, 21]。Blenis课题组发现, MTOR在抑制线粒体中SIRT4蛋白活性的同时激活谷氨酸脱氢酶(glutamate dehydrogenase, GDH)。SIRT4蛋白活性的抑制能削弱其对Gln代谢的控制; GDH的激活则促进Glu生成α-KG, 参与三羧酸循环, 为肿瘤细胞提供能量来源[22]; 两者均促进Gln对肿瘤细胞的能量供给。因此, 采用基因技术降低MTOR蛋白在肿瘤细胞中的表达, 在体内能有效抑制肿瘤的生长。
1.3 KRASKRAS是一种与细胞生长、分裂以及分化相关的基因, 在肿瘤细胞生长和血管生成等过程中起重要调控作用。正常的KRAS基因可抑制肿瘤的发生, 一旦发生突变, 将持续刺激细胞生长, 导致肿瘤的发生[23, 24]。研究人员发现, 20%的非小细胞肺癌(non-small cell carcinoma, NSCLC)患者存在KRAS基因突变, 经代谢组学的手段分析, KRAS基因突变的细胞分解代谢Gln能力更强[25]; 在胰腺导管腺癌(pancreatic ductal adenocarcinoma, PDAC)模型和小鼠成纤维细胞模型(mouse fibroblast)中, 均存在致癌的KRAS基因[26, 27]。值得关注的是, 这些肿瘤模型中高表达的突变型KRAS细胞, 都是通过增强Gln的代谢为细胞提供能量, 进而促进肿瘤的发生。此外, 在GLS和GPT的催化下, 由Gln生成的α-KG有助于KRAS致癌作用的发挥[28]。Saqcena等[29]采用无Gln培养基培养乳腺癌MCF-7细胞, 使得表达突变型KRAS基因的乳腺癌细胞停留在G2/M期, 提升紫杉醇等干扰细胞分裂的化疗药物的作用。可见, KRAS基因和Gln的代谢密切相关, 对Gln代谢的抑制有助于通过KRAS控制肿瘤的发生。
1.4 MYCMYC是一种在多种癌症中都高表达的致癌基因[30]。可通过激活与糖酵解、Gln代谢, 以及线粒体生物合成相关的基因, 调控肿瘤细胞能量代谢, 为DNA复制和细胞分裂做准备, 加速肿瘤的发生和恶化[31]。Yuneva等[32]发现, 在人成纤维细胞IMR90中, 中止葡萄糖的供应对MYC活性影响较小, 但是减少Gln供应会严重影响MYC的活性并引起细胞凋亡; 反之, MYC过表达将会使细胞GLS活性增强, 加快Gln代谢, 有利于人口腔癌细胞KB增殖[33]。所以, 对MYC过表达的肿瘤细胞采取中止Gln供应的方法, 导致肿瘤细胞凋亡, 有望成为一种有效的治疗方法。
2 Gln在肿瘤发展中的作用 2.1 Gln代谢相关转运蛋白当肿瘤细胞发生代谢重编程后, 为了满足细胞快速生长的能量需求, 与Gln代谢相关的转运蛋白和代谢酶的表达量也相应升高。在肿瘤细胞表面主要有两种与Gln相关的转运蛋白, 一种是钠离子依赖性的ASCT2, 主要负责转运包括Gln在内的中性氨基酸[34]。这类转运蛋白在多种肿瘤细胞, 如乳腺癌、前列腺癌、黑色素瘤等细胞中均高表达[35, 36]。因此, 可以利用基因工程手段, 如shRNA, 沉默人乳腺鳞状癌细胞HCC1806中ASCT2基因, 还可以采用ASCT2蛋白抑制剂, 如苄基丝氨酸(benzylserine)或γ-谷氨酸对硝基苯胺(γ-Glu-p-nitroanilide), 降低人前列腺癌细胞PC-3细胞中ASCT2的转运活性[37]。这两种方式都可以通过抑制ASCT2的转运功能降低Gln的细胞摄取, 在细胞水平抑制肿瘤增殖。
除ASCT2外, 肿瘤细胞表面高表达的另一种Gln相关转运蛋白是胱氨酸-谷氨酸反向转运蛋白(cystine/glutamate antiporter, xCT)。它将Gln代谢产生的Glu泵到细胞外, 将胱氨酸转运至细胞内, 进入细胞的胱氨酸很快转变为半胱氨酸[38]。在三阴乳腺癌细胞MDA-MB-231荷瘤小鼠模型中肿瘤细胞高表达xCT, 采用柳氮磺胺吡啶(sulfasalazine, SASP)可以下调xCT的转运活性, 进而抑制肿瘤生长, 体内效果较好, 为预后较差的乳腺癌提供了治疗靶点[39]; 在肺癌模型中也同样观察到对xCT活性的抑制有利于控制肿瘤的发展[40]。除此之外, xCT还会抑制抑癌基因TP53 (tumor protein p53)的表达。如果对肺癌细胞H1299荷瘤小鼠采用TP53蛋白激动剂和SLC7A11转运蛋白抑制剂联用的治疗方式, 既可以抑制GSH的生成, 促进癌细胞的氧化损伤; 同时还可以激活TP53基因表达P53抑癌蛋白, 从而发挥协同抑瘤作用[41]。Martin等[42]发现xCT的表达量会根据肿瘤微环境变化做出相应调整。例如缺氧、高ROS或者低氨基酸供应等条件会刺激xCT表达量的上调, 增加细胞内胱氨酸的转运, 进而导致GSH含量上升, 有利于维护肿瘤氧化还原稳态。这一发现揭示了肿瘤在外界应激条件下会产生相应的适应性反应。因此, 在肿瘤治疗过程中, 不仅需要考虑治疗方法的有效性和安全性, 而且需要考虑到肿瘤微环境的变化对治疗效果的影响。
2.2 Gln代谢相关酶当Gln进入细胞后, 首先会在GLS的作用下分解为Glu和一个铵离子。因此, GLS是Gln代谢过程中的第一步催化酶, 也是肿瘤治疗的重要靶点。GLS存在两种异构体GLS1和GLS2。GLS2被广泛认为是肿瘤抑制因子, 而GLS1则有可能促进肿瘤发展, 目前尚未发现两者可能发生相互转化的研究结果。为了有效抑制GLS1, 除了采用基因沉默的方法外[43], 还选用GLS1抑制剂直接抑制其活性。双-2-(5-苯基乙酰基-1, 2, 4-噻二唑-2-基)乙基硫醚([bis-2-(5-phenylacetmido-1, 2, 4-thiadiazol-2-yl) ethyl sulfide, BPTES])是较常用的GLS1特异性抑制剂。在携带人B淋巴细胞瘤P493异种移植小鼠模型中, 对比BPTES实验组和空白对照组, 实验组明显抑制了肿瘤的生长, 延长了小鼠的存活期, 且未发现显著的毒性。以上结果表明, 直接抑制GLS1活性可以起到一定的抑癌效果[44]。但是Biancur等[45]发现在PDAC模型中, 虽然BPTES在体外实验中有一定效果, 但进入体内后胰腺癌细胞可以通过自身代谢网络的调整, 降低BPTES在小鼠体内抑瘤效果。由此可以看出, 肿瘤组织代谢复杂, 存在着多种代偿机制。在充分了解肿瘤细胞实时、动态的代谢状态的前提下, 采取合适的治疗方式, 才可能提高治疗效果。
相对于直接抑制GLS1产生的抑癌效果, 目前研究更多的是抑制GLS1后产生的相关下游通路的变化。由于Gln的代谢产物Glu是合成GSH的底物之一, 短期限制Gln可诱发细胞产生内质网应激(endoplasmic reticulum stress, ER stress), 有利于具有抗癌效果的促炎趋化因子白细胞介素-8 (interleukin-8, IL-8)的分泌。因此, 使用GLS1抑制剂BPTES限制骨肉瘤U2OS细胞对Gln的供应, 刺激IL-8分泌, 可以在体外抑制肿瘤细胞增殖[46]。另外, Rho GTPases是多种信号通路中的“分子开关”, 调控细胞的形态、骨架重建、迁移、以及细胞周期等, 同时也参与了肿瘤发展过程中的许多重要活动。研究发现, GLS1与Rho GTPases的活性有关。GLS1抑制剂可阻止成纤维细胞中Rho GTPases诱导的致癌转化, 对乳腺癌细胞SKBR3和B淋巴瘤细胞P493的生长都有抑制作用, 而对正常细胞没有影响[47]。以上结果证明了对GLS1的抑制可以有效限制肿瘤细胞对Gln的利用, 不仅减少了碳源、氮源的供应, 而且抑制了肿瘤恶化相关分子的激活, 阻止肿瘤进一步发展。
在肿瘤的发展过程中, 相关转运蛋白和代谢酶表达量增多是促进Gln代谢的主要原因。因此, 目前开发和使用的药物也多为上述两类靶点的抑制剂(表 1)。
| Table 1 Strategies to pharmacologically target glutamine metabolism in cancer. BPTES: bis-2-(5-Phenylacetmido-1, 2, 4-thiadiazol-2-yl) ethyl sulfide; DON: 6-Diazo-5-oxo-L-norlenucine; FDA: US Food and Drug Administration; ASCT2: Alanine-serine-cysteine transporter 2; GLS1: Glutaminase 1; xCT: Cystine/glutamate antiporter |
除了以上靶点外, 还有多个和Gln代谢相关的靶点与肿瘤发展相关。在三阴乳腺癌(triple negative breast cancer, TNBC)模型中, MDA-MB-468对Gln的缺失十分敏感。中断Gln的供应会导致表达有肿瘤坏死因子相关凋亡诱导配体(tumor necrosis factor-related apoptosis-inducing ligand, TRAIL)的细胞更容易发生凋亡。因此, 限制Gln的供给也成为一种潜在的抗肿瘤手段[48]。在强烈的紫外或红外光照射下, 细胞发生DNA的断裂, 刺激细胞产生代偿反应。此时细胞线粒体高表达SIRT4蛋白, 抑制线粒体Gln的代谢, 在降低能量供应的同时, 限制Gln提供修复DNA损伤所需的氮源, 导致突变的DNA无法进一步复制, 从而维持了基因组的稳定性[49] (图 2)。因此, 在治疗肺癌H1299细胞移植模型小鼠时, 采取诱导SIRT4蛋白高表达与调控肿瘤Gln代谢联用的方式, 可以有效抑制肿瘤的生长。
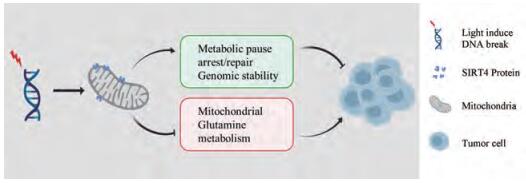
|
Figure 2 The role of mitochondria protein SIRT4 in glutamine metabolism |
值得注意的是, 在肿瘤的发展阶段, 免疫细胞会被大量激活。这些被激活的免疫细胞(如T淋巴细胞[50])与肿瘤细胞类似, 将催化Gln转化为α-KG, 参与TCA循环; 同时用于DNA和RNA的合成[51]。当血液中Gln浓度较低时会影响免疫细胞的功能[52], 因此, 在临床食管癌放疗期间会采取口服Gln的方式保护淋巴细胞[53]。由此可见, 在通过调整Gln代谢治疗肿瘤时, 需要考虑Gln缺乏对免疫系统的不良影响。
3 Gln在肿瘤转移中的作用高度转移性是恶性肿瘤的主要特点。当肿瘤基质、黏附分子或其他相关基因发生改变时, 肿瘤细胞从原发部位, 经淋巴道、血管或体腔等途径, 到达其他组织和器官继续生长的过程称为肿瘤转移。肿瘤转移导致手术切除预后效果差并且易于复发, 是癌症高复发率和死亡率的主要原因, 但目前治疗癌症的手段对防止肿瘤转移的效果有限[54]。研究者利用VM-C3细胞转移肿瘤模型小鼠在体模型评估了Gln类似物6-重氮-5-氧代-L-正亮氨酸(6-diazo-5-oxo-L-norlenucine, DON)对肿瘤转移的治疗效果。结果显示, DON作为Gln的结构类似物竞争性抑制GLS的活性, 从而降低了Gln的代谢, 明显抑制了癌细胞肝、肺和肾的转移。可见, 针对Gln的代谢疗法也可以应用于控制癌症的全身性转移[55]。
3.1 肿瘤基质细胞中影响肿瘤转移的关键分子在代谢重编程后, 肿瘤基质细胞作为肿瘤微环境的重要组成部分, 与肿瘤细胞之间存在着物质和信息的代谢偶联。通过对这一代谢偶联关系的研究, 有利于发现抑制肿瘤转移的新靶点。在卵巢癌SKOV3植瘤小鼠模型中, 采用基因沉默技术同时抑制肿瘤基质细胞中GS和癌细胞中GLS的表达, 可以明显控制肿瘤生长并降低转移[56]。此外, 肿瘤基质细胞表面穴样内陷(caveolae)中的主要膜内在蛋白caveolin-1, 可切断肿瘤基质细胞与肿瘤细胞之前的代谢偶联, 有效抑制肿瘤发生转移。乳腺癌细胞MCF-7体外实验证明, 肿瘤基质细胞中的小窝蛋白(caveolin-1)基因的缺失, 可以促进肿瘤基质细胞自噬。自噬产生的Gln可以为肿瘤细胞供能, 而癌细胞消耗Gln产生的代谢副产物铵离子可以进一步刺激肿瘤基质细胞自噬的发生, 促进肿瘤转移[57]。该蛋白的表达水平调控也成为近年来的研究热点。而在三阴乳腺癌细胞MDA-MB-231中, 肿瘤细胞内的Glu通过xCT转运到细胞外, 会使血液中Glu的浓度上升, 促进与肿瘤细胞膜上的GRM3代谢型谷氨酸受体结合, 激活Rab27通路, 促进基质金属蛋白酶(membrane-type 1 matrix metalloproteinases, MT1-MMP)从肿瘤细胞释放至胞外基质。肿瘤细胞外基质中MT1-MMP浓度的升高加速肿瘤基质的降解, 促进癌细胞通过血液运输、扩散, 并发生转移[58]。
除了存在Gln、Glu等的物质交流外, 肿瘤基质细胞和肿瘤细胞之间还存在单链小分子RNA等信号分子的交流。当三阴乳腺癌细胞MDA-MB-231细胞分泌含有microRNA-105的外泌体到达肿瘤基质细胞时, 激活MYC分子, 增强了基质细胞的Gln代谢, 生成的Glu通过xCT分泌到胞外, 为周围的肿瘤细胞生长提供能量。肿瘤基质细胞也可以对癌细胞产生的铵离子进行再利用, 生成氨基酸等物质。这样不仅支持癌细胞的生物大分子合成, 还起到解毒的作用[59] (图 3)。由此可见, 肿瘤基质细胞和癌细胞两者在肿瘤微环境中是相辅相成的。所以切断两者之间的代谢偶联, 使双方的物质和信息交流中断, 不仅可以使两者缺少能量供应发生细胞凋亡, 还可以阻碍信号通路的传递, 抑制肿瘤的转移。
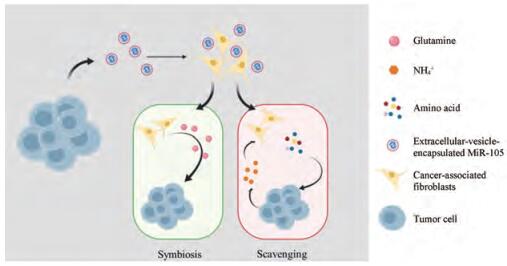
|
Figure 3 Metabolic reprogramming of CAFs by cancer-secreted EVs through a miR-105-mediated mechanism identified herein. CAF: Cancer-associated fibroblasts; EVs: Extracellular-vesicles |
然而, 也有文献[60]报道, 当使用培养过脂肪细胞的培养基对结肠癌MC38及CT26进行培养后, 虽然肿瘤细胞的增殖不受影响, 但是划痕实验证明癌细胞迁移性受到抑制。通过分析发现只有当脂肪细胞内高表达GS时会出现上述现象。这也说明了并非所有的Gln代谢都促进肿瘤转移, 还有存在抑制肿瘤转移进程的情况。
3.2 其他相关靶点Gln不仅影响肿瘤基质细胞和癌细胞的代谢偶联, 还可以通过加快自身物质能量代谢和提高细胞黏附分子(cell adhesion molecule, CAM, 参与细胞间, 以及细胞与细胞外基质之间相互作用的分子)的表达, 促进肿瘤转移。在肿瘤缺氧的微环境下, HIF-1可以促进GLS1高表达, 加快Gln代谢, 为人结肠癌细胞HT29的淋巴结和肺转移提供能量, 有利于肿瘤细胞在转移组织的生长[61]; 而在Gln代谢重编程后, 人前列腺癌细胞PC-3又将Gln作为脂质合成的主要原料, 为转移的肿瘤细胞提供了充足的脂肪供应[62]。另外, CD44是一种在多种癌细胞中高表达的细胞黏附分子, 与肿瘤的侵袭和转移相关[63]。在人胃肠癌细胞MKN28中, CD44蛋白高表达, 并且与xCT相互作用, 增强xCT对胱氨酸的转运效率, 促进还原型GSH的合成, 增强肿瘤细胞的ROS清除能力。因此, 沉默CD44分子在抑制肿瘤转移的同时还将抑制GSH的合成, 使肿瘤细胞对氧化应激反应更敏感, 在小鼠体内实验效果良好, 有助于肿瘤的治疗。综上所述, 采用干扰Gln代谢的方式, 可以切断转移肿瘤的能量供应, 有效抑制肿瘤转移的发生。
4 总结与展望在肿瘤代谢重编程环境下, Gln作为肿瘤生长的“条件性必需氨基酸”, 为肿瘤提供碳源、氮源, 以及维持氧化还原稳态, 是癌细胞重要的物质和能量来源, 在肿瘤发生发展的各个阶段都发挥着重要作用。然而, 并不是所有肿瘤区域都具有较高水平的Gln, 在某些肿瘤模型中心区域, Gln与其他氨基酸相比含量反而较低。低水平Gln会诱导组蛋白的高甲基化, 有利于癌细胞去分化, 导致血管内皮生长因子(vascular endothelial growth factor, VEGF)的表达和血管的生成, 从而促进肿瘤生长和转移[64]。由此可以看出, 在复杂的肿瘤代谢网络中, 要以全局的角度看待问题。目前越来越多的科研人员开始关注肿瘤细胞中Gln异常代谢特征, 期望可以寻找该代谢过程中调控肿瘤细胞状态、发展和恶化水平的新靶点, 这将为抗肿瘤药物开发提供新思路。
| [1] |
Ward PS, Thompson CB. Metabolic reprogramming:a cancer hallmark even warburg did not anticipate[J]. Cancer Cell, 2012, 21: 297-308. DOI:10.1016/j.ccr.2012.02.014 |
| [2] |
Mayers JR, Vander Heiden MG. Famine versus feast:understanding the metabolism of tumors in vivo[J]. Trends Biochem Sci, 2015, 40: 130-140. DOI:10.1016/j.tibs.2015.01.004 |
| [3] |
Lacey JM, Wilmore DW. Is glutamine a conditionally essential amino acid?[J]. Nutr Rev, 1990, 48: 297-309. |
| [4] |
Mohit J, Roland N, Sonia S, et al. Metabolite profiling identifies a key role for glycine in rapid cancer cell proliferation[J]. Science, 2012, 336: 1040-1044. DOI:10.1126/science.1218595 |
| [5] |
Marshall AD, van Geldermalsen M, Otte NJ, et al. ASCT2 regulates glutamine uptake and cell growth in endometrial carcinoma[J]. Oncogenesis, 2017, 6: e367. DOI:10.1038/oncsis.2017.70 |
| [6] |
Kamphorst JJ, Nofal M, Commisso C, et al. Human pancreatic cancer tumors are nutrient poor and tumor cells actively scavenge extracellular protein[J]. Cancer Res, 2015, 75: 544-553. DOI:10.1158/0008-5472.CAN-14-2211 |
| [7] |
Qie S, Yoshida A, Parnham S, et al. Targeting glutamine-addiction and overcoming CDK4/6 inhibitor resistance in human esophageal squamous cell carcinoma[J]. Nat Commun, 2019, 10: 1296. DOI:10.1038/s41467-019-09179-w |
| [8] |
Yang Y, Ishak Gabra MB, Hanse EA, et al. MiR-135 suppresses glycolysis and promotes pancreatic cancer cell adaptation to metabolic stress by targeting phosphofructokinase-1[J]. Nat Commun, 2019, 10: 809. DOI:10.1038/s41467-019-08759-0 |
| [9] |
Coloff JL, Murphy JP, Braun CR, et al. Differential glutamate metabolism in proliferating and quiescent mammary epithelial cells[J]. Cell Metab, 2016, 23: 867-880. DOI:10.1016/j.cmet.2016.03.016 |
| [10] |
Issaq SH, Mendoza A, Fox SD, et al. Glutamine synthetase is necessary for sarcoma adaptation to glutamine deprivation and tumor growth[J]. Oncogenesis, 2019, 8: 20. DOI:10.1038/s41389-019-0129-z |
| [11] |
Yan W, Wu X, Zhou W, et al. Cancer-cell-secreted exosomal miR-105 promotes tumour growth through the MYC-dependent metabolic reprogramming of stromal cells[J]. Nat Cell Biol, 2018, 20: 597-609. DOI:10.1038/s41556-018-0083-6 |
| [12] |
Xiang L, Mou J, Shao B, et al. Glutaminase 1 expression in colorectal cancer cells is induced by hypoxia and required for tumor growth, invasion, and metastatic colonization[J]. Cell Death Dis, 2019, 10: 40. DOI:10.1038/s41419-018-1291-5 |
| [13] |
Xiong G, Stewart RL, Chen J, et al. Collagen prolyl 4-hydroxylase 1 is essential for HIF-1alpha stabilization and TNBC chemoresistance[J]. Nat Commun, 2018, 9: 4456. DOI:10.1038/s41467-018-06893-9 |
| [14] |
Sun RC, Denko NC. Hypoxic regulation of glutamine metabolism through HIF1 and SIAH2 supports lipid synthesis that is necessary for tumor growth[J]. Cell Metab, 2014, 19: 285-292. DOI:10.1016/j.cmet.2013.11.022 |
| [15] |
Mylonis I, Simos G, Paraskeva E. Hypoxia-inducible factors and the regulation of lipid metabolism[J]. Cells, 2019, 8: 1-16. |
| [16] |
Hulea L, Gravel SP, Morita M, et al. Translational and HIF-1alpha-dependent metabolic reprogramming underpin metabolic plasticity and responses to kinase inhibitors and biguanides[J]. Cell Metab, 2018, 28: 817-832. DOI:10.1016/j.cmet.2018.09.001 |
| [17] |
Faubert B, Vincent EE, Griss T, et al. Loss of the tumor suppressor LKB1 promotes metabolic reprogramming of cancer cells via HIF-1alpha[J]. Proc Natl Acad Sci U S A, 2014, 111: 2554-2559. DOI:10.1073/pnas.1312570111 |
| [18] |
Csibi A, Lee G, Yoon SO, et al. The mTORC1/S6K1 pathway regulates glutamine metabolism through the eIF4B-dependent control of c-Myc translation[J]. Curr Biol, 2014, 24: 2274-2280. DOI:10.1016/j.cub.2014.08.007 |
| [19] |
Li C, Chen H, Lan Z, et al. mTOR-dependent upregulation of xCT blocks melanin synthesis and promotes tumorigenesis[J]. Cell Death Differ, 2019, 26: 2015-2028. DOI:10.1038/s41418-019-0274-0 |
| [20] |
Nicklin P, Bergman P, Zhang B, et al. Bidirectional transport of amino acids regulates mTOR and autophagy[J]. Cell, 2009, 136: 521-534. DOI:10.1016/j.cell.2008.11.044 |
| [21] |
Ni F, Yu WM, Li Z, et al. Critical role of ASCT2-mediated amino acid metabolism in promoting leukaemia development and progression[J]. Nat Metab, 2019, 1: 390-403. DOI:10.1038/s42255-019-0039-6 |
| [22] |
Csibi A, Fendt SM, Li C, et al. The mTORC1 pathway stimulates glutamine metabolism and cell proliferation by repressing SIRT4[J]. Cell, 2013, 153: 840-854. DOI:10.1016/j.cell.2013.04.023 |
| [23] |
Bryant KL, Mancias JD, Kimmelman AC, et al. KRAS:feeding pancreatic cancer proliferation[J]. Trends Biochem Sci, 2014, 39: 91-100. DOI:10.1016/j.tibs.2013.12.004 |
| [24] |
Huang L, Carney J, Cardona DM, et al. Decreased tumorigenesis in mice with a Kras point mutation at C118[J]. Nat Commun, 2014, 5: 5410. DOI:10.1038/ncomms6410 |
| [25] |
Brunelli L, Caiola E, Marabese M, et al. Capturing the metabolomic diversity of KRAS mutants in non-small-cell lung cancer cells[J]. Oncotarget, 2014, 5: 4722-4731. DOI:10.18632/oncotarget.1958 |
| [26] |
Son J, Lyssiotis CA, Ying H, et al. Glutamine supports pancreatic cancer growth through a KRAS-regulated metabolic pathway[J]. Nature, 2013, 496: 101-105. DOI:10.1038/nature12040 |
| [27] |
Gaglio D, Metallo CM, Gameiro PA, et al. Oncogenic K-Ras decouples glucose and glutamine metabolism to support cancer cell growth[J]. Mol Syst Biol, 2011, 7: 523. DOI:10.1038/msb.2011.56 |
| [28] |
Weinberg F, Hamanaka R, Wheaton WW, et al. Mitochondrial metabolism and ROS generation are essential for Kras-mediated tumorigenicity[J]. Proc Natl Acad Sci U S A, 2010, 107: 8788-8793. DOI:10.1073/pnas.1003428107 |
| [29] |
Saqcena M, Mukhopadhyay S, Hosny C, et al. Blocking anaplerotic entry of glutamine into the TCA cycle sensitizes K-Ras mutant cancer cells to cytotoxic drugs[J]. Oncogene, 2015, 34: 2672-2680. DOI:10.1038/onc.2014.207 |
| [30] |
Dang CV. MYC on the path to cancer[J]. Cell, 2012, 149: 22-35. DOI:10.1016/j.cell.2012.03.003 |
| [31] |
Lancho O, Herranz D. The MYC enhancer-ome:long-range transcriptional regulation of MYC in cancer[J]. Trends Cancer, 2018, 4: 810-822. DOI:10.1016/j.trecan.2018.10.003 |
| [32] |
Yuneva M, Zamboni N, Oefner P, et al. Deficiency in glutamine but not glncose induces MYC-dependent apoptosis in human cells[J]. J Cell Biol, 2007, 178: 93-105. DOI:10.1083/jcb.200703099 |
| [33] | |
| [34] |
Geldermalsen MV, Wang Q, Nagarajah R, et al. ASCT2/SLC1A5 controls glutamine uptake and tumour growth in triple-negative basal-like breast cancer[J]. Oncogene, 2016, 35: 3201-3208. DOI:10.1038/onc.2015.381 |
| [35] |
Wang Q, Hardie RA, Hoy AJ, et al. Targeting ASCT2-mediated glutamine uptake blocks prostate cancer growth and tumour development[J]. J Pathol, 2015, 236: 278-289. DOI:10.1002/path.4518 |
| [36] |
Wang Q, Beaumont KA, Otte NJ, et al. Targeting glutamine transport to suppress melanoma cell growth[J]. Int J Cancer, 2014, 135: 1060-1071. DOI:10.1002/ijc.28749 |
| [37] |
Bhutia YD, Babu E, Ramachandran S, et al. Amino acid transporters in cancer and their relevance to "glutamine addiction":novel targets for the design of a new class of anticancer drugs[J]. Cancer Res, 2015, 75: 1782-1788. DOI:10.1158/0008-5472.CAN-14-3745 |
| [38] |
Goji T, Takahara K, Negishi M, et al. Cystine uptake through the cystine/glutamate antiporter xCT triggers glioblastoma cell death under glucose deprivation[J]. J Biol Chem, 2017, 292: 19721-19732. DOI:10.1074/jbc.M117.814392 |
| [39] |
Timmerman LA, Holton T, Yuneva M, et al. Glutamine sensitivity analysis identifies the xCT antiporter as a common triple-negative breast tumor therapeutic target[J]. Cancer Cell, 2013, 24: 450-465. DOI:10.1016/j.ccr.2013.08.020 |
| [40] |
Ji X, Qian J, Rahman SMJ, et al. xCT (SLC7A11)-mediated metabolic reprogramming promotes non-small cell lung cancer progression[J]. Oncogene, 2018, 37: 5007-5019. DOI:10.1038/s41388-018-0307-z |
| [41] |
Liu DS, Duong CP, Haupt S, et al. Inhibiting the system xC(-)/glutathione axis selectively targets cancers with mutant-p53 accumulation[J]. Nat Commun, 2017, 8: 14844. DOI:10.1038/ncomms14844 |
| [42] |
Martin L, Gardner LB. Stress-induced inhibition of nonsense-mediated RNA decay regulates intracellular cystine transport and intracellular glutathione through regulation of the cystine/Glutamate exchanger SLC7A11[J]. Oncogene, 2015, 34: 4211-4218. DOI:10.1038/onc.2014.352 |
| [43] |
Szeliga M, Bogacinska-Karas M, Rozycka A, et al. Silencing of GLS and overexpression of GLS2 genes cooperate in decreasing the proliferation and viability of glioblastoma cells[J]. Tumour Biol, 2014, 35: 1855-1862. DOI:10.1007/s13277-013-1247-4 |
| [44] |
Xiang Y, Stine ZE, Xia J, et al. Targeted inhibition of tumor-specific glutaminase diminishes cell-autonomous tumorigenesis[J]. J Clin Invest, 2015, 125: 2293-2306. DOI:10.1172/JCI75836 |
| [45] |
Biancur DE, Paulo JA, Malachowska B, et al. Compensatory metabolic networks in pancreatic cancers upon perturbation of glutamine metabolism[J]. Nat Commun, 2017, 8: 15965. DOI:10.1038/ncomms15965 |
| [46] |
Shanware NP, Bray K, Eng CH, et al. Glutamine deprivation stimulates mTOR-JNK-dependent chemokine secretion[J]. Nat Commun, 2014, 5: 4900. DOI:10.1038/ncomms5900 |
| [47] |
Wang JB, Erickson JW, Fuji R, et al. Targeting mitochondrial glutaminase activity inhibits oncogenic transformation[J]. Cancer Cell, 2010, 18: 207-219. DOI:10.1016/j.ccr.2010.08.009 |
| [48] |
Mauro-Lizcano M, Lopez-Rivas A. Glutamine metabolism regulates FLIP expression and sensitivity to TRAIL in triple-negative breast cancer cells[J]. Cell Death Dis, 2018, 9: 205. DOI:10.1038/s41419-018-0263-0 |
| [49] |
Jeong SM, Xiao C, Finley LW, et al. SIRT4 has tumor-suppressive activity and regulates the cellular metabolic response to DNA damage by inhibiting mitochondrial glutamine metabolism[J]. Cancer Cell, 2013, 23: 450-463. DOI:10.1016/j.ccr.2013.02.024 |
| [50] |
Swamy M, Pathak S, Grzes KM, et al. Glucose and glutamine fuel protein O-GlcNAcylation to control T cell self-renewal and malignancy[J]. Nat Immunol, 2016, 17: 712-720. DOI:10.1038/ni.3439 |
| [51] |
Wasinski F, Gregnani MF, Ornellas FH, et al. Lymphocyte glucose and glutamine metabolism as targets of the anti-inflammatory and immunomodulatory effects of exercise[J]. Mediators Inflamm, 2014, 2014: 1-10. |
| [52] |
Cruzat V, Macedo Rogero M, Noel Keane K, et al. Glutamine:metabolism and immune function, supplementation and clinical translation[J]. Nutrients, 2018, 10. DOI:10.3390/nu10111564 |
| [53] |
Yoshida S, Matsui M, Shirouzu Y, et al. Effects, of glutamine supplements and radiochemotherapy on systemic immune and gut barrier, function in patients with advanced esophageal cancer[J]. Ann Surg, 1998, 227: 485-491. DOI:10.1097/00000658-199804000-00006 |
| [54] |
Leslie PL, Chao YL, Tsai YH, et al. Histone deacetylase 11 inhibition promotes breast cancer metastasis from lymph nodes[J]. Nat Commun, 2019, 10: 4192. DOI:10.1038/s41467-019-12222-5 |
| [55] |
Shelton LM, Huysentruyt LC, Seyfried TN. Glutamine targeting inhibits systemic metastasis in the VM-M3 murine tumor model[J]. Int J Cancer, 2010, 127: 2478-2485. DOI:10.1002/ijc.25431 |
| [56] |
Yang L, Achreja A, Yeung TL, et al. Targeting stromal glutamine synthetase in tumors disrupts tumor microenvironment-regulated cancer cell growth[J]. Cell Metab, 2016, 24: 685-700. DOI:10.1016/j.cmet.2016.10.011 |
| [57] |
Sotgia F, Martinez-Outschoorn UE, Pavlides S, et al. Understanding the Warburg effect and the prognostic value of stromal caveolin-1 as a marker of a lethal tumor microenvironment[J]. Breast Cancer Res, 2011, 13: 213. DOI:10.1186/bcr2892 |
| [58] |
Dornier E, Rabas N, Mitchell L, et al. Glutaminolysis drives membrane trafficking to promote invasiveness of breast cancer cells[J]. Nat Commun, 2017, 8: 2255. DOI:10.1038/s41467-017-02101-2 |
| [59] |
Yan W, Wu X, Zhou W, et al. Cancer-cell-secreted exosomal miR-105 promotes tumour growth through the MYC-dependent metabolic reprogramming of stromal cells[J]. Nat Cell Biol, 2018, 20: 597-609. DOI:10.1038/s41556-018-0083-6 |
| [60] |
Li YF, Chen XZ, Zhang X, et al. Glutamine synthetase from adipocytes inhibits hepatic and pulmonary metastasis of colon cancer cells[J]. J Third Mil Med Univ (第三军医大学学报), 2017, 39: 2255-2261. |
| [61] |
Xiang L, Mou J, Shao B, et al. Glutaminase 1 expression in colorectal cancer cells is induced by hypoxia and required for tumor growth, invasion, and metastatic colonization[J]. Cell Death Dis, 2019, 10: 40. DOI:10.1038/s41419-018-1291-5 |
| [62] |
Dasgupta S, Putluri N, Long W, et al. Coactivator SRC-2-dependent metabolic reprogramming mediates prostate cancer survival and metastasis[J]. J Clin Invest, 2015, 125: 1174-1188. DOI:10.1172/JCI76029 |
| [63] |
Ishimoto T, Nagano O, Yae T, et al. CD44 variant regulates redox status in cancer cells by stabilizing the xCT subunit of system xc(-) and thereby promotes tumor growth[J]. Cancer Cell, 2011, 19: 387-400. DOI:10.1016/j.ccr.2011.01.038 |
| [64] |
Pan M, Reid MA, Lowman XH, et al. Regional glutamine deficiency in tumors promotes dedifferentiation through inhibition of histone demethylation[J]. Nat Cell Biol, 2016, 18: 1090-1101. DOI:10.1038/ncb3410 |
 2020, Vol. 55
2020, Vol. 55


