诺如病毒(norovirus, NoV)是引起全球散发性胃肠炎和暴发性急性胃肠炎的主要病原体之一。1972年, Kapikian等[1]在美国俄亥俄州诺瓦克镇小学暴发的急性胃肠炎患者粪便标本中发现一种新型病毒颗粒, 命名为诺瓦克病毒(Norwalk virus)。此后, 世界各地陆续自胃肠炎患者粪便中分离出多种形态相似的病毒颗粒。2002年, 第八届国际病毒命名委员会正式将形态与诺瓦克病毒相似, 但抗原性略异的病毒颗粒统一命名为诺如病毒(NoV), 归属于杯状病毒科(Caliciviridae)[2]。NoV给社会带来了巨大的健康风险。据统计, 全球有超过50%的病毒性胃肠炎病例是由NoV引起的, 并且有超过85%的非细菌性胃肠炎与NoV相关。NoV直接导致全球每年约90万人次的住院和20万人次的死亡。仅在美国, 每年就有约2 100万例由NoV感染造成的胃肠炎病例[3, 4]。NoV具有高度传染性且感染剂量较低, 通常10~100个病毒即可造成人感染[5]。在人口密集的环境, 如学校、餐馆、养老院和医院等全封闭或半封闭机构中急性胃肠炎的暴发最为常见[6]。NoV的潜伏期多在1~2天, 感染的临床特征包括恶心、呕吐、腹痛、发热和腹泻, 儿童患者呕吐普遍, 成人患者腹泻为多。症状通常持续2~4天, 通常较轻并具有自限性, 但对于幼儿、老年人和免疫功能缺陷患者易发生严重的并发症[7]。
1 诺如病毒简介 1.1 病原学作为杯状病毒科(Caliciviridae)家族的一员, NoV是无包膜的二十面体对称球形, 它是单股正链的RNA病毒, 直径为27~35 nm, 全长约7.4~7.7 kb。基因组包括3个开放阅读框(open reading frames, 即ORF1、ORF2、ORF3, 图 1)[8]。ORF1主要编码非结构蛋白, 其经蛋白酶水解后产生6个功能蛋白, 主要包括: P48或NS1-2、NTPase或NS3、P22或NS4、基因组连接病毒蛋白(VPg)或NS5、NS6Pro或NS6和RNA依赖性RNA聚合酶(RNA-dependent RNA polymerase, RdRp)或NS7[9]。ORF2和ORF3分别编码主要结构蛋白(VP1)和次要结构蛋白(VP2)。VP1是分子质量约60 kDa的病毒衣壳蛋白, 包括两个区域:壳区(shell domain, S区)和突出区(protruding domain, P区), 其中S区形成病毒内壳, P区可介导病毒与人类组织血型抗原受体(human histo-blood group antigens, HBGAs)的结合。VP2分子质量约23 kDa, 有研究显示VP2可帮助重组NoV颗粒, 有助于整个衣壳蛋白的稳定[10, 11]。

|
Figure 1 Structure of norovirus genome |
NoV的遗传基因和抗原性呈高度多样性, 根据其基因特征主要分为5个不同的基因组(genogroups), 每一基因组包含多种基因型(genotypes), 同一基因型病毒又有不同的变异株。在NoV的5个基因组中, GI、GII和GIV组可感染人和其他灵长类动物, GⅢ、GV组分别感染猪和奶牛[12, 13]。其中GII NoV造成了全球80%至90%的NoV感染, 该基因组的第四基因型(GII.4型)则是造成NoV感染的主要原因(约70%)[14]。流行病学研究表明, GII.4菌株会经历周期性进化, 每2~4年就有新变异株出现并流行[15]。
1.2 诺如感染模型的研究NoV是有物种特异性的, 人诺如病毒(human norovirus, HuNoV)只能感染人类并导致人类患病, 而不能在小鼠或其他小型动物体内繁殖扩增, 这极大地限制了抗NoV药物和疫苗评价模型的建立。
研究发现, 感染鼠诺如病毒(MNV)的小鼠体内树突细胞和巨噬细胞会大量复制, 因此推测B细胞是小鼠NoV的敏感细胞[16], 随后科学家便尝试在体外用HuNoV感染人B细胞。2014年, Jones等[17]使用HuNoV GII.4-sydney株成功感染人B细胞, 并指出人类组织血型抗原(HBGAs)对感染起到辅助作用, 然而HuNoV在此模型中复制效率较低。2016年, Ettayebi等[18]成功在源自人干细胞的类肠道组织培养物中培养了HuNoV, 并且揭示了胆汁可以增强GII.4病毒的复制能力, 而其他毒株只在胆汁存在的情况下才可复制。然而, 人肠道组织来源有限, 无法满足病毒的大规模培养及疫苗生产, 在广泛运用于抗病毒筛选和开发前还需要进一步优化。此外, 基于NoV原型株诺瓦克病毒(Norwalk virus, GI.1)的亚基因组复制子体系也被用来评估抗HuNoV候选物。Norwalk复制子可在Huh-7细胞或BHK‐21细胞中自我复制并稳定表达, 它的建立进一步拓宽了NoV细胞培养体系的范围, 在抗病毒药物筛选和抗体评价方面具有重要意义[19]。
迄今为止已有部分动物模型用于扩增HuNoV。Cheetham等[20]用HuNoV GII.4病毒株感染无菌猪, 可引起其轻度腹泻、返吐病毒, 并从其粪便中检测到NoV, 且表现出特殊的免疫应答效应。也有报道称无菌小牛可以支持HuNoV GII.4基因型的感染[21]。除了无菌猪和无菌牛, 其他动物模型也被用于HuNoV研究, 包括非人类灵长类动物, 如黑猩猩、猕猴、恒河猴等[22-24]。但是, 由于临床疾病、肠道环境、微生物群等的明显差异, 目前仍无动物模型可完全模仿HuNoV感染。
此外, 一些与NoV类似性高的病毒也被科学家用来替代NoV进行相关的研究。其中, 能在猫肾细胞培养的猫杯状病毒(feline calicivirus, FCV)和能在小鼠巨噬细胞RAW264.7细胞系中培养的鼠诺如病毒是被最广泛应用的替代病毒[25, 26]。
1.3 病毒复制周期和抗病毒靶点由于缺乏合适和成熟的动物模型和体外细胞培养系统, 人们对NoV的认识进展缓慢, 目前尚无针对NoV的疫苗与抗病毒药物。但随着分子生物技术的发展, NoV复制周期各个阶段的生物学过程不断被阐明, 新的药物靶点不断被发现。NoV复制周期(图 2)主要包括:吸附、侵入、基因组释放、翻译、病毒蛋白酶裂解病毒多蛋白产生成熟病毒蛋白、复制, 最后是组装和释放[27]。理论上, 阻断病毒复制周期的任何一个环节都可以实现抗病毒的目的。近年来, 在研发抗NoV药物方面取得了相当大的进展。本综述精选了具有代表性的研究实例, 总结了抗NoV药物新靶标及其小分子抑制剂的前沿进展, 为加快发现新的安全有效的抗NoV药物提供参考。
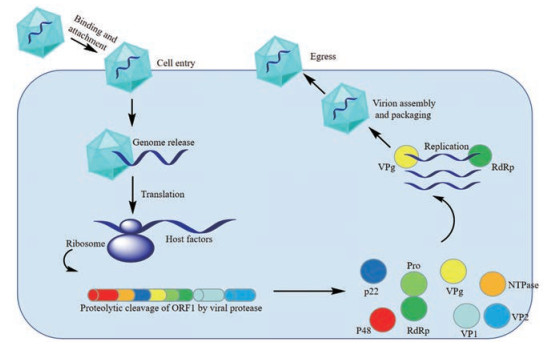
|
Figure 2 The replication cycle of norovirus |
迄今为止, 还没有批准用于治疗用途的抗NoV药物或疫苗, 唯一完成临床试验的候选药物是硝唑尼特(nitazoxanide, NTZ, 1)。NTZ能够抑制多种RNA和DNA病毒, 包括呼吸道合胞病毒(RSV)、冠状病毒、轮状病毒(RV)、乙型肝炎病毒(HBV)、丙型肝炎病毒(HCV)、登革热病毒(DENV)和人类免疫缺陷病毒(HIV)等, 目前被FDA批准用于治疗贾第虫(Giardia)和隐孢子虫(Crytosporidium)的感染[28]。NTZ已被证实在治疗NoV胃肠炎中有一定疗效, 它能够抑制Norwalk复制子(EC50 = 1.6 μmol·L-1)[29, 30]。尽管NTZ是治疗NoV感染的有效分子, 但其精确作用机制仍待阐明。

|
2002年, Hutson等[31]首次提出NoV感染与ABO血型抗原有关的假说。随后的研究发现, 肠道黏膜上的人类组织血型抗原(HBGAs)是NoV的病毒受体[32, 33]。根据NoV通过HBGAs受体吸附侵袭和感染宿主这一原理, 可以设计阻断病毒和HBGAs相互作用的抗NoV药物。
2013年, Zhang等[34]基于酶联免疫吸附测定法(enzyme‐linked immunosorbent assay, ELISA)对200万个化合物进行了虚拟筛选。该方法利用HuNoV VP1/ HBGA阻断试验来筛选能阻断病毒—受体相互作用的潜在分子。结果表明, 具有环戊烷-α-二甲基菲结构的化合物对HBGA-NoV结合具有有效的抑制作用(IC50 < 10 μmol·L-1)。该系列中最有效的化合物是ZINC04041115 (2, IC50约为2.5 μmol·L-1)。其他基于ELISA测定的VLP结合试验表明, 人乳寡糖(human milk oligosaccharides, HMOs)中的2'-岩藻糖基乳糖(2′‐fucosyllactose, 2'FL, 3)和3'-岩藻糖基乳糖(3′‐fucosyllactose, 3'FL)在低浓度(5.5~30.2 mmol·L-1)下能够抑制GII.10 NoV VLPs与HBGAs的结合[35]。随后, 2'FL也被证实可以抑制GII.17和GI.1 VLPs与HBGAs的结合, IC50值分别是13~20和38~50 mmol·L-1 [36]。以类似的方式, 柠檬酸(citrate, 4)也被证明可以与NoV GII.10 VLPs结合导致其形态结构的改变, 从而阻止VLP-HBGA结合[37]。
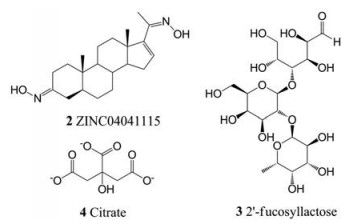
|
单克隆抗体(monoclonal antibodies, mAbs)或纳米抗体(nanobodies, Nbs)的被动免疫疗法是另一种预防NoV附着和侵入的抗病毒策略, 通常采用阻断实验, 即检测mAbs或Nbs是否可以阻断VLP与受体的结合。在黑猩猩模型中, mAb D8能够阻止Norwalk感染。但到目前为止, 产生的mAbs的交叉基因型活性有限, 这使得它们对抗原多样的NoV的抗病毒效果不佳[38]。最近, 已显示Nbs能够通过与衣壳P结构域相互作用而对VLPs产生广泛的中和活性, 且它对特定抗原具有高度亲和力。其中最好的NoV Nbs是Nb-85, 它可阻止GII.1、GII.2、GII.4、GII.12、GII.17和G1.11 VLPs与HBGAs的结合。Nbs显示的交叉基因型活性表明这些分子有潜力克服常规mAbs抗原谱较窄的缺点[39, 40]。
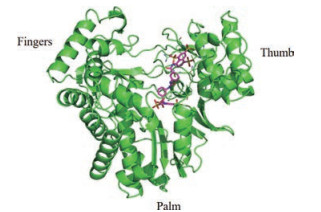
3.2 聚合酶抑制剂RNA依赖性RNA聚合酶(RdRp)对病毒的复制至关重要, 是极具吸引力的抗病毒靶点。NoV RdRp位于ORF1 C端, 具有其他正链RNA病毒RdRp的结构特性和聚合酶共有的结构域, 有手指(fingers)、手掌(palm)以及拇指(thumb)区域(图 3), 主要负责合成负链RNA与大规模正链RNA的配对、翻译病毒衣壳蛋白并组装子代病毒[41]。靶向RdRp的抗病毒药物一般分为核苷类似物与非核苷类抑制剂。值得一提的是, 聚合酶抑制剂同样也是抗HCV、HIV、疱疹病毒和HBV药物的重要组成部分[42-44]。
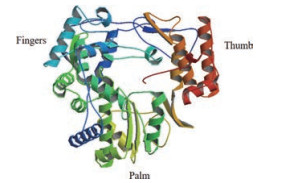
|
Figure 3 Structure of the norovirus polymerase, RdRp (PDB ID: 1SH2) |
核苷类似物(nucleoside analogs, NAs)作为天然底物的类似物, 通过发挥竞争性抑制作用和链终止作用来抑制RNA合成从而发挥抗病毒作用。由于NAs结合在高度保守的RdRp活性位点, 所以与非核苷抑制剂相比, 它们通常表现出广谱抗病毒活性。因此, 针对其他RNA病毒开发的NAs已被用于检测是否具有抗NoV活性。其中, 最初作为抗HCV的抗病毒药物2'-C-甲基胞苷(2′-C‐methylcytidine, 2CMC, 5)是研究最多的药物。尽管口服2CMC前药valopicitabine因胃肠道不良反应而停止用于HCV[45], 它仍被广泛报道为一种潜在的抗NoV药物。2012年, Rocha-Pereira等[46]发现2CMC可抑制MNV RNA的合成和MNV斑块的形成, EC50值分别为1.6和2.0 μmol·L-1。2016年, Kolawole等[47]发现2CMC能够抑制HuNoV BJAB细胞培养系统中的HuNoV复制(EC50 = 0.3 μmol·L-1)。2CMC在小鼠模型中也显示出潜在的抗NoV作用, 将缺乏Ⅰ型Ⅱ型干扰素受体的小鼠在感染MNV后按50 mg·kg-1的剂量1天两次皮下注射2CMC, 共7天, 发现小鼠肠道内NoV的复制和分泌明显减少, 并且小鼠的腹泻发病率和死亡率也有显著的下降[47]。这些研究表明, 2CMC很有可能成为治疗NoV感染和限制NoV蔓延的有效制剂。
法匹拉韦(favipiravir, T705, 6)作为一种广谱NA, 最初是针对流感病毒开发的, 它还可以抑制其他多种病毒的复制, 包括黄病毒、沙粒病毒、汉坦病毒和埃博拉病毒等[48]。T705作为嘌呤类似物, 它可以抑制HuNoV复制子(EC50 = 21 μmol·L-1, CC50 > 100 μmol·L-1)[49]。然而, 由于这种药物存在致畸风险, 需要谨慎使用。
另一种广谱NA利巴韦林(ribavirin, RBV, 7)同样具有对多种DNA和RNA病毒的抗病毒活性, 已应用于临床治疗HCV、RSV、戊型肝炎病毒(HEV)和拉沙热病毒等[50]。2007年, RBV被证明能够抑制MNV (EC50 = 63.5 μmol·L-1)和Norwalk复制子(EC50 = 40 μmol·L-1)[51]。2012年, Alam等[52]通过MNV RdRp的共结晶研究发现RBV的结合位点为聚合酶活性位点, 提示了RBV是作为聚合酶抑制剂发挥抗病毒作用的。
此外, CMX521 (8)是通过高通量筛选发现的一种新型NA。据报道, CMX521是一个泛基因型、强效的抗NoV药物, 目前正处于Ⅰ期临床的招募阶段, 以评估其安全性、耐受性和药代动力学性质。
3.2.2 非核苷抑制剂非核苷抑制剂(non-nucleoside inhibitors, NNIs)通常表现出窄谱抗病毒活性。目前, 在NoV RdRp上存在3个已知的NNIs结合位点:第一个结合口袋位于手指和拇指区域之间的NTP访问路径内; 第二个口袋称为位点A, 它是带有柔性氨基酸侧链的正电荷NTP通道; 第三个口袋称为位点B, 它是位于拇指区域内的高度保守的变构结合口袋[53]。
苏拉明(suramin, 9)作为抗寄生虫药物, 是一个对称的聚阴离子萘基脲, 它能够有效地对抗HIV和HBV。研究表明, 苏拉明能够在体外有效地抑制人和小鼠的NoV聚合酶, IC50值分别为24.6和70.0 nmol·L-1。同样, 作为苏拉明衍生物, NF023 (10)也可抑制人和小鼠的NoV RdRp, IC50分别为71.5和200 nmol·L-1。通过X射线晶体学分析苏拉明和NF023与MNV聚合酶的详细结合模式, 发现这两个分子占据着手指和拇指结构域之间相同的结合位点, 同样, 这两个分子与HuNoV聚合酶的共结晶也显示它们的结合口袋都位于手指和拇指域之间(图 4)[54]。苏拉明的另两个衍生物, NAF2 (11)和PPNDS (12)也被证明能够抑制HuNoV RdRp, IC50值分别为14和0.45 μmol·L-1, PPNDS还可抑制MNV RdRp, IC50为0.88 μmol·L-1 [55]。
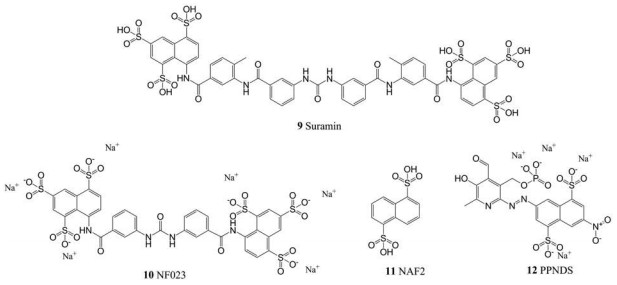
|
|
Figure 4 Structure of the norovirus polymerase, RdRp (PDB ID: 4NRT) bound to NF023 |
尽管苏拉明及其衍生物的抑酶活性较好, 但这些化合物细胞通透性差, 因此它们细胞水平(RAW264.7细胞)的抗病毒效力大大降低, EC50仅为0.3 μmol·L-1 [56]。同样, PPNDS在10 μmol·L-1的噬斑测定中对MNV复制的抑制率仅为20.5%。相比之下, 同浓度的PPNDS对RdRp的抑制率可达98.0%[53]。为进一步提高这些化合物的抗NoV活性, 已有科学家开始尝试通过脂质体输送苏拉明来改善其细胞通透性。
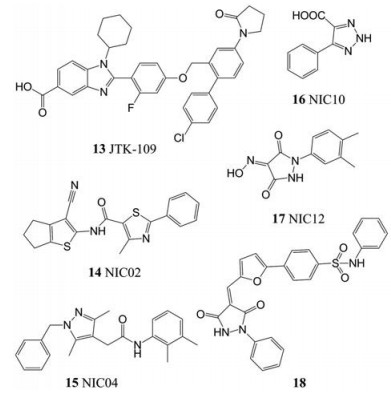
除苏拉明及其衍生物外, 最近几年一些其他非核苷抑制剂也被发现具有抗NoV的功效。其中Netzler等[53]通过荧光聚合酶试验评价了6种HCV NNIs (filibuvir、JTK-109、lomibuvir、nesbuvir、setrobuvir和tegobuvir)对HuNoV RdRp的抗病毒活性。结果发现, 除JTK-109 (13)外, 其他化合物的IC50均超过100 μmol·L-1。JTK-109属于广谱抗病毒分子, 它具有抑制HuNoV聚合酶的活性(IC50 = 4.3 μmol·L-1), 在细胞水平也具有抑制MNV复制的活性(EC50 = 6.1 μmol·L-1)。
2013年, Eltahla等[57]通过先前建立的HCV聚合酶模型对2万个化合物进行了高通量筛选。其中, 4个化合物NIC02 (14)、NIC04 (15)、NIC10 (16)、NIC12 (17)可抑制HuNoV聚合酶, IC50值在5.0~9.8 μmol·L-1之间, 并且也可抑制细胞培养物中的Norwalk复制子和MNV复制, EC50值分别为30.1~ > 100 μmol·L-1和4.8~38.1 μmol·L-1。有报道称, NIC02、NIC04与HuNoV RdRp的结合位点可能与NIC10、NIC12不同, 尚需进一步证实。
此外, Ferla等[58]对30万种市售化合物进行虚拟筛选, 从中筛选并评估了62个化合物对HuNoV RdRp的抑制作用, 并对活性较好的化合物进行了衍生。其中化合物18可以抑制HuNoV RdRp (IC50 = 5.6 μmol·L-1)和MNV RdRp (IC50 = 12.1 μmol·L-1), 成为新的抗NoV先导化合物。
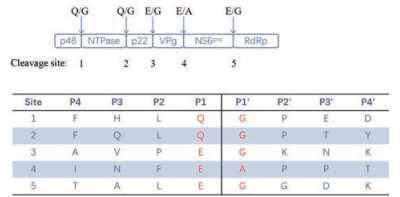
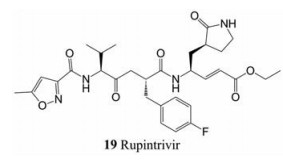
3.3 蛋白酶抑制剂近年来, 病毒蛋白酶作为抗病毒药物靶标引起了人们的广泛关注。与RdRp类似, NoV蛋白酶(NS6)也是一个理想的抗NoV靶点, 它是一种半胱氨酸蛋白酶, 其活性位点由催化三联体组成, 包括半胱氨酸、组氨酸和谷氨酸[11]。NoV多蛋白的蛋白水解发生在5个位点, 其中裂解位点(P1和P1')的N端(P5至P2)和C端(P2'至P5')的氨基酸组成如图 5所示。NoV蛋白酶在非结构性多元蛋白前体加工过程起着重要的作用, 是病毒复制的关键。芦平曲韦(rupintrivir, 19)是第一代的NoV蛋白酶抑制剂, 最初是作为抗人鼻病毒(human rhinovirus)抑制剂开发的。2011年, Kim等[59]发现芦平曲韦对其他小核糖核酸病毒、冠状病毒和杯状病毒具有广谱抗病毒活性。随后的一些研究也证实了这些结果, 并显示芦平曲韦能够抑制Norwalk复制子(EC50 = 1.3 μmol·L-1)[60]。然而, 芦平曲韦的药代动力学性质和生物利用度需要进一步的提高[61]。
|
|
Figure 5 Six functional proteins cleaved by NoVPro and the peptide sequences of the five cleavage sites |
|
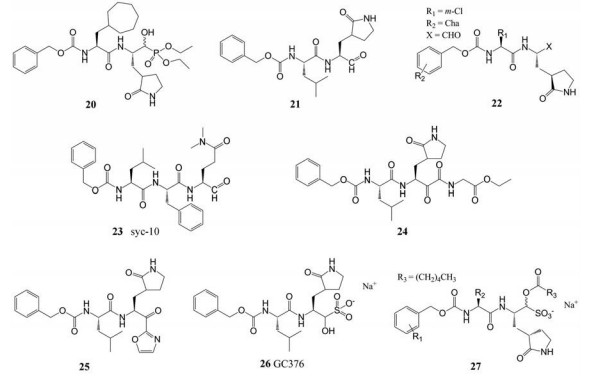
其余的NoV蛋白酶抑制剂可分为过渡态模拟物和过渡态抑制剂。其中, 过渡态模拟物包括α-羟基膦酸盐(α‐hydroxyphosphonates, 20), 它在低微摩尔浓度下能够有效地抑制Norwalk复制子[62]。虽然其效力高, 但相比之下, 对它的研究远少于过渡态抑制剂。第一类过渡态抑制剂是一系列肽基醛, 其结构含有谷氨酰胺替代物, 在这些肽基醛中, 化合物21可同时抑制MNV (EC50 = 5.5 μmol·L-1)和Norwalk复制子(EC50 = 2.1 μmol·L-1)。随后, 进一步的研究总结出肽基醛类化合物的构效关系: ①强效的NoV蛋白酶抑制剂要求有醛基作为P1的亲电体; ② N, N-二取代谷氨酰胺是最有利的P1侧链; ③苯丙氨酸或亮氨酸对P2有利, 而脯氨酸不利于活性[63]。在此之后, 更多的衍生物被开发出来, 包括:二肽基醛类(例如化合物22)、三肽基醛类(例如syc-10, 23)、α-酮基酰胺肽类(例如化合物24)、α-酮杂环类(例如化合物25)、亚硫酸氢盐加合物类(例如GC376, 26)以及双亚硫酸盐加合物的酯或氨基甲酸酯前药(例如化合物27)[64-68]。与最初的肽基醛抑制剂相比, 这些衍生物都显示出同等或更高水平的抗病毒活性。
为了提高上述过渡态抑制剂的膜渗透性和口服生物利用度, 一些对Norwalk复制子具有抑制作用的大环化合物被设计出来(EC50值最低为1.5 μmol·L-1, 例如化合物28), 此外噁二唑类(EC50 = 2.5~51.2 μmol·L-1, 如化合物29)、噁唑烷酮类(EC50 = 6.7~17.5 μmol·L-1如化合物30)、三唑类(EC50 = 3.8~88.3 μmol·L-1, 如化合物31)也显示出一定的抑制作用[69-72], 化合物29和NoV蛋白酶的分子对接图(图 6)显示除了Ala160、Gln110和Ala158与抑制剂之间存在多个氢键外, 抑制剂与His157和Thr134残基也存在氢键作用。尽管这些大环过渡态抑制剂活性并不显著, 但是它们显示出类似于芦平曲韦的广谱抗病毒活性[73]。总而言之, 针对NoV蛋白酶的蛋白酶抑制剂是治疗NoV感染的一类有前景的抗病毒候选物。
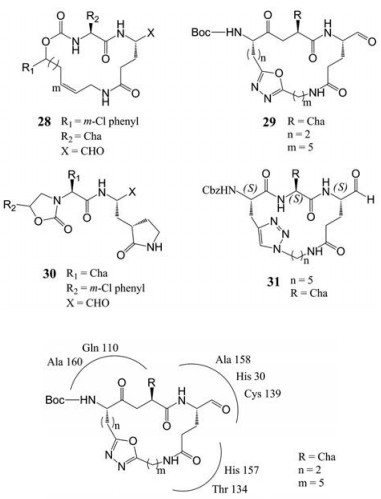
|
Figure 6 The binding mode of 29 to NoV 3CLPro |
随着直接抗病毒药物(direct-acting antiviral agents, DAAs)临床应用的增加, 耐药问题日益突出, 尤其是具有低耐药屏障的非核苷抑制剂和蛋白酶抑制剂。与DAAs相比, 靶向宿主的抗病毒药物通常具有更高的耐药屏障, 并且该类药物可以靶向与病毒直接相互作用或辅助病毒复制的关键蛋白, 具有较好的抗病毒效力, 成为治疗NoV感染的重要类型[74]。
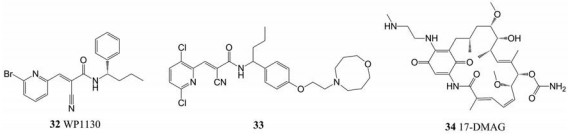
3.4.1 蛋白质靶标最近, 靶向宿主的抗NoV药物去泛素化酶(deubiquitinase, DUB)抑制剂成为研究热点。DUB是一类参与调节泛素-蛋白酶体系统的酶, 该系统通常被病毒利用以进行复制[75, 76]。WP1130 (32)是一个合成的DUB小分子抑制剂, 它通过诱导未折叠蛋白反应(unfolded protein response, UPR)来有效地抑制NoV的复制。然而WP1130的生物利用度较差, 它仅在小鼠小肠中表现出对MNV的抑制作用[77]。为了解决其生物利用度差的问题, 科学家对WP1130进行修饰得到了59种衍生物, 其中化合物33最有效。2.5 μmol·L-1的33能导致Norwalk复制子复制减少84.7%, 并且使感染细胞中MNV滴度降低2.5 log[78]。
|
热休克蛋白90 (heat-shock protein 90, Hsp90)是一种负责多种生物反应过程的蛋白质分子伴侣, 是另外一种抗NoV的宿主靶标[79]。Vashist等[80]最初使用siRNA敲除和过度表达表明Hsp90能与MNV基因组的5′和3′端相互作用, 证实了Hsp90在MNV复制中的关键作用。发现Hsp90抑制剂17-二甲氨基乙胺-17-去甲氧基格尔德霉素(17‐dimethylaminoethylamino‐17‐demethoxygeldanamycin, 17‐DMAG, 34)在体外能够有效抑制MNV复制(IC50 = 60 nmol·L-1, CC50 = 4.5 μmol·L-1), 并且可以使小鼠体内的MNV滴度降低(~1 log)。
虽然一些靶向宿主蛋白的化合物具有潜在的细胞毒性, 但靶向特异性宿主蛋白的治疗可提高抗病毒活性且脱靶效应较小, 逐渐成为抗NoV领域的新热点。
3.4.2 免疫调节剂免疫调节剂已被广泛运用于治疗病毒感染, 其中最好的例子是干扰素(interferons, IFNs)。研究表明, Ⅰ型和Ⅱ型IFNs及其受体能够预防小鼠和人感染NoV[81-83]。最近的研究发现Ⅲ型IFNs (IFN-λ)也有抗NoV感染的作用, IFN-λ可以诱导细胞表达许多由Ⅰ型和Ⅱ型IFNs诱导表达的相同基因[84-86]。然而, 与Ⅰ型和Ⅱ型IFNs不同的是, 单剂量的IFN-λ (1 μg)可预防和清除小鼠持续的MNV感染并且IFN-λ可靶向非造血细胞和肠上皮细胞[87]。在MNV传播模型中, 内源性IFN-λ可阻止感染急性CW3 MNV的小鼠的MNV传播, 不仅如此, IFN-λ还可防止小鼠肠道CW3复制、炎症和抗体反应[88]。总之, 这些研究表明, IFN-λ不仅具有治疗NoV感染的潜力, 而且IFN-λ的预防性用药还可以预防NoV的传播。
|
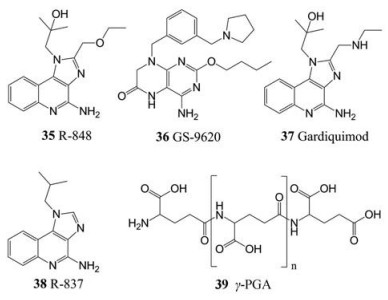
最近, 研究发现免疫调节剂Toll样受体(Toll-like receptor, TLR)激动剂具有抗NoV作用。这类化合物已作为疫苗佐剂使用多年, 能够抑制其他病毒如HIV和HBV的复制[89]。TLR激动剂能够诱导先天免疫反应并刺激IFNs的产生, 已知其在体外对MNV和HuNoV具有抑制作用[81-83]。其中, 几种TLR7激动剂显示出对MNV感染的有效抑制作用, 包括R-848 (35, EC50 = 23.5 nmol·L-1)、GS-9620 (36, EC50 = 0.59 μmol·L-1)、Gardiquimod (37, EC50 = 134.4 nmol·L-1)和R-837 (38, EC50 = 1.5 μmol·L-1)[90]。最近, TLR4激动剂聚谷氨酸(poly-γ-glutamic acid, γ-PGA, 39)显示出体外抑制MNV活性(EC90 < 100 nmol·L-1)。此外, 在MNV感染前后给小鼠注射50 mg·kg-1剂量的γ-PGA会导致≥47%病毒基因组的减少[91]。鉴于TLR7激动剂R-837被批准用于治疗与HPV相关的生殖器疣[92], 并且TLR4激动剂被批准用作HPV和HBV疫苗的佐剂[93], 因此, TLR7和TLR4激动剂在抗NoV感染领域的应用有待于进一步探索。
4 未知靶点药物研究表明, 一些表现出抗病毒活性但作用机制未知的化合物, 包括黄酮类分子, 如茶黄素双没食子酸酯(theaflavin digallate, 40)、杨梅素(myricetin, 41)和表没食子儿茶素没食子酸酯(epigallocatechin-3-gallate, 42)等具有抑制NoV的作用[94-97]。姜黄素(curcumin, 43)在体外对NoV也有一定的抑制作用, 但是目前对其抑制机制知之甚少[98]。此外, 维生素A (vitamin A, 44)在体外能够抑制MNV[99]。硝唑尼特(nitazoxanide, NTZ)也能在细胞水平抑制猫杯状病毒(FCV)的复制(EC50 = 0.6 μmol·L-1)[100]。
|

|
在疫苗研发方面, 由于NoV基因多样、高度变异且无法在体外大规模培养, NoV疫苗的研制进程缓慢, 迄今为止仍无有效的上市疫苗。目前以病毒样颗粒(virus-like particle, VLP)及P粒子(P particle)为代表的NoV疫苗成为主要研发方向。
5.1 VLP疫苗NoV VP1蛋白可在体外表达并能自行组装成病毒样颗粒(VLPs), 其形状和免疫原性与天然NoV十分相似, 且能诱导出较高水平的抗体反应[101], 可应用于疫苗的研发。2009年, El-Kamary等[102]研制出第一批包含局部佐剂的VLP疫苗, 可对同源性感染诱导产生足够的临床保护。此外, 考虑到NoV不同基因型之间交叉保护力弱, 很多研究者致力于研发含主要流行型的多价VLP疫苗。2011年, Treanor等[103]开展了GI.1和GII.4双价疫苗的安全性和免疫原性临床试验, 结果显示该双价疫苗具有良好的安全性和免疫原性。
5.2 P颗粒疫苗相比VLP疫苗, P颗粒疫苗更易于构建, 因为它易于表达、成本低、免疫原性高并且可以减少一些无关抗体的产生, 进而减少不良反应。Tan等[104]进行着P粒子和轮状病毒VP8抗原嵌合疫苗的研发, 以专门针对儿童、老人或免疫功能缺陷患者等特殊群体。现有的研究显示P颗粒疫苗可诱导实验动物产生与VLP疫苗相近的免疫原性和保护效果, 它已经成为近年来继VLP疫苗外另一NoV疫苗的研究热点。
此外, 减毒活疫苗因其高免疫性也受到了人们越来越多的关注和重视。尽管遗传宿主的可变性、基因型组的多样性和病毒的持续进化都干扰着NoV疫苗的研发, 但随着分子检测技术的不断进步和体外感染模型的逐步完善, 相信一定能够研制出一种安全、有效且可持续的NoV疫苗。
6 总结与展望作为引起全球病毒性胃肠炎和腹泻的最主要病原体, NoV在人群的流行和感染越来越频繁, 受到越来越多的关注和重视。尽管现在还没有有效的抗病毒药物和疫苗来预防和治疗NoV感染, 但相关研究从未停止。本文通过对抗NoV病毒的药物靶点、小分子抑制剂及疫苗研究进展的总结, 以期发现安全有效, 具有临床应用价值的抗NoV药物。
目前, 对已上市或未获批准的抗病毒药物进行新应用的重新开发和探索, 很多原先针对其他病毒开发的药物也被发现具有抗NoV的功效。此外, 基于化合物库的计算机辅助药物筛选方法如高通量筛选、虚拟筛选等也被广泛运用于发现抗NoV候选物。近年来, 在研发抗NoV药物方面取得了较大的进展, 包括通过阻断病毒-受体相互作用, 抑制病毒聚合酶、蛋白酶等, 其中阻断HBGA结合、抑制RdRp是目前研究的主要方向。另外靶向必需宿主因子的药物、干扰素, 还有一些未知靶点药物也逐步发现具有抗NoV功效。从天然产物中寻找具有抗NoV活性的化合物也成为发现抗NoV先导化合物的重要途径。同时, 以VLP为主要方向的疫苗研究前景广阔。
随着人们对NoV基因组结构和发病机制研究的日益深入, B细胞和肠上皮干细胞培养系统的完善, NoV受体的发现和证实, 分子克隆、基因重组等新技术的飞速发展, 抗NoV药物的研发提升至一个新的平台。而深入研究NoV特性和复制机制, 完善NoV感染模型, 将会是抗NoV药物研究取得实质性突破的关键。
| [1] |
Kapikian AZ, Wyatt RG, Dolin R, et al. Visualization by immune electron microscopy of a 27-nm particle associated with acute infectious nonbacterial gastroenteritis[J]. J Virol, 1972, 10: 1075-1081. DOI:10.1128/JVI.10.5.1075-1081.1972 |
| [2] |
Vinjé J. Advances in laboratory methods for detection and typing of norovirus[J]. J Clin Microbiol, 2015, 53: 373-381. DOI:10.1128/JCM.01535-14 |
| [3] |
Patel MM, Widdowson MA, Glass RI, et al. Systematic literature review of role of Noroviruses in sporadic gastroenteritis[J]. Emerg Infect Dis, 2008, 14: 1224-1231. DOI:10.3201/eid1408.071114 |
| [4] |
Ramani S, Atmar RL, Estes MK. Epidemiology of human Noroviruses and updates on vaccine development[J]. Curr Opin Gastroenterol, 2014, 30: 25-33. DOI:10.1097/MOG.0000000000000022 |
| [5] |
Green KY. Norovirus infection in immunocompromised hosts[J]. Clin Microbiol Infect, 2014, 20: 717-723. DOI:10.1111/1469-0691.12761 |
| [6] |
Harris JP, Lopman BA, O'Brien SJ. Infection control measures for norovirus: a systematic review of outbreaks in semi-enclosed settings[J]. J Hosp Infect, 2010, 74: 1-9. DOI:10.1016/j.jhin.2009.07.025 |
| [7] |
Atmar RL, Estes MK. Diagnosis of noncultivatable gastroenteritis viruses, the human caliciviruses[J]. Clin Microbiol Rev, 2001, 14: 15-37. |
| [8] |
Thorne L, Arias A, Goodfellow I. Advances toward a Norovirus antiviral: from classical inhibitors to lethal mutagenesis[J]. J Infect Dis, 2016, 213: S27-S31. DOI:10.1093/infdis/jiv280 |
| [9] |
Xi JN, Graham DY, Wang KN, et al. Norwalk virus genome cloning and characterization[J]. Science, 1990, 250: 1580-1583. DOI:10.1126/science.2177224 |
| [10] |
Hardy ME. Norovirus protein structure and function[J]. FEMS Microbiol Lett, 2005, 253: 1-8. DOI:10.1016/j.femsle.2005.08.031 |
| [11] |
Prasad BV, Shanker S, Muhaxhiri Z, et al. Antiviral targets of human noroviruses[J]. Curr Opin Virol, 2016, 18: 117-125. DOI:10.1016/j.coviro.2016.06.002 |
| [12] |
Kageyama T, Shinohara M, Uchida K, et al. Coexistence of multiple genotypes, including newly identified genotypes, in outbreaks of gastroenteritis due to norovirus in Japan[J]. J Clin Microbiol, 2004, 42: 2988-2995. |
| [13] |
Zheng DP, Ando T, Fankhauser RL, et al. Norovirus classification and proposed strain nomenclature[J]. Virology, 2006, 346: 312-323. DOI:10.1016/j.virol.2005.11.015 |
| [14] |
Hoa Tran TN, Trainor E, Nakagomi T, et al. Molecular epidemiology of Noroviruses associated with acute sporadic gastroenteritis in children: global distribution of genogroups, genotypes and GII.4 variants[J]. J Clin Virol, 2013, 56: 185-193. |
| [15] |
Centers for Disease Control and Prevention (CDC). Emergence of new Norovirus strain GII.4 Sydney--United States, 2012[J]. Morb Mortal Wkly Rep, 2012, 62: 55. |
| [16] |
Mumphrey SM, Changotra H, Moore TN, et al. Murine norovirus 1 infection is associated with histopathological changes in immunocompetent hosts, but clinical disease is prevented by STAT1-dependent interferon responses[J]. J Virol, 2007, 81: 3251-3263. DOI:10.1128/JVI.02096-06 |
| [17] |
Jones MK, Watanabe M, Zhu S, et al. Enteric bacteria promote human and mouse norovirus infection of B cells[J]. Science, 2014, 346: 755-759. DOI:10.1126/science.1257147 |
| [18] |
Ettayebi K, Crawford SE, Murakami K, et al. Replication of human noroviruses in stem cell-derived human enteroids[J]. Science, 2016, 353: 1387-1393. |
| [19] |
Chang KO, Sosnovtsev SV, Belliot G, et al. Stable expression of a Norwalk virus RNA replicon in a human hepatoma cell line[J]. Virology, 2006, 353: 463-473. DOI:10.1016/j.virol.2006.06.006 |
| [20] |
Cheetham S, Souza M, Meulia T, et al. Pathogenesis of a genogroup Ⅱ human norovirus in gnotobiotic pigs[J]. J Virol, 2006, 80: 10372-10381. DOI:10.1128/JVI.00809-06 |
| [21] |
Souza M, Azevedo MS, Jung K, et al. Pathogenesis and immune responses in gnotobiotic calves after infection with the genogroup Ⅱ.4-HS66 strain of human norovirus[J]. J Virol, 2008, 82: 1777-1786. DOI:10.1128/JVI.01347-07 |
| [22] |
Bok K, Parra GI, Mitra T, et al. Chimpanzees as an animal model for human norovirus infection and vaccine development[J]. Proc Natl Acad Sci U S A, 2011, 108: 325-330. DOI:10.1073/pnas.1014577107 |
| [23] |
Rockx BH, Bogers WM, Heeney JL, et al. Experimental norovirus infections in non‐human primates[J]. J Med Virol, 2005, 75: 313-320. DOI:10.1002/jmv.20273 |
| [24] |
Farkas T. Natural norovirus infections in Rhesus Macaques[J]. Emerg Infect Dis, 2016, 22: 1272-1274. DOI:10.3201/eid2207.151740 |
| [25] |
Vashist S, Bailey D, Putics A, et al. Model systems for the study of human norovirus Biology[J]. Future Virol, 2009, 4: 353-367. DOI:10.2217/fvl.09.18 |
| [26] |
Karst SM, Wobus CE, Lay M, et al. STAT1-dependent innate immunity to a Norwalk-like virus[J]. Science, 2003, 299: 1575-1578. DOI:10.1126/science.1077905 |
| [27] |
Netzler NE, Enosi Tuipulotu D, White PA. Norovirus antivirals: where are we now?[J]. Med Res Rev, 2019, 39: 860-886. DOI:10.1002/med.21545 |
| [28] |
Rossignol JF. Nitazoxanide: a first-in-class broad-spectrum antiviral agent[J]. Antiviral Res, 2014, 110: 94-103. |
| [29] |
Rossignol JF, El-Gohary YM. Nitazoxanide in the treatment of viral gastroenteritis: a randomized double-blind placebo-controlled clinical trial[J]. Aliment Pharmacol Ther, 2006, 24: 1423-1430. DOI:10.1111/j.1365-2036.2006.03128.x |
| [30] |
Siddiq DM, Koo HL, Adachi JA, et al. Norovirus gastroenteritis successfully treated with nitazoxanide[J]. J Infect, 2011, 63: 394-397. DOI:10.1016/j.jinf.2011.08.002 |
| [31] |
Hutson AM, Atmar RL, Graham DY, et al. Norwalk virus infection and disease is associated with ABO histo-blood group type[J]. J Infect Dis, 2002, 185: 1335-1337. DOI:10.1086/339883 |
| [32] |
Tan M, Hegde RS, Jiang X. The P domain of Norovirus capsid protein forms dimer and binds to histo-blood group antigen receptors[J]. J Virol, 2004, 78: 6233-6242. DOI:10.1128/JVI.78.12.6233-6242.2004 |
| [33] |
Choi JM, Hutson AM, Estes MK, et al. Atomic resolution structural characterization of recognition of histo-blood group antigens by Norwalk virus[J]. Proc Natl Acad Sci U S A, 2008, 105: 9175-9180. DOI:10.1073/pnas.0803275105 |
| [34] |
Zhang XF, Tan M, Chhabra M, et al. Inhibition of histo-blood group antigen binding as a novel strategy to block Norovirus infections[J]. PLoS One, 2013, 8: e69379. DOI:10.1371/journal.pone.0069379 |
| [35] |
Weichert S, Koromyslova A, Singh BK, et al. Structural basis for norovirus inhibition by human milk oligosaccharides[J]. J Virol, 2016, 90: 4843-4848. DOI:10.1128/JVI.03223-15 |
| [36] |
Koromyslova A, Tripathi S, Morozov V, et al. Human norovirus inhibition by a human milk oligosaccharide[J]. Virology, 2017, 508: 81-89. DOI:10.1016/j.virol.2017.04.032 |
| [37] |
Koromyslova AD, White PA, Hansman GS. Treatment of norovirus particles with citrate[J]. Virology, 2015, 485: 199-204. DOI:10.1016/j.virol.2015.07.009 |
| [38] |
Chen Z, Sosnovtsev SV, Bok K, et al. Development of Norwalk virus-specific monoclonal antibodies with therapeutic potential for the treatment of Norwalk virus gastroenteritis[J]. J Virol, 2013, 87: 9547-9557. DOI:10.1128/JVI.01376-13 |
| [39] |
Koromyslova AD, Hansman GS. Nanobodies targeting norovirus capsid reveal functional epitopes and potential mechanisms of neutralization[J]. PLoS Pathog, 2017, 13: e1006636. |
| [40] |
Koromyslova AD, Hansman GS. Nanobody binding to a conserved epitope promotes norovirus particle disassembly[J]. J Virol, 2015, 89: 2718-2730. DOI:10.1128/JVI.03176-14 |
| [41] |
Ng KK, Pendas-Franco N, Rojo J, et al. Crystal structure of Norwalk virus polymerase reveals the carboxyl terminus in the active site cleft[J]. J Biol Chem, 2004, 279: 16638-16645. DOI:10.1074/jbc.M400584200 |
| [42] |
Eltahla AA, Luciani F, White PA, et al. Inhibitors of the hepatitis C virus polymerase; mode of action and resistance[J]. Viruses, 2015, 7: 5206-5224. DOI:10.3390/v7102868 |
| [43] |
Fung J, Lai CL, Seto WK, et al. Nucleoside/nucleotide analogues in the treatment of chronic hepatitis B[J]. J Antimicrob Chemother, 2011, 66: 2715-2725. DOI:10.1093/jac/dkr388 |
| [44] |
De Clercq E. The nucleoside reverse transcriptase inhibitors, nonnucleoside reverse transcriptase inhibitors, and protease inhibitors in the treatment of HIV infections (AIDS)[J]. Adv Pharmacol, 2013, 67: 317-358. DOI:10.1016/B978-0-12-405880-4.00009-3 |
| [45] |
Gardelli C, Attenni B, Donghi M, et al. Phosphoramidate prodrugs of 2'-C-methylcytidine for therapy of hepatitis C virus infection[J]. J Med Chem, 2009, 52: 5394-5407. DOI:10.1021/jm900447q |
| [46] |
Rocha-Pereira J, Jochmans D, Debing Y, et al. The viral polymerase inhibitor 2'-C-methylcytidine inhibits Norwalk virus replication and protects against norovirus-induced diarrhea and mortality in a mouse model[J]. J Virol, 2013, 87: 11798-11805. DOI:10.1128/JVI.02064-13 |
| [47] |
Kolawole AO, Rocha-Pereira J, Elftman MD, et al. Inhibition of human norovirus by a viral polymerase inhibitor in the B cell culture system and in the mouse model[J]. Antiviral Res, 2016, 132: 46-49. DOI:10.1016/j.antiviral.2016.05.011 |
| [48] |
Furuta Y, Gowen BB, Takahashi K, et al. Favipiravir (T-705), a novel viral RNA polymerase inhibitor[J]. Antiviral Res, 2013, 100: 446-454. DOI:10.1016/j.antiviral.2013.09.015 |
| [49] |
Jin Z, Tucker K, Lin X, et al. Biochemical evaluation of the inhibition properties of favipiravir and 2'-C-methyl-cytidine triphosphates against human and mouse norovirus RNA polymerases[J]. Antimicrob Agents Chemother, 2015, 59: 7504-7516. DOI:10.1128/AAC.01391-15 |
| [50] |
Snell NJ. Ribavirin--current status of a broad spectrum antiviral agent[J]. Expert Opin Pharmacother, 2001, 2: 1317-1324. DOI:10.1517/14656566.2.8.1317 |
| [51] |
Chang KO, George DW. Interferons and ribavirin effectively inhibit Norwalk virus replication in replicon-bearing cells[J]. J Virol, 2007, 81: 12111-12118. |
| [52] |
Alam I, Lee JH, Cho KJ, et al. Crystal structures of murine norovirus-1 RNA-dependent RNA polymerase in complex with 2-thiouridine or ribavirin[J]. Virology, 2012, 426: 143-151. DOI:10.1016/j.virol.2012.01.016 |
| [53] |
Netzler NE, Enosi Tuipulotu D, Eltahla AA, et al. Broad-spectrum non-nucleoside inhibitors for caliciviruses[J]. Antiviral Res, 2017, 146: 65-75. DOI:10.1016/j.antiviral.2017.07.014 |
| [54] |
Mastrangelo E, Pezzullo M, Tarantino D, et al. Structure-based inhibition of Norovirus RNA-dependent RNA polymerases[J]. J Mol Biol, 2012, 419: 198-210. DOI:10.1016/j.jmb.2012.03.008 |
| [55] |
Tarantino D, Pezzullo M, Mastrangelo E, et al. Naphthalene-sulfonate inhibitors of human norovirus RNA-dependent RNA-polymerase[J]. Antiviral Res, 2014, 102: 23-28. DOI:10.1016/j.antiviral.2013.11.016 |
| [56] |
Mastrangelo E, Mazzitelli S, Fabbri J, et al. Delivery of suramin as an antiviral agent through liposomal systems[J]. ChemMedChem, 2014, 9: 933-939. DOI:10.1002/cmdc.201300563 |
| [57] |
Eltahla AA, Lim KL, Eden JS, et al. Nonnucleoside inhibitors of norovirus RNA polymerase: scaffolds for rational drug design[J]. Antimicrob Agents Chemother, 2014, 58: 3115-3123. DOI:10.1128/AAC.02799-13 |
| [58] |
Ferla S, Netzler NE, Ferla S, et al. In silico screening for human norovirus antivirals reveals a novel non-nucleoside inhibitor of the viral polymerase[J]. Sci Rep, 2018, 8: 4129. DOI:10.1038/s41598-018-22303-y |
| [59] |
Kim Y, Lovell S, Tiew KC, et al. Broad-spectrum antivirals against 3C or 3C-like proteases of picornaviruses, noroviruses, and coronaviruses[J]. J Virol, 2012, 86: 11754-11762. |
| [60] |
Kitano M, Hosmillo M, Emmott E, et al. Selection and characterization of rupintrivir-resistant Norwalk virus replicon cells in vitro[J]. Antimicrob Agents Chemother, 2018, 62: e00201-00218. |
| [61] |
Hayden FG, Turner RB, Gwaltney JM, et al. Phase Ⅱ, randomized, double-blind, placebo-controlled studies of ruprintrivir nasal spray 2-percent suspension for prevention and treatment of experimentally induced rhinovirus colds in healthy volunteers[J]. Antimicrob Agents Chemother, 2003, 47: 3907-3916. DOI:10.1128/AAC.47.12.3907-3916.2003 |
| [62] |
Mandadapu SR, Gunnam MR, Galasiti Kankanamalage AC, et al. Potent inhibition of norovirus by dipeptidyl α-hydroxyphosphonate transition state mimics[J]. Bioorg Med Chem Lett, 2013, 23: 5941-5944. DOI:10.1016/j.bmcl.2013.08.073 |
| [63] |
Tiew KC, He G, Aravapalli S, et al. Design, synthesis, and evaluation of inhibitors of Norwalk virus 3C protease[J]. Bioorg Med Chem Lett, 2011, 21: 5315-5319. DOI:10.1016/j.bmcl.2011.07.016 |
| [64] |
Galasiti Kankanamalage AC, Kim Y, Weerawarna PM, et al. Structure-guided design and optimization of dipeptidyl inhibitors of norovirus 3CL protease. Structure-activity relationships and biochemical, X-ray crystallographic, cell-based, and in vivo studies[J]. J Med Chem, 2015, 58: 3144-3155. |
| [65] |
Muhaxhiri Z, Deng L, Shanker S, et al. Structural basis of substrate specificity and protease inhibition in Norwalk virus[J]. J Virol, 2013, 87: 4281-4292. DOI:10.1128/JVI.02869-12 |
| [66] |
Mandadapu SR, Weerawarna PM, Gunnam MR, et al. Potent inhibition of norovirus 3CL protease by peptidyl α-ketoamides and α-ketoheterocycles[J]. Bioorg Med Chem Lett, 2012, 22: 4820-4826. DOI:10.1016/j.bmcl.2012.05.055 |
| [67] |
Mandadapu SR, Gunnam MR, Tiew KC, et al. Inhibition of norovirus 3CL protease by bisulfite adducts of transition state inhibitors[J]. Bioorg Med Chem Lett, 2013, 23: 62-65. DOI:10.1016/j.bmcl.2012.11.026 |
| [68] |
Galasiti Kankanamalage AC, Kim Y, Rathnayake AD, et al. Design, synthesis, and evaluation of novel prodrugs of transition state inhibitors of norovirus 3CL protease[J]. J Med Chem, 2017, 60: 6239-6248. |
| [69] |
Damalanka VC, Kim Y, Alliston KR, et al. Oxadiazole-based cell permeable macrocyclic transition state inhibitors of norovirus 3CL protease[J]. J Med Chem, 2016, 59: 1899-1913. DOI:10.1021/acs.jmedchem.5b01464 |
| [70] |
Damalanka VC, Kim Y, Galasiti Kankanamalage AC, et al. Design, synthesis, and evaluation of a novel series of macrocyclic inhibitors of norovirus 3CL protease[J]. Eur J Med Chem, 2017, 127: 41-61. DOI:10.1016/j.ejmech.2016.12.033 |
| [71] |
Damalanka VC, Kim Y, Galasiti Kankanamalage AC, et al. Structure-guided design, synthesis and evaluation of oxazolidinone-based inhibitors of norovirus 3CL protease[J]. Eur J Med Chem, 2018, 143: 881-890. |
| [72] |
Weerawarna PM, Kim Y, Galasiti Kankanamalage AC, et al. Structure-based design and synthesis of triazole-based macrocyclic inhibitors of norovirus protease: structural, biochemical, spectroscopic, and antiviral studies[J]. Eur J Med Chem, 2016, 119: 300-318. DOI:10.1016/j.ejmech.2016.04.013 |
| [73] |
Mandadapu SR, Weerawarna PM, Prior AM, et al. Macrocyclic inhibitors of 3C and 3C-like proteases of picornavirus, norovirus, and coronavirus[J]. Bioorg Med Chem Lett, 2013, 23: 3709-3712. |
| [74] |
Kaufmann SHE, Dorhoi A, Hotchkiss RS, et al. Host-directed therapies for bacterial and viral infections[J]. Nat Rev Drug Discov, 2018, 17: 35-56. DOI:10.1038/nrd.2017.162 |
| [75] |
Gonzalez-Hernandez MJ, Pal A, Gyan KE, et al. Chemical derivatives of a small molecule deubiquitinase inhibitor have antiviral activity against several RNA viruses[J]. PLoS One, 2014, 9: e94491. DOI:10.1371/journal.pone.0094491 |
| [76] |
Luo H. Interplay between the virus and the ubiquitin-proteasome system: molecular mechanism of viral pathogenesis[J]. Curr Opin Virol, 2016, 17: 1-10. DOI:10.1016/j.coviro.2015.09.005 |
| [77] |
Perry JW, Ahmed M, Chang KO, et al. Antiviral activity of a small molecule deubiquitinase inhibitor occurs via induction of the unfolded protein response[J]. PLoS Pathog, 2012, 8: e1002783. |
| [78] |
Charbonneau ME, Gonzalez-Hernandez MJ, Showalter HD, et al. Small molecule deubiquitinase inhibitors promote macrophage anti-infective capacity[J]. PLoS One, 2014, 9: e104096. DOI:10.1371/journal.pone.0104096 |
| [79] |
Li J, Soroka J, Buchner J. The Hsp90 chaperone machinery: conformational dynamics and regulation by co-chaperones[J]. Biochim Biophys Acta, 2012, 1823: 624-635. DOI:10.1016/j.bbamcr.2011.09.003 |
| [80] |
Vashist S, Urena L, Gonzalez-Hernandez MB, et al. Molecular chaperone Hsp90 is a therapeutic target for noroviruses[J]. J Virol, 2015, 89: 6352-6363. DOI:10.1128/JVI.00315-15 |
| [81] |
Maloney NS, Thackray LB, Goel G, et al. Essential cell-autonomous role for interferon (IFN) regulatory factor 1 in IFN-γ-mediated inhibition of norovirus replication in macrophages[J]. J Virol, 2012, 86: 12655-12664. DOI:10.1128/JVI.01564-12 |
| [82] |
Thackray LB, Duan E, Lazear HM, et al. Critical role for interferon regulatory factor 3 (IRF-3) and IRF-7 in type Ⅰ interferon-mediated control of murine norovirus replication[J]. J Virol, 2012, 86: 13515-13523. |
| [83] |
Changotra H, Jia Y, Moore TN, et al. Type Ⅰ and Type ⅠI interferons inhibit the translation of murine norovirus proteins[J]. J Virol, 2009, 83: 5683-5692. DOI:10.1128/JVI.00231-09 |
| [84] |
Nice TJ, Robinson BA, Van Winkle JA. The role of interferon in persistent viral infection: insights from murine norovirus[J]. Trends Microbiol, 2018, 26: 510-524. DOI:10.1016/j.tim.2017.10.010 |
| [85] |
Kotenko SV, Gallagher G, Baurin VV, et al. IFN-lambdas mediate antiviral protection through a distinct class Ⅱ cytokine receptor complex[J]. Nat Immunol, 2003, 4: 69-77. |
| [86] |
Bolen CR, Ding S, Robek MD, et al. Dynamic expression profiling of type Ⅰ and type ⅠII interferon-stimulated hepatocytes reveals a stable hierarchy of gene expression[J]. Hepatology, 2014, 59: 1262-1272. DOI:10.1002/hep.26657 |
| [87] |
Nice TJ, Baldridge MT, McCune BT, et al. Interferon-λ cures persistent murine norovirus infection in the absence of adaptive immunity[J]. Science, 2015, 347: 269-273. DOI:10.1126/science.1258100 |
| [88] |
Rocha-Pereira J, Jacobs S, Noppen S, et al. Interferon lambda (IFN-λ) efficiently blocks norovirus transmission in a mouse model[J]. Antiviral Res, 2018, 149: 7-15. DOI:10.1016/j.antiviral.2017.10.017 |
| [89] |
Bam RA, Jones GS, Irrinki A, et al. TLR7 agonist GS-9620 is a potent inhibitor of acute HIV-1 infection in human peripheral blood mononuclear cells[J]. Antimicrob Agents Chemother, 2016, 61: e01369-16. |
| [90] |
Enosi Tuipulotu D, Netzler NE, Lun JH, et al. TLR7 agonists display potent antiviral effects against norovirus infection via innate stimulation[J]. Antimicrob Agents Chemother, 2018, 62: e02417-17. DOI:10.1128/AAC.02417-17 |
| [91] |
Lee W, Kim M, Lee SH, et al. Prophylactic efficacy of orally administered Bacillus poly-γ-glutamic acid, a non-LPS TLR4 ligand, against norovirus infection in mice[J]. Sci Rep, 2018, 8: 8667. DOI:10.1038/s41598-018-26935-y |
| [92] |
Moore RA, Edwards JE, Hopwood J, et al. Imiquimod for the treatment of genital warts: a quantitative systematic review[J]. BMC Infect Dis, 2001, 1: 3. DOI:10.1186/1471-2334-1-3 |
| [93] |
Dowling JK, Mansell A. Toll-like receptors: the swiss army knife of immunity and vaccine development[J]. Clin Transl Immunol, 2016, 5: e85. DOI:10.1038/cti.2016.22 |
| [94] |
Ohba M, Oka T, Ando T, et al. Antiviral effect of theaflavins against caliciviruses[J]. J Antibiot (Tokyo), 2017, 70: 443-447. DOI:10.1038/ja.2016.128 |
| [95] |
Seo DJ, Choi C. Inhibitory mechanism of five natural flavonoids against murine norovirus[J]. Phytomedicine, 2017, 30: 59-66. DOI:10.1016/j.phymed.2017.04.011 |
| [96] |
Dong JS, Su BJ, Oh H, et al. Comparison of the antiviral activity of flavonoids against murine norovirus and feline calicivirus[J]. Food Control, 2016, 60: 25-30. DOI:10.1016/j.foodcont.2015.07.023 |
| [97] |
Su X, D'Souza DH. Naturally occurring flavonoids against human norovirus surrogates[J]. Food Environ Virol, 2013, 5: 97-102. DOI:10.1007/s12560-013-9106-4 |
| [98] |
Yang M, Lee G, Si J, et al. Curcumin shows antiviral properties against norovirus[J]. Molecules, 2016, 21: 1401. DOI:10.3390/molecules21101401 |
| [99] |
Lee H, Ko G. Antiviral effect of vitamin A on norovirus infection via modulation of the gut microbiome[J]. Sci Rep, 2016, 6: 25835. DOI:10.1038/srep25835 |
| [100] |
Fumian TM, Tuipulotu DE, Netzler NE, et al. Potential therapeutic agents for feline calicivirus infection[J]. Viruses, 2018, 10: 433. DOI:10.3390/v10080433 |
| [101] |
Jiang X, Wang M, Graham DY, et al. Expression, self-assembly, and antigenicity of the Norwalk virus capsid protein[J]. J Virol, 1992, 66: 6527-6532. DOI:10.1128/JVI.66.11.6527-6532.1992 |
| [102] |
El-Kamary SS, Pasetti MF, Mendelman PM, et al. Adjuvanted intranasal Norwalk virus-like particle vaccine elicits antibodies and antibody-secreting cells that express homing receptors for mucosal and peripheral lymphoid tissues[J]. J Infect Dis, 2010, 202: 1649-1658. DOI:10.1086/657087 |
| [103] |
Treanor JJ, Atmar RL, Frey SE, et al. A novel intramuscular bivalent norovirus virus-like particle vaccine candidate--reactogenicity, safety, and immunogenicity in a Phase 1 trial in healthy adults[J]. J Infect Dis, 2014, 210: 1763-1771. DOI:10.1093/infdis/jiu337 |
| [104] |
Tan M, Huang P, Xia M, et al. Norovirus P particle, a novel platform for vaccine development and antibody production[J]. J Virol, 2011, 85: 753-764. DOI:10.1128/JVI.01835-10 |
 2020, Vol. 55
2020, Vol. 55


