呼吸道合胞病毒可引起呼吸道感染, 在某些患者人群中可导致严重疾病。病毒感染从上呼吸道到下呼吸道导致气道感染和毛细支气管炎、肺炎等症状, 在某些情况下, 还会导致呼吸衰竭[1-3]。RSV是世界范围内引起婴儿急性下呼吸道感染最重要的病毒病原体[4, 5], 据估计全球每年约340万人住院, 约20万人死亡。在1岁以下的婴儿中, 与RSV相关的死亡病例明显多于流感病毒[6]。此外, RSV感染与儿童反复喘息和哮喘的长期发展风险有关。除婴儿外, 患有慢性阻塞性肺疾病等潜在心肺疾病的老年人越来越被认为是严重感染的高危人群。在这一人群中, 据估计, 美国每年因呼吸道合并症而住院的人数为18万人, 死亡人数为1.4万人。第三类易受RSV感染的群体是移植后免疫抑制的患者, 其中严重的下呼吸道感染具有非常高的死亡风险[7]。
RSV严重威胁人类的健康, 但目前尚无疫苗或有效的抗病毒疗法。美国FDA批准用于RSV感染防治的药物仅限于(雾化)广谱抗病毒药物利巴韦林(ribavirin)和palivizumab[8, 9]。利巴韦林被批准用于治疗住院儿童严重RSV感染, 但由于其非特异性、潜在毒性和相对较高的成本等问题[9], 美国儿科协会并不推荐将利巴韦林用于RSV感染患儿的治疗。Palivizumab是一种人源化的抗RSV融合蛋白单克隆抗体, 它以高度保守的RSV F糖蛋白为靶标, 抑制病毒进入宿主细胞, 主要用于预防早产儿或有潜在疾病的高危婴儿RSV感染, 并不能用于RSV感染后治疗, 而且治愈率低、费用昂贵。因此, 开展新型抗RSV药物的研究具有重要意义。
RSV是一种包膜病毒, 属于肺炎病毒科。其基因组由10个基因组成(图 1), 编码11种蛋白质:非结构蛋白NS1和NS2、L蛋白(RNA依赖的RNA聚合酶, RdRp)、核蛋白(N)、磷蛋白(P)、基质蛋白(M)、小疏水蛋白(SH)、糖蛋白(G)、融合蛋白(F)以及转录抗终止子蛋白M2-1和M2-2[10, 11] (图 2)。其中, G蛋白是翻译后的糖基化表面蛋白, 并且在病毒附着过程中识别细胞表面成分(例如肝素); F蛋白介导病毒进入细胞质, 也促进合胞体的形成。根据G蛋白羧基末端外周域的核苷酸序列, RSV可分为两个亚组RSV-A和RSV-B, 它们含有不同的基因型[1]。

|
Figure 1 Respiratory syncytial virus (RSV) genome |
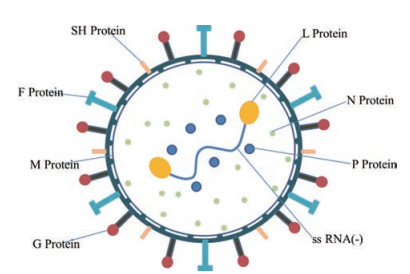
|
Figure 2 Structure and drug targets of RSV |
RSV感染是由病毒糖蛋白(G)附着到细胞表面引起的。然后, RSV通过F蛋白的6螺旋卷曲线束与宿主细胞膜融合, 允许病毒复制复合体进入细胞, 这是副粘病毒科特有的机制[1]。虽然RSV感染的详细机制尚不明确, 但最被认可的机制是由F蛋白通过甲壳蛋白介导的内吞作用使核衣壳进入宿主细胞。RSV的RNA首先转化为正链, 以此作为复制的模板产生子代基因组。当核衣壳以出芽方式通过被感染细胞的胞膜时, 病毒颗粒获得包膜。子代RSV在被感染细胞的顶部以芽生方式释放进入呼吸道。RSV的吸附、融合、去包膜、脱核衣壳和复制、转录、翻译、组装以及释放组成其生命周期, 其中任何一个阶段都是抗病毒治疗潜在的干预靶标[11] (图 3)。

|
Figure 3 The RSV infection and replication process |
近年来, 除了FDA批准的抗RSV药物外, 许多针对RSV复制周期不同环节的其他抑制剂正在开发中, 包括融合抑制剂、RSV聚合酶抑制剂、核蛋白抑制剂等(表 1)。本文综述了近几年的研究进展。
| 表 1 Anti-RSV drugs and targets in research and development |
融合是RSV生命周期中的关键一步, 抑制该步骤会导致病毒载量和合体形成的减少。在病毒与靶细胞膜结合时, F糖蛋白发生构象变化, 暴露出疏水口袋或表位。通过RSV融合抑制剂结合这些暴露的靶点, 可以防止病毒进入宿主细胞[12]。按照化合物的结构类型, 融合抑制剂可分为以下几种。
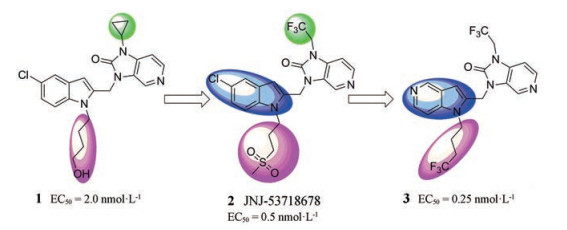
1.1 苯并咪唑及相关骨架 1.1.1 JNJ-537186782014年, Janssen制药公司报道了一系列5-氯吲哚类RSV特异性融合抑制剂, 以化合物1为先导化合物, 经过结构优化得到代表结构JNJ-53718678 (化合物2, 图 4), 具体是将1中的苯并咪唑-2-酮N-环丙基替换为三氟乙基, 提高了代谢稳定性; 同时在5-氯吲哚上引入含甲砜基的基团[1]。JNJ-53718678已被证明通过与病毒融合糖蛋白(F)结合, 进而抑制RSV的活性, 它在细胞和动物模型中具有强效的抗RSV作用(EC50 = 0.5 nmol·L-1), 在HeLa细胞中抑制重组rgRSV224病毒的EC50值为0.46 nmol·L-1, 在空斑减少实验中对8个非重组RSV-A和RSV-B株的EC50值约为0.2~20 nmol·L-1。健康成年人的临床研究评估了它的抗病毒疗效以及安全性, 结果表明, JNJ-53718678减少了RSV的病毒载量、RSV引起呼吸道感染的严重程度以及疾病的持续时间[13]。2018年, 启动了分别针对RSV住院婴儿和RSV感染成人的两项Ⅱ期临床研究[14]。
|
Figure 4 The structures of compounds 1-3 |
此外, 还合成了含有吲哚结构的氮杂环替代品化合物3 (图 4), 其药代动力学性质与5-氯吲哚类化合物类似。
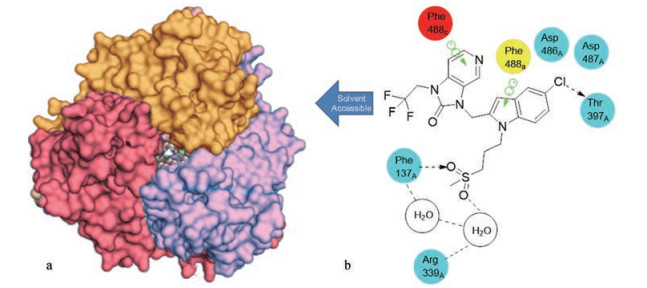
等温量热法(isothermal calorimetry, ITC)等实验表明该类化合物的结合位点位于预融合F蛋白的三聚体外域内的口袋上(图 5a)。此外, 细胞水平的热激触发实验表明该化合物能稳定融合前构象。与未结合配体的蛋白结构相比, 结合位点苯丙氨酸等残基的构象重排有利于化合物的结合。其中关键结合作用包括: JNJ-53718678结构中的吲哚和苯并咪唑-2-酮芳香性残基形成的堆积作用、5-氯取代基与Thr397的骨架羰基的氢键, 以及砜基与Arg339之间存在的水介导的氢键(图 5b)[15]。
|
Figure 5 a) The pattern of JNJ 53718678 binding to the central site of trimer fusion protein; b) Diagram of key interactions between JNJ 53718678 and binding sites |
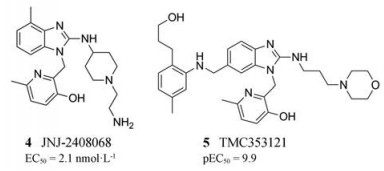
2008年, Johnson公司采用基于结构的设计策略通过对JNJ-2408068 (化合物4, EC50=2.1 nmol·L-1)的结构衍生化得到了一种苯并咪唑类RSV融合抑制剂TMC353121 (化合物5, pEC50 =9.9)[16], 它显示出剂量依赖性的抗病毒活性。在体外实验中, TMC353121能够结合于融合蛋白F的HR1区和HR2区, 抑制病毒-细胞融合以及细胞-细胞合胞体的形成, 进而抑制RSV进入宿主细胞, 达到抗病毒效果[17]。另一种可能的作用机制是它可以稳定F蛋白融合前构象并阻止其向融合后的构象转变。用TMC353121处理RSV-A2感染的BALB/c小鼠, 结果表明小鼠肺中的病毒载量明显降低。在棉花大鼠和非洲绿猴的临床前研究中使用TMC353121, 发现病毒载量以剂量依赖的方式减少, 肺部炎症也减轻[17]。因此, TMC353121可作为治疗RSV感染的候选药物。
|
2016年, Re Viral Ltd公司为提高化合物6的活性与药代动力学性质(EC50 = 31 nmol·L-1), 对其进行结构优化得到了RV521 (化合物7, EC50=1.3 nmol·L-1), 其中氧化吲哚螺环丙烷是RV521的关键基团。RV521的病毒亚型覆盖率非常广泛, 在针对14个RSV-A和10个RSV-B临床分离株的空斑减少实验中活性几乎没有变化(EC50值为0.1~1.4 nmol·L-1)。临床候选RV521在小鼠(F = 46%)、大鼠(F = 42%)和犬(F = 63%)体内研究中具有良好的口服生物利用度, 其有效性在体外人气道上皮细胞(human airway epithelial, HAE)模型和体内BALB/c小鼠中得到证实[1]。RV521于2018年完成了临床Ⅱa期试验, 结果表明它可有效地降低病毒载量和疾病严重程度, 其疗效正在RSV感染的成人和婴儿中进一步评估[18]。
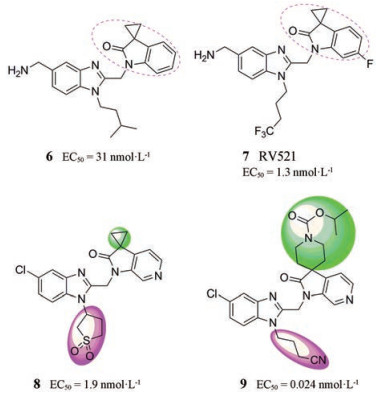
随后, Hoffmann-La Roche通过研究3, 3'-环丙基氮杂羟吲哚与苯并咪唑连接的相关结构, 发现了化合物8, 其在细胞病变效应(cytopathic effect, CPE)测定中具有活性(EC50 = 1.9 nmol·L-1)。此外, Janssen将化合物8中的环丙基和N1-苯并咪唑甲磺酰基丙基用氨基甲酸酯和氰基丁基取代得到化合物9 (EC50 = 0.024 nmol·L-1)[1]。
|
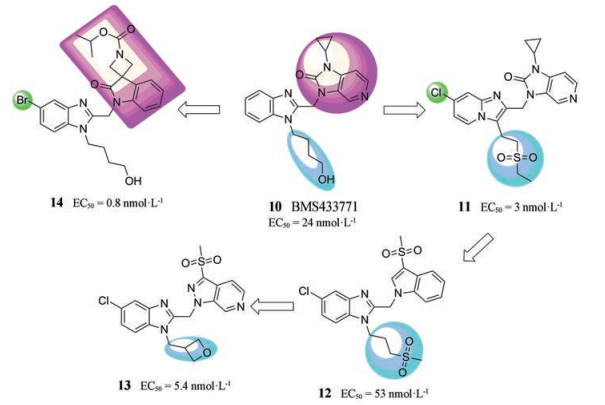
2015年, 罗氏公司基于苯并咪唑骨架, 运用生物电子等排原理设计了咪唑[1, 2-a]吡啶结构, 在BMS433771 (化合物10, EC50 = 24 nmol·L-1)的基础上引入7-Cl取代基和乙磺酰基乙基链得到化合物11 (EC50 = 3 nmol·L-1, 图 6)[19], 但是进一步的分析揭示了其药代动力学性质不佳且有谷胱甘肽加合物(glutathione, GSH)的形成。随后, Janssen公司通过将3-甲基磺酰基吲哚连接到5-氯苯并咪唑中得到化合物12 (EC50 = 53 nmol·L-1)[20]。然后将吲哚换为氮杂吲唑, 并使氧杂环丁烷替代(甲磺酰基)丙基, 得到化合物13 (EC50 = 5.4 nmol·L-1), 其在微粒体稳定性测定中表现出低清除率, 并且在小鼠药代动力学研究中具有合理的口服生物利用度(F = 24%)。在RSV感染的BALB/c小鼠模型实验中, 13对主要CYP亚型无抑制作用, 无显著的HERG抑制或GSH加合物的形成。
|
Figure 6 The structures of compounds 10-14 |
2018年, 药明康德报道了化合物14, 它是在10的基础上对吡啶并咪唑酮部分及苯并咪唑5位取代基进行优化得到的, 14的口服生物利用度较高(F = 71%), 并且在RSV感染的BALB/c小鼠模型中有效(EC50 = 0.8 nmol·L-1)[21]。
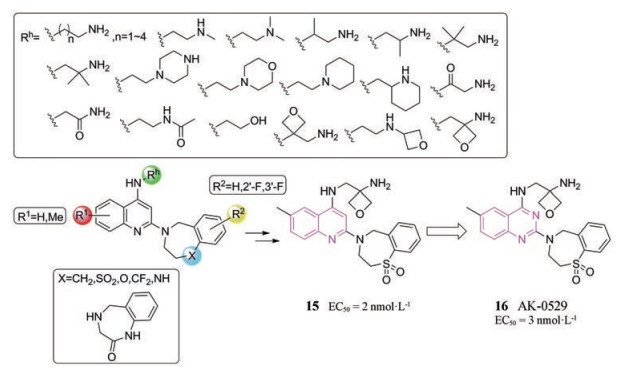
1.2 喹唑啉类抑制剂 1.2.1 AK-05292014年, Ark Biosciences公司从罗氏公司获得AK-0529的全球许可。AK-0529已被证明通过抑制RSV F蛋白诱导的细胞-细胞融合过程实现抗病毒活性。以已知融合抑制剂作为配体, 运用基于相似性的虚拟筛选技术得到了BAQ系列[22]化合物。在BALB/c小鼠RSV感染模型中, BAQ系列中的化合物15显示出良好的抗RSV活性(EC50 = 2 nmol·L-1)。在15的基础上进行了SAR研究, 通过将喹啉转化为喹唑啉发现了AK-0529 (化合物16, 图 7), 其显示出与15相似的抗RSV活性(EC50 = 3 nmol·L-1), 但是与15相比, AK-0529的安全性和口服生物利用度更高, 因此AK-0529被遴选为临床候选药物。
|
Figure 7 The discovery of compound AK-0529 (16) |
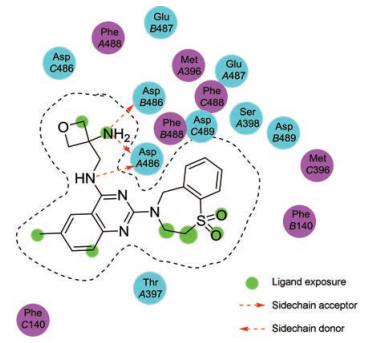
Battles等[23]报道了AK-0529的共晶结构, 发现它与其他的RSV F抑制剂相似, 都靶向相同的RSV F微区, 其中关键的结合作用有:与Asp486作用的氢键、与Phe488的疏水相互作用、氧杂环丁烷侧链的两个N原子与Asp486形成的强氢键相互作用以及Asp489的侧链与喹唑啉环的6-甲基形成的疏水相互作用(图 8)。在Ⅰ期口服AK-0529研究中, 未见药物不良反应发生, AK-0529耐受性良好, 符合标准安全性要求[24]。目前, AK-0529被命名为“儿童呼吸道合胞病毒感染治疗中的病毒抑制剂”, 正在进行Ⅱ期临床试验。
|
Figure 8 The interactions of AK-0529 with RSV F protein main-chain and side-chain atoms |
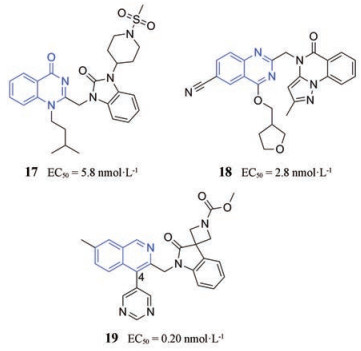
2015年, Medivir AB鉴定了3个系列的6, 6-杂环融合抑制剂, 其中心母核含有喹唑啉酮、喹唑啉或异喹啉(化合物17、18、19)。在喹唑啉系列中, 吡唑并[1, 5-a]喹唑啉-5 (4H)-酮在CPE测定中表现出纳摩尔活性(EC50 = 2.8 nmol·L-1); 然而, 该基团也导致亲脂性增加(clogP = 4.59)。另外异喹啉可以与杂环螺环氧吲哚相连, 其中含有4-嘧啶基取代的异喹啉(19)活性较强, 在CPE测定中表现出纳摩尔活性(EC50 = 0.20 nmol·L-1)[1]。
|
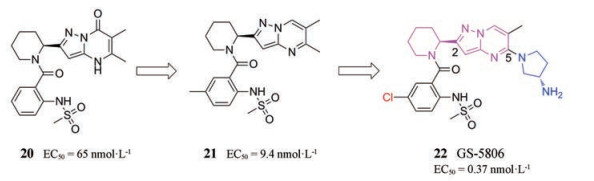
2014年, Gilead Sciences通过对高通量筛选得到的抗病毒苗头化合物进行结构优化发现了GS-5806, 它通过抑制病毒与宿主细胞膜融合所需的F蛋白内融合前至融合后构象的变化来干扰病毒融合过程, 从而阻止RSV进入宿主细胞[25]。关键的结构改造是向中心吡唑并[1, 5-a]嘧啶-2-氨基杂环的转化和杂环上C-5位氨基吡咯烷的引入。在化合物20的基础上, 通过结构优化得到了极性提高的吡唑并[1, 5-a]嘧啶-2-氨基化合物21 (图 9), 但是亲脂性的中心杂环使其代谢稳定性降低。引入(S)-3氨基吡咯烷取代基, 同时将甲基替换为氯原子得到GS5806 (化合物22), 进一步提高了代谢稳定性和抗病毒活性(RSV A2)[7]。胺的碱性有利于增强溶解性, 使GS-5806更适合于优选的口服/肠外给药途径。
|
Figure 9 The structures of compounds 20-22 |
在临床前评估中, GS-5806在75个RSV-A和RSV-B临床分离株中表现出相似的活性水平, 平均EC50值为0.43 nmol·L-1 [6]。在棉花大鼠的肺组织中, 生物利用度和渗透性良好。GS-5806在感染RSV株M37的健康成年志愿者中, 每天口服一次, 显示出良好的安全性和耐受性, 病毒滴度与疾病严重程度显著降低。目前正处于Ⅱ期临床试验[26]。
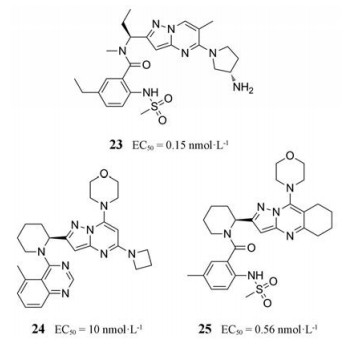
随后, 专利文献公开了几类相关结构。例如, 2016年, 泰顺药业报道了吡唑并[1, 5-a]嘧啶类化合物23; Janssen公司公开了结构类似物, 代表性化合物为24和25[1]。
|
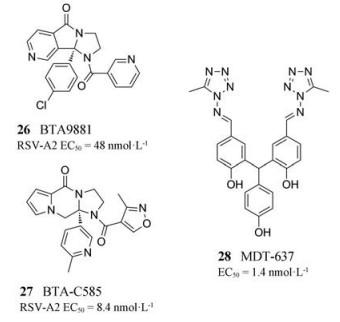
2014年, Biota公司基于BTA9881 (化合物26), 通过骨架跃迁与取代基修饰发现了RSV F蛋白抑制剂BTA-C585 (化合物27)。其在HAE细胞实验中能够有效抑制RSV-A2的复制(EC50 = 8.4 nmol·L-1), 在体外实验中能够抑制临床分离株RSV-A和RSV-B的复制(EC50 < 100 nmol·L-1), 在大鼠和犬体内的生物利用度分别为59%和100%[27]。BTA-C585在2018年5月30日已完成Ⅱ期临床研究, 未见进一步研究的报道。
1.4.2 MDT-6372003年, Douglas等[28]报道了一种取代的双四唑-苯酚类融合抑制剂VP-14637化合物28)的体外抗病毒作用(EC50 = 1.4 nmol·L-1)。但28的口服生物利用度较差, 因此被开发为可直接递送至感染部位的干粉吸入产品MDT-637[29], 可能的作用机制是通过阻断关键蛋白-蛋白相互作用或F蛋白复合物内构象的变化, 抑制RSV诱导的细胞-细胞融合, 并与RSV感染细胞特异性结合[30], 从而抑制RSV进入细胞。MDT-637的抗RSV活性在体外及临床前研究中得以证实。Ⅰ期临床试验中, 该化合物表现出良好的安全性和理想的药代动力学特征。
|
RSV通过细胞表面受体结合的糖蛋白(G蛋白)和融合蛋白(F蛋白)进入细胞。N蛋白结合RSV基因组RNA形成左手螺旋N-RNA核糖核蛋白(ribonucleoprotein, RNP)复合物, RSV编码的RNA依赖性RNA聚合酶(RNA-dependent RNA polymerase, RdRp, L蛋白)以RNP复合物作为模板进行转录和复制[31]。因此, 可以通过破坏RSV聚合酶的活性来抑制RSV的复制。
2.1 核苷类RSV聚合酶抑制剂目前大多数已批准的抗病毒核苷药物通过链终止机制抑制病毒聚合酶, 其中核苷类似物被有效地整合到正在延长的DNA (或RNA)链中, 通过阻止随后的核苷酸结合, 可以“链终止”病毒基因组复制。在结构上, 链终止机制通常源于终止核苷类似物独特的糖修饰, 其通常对特定类型的病毒聚合酶具有高度特异性。RSV聚合酶的活性形式是由L和P蛋白组成的异二聚体; L蛋白是负责RdRp功能的催化亚基。为了寻找有效的核苷类RSV聚合酶抑制剂, 研究者更多地关注糖修饰的核苷, 这些核苷有可能通过链终止机制抑制RSV聚合酶活性[32]。
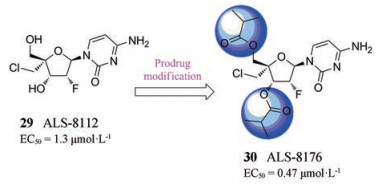
2.1.1 ALS-8176及其衍生物2014年, Janssen制药公司经表型筛选发现了一种核苷类RSV聚合酶抑制剂ALS-8176, 该化合物是通过对一系列4'-胞嘧啶核苷类似物进行药效和药代动力学性质筛选得到, 其中活性最好的是ALS-8112 (化合物29, 图 10, EC50 = 1.3 μmol·L-1)。ALS-8176 (化合物30, EC50 = 0.47 μmol·L-1)是29的3', 5'-氧-二异丁酸酯前药, 在体内具有良好的生物利用度并且能够较容易地转化为29的5'-三磷酸酯。通过体外实验揭示了29的活性三磷酸形式通过掺入链终止机制抑制RSV聚合酶的活性[33]。一项针对健康成年人的临床试验表明, 与安慰剂接受者相比, 在ALS-8176治疗个体的鼻腔冲洗中, RSV载量降低了73%~88%。结果表明, RSV没有对ALS-8176产生耐药性, 并能有效抑制RSV复制。2018年, Janssen完成了一项因毛细支气管炎住院婴儿的Ⅰ期研究, 目前ALS-8176正处于Ⅱ期临床试验[14]。
|
Figure 10 The structures of compounds 29, 30 |
2015年, Gilead通过筛选具有天然核苷和C连接碱基的2'-脱氧-2'-氟核苷类化合物发现了一系列抑制RSV活性的C连接的腺苷核苷。其中化合物31对RSV聚合酶具有中等抑制活性(IC50 = 0.6 μmol·L-1), 但无细胞水平的抗病毒活性。4'-氰基取代得到了活性更好的抑制剂32 (IC50 = 0.086 μmol·L-1), 但细胞水平的抗病毒活性仍不高(EC50 = 2 μmol·L-1)[34]。2018年, ATEA公司公开了以2'-脱氧-2'-氟-4'-甲基核苷为核心的N-甲基-6-氨基嘌呤衍生物作为RSV聚合酶抑制剂。ProTide磷酰胺前药33在HAE细胞实验中可有效地抑制病毒复制(EC90 = 0.052 μmol·L-1), 并且无骨髓干细胞毒性[1]。
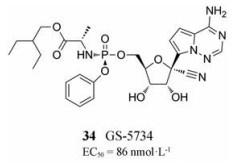
2.1.2 GS-57342016年, 美国疾病控制和预防中心与美国陆军传染病医学研究所合作, 通过筛选含有约1 000个核苷和核苷磷酸酯类似物的化合物库得到了具有体外抗RSV活性的化合物GS-5734 (34, EC50 = 86 nmol·L-1)[35]。GS-5734可通过抑制RSV聚合酶催化的RNA合成发挥抗病毒活性, 它还能抑制埃博拉病毒(Ebola Virus, EBOV)的RNA聚合酶活性, 目前正在对健康志愿者进行多剂量的静脉注射研究, 以评估其临床安全性和药代动力学。由于RSV RNA聚合酶与EBOV RNA聚合酶催化亚结构域的序列和结构具有高度同源性, 因此这种药物在体内活性测试中也可能具有RSV抑制活性。
|
由于RSV聚合酶在病毒复制周期中发挥着重要的作用, 近年来, 除了对核苷类RSV聚合酶抑制剂的研究, 有关非核苷类RSV聚合酶抑制剂的报道也越来越多。根据化合物的结构类型, 非核苷类RSV聚合酶抑制剂可分为以下几种。
2.2.1 噻吩并氮杂䓬及相关骨架2005年, Yamanouchi制药公司通过对化合物库的大规模随机筛选最先报道了基于硫代[3, 2-d]苯并氮杂䓬结构的L蛋白变构抑制剂35 (YM-53403, 图 11), 它通过破坏RSV聚合酶的活性来抑制RSV的复制[36]。虽然35对RSV-A株相当有效, 但对RSV-B株几无活性[37]。

|
Figure 11 The structures of compounds 35-39 |
2011年, Gilead公司为增加35的抗病毒活性和改善溶解性, 通过用吡咯烷基取代的烟酰胺替换联苯苄酰胺基团得到化合物36。2013年, Astra-Zeneca通过将螺环胺并入烟酰胺得到化合物37[38] (AZ-27), 它通过抑制RNA合成的起始阶段来抑制mRNA转录和基因组复制[39]。在37的大鼠药代动力学实验中, 气管给药5 min后, 肺组织中药量仅残留不到最高剂量的5%, 这一结果影响了其进一步的研发[38]。
2017年, Pulmoides公司用2-氟-6-甲基苯酰胺取代37的环丙酰胺, 并且在烟酰胺的C-5位引入甲基得到了候选药物PC786 (化合物38), 活性比37明显提高。PC786已被证明可以通过抑制RSV聚合酶的活性来抑制病毒基因组RNA复制和mRNA转录。它在人上皮样2型(human epithelial type-2, HEp-2)细胞的无细胞酶测定和最小基因组测定中有效地抑制了RSV聚合酶活性(IC50分别为2.1和0.5 nmol·L-1)[40]; 在人支气管上皮细胞中也表现出持久的抗RSV作用, 在接种病毒后的第3天开始治疗, PC786呈浓度依赖性抑制RSV-A2的复制, 病毒载量在第6天降低到不可检测的水平[31]。PC786可以混悬液形式肺部雾化吸入, 这种局部给药成为治疗人类RSV感染一种新的潜在疗法。RSV聚合酶抑制剂PC786目前正处于Ⅱ期临床研究中[31]。
在进一步的研发中, 用吲哚酰胺取代2-氟-6-甲基苯酰胺, 并通过引入4-氟取代基得到了化合物39, 其抑制RSV-B亚型的活性得以提高[41]。
2.2.2 喹唑啉二酮衍生物2014年, Matharu等[42]通过对喹唑啉二酮衍生物进行构效关系研究得到了活性最好的化合物40 (图 12, EC50 = 0.3 μmol·L-1), 并探究了喹唑啉二酮衍生物的作用机制, 结果表明该类化合物在RdRp测定中抑制了RSV聚合酶活性。

|
Figure 12 The discovery of compound 40 |
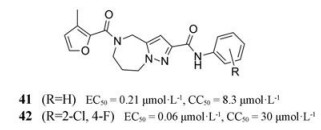
2016年, 乔治亚州立大学的Plemper课题组在高通量筛选中发现了含有中心吡唑并氮杂䓬基团的非核苷类RSV聚合酶抑制剂[43]。通过对约5 000个化合物进行筛选得到化合物41进行下一步的研究, 虽然呋喃酰胺不适于修饰, 但苯酰胺的取代改善了抗病毒活性和选择性指数(化合物42)。
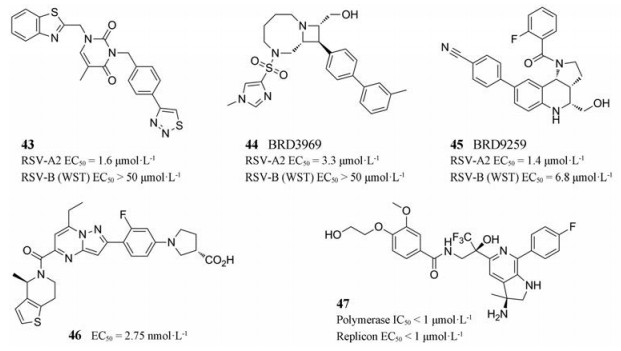
2.2.4 其他非核苷类RSV聚合酶抑制剂2015年, Laganas等[44]报道了通过高通量RSV复制子实验筛选得到的化合物43的特征, 发现43只对RSV-A亚型有活性。突变分析实验得到两个L蛋白突变(Y1631C和I1413T), 并且显示对43与37有交叉耐药性, 表明RSV聚合酶是该抑制剂的靶标[44]。
|
2016年, 博德研究所与阿斯利康合作发现了对RSV-A亚型具有中等活性的先导化合物BRD3969 (化合物44), 它被证明可以抑制病毒复制, 但对RSV-B亚型无活性[45]。然而, BRD9259 (化合物45)却对两种亚型均有活性, 但对其SAR的研究较少。
2016年, Janssen申请了关于吡唑并嘧啶类RSV聚合酶抑制剂的专利(化合物46), 但是没有公开详细的作用机制。Alios也公开了结构不同的非核苷类RSV聚合酶抑制剂, 其中含有三氟甲基醇基团的化合物47在酶促RSV聚合酶和基于细胞的复制子实验中具有活性(EC50 < 1 μmol·L-1)[1]。
3 核蛋白抑制剂针对病毒核蛋白的RSV抑制剂是一个有希望的开发领域。RSV核蛋白(N)作为病毒核糖核蛋白(RNP)复合物的一部分, 对病毒的组装和复制至关重要[46]。因此任何对N蛋白结构或功能的影响都极有可能对病毒有害, 这使得N蛋白成为一个很好的抗病毒靶标。
3.1 RSV-6042007年, Chapman等[47]通过高通量筛选发现了RSV604 (化合物48, EC50 = 0.5~0.9 μmol·L-1), 它是一种具有微摩尔活性可口服的苯二氮䓬类小分子药物。RSV604在体外直接与RSV N蛋白结合, 可以阻断病毒RNA的合成和抑制释放病毒的感染性[46]。它被证明对所有临床分离株RSV-A和RSV-B具有同等效力。感染24 h内给予RSV604, 在HAE细胞模型中病毒载量显著降低[47]。RSV感染的干细胞移植患者进行的Ⅱa期临床试验表明, 经RSV604治疗后, 血浆暴露量达到90%的有效浓度(EC90)。此外, 患者的病毒滴度降低, RSV感染症状也有所减轻。
|
2016年, Enanta制药公司报道了一种新型抑制剂EDP-938。尽管EDP-938的结构尚未公开, 但Enanta公开的一项专利中描述了一种用侧链芳香族连接的氨基噁二唑取代的苯二氮䓬类化合物49。EDP-938在CPE测定中对RSV-A Long和RSV-B WST菌株的EC50值分别为53和72 nmol·L-1, 在含有14个RSV-A和11个RSV-B的临床分离株中显示出广谱抗病毒活性, EC50值在43~190 nmol·L-1之间。EDP-938目前正处于Ⅰ期临床试验[48]。
3.3 ALN-RSV01RNA干扰是一种自然的生物过程, 小干扰RNA (siRNA)的长度通常为19~23个核苷酸, 可以直接对mRNA序列进行特异性降解, 导致相应蛋白的表达减少。

|
2008年, DeVincenzo等[49]报道了一种利用小干扰RNA技术发现的核蛋白抑制剂ALN-RSV01, 它是一种针对RSV核蛋白基因高度保守区域的19个核苷酸的小干扰RNA (SiRNA), 通过阻断病毒核衣壳蛋白(N)的合成来抑制RSV的复制。在一项针对健康成年人的感染研究中, 鼻内注射ALN-RSV01显著降低了RSV的感染率; 在对RSV感染的肺移植受者进行的Ⅱ期临床试验中, 观察到这种siRNA在降低闭塞性细支气管炎综合征风险方面具有良好的安全性和耐受性[50]。
4 G蛋白抑制剂G蛋白是一种黏附蛋白, 主要介导病毒和分布在宿主细胞膜上的受体的结合与吸附。G蛋白的中心区域包含一个由13个高度保守的氨基酸组成的结构域(图 13), 半胱氨酸绞索结构域与4个连接1-4和2-3的半胱氨酸部分重叠, 然后是一个高碱性肝素结合结构域(heparin binding domain, HBD)。HBD可能是大多数细胞表面发现的硫酸乙酰肝素(HS)的附着位点[12]。
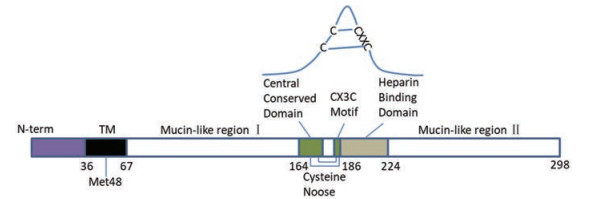
|
Figure 13 The diagram of G protein |
G蛋白介导病毒附着, 然而由于结构高度可变, 目前尚不清楚该蛋白是否适合小分子的治疗性干预。2015年, Evans等[51]采用高通量筛选发现了化合物50, 突变体实验表明G蛋白是其分子靶标。50在感染后的前2 h内给药具有活性(EC50 = 0.66 μmol·L-1), 但在RSV感染的棉花大鼠模型中没有观察到活性。

|
以RSV劫持的宿主蛋白为靶点以抑制复制是一种很有前途的抗病毒策略, 因为靶向宿主蛋白降低了耐药性的产生。核输出蛋白1 (nuclear export protein 1, XPO1)介导RSV M蛋白的核输出, 是RSV组装和出芽的关键。
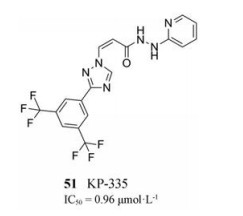
2019年, Jorquera等[52]报道了一种选择性的XPO1抑制剂KPT-335 (化合物51, IC50 = 0.96 μmol·L-1), 它可通过XPO1表达降低、RSV M蛋白核输出中断以及NF-κB信号通路失活的共同作用而抑制RSV复制。KPT-335对RSV-A和RSV-B均有效, 在健康志愿者中进行的Ⅰ期临床试验发现, KPT-335总体安全且耐受性良好。
|
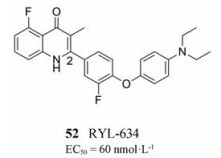
2019年, 清华大学药学院饶燏课题组通过“优势结构”重定位策略发现了一种新型广谱抗病毒药物RYL-634 (化合物52)[53]。基于目前的抗病毒现状, 饶燏课题组与娄智勇课题组合作, 利用之前在发展抗疟疾Ⅱ型NADH脱氢酶(NDH2)抑制剂过程中构建的一类2位二芳基取代的喹诺酮类化合物作为基于表型的筛选对象, 得到了一个活性最强的分子RYL-634, 这也是喹诺酮类化合物在药物发现中作为一种优势结构的体现。
进一步的研究发现, RYL-634对包括RSV在内的多种对人致病的病毒具有很强或较明显的抑制效果(EC50 = 60 nmol·L-1), 对宿主细胞的毒性也在可接受范围内。RYL-634与目前批准的抗病毒药物联用还具有协同效应。经过耐药压力筛选, 未发现对RYL-634耐药的病毒株产生。以上结果显示了基于RYL-634发展新型抗病毒疗法具有很大的潜力。最终, 研究人员通过一系列生化实验、药物亲和力相应的靶标稳定性评价(drug affinity responsive target stability, DARTS)等方法确定了人的二氢乳清酸脱氢酶(dihydroorotate dehydrogenase, DHODH)是RYL-634的一个抗病毒靶点。除了DHODH, 研究人员并不排除RYL-634可能通过其他途径发挥抗病毒作用, 对于其作用机制的进一步研究和类药性质的优化还在进行中[53]。
|
自从20世纪60年代第一次尝试接种RSV以来, 抗体和疫苗的开发一直是RSV药物发现的一个重要领域。尽管Pavilizumab已经成功上市, 但因其疗效和使用群体的有限性, 鼓励着研究者继续寻找新的生物制剂。
目前研发中的抗体主要包括多克隆抗体、单克隆抗体和纳米抗体。多克隆抗体RI-001作为一种新的候选高免疫IVIG产品, 目前正在免疫抑制方面进行Ⅱ期临床试验[9]。单克隆抗体是抗体研发中的主流方向, 主要有REGN2222、MEDI8897、131-2G和Motavizumab, 其中Motavizumab是从Palivizumab发展而来的第2代人源化IgG1单克隆抗体, 它与RSV F糖蛋白上24个残基的线性构象表位FFL结合。与Palivizumab相比抗RSV活性更高, 这表明Motavizumab可能是RSV治疗和预防的重要手段, 目前正在等待FDA的批准[54]。ALX-0171是为治疗RSV感染而开发的第1个纳米抗体, 能有效中和多个RSV毒株[55]。纳米抗体的相对分子质量小且稳定性好, 使其能以鼻腔途径给药, 这一优势也引发了研究者的关注。
尽管RSV疫苗的研发从未止步, 但由于免疫不成熟和母体抗体的免疫抑制作用等原因使有效疫苗的发现依然有很多障碍[56]。目前正在研制的候选疫苗主要包括减毒活疫苗、亚单位疫苗、载体疫苗和纳米颗粒疫苗[57]。最近, 美国国立卫生研究院Graham团队与德克萨斯大学奥斯汀分校研究团队合作发现了一种开发疫苗的新技术:基于结构的疫苗设计, 并获得了一个保持RSV融合糖蛋白融合前构象稳定的候选疫苗(DS-Cav1), 该研究验证了利用结构设计人RSV疫苗的可行性[58]。
8 总结与展望RSV感染引发的呼吸系统疾病给患者带来了沉重的负担, 但是目前FDA批准用于其防治的药物只有利巴韦林和Palivizumab, 且两者都存在着明显的缺陷。因此, 抗RSV药物的新靶标及新型抑制剂将是未来持续的研究热点。当前抗RSV药物研发的途径主要有基于结构的设计策略、对化合物库的高通量筛选、基于相似性的虚拟筛选、表型筛选以及“优势结构”重定位策略。
此外, RSV复制周期依赖于多种宿主蛋白和途径, 靶向关键宿主蛋白是一种研发有效抗RSV药物的替代策略。这种方法的优点是出现RSV逃逸突变体的可能性较低, 但主要的挑战是避免不希望的脱靶效应或毒性。另外有多种途径可以考虑, 比如阻断RSV用于进入宿主细胞的受体。
除了上述靶点如融合抑制剂、RSV聚合酶抑制剂和核蛋白抑制剂外, 体外实验发现SH蛋白很可能与RSV的致病性有关, N蛋白-P蛋白相互作用及M2-1蛋白在病毒转录和复制过程中也发挥着关键的作用, 在以后的研究中应进一步加强对其作用机制的理解, 促进抗RSV药物的研发。而且G蛋白的晶体结构尚未得到, 一旦可用, 它将提供有关G蛋白同CX3CR1和其他宿主蛋白相互作用的机制, 这有利于更好地理解抑制模式以及为新型RSV抑制剂的研发提供帮助。
最后, 为了提高抗病毒效果, 应该探索具有协同作用的多靶点、多位点抑制剂, 以减少RSV耐药突变株的出现。同时, 应广泛运用药物化学领域的新策略、新技术来提高新一代抗RSV药物发现的成功率。
| [1] |
Cockerill GS, Good JAD, Mathews N. State of the art in respiratory syncytial virus drug discovery and development[J]. J Med Chem, 2019, 62: 3206-3227. DOI:10.1021/acs.jmedchem.8b01361 |
| [2] |
Behzadi MA. Overview of current therapeutics and novel candidates against influenza, respiratory syncytial virus, and middle east respiratory syndrome coronavirus infections[J]. Front Microbiol, 2019, 10: 1327. DOI:10.3389/fmicb.2019.01327 |
| [3] |
Zheng X, Liang C, Wang L, et al. Discovery of (aza) indole derivatives as novel respiratory syncytial virus fusion inhibitors[J]. MedChemComm, 2019, 10: 970-973. DOI:10.1039/C9MD00178F |
| [4] |
Pryde DC, Tran TD, Gardner I, et al. Non-benzimidazole containing inhibitors of respiratory syncytial virus[J]. Bioorg Med Chem Lett, 2013, 23: 827-833. |
| [5] |
Chathuranga K, Kim MS, Lee HC, et al. Anti-respiratory syncytial virus activity of and extracts in vitro and in vivo[J]. Viruses, 2019, 11: 7. |
| [6] |
Perron M, Stray K, Kinkade A, et al. GS-5806 inhibits a broad range of respiratory syncytial virus clinical isolates by blocking the virus-cell fusion process[J]. Antimicrob Agents Chemother, 2015, 60: 1264-1273. |
| [7] |
Mackman RL, Sangi M, Sperandio D, et al. Discovery of an oral respiratory syncytial virus (RSV) fusion inhibitor (GS-5806) and clinical of concept in a human RSV challenge study[J]. J Med Chem, 2015, 58: 1630-1643. DOI:10.1021/jm5017768 |
| [8] |
Grindeland CJ, Mauriello CT, Leedahl DD, et al. Association Between updated guideline-based palivizumab administration and hospitalizations for respiratory syncytial virus infections[J]. Pediatr Infect Dis, 2016, 35: 728-732. DOI:10.1097/INF.0000000000001150 |
| [9] |
Empey KM, Peebles RS. Pharmacologic advances in the treatment and prevention of respiratory syncytial virus[J]. Clin Infect Dis, 2010, 50: 1258-1267. DOI:10.1086/651603 |
| [10] |
Jorquera PA. Respiratory syncytial virus: prospects for new and emerging therapeutics[J]. Expert Rev Respir Med, 2017, 11: 609-615. |
| [11] |
Pandya MC, Callahan SM, Savchenko KG. A contemporary view of respiratory syncytial virus (RSV) biology and strain-specific differences[J]. Pathogens, 2019, 8: 67. DOI:10.3390/pathogens8020067 |
| [12] |
McLellan JS, Ray WC. Structure and function of respiratory syncytial virus surface glycoproteins[J]. Curr Top Microbiol Immunol, 2013, 372: 83-104. |
| [13] |
Stevens M, Rusch S, DeVincenzo J, et al. Antiviral activity of oral JNJ-53718678 in healthy adult volunteers challenged with respiratory syncytial virus: a placebo-controlled study[J]. J Infect Dis, 2018, 218: 748-756. DOI:10.1093/infdis/jiy227 |
| [14] |
Xing Y. New therapies for acute RSV infections: where are we?[J]. Eur J Pediatr, 2019, 178: 131-138. DOI:10.1007/s00431-018-03310-7 |
| [15] |
Roymans D, Alnajjar SS, Battles MB, et al. Therapeutic efficacy of a respiratory syncytial virus fusion inhibitor[J]. Nat Commun, 2017, 8: 167. DOI:10.1038/s41467-017-00170-x |
| [16] |
Bonfanti JF, Meyer C, Doublet F, et al. Selection of a respiratory syncytial virus fusion inhibitor clinical candidate. 2. Discovery of a morpholinopropylaminobenzimidazole derivative (TMC353121)[J]. J Med Chem, 2008, 51: 875-896. DOI:10.1021/jm701284j |
| [17] |
Ispas G, Koul A, Verbeeck J, et al. Antiviral activity of TMC353121, a respiratory syncytial virus (RSV) fusion inhibitor, in a non-human primate model[J]. PLoS One, 2015, 10: e0126959. DOI:10.1371/journal.pone.0126959 |
| [18] |
DeVincenzo J, Tait D, Oluwayi O, et al. Safety and efficacy of oral RV521 in a human respiratory syncytial virus (RSV) Phase 2a challenge study[J]. Am J Resp Crit Care, 2018, 197: A7715. |
| [19] |
Feng S, Hong D, Wang B, et al. Discovery of imidazopyridine derivatives as highly potent respiratory syncytial virus fusion inhibitors[J]. ACS Med Chem Lett, 2015, 6: 359-362. |
| [20] |
Feng S, Li C, Chen D, et al. Discovery of methylsulfonyl indazoles as potent and orally active respiratory syncytial virus (RSV) fusion inhibitors[J]. Eur J Med Chem, 2017, 138: 1147-1157. DOI:10.1016/j.ejmech.2017.07.032 |
| [21] |
Shi W, Jiang Z, He H, et al. Discovery of 3, 3'-spiro [azetidine]-2-oxo-indoline derivatives as fusion inhibitors for treatment of RSV infection[J]. ACS Med Chem Lett, 2018, 9: 94-97. DOI:10.1021/acsmedchemlett.7b00418 |
| [22] |
Zheng X, Liang C, Wang L, et al. Discovery of benzoazepinequinoline (BAQ) derivatives as novel, potent, orally bioavailable respiratory syncytial virus fusion inhibitors[J]. J Med Chem, 2018, 61: 10228-10241. DOI:10.1021/acs.jmedchem.8b01394 |
| [23] |
Battles MB, Langedijk JP, Furmanova-Hollenstein P, et al. Molecular mechanism of respiratory syncytial virus fusion inhibitors[J]. Nat Chem Biol, 2016, 12: 87-93. DOI:10.1038/nchembio.1982 |
| [24] |
Zheng X, Gao L, Wang L, et al. Discovery of ziresovir as a potent, selective, and orally bioavailable respiratory syncytial virus fusion protein inhibitor[J]. J Med Chem, 2019, 62: 6003-6014. |
| [25] |
Samuel D, Xing W, Niedziela-Majka A, et al. GS-5806 inhibits pre- to postfusion conformational changes of the respiratory syncytial virus fusion protein[J]. Antimicrob Agents Chemother, 2015, 59: 7109-7112. DOI:10.1128/AAC.00761-15 |
| [26] |
Hanfelt-Goade D, Maimon N, Nimer A, et al. A Phase 2b, randomized, double-blind, placebo-controlled trial of presatovir (gs-5806), a novel oral RSV fusion inhibitor, for the treatment of respiratory syncytial virus (RSV) in hospitalized adults[J]. Am J Respir Crit Care Med, 2018, 197: A4457. |
| [27] |
Denoia E, Campaneria R, Wenzel E, et al. Safety and pharmacokinetic profile of BTA585, a novel fusion inhibitor of respiratory syncytial virus, in single and multiple-ascending dose healthy volunteer studies[J]. Open Forum Infect Di, 2016, 3: 652. DOI:10.1093/ofid/ofw172.515 |
| [28] |
Douglas JL, Panis ML, Ho E, et al. Inhibition of respiratory syncytial virus fusion by the small molecule VP-14637 via specific interactions with F protein[J]. J Virol, 2003, 77: 5054-5064. DOI:10.1128/JVI.77.9.5054-5064.2003 |
| [29] |
Kim YI, Pareek R, Murphy R, et al. The antiviral effects of RSV fusion inhibitor, MDT-637, on clinical isolates, vs its achievable concentrations in the human respiratory tract and comparison to ribavirin[J]. Influenza Other Respir Viruses, 2017, 11: 525-530. DOI:10.1111/irv.12503 |
| [30] |
Douglas JL, Panis ML, Ho E, et al. Small molecules VP-14637 and JNJ-2408068 inhibit respiratory syncytial virus fusion by similar mechanisms[J]. Antimicrob Agents Chemother, 2005, 49: 2460-2466. |
| [31] |
Brookes DW, Coates M, Allen H, et al. Late therapeutic intervention with a respiratory syncytial virus L-protein polymerase inhibitor, PC786, on respiratory syncytial virus infection in human airway epithelium[J]. Br J Pharmacol, 2018, 175: 2520-2534. DOI:10.1111/bph.14221 |
| [32] |
Wang G, Deval J, Hong J, et al. Discovery of 4'-chloromethyl-2'-deoxy-3', 5'-di-O-isobutyryl-2'-fluorocytidine (ALS-8176), a first-in-class RSV polymerase inhibitor for treatment of human respiratory syncytial virus infection[J]. J Med Chem, 2015, 58: 1862-1878. DOI:10.1021/jm5017279 |
| [33] |
De Vincenzo JP, McClure MW, Symons JA, et al. Activity of oral ALS-008176 in a respiratory syncytial virus challenge study[J]. N Engl J Med, 2015, 373: 2048-2058. |
| [34] |
Clarke MO, Mackman R, Byun D, et al. Discovery of β-D-2'-deoxy-2'-α-fluoro-4'-α-cyano-5-aza-7, 9-dideaza adenosine as a potent nucleoside inhibitor of respiratory syncytial virus with excellent selectivity over mitochondrial RNA and DNA polymerases[J]. Bioorg Med Chem Lett, 2015, 25: 2484-2487. DOI:10.1016/j.bmcl.2015.04.073 |
| [35] |
Siegel D, Hui HC, Doerffler E, et al. Discovery and synthesis of a phosphoramidate prodrug of a pyrrolo[2, 1-f] [triazin-4-amino] adenine C-nucleoside (GS-5734) for the treatment of Ebola and emerging viruses[J]. J Med Chem, 2017, 60: 1648-1661. DOI:10.1021/acs.jmedchem.6b01594 |
| [36] |
Sudo K, Miyazaki Y, Kojima N, et al. YM-53403, a unique anti-respiratory syncytial virus agent with a novel mechanism of action[J]. Antiviral Res, 2005, 65: 125-131. DOI:10.1016/j.antiviral.2004.12.002 |
| [37] |
Tiong-Yip CL, Aschenbrenner L, Johnson KD, et al. Characterization of a respiratory syncytial virus L protein inhibitor[J]. Antimicrob Agents Chemother, 2014, 58: 3867-3873. DOI:10.1128/AAC.02540-14 |
| [38] |
Xiong H, Foulk M, Aschenbrenner L, et al. Discovery of a potent respiratory syncytial virus RNA polymerase inhibitor[J]. Bioorg Med Chem Lett, 2013, 23: 6789-6793. DOI:10.1016/j.bmcl.2013.10.018 |
| [39] |
Noton SL, Nagendra K, Dunn EF, et al. Respiratory syncytial virus inhibitor AZ-27 differentially inhibits different polymerase activities at the promoter[J]. J Virol, 2015, 89: 7786-7798. DOI:10.1128/JVI.00530-15 |
| [40] |
Coates M, Brookes D, Kim YI, et al. Preclinical characterization of PC786, an inhaled small-molecule respiratory syncytial virus l protein polymerase inhibitor[J]. Antimicrob Agents Chemother, 2017, 61: e0073717. |
| [41] |
Fordyce EAF, Fraser Hunt S, Crepin D, et al. Conformationally restricted benzothienoazepine respiratory syncytial virus inhibitors: their synthesis, structural analysis and biological activities[J]. Med Chem Commun, 2018, 9: 583-589. |
| [42] |
Matharu DS, Flaherty DP, Simpson DS, et al. Optimization of potent and selective quinazolinediones: inhibitors of respiratory syncytial virus that block RNA-dependent RNA-polymerase complex activity[J]. J Med Chem, 2014, 57: 10314-10328. DOI:10.1021/jm500902x |
| [43] |
Jiménez-Somarribas A, Mao S, Yoon JJ, et al. Identification of non-nucleoside inhibitors of the respiratory syncytial virus polymerase complex[J]. J Med Chem, 2017, 60: 2305-2325. DOI:10.1021/acs.jmedchem.6b01568 |
| [44] |
Laganas VA, Dunn EF, McLaughlin RE, et al. Characterization of novel respiratory syncytial virus inhibitors identified by high throughput screen[J]. Antiviral Res, 2015, 115: 71-74. DOI:10.1016/j.antiviral.2014.12.012 |
| [45] |
Duvall JR, VerPlank L, Ludeke B, et al. Novel diversity-oriented synthesis-derived respiratory syncytial virus inhibitors identified via a high throughput replicon-based screen[J]. Antiviral Res, 2016, 131: 19-25. |
| [46] |
Challa S, Scott AD, Yuzhakov O, et al. Mechanism of action for respiratory syncytial virus inhibitor RSV604[J]. Antimicrob Agents Chemother, 2015, 59: 1080-1087. DOI:10.1128/AAC.04119-14 |
| [47] |
Chapman J, Abbott E, Alber DG, et al. RSV604, a novel inhibitor of respiratory syncytial virus replication[J]. Antimicrob Agents Chemother, 2007, 51: 3346-3353. DOI:10.1128/AAC.00211-07 |
| [48] |
Nicholson EG. A review of therapeutics in clinical development for respiratory syncytial virus and influenza in children[J]. Clin Ther, 2018, 40: 1268-1281. DOI:10.1016/j.clinthera.2018.06.014 |
| [49] |
DeVincenzo J, Cehelsky JE, Alvarez R, et al. Evaluation of the safety, tolerability and pharmacokinetics of ALN-RSV01, a novel RNAi antiviral therapeutic directed against respiratory syncytial virus (RSV)[J]. Antiviral Res, 2008, 77: 225-231. DOI:10.1016/j.antiviral.2007.11.009 |
| [50] |
Gottlieb J, Zamora MR, Hodges T, et al. ALN-RSV01 for prevention of bronchiolitis obliterans syndrome after respiratory syncytial virus infection in lung transplant recipients[J]. J Heart Lung Transplant, 2016, 35: 213-221. DOI:10.1016/j.healun.2015.08.012 |
| [51] |
Evans CW, Atkins C, Pathak A, et al. Benzimidazole analogs inhibit respiratory syncytial virus G protein function[J]. Antiviral Res, 2015, 121: 31-38. DOI:10.1016/j.antiviral.2015.06.016 |
| [52] |
Jorquera PA, Mathew C, Pickens J, et al. Verdinexor (KPT-335), a selective inhibitor of nuclear export, reduces respiratory syncytial virus replication[J]. J Virol, 2019, 93: e0168418. |
| [53] |
Yang Y, Cao L, Gao H, et al. Discovery, optimization, and target identification of novel potent broad-spectrum antiviral inhibitors[J]. J Med Chem, 2019, 62: 4056-4073. DOI:10.1021/acs.jmedchem.9b00091 |
| [54] |
McLellan JS, Chen M, Joyce MG, et al. Structure-based design of a fusion glycoprotein vaccine for respiratory syncytial virus[J]. Science, 2013, 342: 592-598. DOI:10.1126/science.1243283 |
| [55] |
Larios Mora A, Detalle L, Gallup JM, et al. Delivery of ALX-0171 by inhalation greatly reduces respiratory syncytial virus disease in newborn lambs[J]. MAbs, 2018, 10: 778-795. DOI:10.1080/19420862.2018.1470727 |
| [56] |
Lee Y, Ko EJ, Kim KH, et al. A unique combination adjuvant modulates immune responses preventing vaccine-enhanced pulmonary histopathology after a single dose vaccination with fusion protein and challenge with respiratory syncytial virus[J]. Virology, 2019, 534: 1-13. DOI:10.1016/j.virol.2019.05.010 |
| [57] |
Zu XY, Gao WN, Du Z, et al. Research progress with vaccines against respiratory syncytial virus[J]. Chin J Vac Immun (中国疫苗和免疫), 2018, 24: 237-242. |
| [58] |
Crank MC, Ruckwardt TJ, Chen M, et al. A proof of concept for structure-based vaccine design targeting RSV in humans[J]. Science, 2019, 365: 505-509. DOI:10.1126/science.aav9033 |
 2020, Vol. 55
2020, Vol. 55


