2. 江苏省中医药研究院, 国家中医药管理局中药释药系统重点研究室, 江苏 南京 210028
2. Key Laboratory of New Drug Delivery Systems of Chinese Materia Medica, Jiangsu Provincial Academy of Chinese Medicine, Nanjing 210028, China
灵芝(Ganoderma lucidum)又名芝草、瑞草, 是担子菌门伞菌纲多孔菌目灵芝科灵芝属真菌。灵芝在中国被称为“仙草”, 《神农本草经》记载“灵芝味甘温, 保神益精, 坚筋骨, 好颜色, 久服轻身不老延年”。现代研究表明, 灵芝中含有约400种不同的生物活性物质, 包括多糖类、三萜类、甾醇类、生物碱类、脂肪酸类、蛋白质/多肽类等[1]。其中多糖类已被确定为灵芝的主要生物活性成分之一[2]。目前已经从中分离解析出200多种多糖, 这些多糖中有一部分为单一葡萄糖组成的聚糖——β-葡聚糖(β-glucan), 而大多数为杂多糖, 由葡萄糖、甘露糖、半乳糖、木糖、岩藻糖和阿拉伯糖组成[3]。β-Glucan是公认的免疫应答调节剂, 被归类为病原体相关分子, 可被先天免疫细胞表面的模式识别受体(pattern recognition receptor, PRR)识别[4, 5]。已有数种源自真菌的β-glucan被开发成临床使用的处方药, 如香菇多糖注射液、猪苓多糖注射液, 以及酿酒酵母β-glucan制剂等, 文献[6]报道, 许多真菌来源的β-glucan能诱导宿主介导的抗肿瘤免疫应答。β-Glucan的不同制剂, 包括颗粒和可溶性β-glucan, 都能与重要的模式识别受体dectin-1结合, 但只有颗粒性β-glucan才能激活, 显示出更强的免疫刺激能力[7]。目前经国家食品药品监督管理局(SFDA)审批上市的灵芝制剂已经涵盖注射液、口服液、胶囊、分散片、滴丸和颗粒剂等多个剂型, 主要治疗神经官能症、多发性肌炎等, 其中灵芝多糖注射液和灵芝孢子胶囊更是用于减少化疗期间癌症患者的不良反应并改善其生活质量[1], 但是灵芝β-glucan及其肿瘤免疫调节的研究却鲜有报道。巨噬细胞在体内广泛分布, 在突变细胞的识别、结合与吞噬, 肿瘤相关抗原的递呈及特异性继发抗肿瘤免疫中扮演重要的角色[8]。因此, 本文利用响应面分析法对灵芝颗粒性β-glucan (Ganoderma lucidum particulate β-glucan, GLG)碱提条件进行优化, 并利用小鼠腹腔巨噬细胞模型和荷瘤小鼠模型, 初步评价GLG的免疫调节活性以及对肿瘤免疫的影响, 以期为灵芝及其多糖的临床抗肿瘤应用提供实验依据。
材料与方法材料与仪器 灵芝子实体购自安徽亳州(亳州市万珍中药饮片厂, 批号: 1712020), 经江苏省中医药研究院钱士辉鉴定为灵芝属多孔菌科植物赤芝(Ganoderma lucidum)的干燥子实体。GLG (由本实验室提取); 细胞因子白细胞介素(IL-6)和肿瘤坏死因子-α (TNF-α)的ELISA试剂盒、Golgiplug、抗小鼠mAb CD40-PE、CD86-FITC、CD80-PE、MHC-II-FITC、F4/80-PE及相关的同种型标记物(加拿大Biolegend公司); 奥沙利铂(oxaliplatin, OXA, 江苏恒瑞医药股份有限公司); 巯基乙酸盐、荧光素二氯三嗪(fluorescein dichlorotriazine, DTAF)、脂多糖(lipopolysaccharide, LPS)、佛波醇-12-肉豆蔻酸-13-乙酸酯(phorbol-12-nyristate-13-acetate, PMA)、离子霉素(ionomycin)、伴刀豆蛋白A (concanavalin A, Con A) (美国Sigma-Aldrich公司); 酵母和蘑菇β-葡聚糖检测试剂盒(爱尔兰Megazyme公司); 胎牛血清(fetal bovine serum, FBS)、2-巯基乙醇、RPMI1640培养基、DMEM培养基(美国Gibco Life Technologies公司); 细胞增殖-毒性检测试剂盒(Cell Counting Kit-8, CCK-8, 日本同仁化学研究所); 多黏菌素B (polymyxin B sulphate, PMB, 上海蓝木化工有限公司); 苯酚、浓硫酸和氢氧化钠等试剂(南京化学试剂有限公司)。
全自动酶标仪、Hera cell 150 CO2培养箱(美国Thermo公司); 5430R冷冻离心机(德国Eppendorf公司); Guava easyCyte流式细胞仪(德国Merck millipore公司); IX51Olympus显微镜(日本Olympus公司)。
动物与细胞株 BALB/c小鼠(雄性), 6~8周龄, 体重18~22 g, 由扬州大学比较医学中心提供, 许可证号: SCXK (苏) 2017-0007。C57BL/6小鼠(雄性), 6周龄, 体重18~20 g, 由斯贝福(北京)生物技术有限公司提供, 许可证号: SCXK (京) 2016-0002, 在江苏省中医药研究院实验中心饲养。CT26.WT小鼠结肠癌细胞购自中国科学院细胞库。动物实验获得江苏省中医药研究院伦理委员会的批准。
GLG的提取 参照Wang等[9]的提取方法并稍加修改, 将灵芝药材干燥粉碎, 过80目筛, 取药材粉末1 000 g, 分别用10倍和8倍体积的95%乙醇于80 ℃下脱脂处理两次, 每次2 h, 药材干燥后加入10倍体积蒸馏水加热提取两次, 每次提取2 h; 药材残渣干燥后精密称取10 g, 加入1 mol·L-1 NaOH溶液200 mL, 充分搅拌, 水浴加热提取2次, 过滤并合并滤液; 以乙酸溶液中和滤液, 静置过夜后离心收集沉淀, 洗涤并溶解于1 mol·L-1 NaOH溶液,重复此操作3次; 收集沉淀并洗涤数次后溶解于1 mol·L-1 NaOH, 经离心、透析和冷冻干燥等步骤得到粉末状GLG试样。
GLG的单因素实验 以GLG提取得率为指标, 分别考察不同的提取温度、提取时间和液料比对提取率的影响并进行单因素实验。设定提取温度65 ℃, 料液比1:15, 提取时间分别为4、6、8、10和12 h; 设定提取温度65 ℃, 提取时间8 h, 料液比分别为1:10、1:15、1:20、1:25、1:30;设定提取时间8 h, 料液比1:15, 温度分别为25、35、45、55、65和75 ℃。每组实验重复3次, 取平均值考察各因素对GLG提取得率的影响。
响应面优化设计 综合单因素实验结果, 根据Box-Behnken中心组合实验设计原理, 以GLG提取得率为响应值(因变量), 提取温度、提取时间和液料比为自变量, 应用Design Expert 8.0.6.1软件处理数据并进行结果分析, 拟合出GLG碱提法的最优提取条件。
总多糖含量测定 采用苯酚-硫酸法测定总多糖含量。精密称取干燥恒重的葡萄糖对照品10 mg, 置于100 mL量瓶中, 用蒸馏水定容至刻度, 配成0.1 mg·mL-1标准品溶液, 分别取上述标准葡萄糖溶液0、0.2、0.4、0.6、0.8、1.0和1.2 mL, 加蒸馏水补足至2.0 mL并摇匀。然后依次加入5%苯酚溶液1.0 mL, 充分混匀后迅速加入浓硫酸5 mL, 置沸水浴中约10 min, 取出冷却至室温。490 nm下测定吸光度值, 得到线性回归方程: y = 8.406 x - 0.008 7(R2 = 0.990 4, n = 3), 其中y为吸光度值, x为葡萄糖质量浓度。按式(1)计算提取GLG总多糖得率:
| $ Y = (A \times B)/C \times 100\% $ | (1) |
其中, Y为多糖得率, A为由回归方程求得的总多糖浓度(mg·mL-1), B为总多糖溶液体积(mL), C为灵芝药材干品质量(g)。
β-1, 3-glucan 检测方法及含量测定精密称取GLG提取试样10 mg, 按照需要配成合适的浓度, 采用β-glucan酶法测定所得的试样中β-1, 3-glucan的含量(实验方法参照测试剂盒说明书)。
GLG样品的前处理 称取GLG样品适量并重悬于0.2 mol·L-1 NaOH溶液, 温室静置20 min, 用灭菌磷酸盐缓冲液(PBS)洗涤3次, 最后重悬于并定容至无LPS的去离子水中, 调节质量浓度至10 mg·mL-1, 经南京迪安医学检验所检测细菌内毒素水平为0.09 EU·mL-1。
腹腔静息巨噬细胞的分离与给药 颈椎脱臼处死雄性C57BL/6小鼠, 75%乙醇消毒, 腹腔注射4 mL DMEM完全培养基, 轻轻按摩腹部后收集腹腔液体, 离心、洗涤后, 制成1×106个/mL的细胞悬液备用; 设置空白对照组、LPS组、GLG组和GLG+PMB组, 按每孔500 μL接种于48孔板中, 37 ℃、5% CO2培养箱中孵育, 贴壁2 h后, 轻柔震荡培养板, 洗涤细胞, 吸尽上清液, 各加入500 μL新鲜培养基, 按不同组别给药, 并于37 ℃、5% CO2培养箱中培养24 h。
GLG对体外腹腔静息巨噬细胞毒性的影响 各取上述巨噬细胞200 μL接种于96孔板, 加入不同浓度的GLG, 使终质量浓度分别为0、15.63、31.25、62.5、125、250、500和1 000 μg·mL-1, 每组6复孔, 置37 ℃、5% CO2培养箱中培养24 h, 每孔各加入CCK-8溶液10 μL, 在培养箱中孵育2 h, 用酶标仪在450 nm处测定吸光度值。
ELISA法测定腹腔静息巨噬细胞IL-6、TNF-α的分泌 取巨噬细胞培养上清液, 以测定细胞因子IL-6、TNF-α的水平。严格按试剂盒说明书进行实验操作, 利用酶标仪检测各实验组细胞因子的吸光度值, 根据标准曲线计算求得其浓度。
GLG对腹腔静息巨噬细胞成熟的影响 收集培养的巨噬细胞, 离心、洗涤, 制备细胞悬液; 用Fc-blocking单克隆抗体阻断细胞15 min后, 用F4/80-APC、CD40-PE、CD86-FITC、CD80-PE和MHC-II-FITC单克隆抗体在冰上染色20 min, 通过流式细胞仪检测分析, 巨噬细胞通过F4/80表达来鉴定。
GLG对腹腔静息巨噬细胞吞噬中性红的影响取上述腹腔静息巨噬细胞100 μL接种于96孔板, 加入不同浓度的GLG, 使终质量浓度分别为0、31.25、62.5、125、250、500和1 000 μg·mL-1, 同时设置5 μg·mL-1 LPS对照组, 每组6复孔, 置37 ℃、5% CO2培养箱中培养24 h, 用PBS洗涤2次, 再加入0.05%中性红溶液100 μL, 20 min后用PBS洗2次, 加入100 μL细胞裂解液(50%酒精、49%水、1%乙酸)释放中性红, 用酶标仪在540 nm处检测吸光度值。
DTAF标记GLG 将GLG 50 mg加至2.5 mL硼酸盐缓冲液(pH 10.8)中制成悬浮液, 再加入2 mg·mL-1 DTAF溶液5 mL, 在室温下搅拌过夜; 3 000 r·min-1离心5 min, 弃去上清后沉淀用PBS洗涤, 以除去未共价结合的DTAF; 按相同方法处理去除LPS后, 得到DTAF标记GLG (GLG-DTAF), 质量浓度调节至4 mg·mL-1, 室温下避光保存备用。
3%巯基乙酸盐肉汤诱导的巨噬细胞对GLG-DTAF的结合与吞噬作用 取雄性C57BL/6小鼠, 腹腔注射3%巯基乙酸盐1 mL, 4天后收集腹腔细胞, 将分离的细胞在冰冷的PBS中洗涤两次, 细胞重悬于DMEM培养基中, 接种在24孔板上过夜, 实验前用PBS洗涤3次。对于吞噬实验的测定, 取5×105个巨噬细胞与GLG-DTAF (20 μg·mL-1)在37 ℃下混合1 h, 然后用冰冷的PBS洗涤, F4/80鉴定巨噬细胞, 通过流式细胞术测定细胞吞噬GLG-DTAF的百分比; 对于结合作用的测定, 将5×105个巨噬细胞与GLG-DTAF (20 μg·mL-1)在冰上混合30 min, F4/80鉴定巨噬细胞, 通过流式细胞术确定细胞结合GLG-DTAF的百分比。
GLG对体外脾细胞增殖的影响 颈椎脱臼处死C57BL/6小鼠, 在无菌环境下摘取脾脏, 充分研磨, 经70 μm孔径筛网过滤, 1 600 r·min-1离心5 min, 弃上清; 加入红细胞裂解液1 mL, 充分混匀, 静置30 s后迅速加入RPMI 1640完全培养基5 mL, 混匀后离心, 用PBS缓冲液重复洗涤2次, 调整细胞数5×106个/mL, 每孔100 μL接种于96孔板中。
设置LPS组、Con A组与GLG不同浓度给药组。LPS组加入终质量浓度为5 μg·mL-1的LPS诱导B细胞; Con A组加入终质量浓度为1 μg·mL-1的Con A诱导T细胞; GLG不同浓度给药组分别加入终质量浓度为25、50、100、200和400 μg·mL-1的GLG考察其对脾细胞增殖的影响。每组设置6复孔, 毎孔终体积为200 μL, 放入5% CO2、37 ℃培养箱中培养24 h。然后, 每孔加入CCK-8 10 μL, 在培养箱中孵育2 h, 采用酶标仪在450 nm处检测吸光度值。
小鼠CT26肿瘤模型的建立 取健康BALB/c小鼠, 于左前肢腋下皮下注射CT-26肿瘤细胞5×105个。24 h后随机分组, 分别为空白组、模型组、奥沙利铂阳性对照组和GLG不同剂量组(200、400和800 μg·d-1)。在可触知的肿瘤形成后开始灌胃给药, 连续给药3周, 每隔3天用卡尺测量肿瘤直径, 当肿瘤直径达到15 mm时颈椎脱臼处死小鼠。完整剥离瘤块, 称量瘤体湿重, 按下列公式计算各指标[10]:
| $ V = \left( {L \times {W^2}} \right)/2 $ | (2) |
其中, V为肿瘤体积, L和W分别为肿瘤的长和宽(mm)。
| $ {\rm{ IR }}(\% ) = \left( {{M_{\rm{M}}} - {M_{\rm{E}}}} \right)/{M_{\rm{M}}} \times 100\% $ | (3) |
其中, IR为肿瘤抑制率(%), MM和ME分别为模型组肿瘤平均质量和各实验组肿瘤平均质量(g)。
| $ {\rm{TI}} = T/{W_{\rm{m}}}, {\rm{SI}} = |S/{W_{\rm{m}}} $ | (4) |
其中, TI和SI分别为胸腺指数和脾脏指数, T和S分别为胸腺质量和脾脏质量(mg), Wm为小鼠质量(g)。
免疫组织化学检测CT26肿瘤小鼠中Ki67蛋白的表达 剥离小鼠肿瘤组织并制成石蜡病理切片, 经过烘烤、脱蜡水化、抗原修复等步骤进行免疫组化染色, 再利用光学显微镜和Image pro plus软件进行拍照和结果分析[11]。
流式细胞仪检测CT26肿瘤小鼠脾脏中Th1细胞的分布 取模型组、OXA组、GLG高剂量组小鼠脾脏并通过70 μm尼龙滤网制成单细胞悬液, 取24孔板, 每孔加入细胞悬液200 μL, 在Golgiplug存在条件下, 加入25 ng·mL-1 PMA和1 μg·mL-1离子霉素(ionomycin)培养4 h, 用抗CD4+、CD8+单克隆抗体表面染色, 细胞经过固定后加入抗INF-γ抗体染色, 通过流式细胞仪检测脾脏细胞中Th1细胞的分布。
统计学方法 对于响应面模型的显著性统计和回归方程式, 采用Design Expert 8.0.6.1软件进行分析; 对于免疫相关数据, 采用SPSS19.0软件进行分析, 通过单因素方差One-way ANOVA分析比较多组间的值以确定统计学上显著性差异, 数据表示为x ± s。P < 0.05被认为具有统计学意义。
结果 1 GLG提取条件优化 1.1 GLG提取工艺的单因素考察为了探究提取时间、温度、料液比对GLG提取得率的影响, 选用苯酚硫酸法和β-glucan酶法试剂盒检测法对单因素实验进行了考察分析。结果显示, β-glucan提取得率随着提取时间的增加呈上升趋势, 这可能由于碱液与药材接触时间较短提取不充分, 但在10 h后上升水平趋于平稳, 考虑提取得率和时间成本, 故选择提取时间为10 h左右; 在料液比1:10至1:20内, β-glucan提取得率明显上升, 这可能与药材粉末吸水量大有关, 而1:20后得率趋于平稳上升趋势, 根据提取得率和实验操作的实际情况选择料液比1:20左右; β-glucan提取得率在55 ℃前呈逐渐升高趋势, 但之后则较大幅度下降, 可能是温度过高对糖类成分有所破坏造成, 所以选择提取温度在55 ℃左右。
1.2 响应面优化实验 1.2.1 Box-Behnken实验模型及分析在单因素实验结果分析的基础上, 选取提取时间、提取温度和料液比为自变量, 以GLG提取率为因变量, 利用响应面法进行三因素三水平试验设计, 结果见表 1。根据Box-Behnken模型共设计实验17组, 每组重复3次, 结果取平均值。实验结果表明, 在提取时间12 h、提取温度45 ℃及料液比1:15时, 提取得率最低, 为4.37%, 在提取时间10 h、提取温度45 ℃及料液比1:20时, 提取得率最高, 为11.00%。
| 表 1 Factors and levels for response surface methodology design |
响应面曲面可比较直观地反映出各因素交互作用对响应值的影响。GLG提取的等高线图与响应面3D图谱见图 1。圆形表示两因素之间的交互作用不显著, 椭圆表示两因素之间的交互作用显著; 交互作用图的纵切面呈开口向下的抛物线, 说明提取温度、时间与料液比在实验数据误差范围内, 对GLG的提取得率的影响显著; 提取温度对GLG的提取得率的影响最大, 而提取时间对提取得率的影响也较为明显, 但料液比变化对GLG提取得率的影响则最小。

|
Figure 1 Response surface and contour plots showing the influence of operating parameters on the extraction efficiency of Ganoderma lucidum particulate β-glucan (GLG) |
使用响应面模型参数评价实验结果, 利用软件分析各变量对GLG得率的影响效果, 并进行多项式回归拟合, 建立提取时间、提取温度和料液比三个因素的二次多项回归方程为: Y = 9.94 - 0.71 XA + 2.05 XB + 0.065 XC + 0.16 XAB + 0.72 XAC + 0.000 XBC - 1.60 XA2 - 1.37 XB2 - 2.00 XC2, 回归方程的方差分析表明模型的F值为14.72 (P < 0.001), 失拟项0.629 1 > 0.05, 差异不显著, 表明该二次多项回归方程选用适当, 该模型总决定系数R2 = 0.949 8, 校正决定系数R2adj = 0.885 3, 说明实验结果与理论预测值相关性较高, 以上各参数表明实验结果具有显著性差异, 模型成立, 可用于GLG优化提取条件的预测和分析。
1.2.3 Box-Behnken法组合优化条件的验证实验运用Design Expert 8.0.6.1软件预测GLG提取的理论最佳条件:温度55 ℃、时间8 h和料液比1:20。此条件下重复3次实验, 所得多糖得率的平均值为8.57%, 在此条件下由回归方程所得的GLG提取得率的理论值8.46%, 相对误差1.25%。该模型拟合度高, 所得到的提取条件参数可靠, 为GLG的提取提供了参考。
2 GLG免疫调节活性研究 2.1 GLG促进小鼠腹腔静息巨噬细胞的活化及对细胞因子谱的极化作用为了研究GLG在巨噬细胞中细胞毒性作用, 选用不同浓度的GLG进行CCK-8测定, 发现GLG在实验浓度范围内对巨噬细胞无细胞毒性作用, 且能够促进巨噬细胞的活力增长(图 2A)。巨噬细胞被PRR或细胞因子活化后, 能够表达大量的MHC分子和共刺激因子, 发挥抗原递呈的功能, 而且不同的免疫刺激物能够诱导巨噬细胞产生不同的活化状态[11]。为了评估GLG对巨噬细胞激活的影响, 采用流式细胞术分析巨噬细胞活化相关表面标志物的表达, 发现GLG可上调巨噬细胞表面共刺激因子CD40、CD80、CD86及主要组织相容性抗原Ⅱ (MHC Ⅱ)的表达水平(图 2B), 这对于抗原呈递具有关键作用。TNF-α、IL-6主要是由活化的淋巴细胞、巨噬细胞等免疫细胞表达的炎性细胞因子, 可以通过激活免疫反应而发挥重要的抗肿瘤效果[12]。GLG刺激后可显著上调巨噬细胞分泌TNF-α、IL-6的水平(图 2C), 说明GLG有助于巨噬细胞分泌免疫细胞因子。
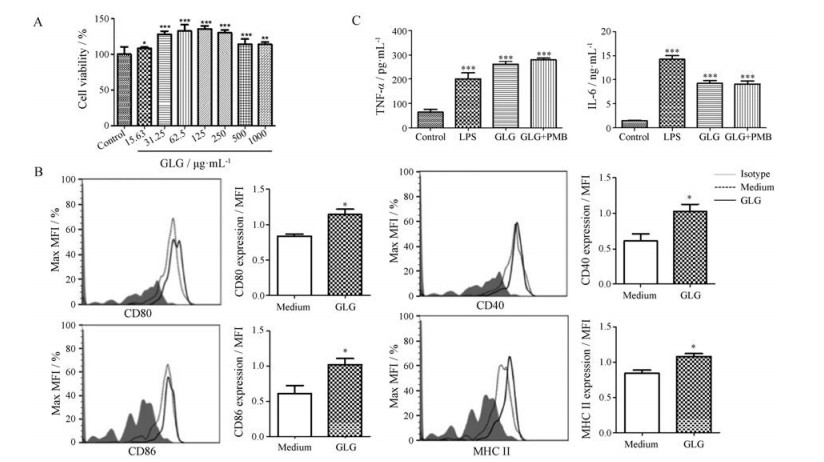
|
Figure 2 Surface marker expression and cytokines secretion by murine resident peritoneal macrophages stimulated with GLG (100 μg·mL-1). A: Toxic effects of different concentrations of GLG on macrophages. n = 6. x ± s. *P < 0.05, **P < 0.01, ***P < 0.001 vs control group; B: Murine resident peritoneal macrophages from C57BL/6 mice were collected and stimulated with GLG for 12 hours. The cells were harvested and stained with indicated mAbs F4/80-APC, CD40-PE, CD86-FITC, CD80-PE, MHC-II-FITC or isotype controls. Unstimulated macrophages were used as controls. Co-stimulatory molecules (CD40, CD86 and CD80) and major histocompatibility antigen (MHC II) of resident peritoneal macrophages stimulated with GLG were increased compared with medium group. The histograms are one representative of three independent experiments with similar results and represent median fluorescent intensity (MFI). Cells were gated on F4/80 cells. n = 3. x ± s. *P < 0.05 vs medium group; C: Supernatants of GLG stimulated macrophages were collected and detected for cytokines using ELISA kit. The levels of IL-6 and TNF-α were obviously increased compared with control group. LPS: Lipopolysaccharide. n = 3, x ± s. ***P < 0.001 vs control group |
抗原递呈细胞是固有免疫与适应性免疫的桥梁, 能识别和吞噬突变的肿瘤细胞, 并将肿瘤相关抗原(tumor associated antigen, TAA)递呈, 触发持久与强烈的TAA特异性抗肿瘤T细胞免疫应答[13]。巨噬细胞是机体中分布最广泛的抗原递呈细胞, 其活化最显著的特征之一是吞噬活性的增强。作者考察了GLG对腹腔静息巨噬细胞吞噬中性红能力的影响, 结果发现, 与对照组相比, GLG能显著促进巨噬细胞对中性红的吞噬, 并呈浓度依赖性(图 3A); 进一步采用荧光染料DTAF标记GLG (GLG-DTAF), 流式细胞术分析考察GLG对3%巯基乙酸盐肉汤诱导巨噬细胞结合与吞噬GLG-DTAF能力的促进作用, 结果发现, GLG可介导巨噬细胞的吞噬作用(图 3B); GLG具有结合巨噬细胞的活性(图 3C)。
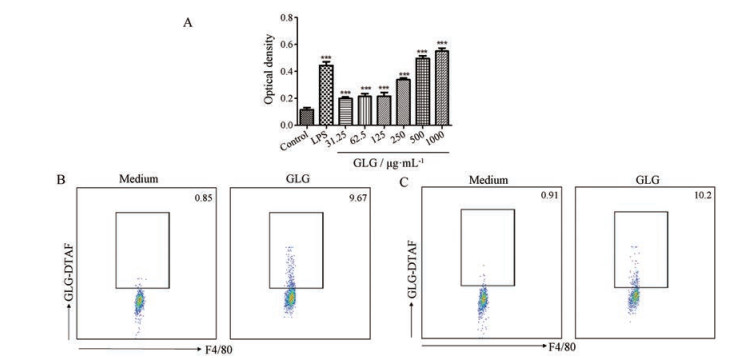
|
Figure 3 Effect of GLG on phagocytosis and binding function of macrophages. A: Effects of different concentrations of GLG on the phagocytosis of neutral red by macrophages. n = 6, x ± s. ***P < 0.001 vs control group; B: GLG phagocytosis on the macrophages. Macrophages were incubated with DTAF-GLG at 37 ℃ and phagocytosis of GLG was assessed by flow cytometry; C: GLG binding on the macrophages. Macrophages were incubated with DTAF-GLG on ice and binding of GLG was assessed by flow cytometry. Percent of GLG positive cells were summarized. Cells were gated on F4/80 cells. The dot plot are one representative of three independent experiments with similar results |
细胞免疫反应和体液免疫反应的激活与淋巴细胞的增殖密切相关[14], 因此, 以LPS和Con A为阳性对照检测了不同浓度的GLG对小鼠脾淋巴细胞增殖的影响。GLG对脾淋巴细胞的增殖具有浓度依赖性地促进作用, 说明GLG能够改善脾脏的免疫功能(图 4)。

|
Figure 4 Effects of different concentrations GLG (25, 50, 100, 200, 400 μg·mL-1) on spleen lymphocyte proliferation. Con A: Concanavalin A. n = 6, x ± s. ***P < 0.001 vs control group |
与模型组相比, 400和800 μg·d-1 GLG给药组小鼠的肿瘤负荷均显著降低(图 5A~E), 抑瘤率分别为36.74%和56.16%;与阳性药OXA组相比, GLG给药各组小鼠体重均无显著下降趋势(图 5F)。结果提示, GLG能显著抗结肠癌, 并具有较好的安全性。

|
Figure 5 GLG treatment significantly reduces tumor burden. A: Tumor outlook of different groups; B: Tumor diameters change curve from the tumor-bearing mice; C: Tumor volume change curve from the tumor-bearing mice; D: Tumor tissues weight from the tumor-bearing mice; E: Tumor inhibition rate of GLG or OXA in the tumor-bearing mice; F: Body weight change curve of the tumor-bearing mice. OXA: Oxaliplatin. n = 6, x ± s. *P < 0.05, **P < 0.01, ***P < 0.001 vs model group |
随着肿瘤的进展, 宿主的免疫系统受到影响, 化疗药物的使用会进一步损伤免疫器官, 而免疫增强剂则对免疫器官具有保护作用, 可以增强宿主免疫应答。在肿瘤发展早期, 脾脏具有正向免疫调节作用; 在肿瘤晚期, 随着肿瘤微环境的变化, 脾脏却抑制机体的免疫功能而发挥负向免疫调节作用, 出现脾脏肿大等症状。作者考察了GLG对荷瘤小鼠脾脏与胸腺的影响, 结果表明, OXA对免疫器官具有明显的抑制作用; GLG对免疫器官几乎无抑制作用, 且可以减轻肿瘤小鼠的脾脏肿大症状, 逆转肿瘤微环境对免疫细胞的调控作用(图 6)。
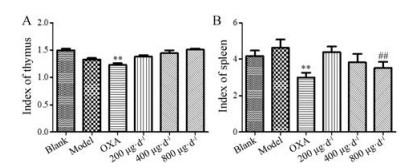
|
Figure 6 The influence of GLG on spleen and thymus in CT26 tumor-bearing mice. A: Thymus index of the mice; B: Spleen index of the mice. n = 6, x ± s. **P < 0.01 vs blank group; ##P < 0.01 vs model group |
Ki67能够反映癌细胞数量和活跃程度。与模型组相比, 400和800 μg·d-1 GLG组荷瘤小鼠肿瘤组织Ki67的表达均显著降低(图 7), 显示GLG在体内对肿瘤细胞具有一定程度的抑制效果。
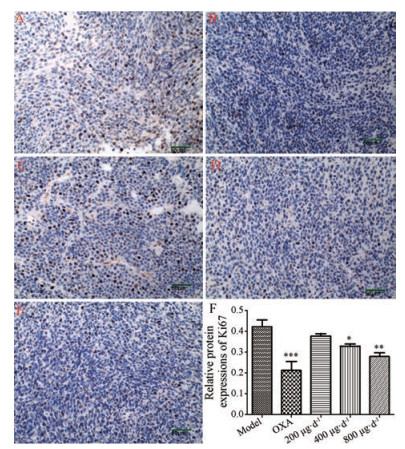
|
Figure 7 Protein expressions of Ki67 in different groups of mice. Magnification × 200. Inhibiting effects on Ki67 of model group (A), OXA group (B), 200 μg·d-1 GLG group (C), 400 μg·d-1 GLG group (D) and 800 μg·d-1 group (E). F: Relative protein expression of Ki67 of different groups. n = 6, x±s. *P < 0.05, **P < 0.01, ***P < 0.001 vs model group |
作为机体最大的免疫器官, 脾脏占有全身循环T淋巴细胞的25%, 直接参与细胞免疫, 并可调节T细胞亚群的分布, 是肿瘤免疫中重要的环节。T细胞经诱导可分化为不同的亚群, 如CD4+ T细胞、CD8+ T细胞, 其中CD8+ T细胞具有消灭受感染细胞的功能, CD4+ T细胞具有增强宿主对病原体的免疫性和防御功能[15]。作者发现GLG给药后CT-26荷瘤小鼠脾脏中产生IFN-γ的CD4+ T (Th1)细胞与产生IFN-γ的CD8+ T (CTL)细胞的比例显著高于模型组(图 8), 表明GLG能促进具有杀伤肿瘤细胞作用的Th1和CTL的增殖与分化, 从而增强机体抗肿瘤免疫。
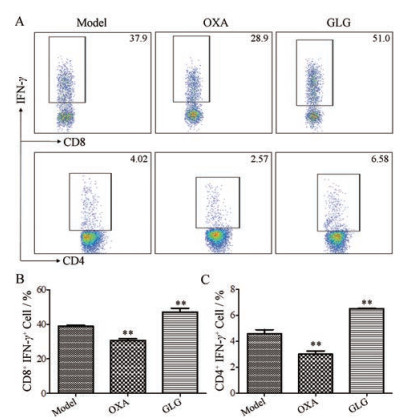
|
Figure 8 GLG (800 μg·d-1) treatment in vivo reduces tumor burden and impacts the frequency of T cell in spleens of CT26 tumor-bearing mice. A: Flow cytometry analysis of the frequencies of T cell in the spleens of CT26 tumor-bearing mice treated with phosphate buffer saline (PBS), OXA or GLG; B: Percent of CD8+ IFN-γ+ cells; C: Percent of CD4+ IFN-γ+ cells. The dot plot are one representative of three independent experiments with similar results. n = 3, x±s. **P < 0.01 vs model group |
近年来, 免疫治疗已成为继手术、放疗和化疗之后最有前景的癌症治疗策略, 被称为肿瘤治疗的“第三次革命”[16]。有效的肿瘤免疫疗法需要引发抗肿瘤T细胞应答, 利用适当的免疫增强剂可以定性和定量的增强T细胞应答[17]。相关研究表明, 颗粒性β-glucan可作为有效的免疫增强剂, 刺激先天性和适应性免疫应答, 增强抗肿瘤T细胞活性和肿瘤微环境对Th1应答的改变, 其抗肿瘤活性与增强宿主免疫应答密切相关[18]。灵芝子实体中富含β-glucan, 因此本文研究了灵芝颗粒性β-glucan的提取及其抗肿瘤免疫调节作用。
目前, 常采用酸、碱、酶法或与有机溶剂相结合的方法提取β-glucan[19]。酸浸提法粗多糖得率高, 但含大量其他多糖及蛋白质, 需要后续纯化, 工艺复杂, 且酸法腐蚀性太大, 安全性低[20]; 酶法生产成本高且较难批量连续生产; 碱法浸提相比于上述提取方法简单, 具有成本低、易除去变性蛋白质[21]等优势, 是从蘑菇等大型真菌中有效提取高纯度β-glucan的理想途径[22], 综上考虑, 本文采用碱浸提GLG。参考Sone[23]的方法得到GLG的提取得率为6.23%。在此基础上利用Box-Benhnken中心组合试验设计原理和响应面分析法优选提取条件为提取温度55 ℃、料液比1:20、提取时间8 h, GLG提取得率为8.57%, 较原有方法提高了37.56%。利用苯酚-硫酸比色法[24]测定得到的GLG几乎为纯的葡聚糖, 这与Sone等[23]、Wang等[25]和Chen等[26]的实验结果一致。进一步对不同提取条件获得GLG对巨噬细胞活化能力进行筛选, 发现35 ℃、45 ℃、55 ℃和65 ℃提取的GLG均能显著促进腹腔静息巨噬细胞分泌IL-6和TNF-α, 且不同GLG之间无显著性差异, 提示它们均具有很好的免疫调节能力, 因此采用得率最高的55 ℃时提取的GLG进行后续实验。对比苯酚硫酸法和酶法试剂盒法对β-glucan测定的结果, 苯酚硫酸法测定的是总多糖含量, 而酶法试剂盒法排除了其他多糖对测定结果的干扰, 对β-glucan的测定具有更强的专一性, 因此后续实验采用酶法试剂盒法进行检测[27]。
巨噬细胞在先天性免疫系统[28]和适应性免疫系统[29]中均发挥重要作用。作为肿瘤组织内主要的吞噬细胞, 巨噬细胞可将抗原从抗原递呈细胞转移、清除凋亡细胞和碎片并抑制巨噬细胞自身对凋亡细胞吞噬作用的激活, 从而诱导抗肿瘤免疫[30]。相关研究表明, 经口服给药后, 颗粒β-glucan可以被巨噬细胞吸收并被转运到脾脏、淋巴组织和骨髓中, 并被骨髓中的巨噬细胞处理释放出小分子可溶性活性β-glucan, 进一步通过刺激中性粒细胞补体受体3 (complement receptor 3, CR3), 引发iC3b介导的的肿瘤细胞CR3依赖性细胞毒性, 这与β-glucan在癌症治疗中的作用机制密切相关[31]。因此, 作者考察了与巨噬细胞活化相关的表面共刺激因子CD40、CD80、CD86和MHC Ⅱ的表达变化, 以及促炎细胞因子TNF-α、IL-6的分泌, 证实了GLG对巨噬细胞活化的促进作用及对宿主免疫系统功能的活化作用。PRR存在于固有免疫细胞表面, 是能够识别结合宿主凋亡细胞或病原微生物表面特定分子结构的受体, 具有启动细胞活化、活化补体、吞噬和诱导凋亡等多种生物学功能。吞噬活性的增强也是巨噬细胞活化最显著的特征之一, 活化的巨噬细胞可以与抗原结合, 通过释放溶解酶直接杀灭抗原, 也可以通过巨噬细胞表面PRR介导的作用将抗原吞噬摄取[32]。因此, 考察了GLG对腹腔静息巨噬细胞吞噬作用的影响, 发现GLG能以浓度依赖性的方式显著促进巨噬细胞对中性红的吞噬; 进一步用巯基乙酸盐肉汤激活巨噬细胞, 并用荧光染料标记GLG, 观察到GLG还能促进巨噬细胞对GLG-DTAF的结合与吞噬, 提示GLG不仅能提高巨噬细胞的吞噬能力, 还能促进巨噬细胞吞噬GLG自身, 提示GLG可能在巨噬细胞内进一步裂解为分子量较低的葡聚糖, 持续地发挥免疫刺激作用[33, 34]。
脾脏是成熟淋巴细胞等免疫细胞定居的场所, 也是产生免疫应答的部位。肿瘤特异性效应T细胞可以通过淋巴回流从免疫器官转向外周血, 经过一系列的步骤完成肿瘤消除[35]。在实验中观察到不同浓度的GLG能促进小鼠脾淋巴细胞的增殖; 更重要的是, 发现了口服灵芝颗粒性β-glucan能够显著提高脾脏中细胞毒性T淋巴细胞(cytotoxic T lymphocytes, CTL; CD8+ IFN-γ+ T cell, Teff)及辅助性T细胞1 (Th1; CD4+ IFN-γ+ T cell)的分布, 而CTL与Th1是肿瘤免疫应答中杀伤肿瘤的最关键的细胞[17]。
本文采用碱提法作为提取方式, 利用响应面优化法来提高灵芝颗粒性β-glucan的提取得率, 并对其肿瘤免疫调节活性进行了初步评价, 为灵芝及其多糖的临床抗肿瘤应用提供研究思路, 具有重要的医学价值和实际意义。
| [1] |
Zeng P, Guo Z, Zeng X, et al. Chemical, biochemical, preclinical and clinical studies of Ganoderma lucidum polysaccharide as an approved drug for treating myopathy and other diseases in China[J]. J Cell Mol Med, 2018, 22: 3278-3297. DOI:10.1111/jcmm.13613 |
| [2] |
Zhang X, Shao J, Ma D, et al. Research on antitumor active components and mechanisms of natural products[J]. Acta Pharm Sin (药学学报), 2019, 54: 1-19. |
| [3] |
Xu Z, Chen X, Zhong Z, et al. Ganoderma lucidum polysaccharides: immunomodulation and potential anti-tumor activities[J]. Am J Chin Med, 2011, 39: 15-27. DOI:10.1142/S0192415X11008610 |
| [4] |
Batbayar S, Lee D, Kim H. Immunomodulation of fungal β-glucan in host defense signaling by dectin-1[J]. Biomol Therapeut, 2012, 20: 433-445. DOI:10.4062/biomolther.2012.20.5.433 |
| [5] |
Reid DM, Gow NA, Brown GD. Pattern recognition: recent insights from Dectin-1[J]. Curr Opin Immunol, 2009, 21: 30-37. DOI:10.1016/j.coi.2009.01.003 |
| [6] |
Jiang Y, He A, Liu Y, et al. Development of Lingzhi or Reishi medicinal mushroom, Ganoderma lucidum (higher basidiomycetes) polysaccharides injection formulation[J]. Int J Med Mushrooms, 2014, 16: 411-419. DOI:10.1615/IntJMedMushrooms.v16.i5.10 |
| [7] |
Qi C, Cai Y, Gunn L, et al. Differential pathways regulating innate and adaptive antitumor immune responses by particulate and soluble yeast-derived beta-glucans[J]. Blood, 2011, 117: 6825-6836. DOI:10.1182/blood-2011-02-339812 |
| [8] |
Lin Y, Zhao JL, Zheng QJ, et al. Notch signaling modulates macrophage polarization and phagocytosis through direct suppression of signal regulatory protein alpha expression[J]. Front Immunol, 2018, 9: 1744. DOI:10.3389/fimmu.2018.01744 |
| [9] |
Wang J, Zhang L, Yu Y, et al. Enhancement of antitumor activities in sulfated and carboxymethylated polysaccharides of Ganoderma lucidum[J]. J Agric Food Chem, 2009, 57: 10565-10572. DOI:10.1021/jf902597w |
| [10] |
Wang C, Su J, Cai J, et al. Response surface analysis for the optimization of extraction condition for polysaccharides from Epimedium polysaccharides and studies on its tumor immune activities[J]. Acta Pharm Sin (药学学报), 2016, 51: 1464-1471. |
| [11] |
Wang C, Feng L, Su J, et al. Polysaccharides from Epimedium koreanum Nakai with immunomodulatory activity and inhibitory effect on tumor growth in LLC-bearing mice[J]. J Ethnopharmacol, 2017, 207: 8-18. DOI:10.1016/j.jep.2017.06.014 |
| [12] |
Ataie-Kachoie P, Morris DL, Pourgholami MH. Minocycline suppresses interleukine-6, its receptor system and signaling pathways and impairs migration, invasion and adhesion capacity of ovarian cancer cells: in vitro and in vivo studies[J]. PLoS One, 2013, 8: e60817. DOI:10.1371/journal.pone.0060817 |
| [13] |
Li B, Cai Y, Qi C, et al. Orally administered particulate β-glucan modulates tumor-capturing dendritic cells and improves antitumor T-cell responses in cancer[J]. Clin Cancer Res, 2010, 16: 5153-5164. DOI:10.1158/1078-0432.CCR-10-0820 |
| [14] |
Li H, Sun M, Xu J, et al. Immunological response in H22 transplanted mice undergoing Aconitum coreanum polysaccharide treatment[J]. Int J Biol Macromol, 2013, 55: 295-300. DOI:10.1016/j.ijbiomac.2013.01.011 |
| [15] |
Melssen M, Slingluff CL. Vaccines targeting helper T cells for cancer immunotherapy[J]. Curr Opin Immunol, 2017, 47: 85-92. DOI:10.1016/j.coi.2017.07.004 |
| [16] |
Falzone L, Salomone S, Libra M. Evolution of cancer pharmacological treatments at the turn of the third millennium[J]. Front Pharmacol, 2018, 9: 1300. DOI:10.3389/fphar.2018.01300 |
| [17] |
Berner VK, duPre SA, Redelman D, et al. Microparticulate β-glucan vaccine conjugates phagocytized by dendritic cells activate both naïve CD4 and CD8 T cells in vitro[J]. Cell Immunol, 2015, 298: 104-114. DOI:10.1016/j.cellimm.2015.10.007 |
| [18] |
Devaud C, John LB, Westwood JA, et al. Immune modulation of the tumor microenvironment for enhancing cancer immunotherapy[J]. Oncoimmunology, 2013, 2: e25961. DOI:10.4161/onci.25961 |
| [19] |
Varelas V, Liouni M, Calokerinos AC, et al. An evaluation study of different methods for the production of beta-D-glucan from yeast biomass[J]. Drug Test Anal, 2016, 8: 46-55. DOI:10.1002/dta.1833 |
| [20] |
Ishimoto Y, Ishibashi K, Yamanaka D, et al. Production of low-molecular weight soluble yeast β-glucan by an acid degradation method[J]. Int J Biol Macromol, 2018, 107: 2269-2278. DOI:10.1016/j.ijbiomac.2017.10.094 |
| [21] |
Zheng Z, Huang Q, Luo X, et al. Effects and mechanisms of ultrasound- and alkali-assisted enzymolysis on production of water-soluble yeast β-glucan[J]. Bioresource Technol, 2019, 273: 394-403. DOI:10.1016/j.biortech.2018.11.035 |
| [22] |
Ruthes AC, Smiderle FR, Iacomini M. D-glucans from edible mushrooms: a review on the extraction, purification and chemical characterization approaches[J]. Carbohydr Polym, 2015, 117: 753-761. DOI:10.1016/j.carbpol.2014.10.051 |
| [23] |
Sone Y, Okuda R, Wada N, et al. Structures and antitumor activities of the polysaccharides isolated from fruiting body and the growing culture of mycelium of Ganoderma lucidum[J]. Agric Biol Chem, 1985, 49: 2641-2653. |
| [24] |
Dubois M, Gilles K, Hamilton JK, et al. A colorimetric method for the determination of sugars[J]. Nature, 1951, 168: 167. |
| [25] |
Wang J, Zhang L. Structure and chain conformation of five water-soluble derivatives of a β-D-glucan isolated from Ganoderma lucidum[J]. Carbohydr Res, 2009, 344: 105-112. DOI:10.1016/j.carres.2008.09.024 |
| [26] |
Chen J, Zhou J, Zhang L, et al. Chemical stucture of the water-insoluble polysaccharide isolated from the fruiting body of Ganoderma lucidum[J]. Polym J, 1998, 30: 838-842. DOI:10.1295/polymj.30.838 |
| [27] |
Danielson ME, Dauth R, Elmasry NA, et al. Enzymatic method to measure β-1, 3-β-1, 6-glucan content in extracts and formulated products (GEM assay)[J]. J Agric Food Chem, 2010, 58: 10305-10308. DOI:10.1021/jf102003m |
| [28] |
Li B, Cramer D, Wagner S, et al. Yeast glucan particles activate murine resident macrophages to secrete proinflammatory cytokines via MyD88- and Syk kinase-dependent pathways[J]. Clin Immunol, 2007, 124: 170-181. DOI:10.1016/j.clim.2007.05.002 |
| [29] |
Gonzalez H, Hagerling C, Werb Z. Roles of the immune system in cancer: from tumor initiation to metastatic progression[J]. Genes Dev, 2018, 32: 1267-1284. DOI:10.1101/gad.314617.118 |
| [30] |
DeNardo DG, Ruffell B. Macrophages as regulators of tumour immunity and immunotherapy[J]. Nat Rev Immunol, 2019, 19: 369-382. DOI:10.1038/s41577-019-0127-6 |
| [31] |
Hong F, Yan J, Baran JT, et al. Mechanism by which orally administered beta-1, 3-glucans enhance the tumoricidal activity of antitumor monoclonal antibodies in murine tumor models[J]. J Immunol, 2004, 173: 797-806. DOI:10.4049/jimmunol.173.2.797 |
| [32] |
Tang J, Zhen H, Wang N, et al. Curdlan oligosaccharides having higher immunostimulatory activity than curdlan in mice treated with cyclophosphamide[J]. Carbohydr Polym, 2019, 207: 131-142. DOI:10.1016/j.carbpol.2018.10.120 |
| [33] |
Germic N, Frangez Z, Yousefi S, et al. Regulation of the innate immune system by autophagy: monocytes, macrophages, dendritic cells and antigen presentation[J]. Cell Death Different, 2019, 26: 715-727. DOI:10.1038/s41418-019-0297-6 |
| [34] |
Goodridge HS, Reyes CN, Becker CA, et al. Activation of the innate immune receptor Dectin-1 upon formation of a 'phagocytic synapse'[J]. Nature, 2011, 472: 471-475. DOI:10.1038/nature10071 |
| [35] |
de Graaff P, Govers C, Wichers H J, et al. Consumption of beta-glucans to spice up T cell treatment of tumors: a review[J]. Exp Opin Biol Ther, 2018, 18: 1023-1040. DOI:10.1080/14712598.2018.1523392 |
 2020, Vol. 55
2020, Vol. 55


