2. 天津药物研究院, 释药技术与药代动力学国家重点实验室, 天津 300193
2. State Key Laboratory of Drug Delivery Technology and Pharmacokinetics, Tianjin Institute of Pharmaceutical Research, Tianjin 300193, China
维拉帕米(verapamil, Ver)属于苯烷基胺类的钙离子通道阻滞剂, 临床上对快速性心律失常、各类心绞痛、高血压、阵发性室上性心动过速及肥厚型心肌病均有显著疗效。近年来, 维拉帕米作为多药耐药蛋白抑制剂, 在靶部位联合治疗癌症方面有较大研究进展, 可有效逆转癌细胞耐药性[1-3]。维拉帕米的传统剂型为片剂, 口服后原形药物维拉帕米和N-去甲基维拉帕米(norverapamil, Nor)都是活性形式, 药代动力学和仿制药的生物等效性研究都需要同时测定二者的血药浓度, 美国食品药品监督管理局(FDA)还专门规定以维拉帕米和去甲基维拉帕米二者的药代参数进行等效性统计检验。
维拉帕米口服给药吸收速度较快, 约0.5~2 h达峰, 但由于肝脏首过代谢的原因, 维拉帕米和去甲维拉帕米的血浆浓度都不高, 人单次口服维拉帕米片40 mg后, 其中维拉帕米的血浆峰浓度Cmax为(31.67 ± 7.35) ng·mL-1, 去甲维拉帕米的Cmax为(27.35 ± 5.54) ng·mL-1[4]。目前, 已有同时测定人血浆中维拉帕米及其活性代谢产物去甲维拉帕米的文献报道, 测定方法有高效液相色谱法、高效液相色谱荧光检测法、高效毛细管电泳法及液质联用法(LC-MS/MS)等[5-13]。但这些方法血浆用量较大且灵敏度较低, 定量下限均大于1 ng·mL-1, 对于满足240和120 mg等大规格制剂的人体药代动力学及生物等效性方面的研究是可行的。但考虑到维拉帕米属于高变异药物, 部分受试者口服维拉帕米40 mg后, 维拉帕米及去甲维拉帕米的Cmax值会接近或低于10 ng·mL-1, 预计4或5个半衰期后部分受试者的血浆浓度会低于0.5 ng·mL-1, 为了准确、完整描述维拉帕米片剂口服后的体内药代动力学行为, 需要建立灵敏度更高的简便、快速的定量分析方法。本研究建立了一种简便、快速、灵敏的同时测定人血浆中维拉帕米及去甲维拉帕米浓度的LC-MS/MS方法, 该方法前处理简便, 生物基质用量少, 灵敏度高, 定量下限为0.1 ng·mL-1并成功应用于健康人体的药代动力学研究。
材料与方法药品与试剂 盐酸维拉帕米(纯度为98%, 批号为11-XJZ-55-1)、盐酸N-去甲维拉帕米(纯度为98%, 批号为4-MAR-66-3)、盐酸维拉帕米-d6 (纯度为98%, 批号为8-JWA-37-1)均来源于加拿大Toronto Research Chemicals公司; 甲酸铵和甲酸(天津市光复精细化工研究所); 色谱纯甲醇和乙腈(美国Fisher公司); 维拉帕米片(规格: 40 mg/片, 天津市中央药业有限公司)。
仪器 液相色谱-质谱联用系统由日本Shimadzu公司生产的Prominence 30A岛津高效液相色谱仪, 配备LC-30AD型二元梯度泵、CTO-30A型柱温箱和SIL-30AC型自动进样器和美国Applied Biosystems公司生产的SCIEX TRIPLE QUADTM 5500型三重四极杆串联质谱仪(配备Turbo Spray离子源)构成。其他仪器包括Turbo Vap® LV型氮吹样品浓缩仪(美国Caliper公司), TARGINTM MINI-A型涡旋振荡器、TARGINTM VX-Ⅱ型多管涡旋振荡器(北京踏锦科技有限公司), 17R台式高速冷冻离心机(美国Thermo Scientific), 3K15型高速冷冻离心机(德国Sigma公司), XS105型分析天平(瑞士METTER TOLEDO公司), BM-40型纯水制备系统(北京中盛茂源科技发展有限公司)。
色谱条件 色谱柱采用Agilent ZORBAX Eclipse C18柱(50 mm×4.6 mm, 5 μm); 流动相采用甲醇-乙腈(50:50, v/v)溶液作为A相, 0.1%甲酸-5%乙腈-10 mmol·L-1甲酸铵水溶液为B相; 采用梯度洗脱方式进行色谱分离, 色谱梯度设置为: 0~0.2 min, 70% B; 0.2~3.0 min, 70%→30% B; 3.0~4.0 min, 30% B; 4.0~4.1 min, 30%→2% B; 4.1~5.5 min, 2% B; 5.5~5.6 min, 2%→70% B; 5.6~7.0 min, 70% B; 柱温为40 ℃, 流速为0.5 mL·min-1, 进样5 μL分析。
质谱条件 采用电喷雾离子源(ESI), 多反应(MRM)正离子监测模式对待测物维拉帕米、去甲维拉帕米及内标维拉帕米-d6 (IS)进行定量检测, 质谱参数设置如下:卷帘气为15 psi (1 psi ≈ 6.9 kPa); 碰撞气为10 psi; 源温度为550 ℃; 喷雾电压为3 500 V。化合物参数优化如下:维拉帕米、去甲维拉帕米及内标的碰撞能分别为33、25和33 eV, 入口电压分别为7、10和7 V, 去簇电压分别为40、30和40 V, 出口电压均为10 V。维拉帕米和去甲维拉帕米的监测离子对分别为m/z 445.0→165.2、m/z 441.0→165.2, 内标的监测离子对为m/z 461.1→165.2。
标准溶液的配制 分别称取盐酸维拉帕米和盐酸N-去甲维拉帕米对照品适量于10 mL量瓶中, 加入适量甲醇溶解并定容, 配制维拉帕米和去甲维拉帕米浓度分别为1 mg·mL-1的标准储备液和质控储备液。
精密量取维拉帕米及去甲维拉帕米标准储备液和质控储备液适量, 混合后得到混合标准储备液和质控储备液。将混合标准储备液及质控储备液用甲醇逐步稀释, 得浓度为2/2、4/4、20/20、40/40、100/100、400/400、1000/1000 ng·mL-1的系列混合标准工作液及浓度为2/2、5/5、80/80、800/800 ng·mL-1的质控工作液。精密称取维拉帕米-d6对照品一支(规格: 5 mg/支)加适量甲醇溶解后转移至量瓶中, 加入甲醇定容至刻度, 制备内标储备液, 并用甲醇稀释制得浓度为10 ng·mL-1的内标工作液。
校正血浆样品配制 精密吸取空白人血浆475 μL, 分别加入25 μL系列混合标准工作液和质控工作液, 获得浓度为0.1/0.1、0.2/0.2、1/1、2/2、5/5、20/20、50/50 ng·mL-1的标准曲线样品及0.1/0.1、0.25/0.25、4/4、40/40 ng·mL-1的质控样品。
血浆样品处理方法 精密吸取血浆样品50 μL置于1.5 mL离心管中, 加入内标工作液50 μL, 甲醇100 μL, 涡旋混匀, 4 ℃、12 000 r·min-1离心10 min, 吸取上清液100 μL于内插管中, 4 ℃、12 000 r·min-1离心5 min后, 取上清液5 μL进样分析。
方法学验证
选择性 取6个不同来源的空白人血浆, 除不加内标溶液(改加等体积甲醇)外, 其余按“血浆样品处理方法”项下处理后进样分析; 配制维拉帕米及去甲维拉帕米浓度为0.1 ng·mL-1血浆样品(LLOQ), 按“血浆样品处理方法”项下处理后进样分析, 考察方法对待测物及内标的测定是否存在干扰。
线性范围和定量下限 配制维拉帕米及去甲维拉帕米浓度范围均为0.1~50 ng·mL-1的校正曲线样品, 并按“血浆样品处理方法”项下处理后进样分析, 记录待测物及内标的色谱峰面积。采用加权最小二乘法(1/x2), 用待测物与内标峰面积之比(Y)对待测物浓度(X)进行回归, 获得维拉帕米及去甲维拉帕米标准曲线回归方程。
按“血浆样品处理方法”项下处理维拉帕米及去甲维拉帕米浓度为0.1 ng·mL-1血浆样品, 考察3个分析批, 每批次6样本, 以当批标准曲线计算各样本的浓度, 获得该浓度下的精密度及准确度。
进样残留情况 为分析样品的进样残留情况, 在标准曲线最高浓度点之后进样空白人血浆样品。
准确度和精密度 配制并处理浓度为0.25/0.25、4/4、40/40 ng·mL-1的低、中、高质控样品, 进行LC-MS/MS分析, 连续分析3个分析批, 每个浓度平行6样本, 用当批标准曲线计算各质控样本的浓度, 考察分析方法的精密度(precision)和准确度(accuracy)。
基质效应和提取回收率 分别取0.25/0.25、4/4、40/40 ng·mL-1低、中、高3个浓度水平的质控工作液50 μL, 加入50 μL水, 50 μL内标和50 μL甲醇溶液, 各浓度平行6样本处理solution样品, 得峰面积As。取6个不同来源的空白人血浆样品50 μL, 除不加内标溶液(以等体积甲醇替代)外, 其余按“血浆样品处理方法”项下操作, 取100 μL上清液氮气挥干, 分别加入100 μL低、中、高3个浓度的solution溶液样品复溶后进样分析, 各浓度平行6样本处理, 得峰面积Am; 配制低、中、高3个质控浓度的血浆样品, 按“血浆样品处理方法”项下操作, 各浓度平行6样本处理, 得峰面积Aq; 基质效应的表达式为Am/As ×100%, 提取回收率的表达式为Aq/Am×100%。
稳定性 配制低、高两个浓度的血浆样品, 各浓度水平均为6样本。分别考察室温放置4 h稳定性、-70 ℃—室温冻融循环3次、-70 ℃长期冻存60天、-20 ℃冻存8天及处理后样品进样器放置48 h稳定性。考虑到样本采集过程中的室温放置过程, 本实验配制了维拉帕米及去甲维拉帕米低、高质控浓度的全血样品, 评价维拉帕米及去甲维拉帕米在全血中室温放置2 h的稳定性。
人体药代动力学研究 临床实验经伦理委员会批准[临邑县中医院, 临卫中医字(2018)第(004)-01号)], 筛选12名健康成年受试者(无脱落)空腹单次口服维拉帕米片40 mg后, 分别于给药前和给药后0.25、0.5、0.75、1、1.5、2、2.5、3、3.5、4、4.5、5、5.5、6、8、10、12、24和48 h采集血样置于含有肝素锂的抗凝管中, 4 ℃、3 000 r·min-1条件下离心10 min, 获得的血浆样品存放至-70 ℃冰箱保存备用。
结果 1 质谱分析在上述质谱条件下, 待测物及内标在ESI源正离子检测模式下进行一级全扫描, 获得维拉帕米、去甲维拉帕米及内标维拉帕米-d6的准分子离子峰[M+H]+分别为m/z 445.0、m/z 441.0和m/z 461.1, 为得到待测物及内标的主要产物离子, 选择性的对待测物和内标的准分子离子进行二级质谱扫描, 如图 1所示, 维拉帕米、去甲维拉帕米及内标生成的主要产物离子均为m/z 165.2。
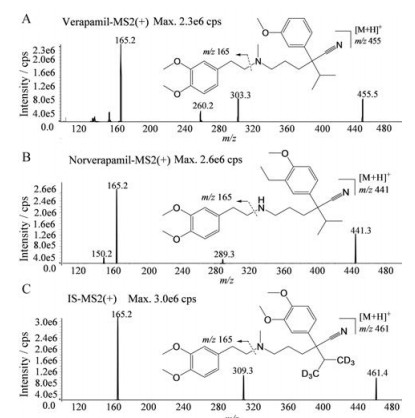
|
Figure 1 The product mass spectrum of the [M+H]+ ions of verapamil (A), norverapamil (B) and the internal standard verapamil-d6 (C) |
空白血浆样品的代表性色谱图见图 2(A); LLOQ样品色谱图见图 2 (B); 图 2 (C)为健康受试者空腹口服维拉帕米片40 mg后2.5 h的血浆样品色谱图。维拉帕米和去甲维拉帕米及内标的色谱保留时间分别为3.48、3.44和3.46 min, 结果显示, 空白血浆中的内源性物质不干扰待测物和内标的定量分析, 该方法具有良好的专属性。
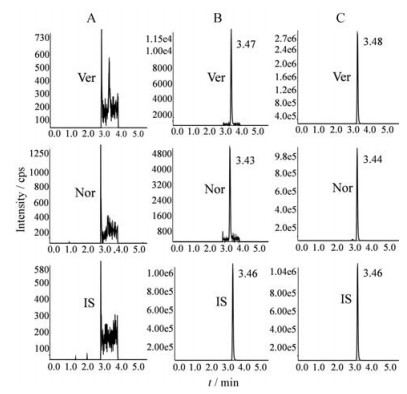
|
Figure 2 Representative chromatogram of verapamil (Ver), norverapamil (Nor) and verapamil-d6 (IS) in human plasma. A: Blank human plasma sample; B: Representative chromatogram of simulated biological samples with analytes (0.1 ng·mL-1) and verapamil-d6 (10 ng·mL-1) in blank human plasma; C: Representative chromatogram of plasma samples after 2.5 hours of oral verapamil (40 mg) |
标准曲线拟合后维拉帕米及去甲维拉帕米的典型回归方程分别为Y = 0.096 2X + 0.002 75 (r = 0.998 6)和Y = 0.044 5X + 0.000 399 (r = 0.999 6)。结果表明, 维拉帕米及去甲维拉帕米在0.1~50 ng·mL-1内线性关系良好。在0.1 ng·mL-1的浓度下测得维拉帕米及去甲维拉帕米的平均准确度分别为99.7%和102%, 批内精密度分别在3.10%~13.1%和2.85%~6.34%之内, 批间精密度分别为5.19%和5.49%, 且信噪比(S/N)大于10。表明该方法同时测定维拉帕米及去甲维拉帕米浓度的定量下限(LLOQ)均可达到0.1 ng·mL-1。
2.3 进样残留情况人空白血浆样品中的干扰组分的响应低于当批次中LLOQ样品待测物响应的20%和内标响应的5%, 表明该方法不存在残留干扰, 不影响维拉帕米和去甲维拉帕米的含量测定。
2.4 准确度和精密度精密度及准确度数据如表 1所示, 维拉帕米及去甲维拉帕米各质控浓度水平的平均准确度均在标示值的85%~115%之间, 维拉帕米低、中、高3个浓度水平的批内精密度均小于3.10%, 批间精密度小于5.34%;去甲维拉帕米低、中、高3个浓度水平的批内精密度均小于3.38%, 批间精密度小于6.15%。表明该方法测定人血浆中维拉帕米及去甲维拉帕米浓度的精密度及准确度均良好。
| Table 1 Analysis of precision and accuracy for verapamil and norverapamil in human plasma. n = 18, x± s |
结果显示, 维拉帕米在0.25、4和40 ng·mL-1浓度水平经内标归一化的基质效应分别为100%、99.2%和100%, 相对标准偏差(RSD)不超过3.61%;去甲维拉帕米在0.25、4和40 ng·mL-1浓度水平上的基质效应分别为101%、101%和102%, RSD不超过4.96%。结果表明, 基质效应不会对待测物的分析产生影响。
维拉帕米在0.25、4、40 ng·mL-1浓度水平的提取回收率分别为86.8%、89.7%和95.9%, 总体回收率的RSD为4.55%;去甲维拉帕米在0.25、4和40 ng·mL-1浓度水平的提取回收率分别为87.4%、90.4%和94.8%, 总体回收率的RSD为4.10%。结果符合相关指导原则的要求。
| Table 2 Stability of verapamil and norverapamil in human plasma. n = 6, x ± s |
表 2所示为维拉帕米及去甲维拉帕米低、高两个浓度血浆样品在各储存条件下稳定性数据。结果表明, 含药血浆在以下储存条件下稳定性良好。此外, 全血样品室温放置2 h稳定性结果显示, 与0 h相比, 维拉帕米低、高两个浓度的含药全血样品的平均准确度分别为99.3%和102%, RSD分别为3.60%和1.04%;去甲维拉帕米低、高两个浓度的含药全血样品的平均准确度分别为99.2%和103%, RSD分别为4.36%和1.46%。表明含药全血室温放置2 h稳定。
2.7 人体药代动力学研究该方法通过方法学验证后应用于12名健康受试者口服维拉帕米片40 mg后的药代动力学分析, 采用Phoenix WinNonlin 7.0软件计算药代动力学参数见表 3, 维拉帕米及去甲维拉帕米的平均血药浓度-时间曲线见图 3。
| Table 3 The pharmacokinetic parameters of verapamil and norverapamil after oral administration of verapamil (40 mg). n = 12, x± s |
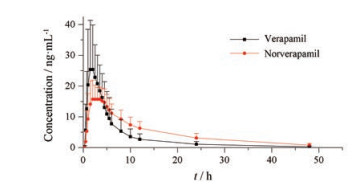
|
Figure 3 Mean plasma concentration-time curve after oral administration of verapamil (40 mg) in 12 healthy adult volunteers |
本研究在建立同时测定人血浆中维拉帕米及去甲维拉帕米含量的LC-MS/MS定量分析方法时, 对色谱条件进行了优化。在建立LC-MS/MS分析方法实验初期, 分别考察了Agilent ZORBAX Eclipse C18、Atlantis® T3、ACE Excel 2 Super C18等不同类型的色谱柱, 结果发现, 使用Agilent ZORBAX Eclipse C18色谱柱能够得到较对称的色谱峰, 峰型较好。在流动相的选择中, 分别考察了不同浓度的缓冲盐体系(如5 mmol·L-1、10 mmol·L-1甲酸铵)下对色谱峰行为的影响, 发现0.1%甲酸-5%乙腈-10 mmol·L-1甲酸铵作为流动相时, 能获得较为对称的色谱峰。同时对洗脱方式及流速进行优化, 考察了等度和不同梯度的洗脱方式, 结果显示, 等度洗脱时峰型较差, 在0.5 mL·min-1的流速下, 采用梯度洗脱的方式, 可实现与内源性干扰物质较好的分离, 并且提高了检测的灵敏度。
由于维拉帕米口服吸收后血浆浓度较低, 因此对含量分析方法的灵敏度及样品的预处理方式要求较高。关于生物样品前处理方法的选择, 据国内外相关文献报道, 多数研究者采用有机溶剂提取的方式进行生物样品前处理[6-12, 14], 方法血浆用量大, 有机溶剂消耗多且经过挥干、复溶后进样, 步骤繁琐。Richter等[15]采用固相萃取的方式处理生物样品, 操作繁琐, 血浆用量大(1 mL), 且应用固相萃取柱成本较高。蛋白沉淀法作为样品前处理方式更为简便快速, Li等[13]建立了LC-MS/MS的方法同时测定人血浆中维拉帕米及去甲维拉帕米的浓度, 使用乙腈沉淀蛋白对生物样品进行前处理, 操作简便, 但该方法血浆用量为100 μL, 定量下限高且线性范围较窄为2~400 ng·mL-1。本研究建立的同时测定人血浆中维拉帕米及去甲维拉帕米含量的LC-MS/MS方法, 直接用甲醇沉淀蛋白对血浆样品进行预处理, 操作简便快速, 与已有相关文献报道的方法相比, 血浆用量减少, 灵敏度较高, 精密度、准确度均较好, 同时测定维拉帕米及去甲维拉帕米的定量下限可达到0.1 ng·mL-1, 并完成了完整的方法学验证, 符合2015年版《中国药典生物样品定量分析方法验证指导原则》的相关要求[16], 并应用于临床健康受试者空腹口服维拉帕米片40 mg后人体的药代动力学研究, 为维拉帕米临床用药的进一步研究和仿制药一致性评价提供了可靠的分析方法。
| [1] |
Zheng W, Li M, Lin Y, et al. Encapsulation of verapamil and doxorubicin by MPEG-PLA to reverse drug resistance in ovarian cancer[J]. Biomed Pharmacother, 2018, 108: 565-573. DOI:10.1016/j.biopha.2018.09.039 |
| [2] |
Fan GF, Pan JJ, Fan PS, et al. The clinical observation of verapamil in combination with interventional chemotherapy in advanced gastric cancer[J]. Eur Rev Med Pharmacol Sci, 2018, 22: 5508-5518. |
| [3] |
Trompier D, Chang XB, Barattin R, et al. Verapamil and its derivative trigger apoptosis through glutathione extrusion by multidrug resistance protein MRP1[J]. Cancer Res, 2004, 64: 4950-4956. DOI:10.1158/0008-5472.CAN-04-0143 |
| [4] |
Sawicki W, Janicki S. Pharmacokinetics of verapamil and its metabolite norverapamil from a buccal drug formulation[J]. Int J Pharm, 2002, 238: 184-189. |
| [5] |
Yang J, Jia JY, Zhang H, et al. Determination of verapamil and norverapamil in serum by HPLC with fluorescence detection[J]. Chin J Clin Pharm (中国临床药学杂志), 2001, 10: 99-101. |
| [6] |
Zou H, Jiang XT, Ma BL, et al. Simultaneous determination of verapamil and norverapamil in plasma by high-performance liquid chromatography using fluorometric detection[J]. Chin Pharm J (中国药学杂志), 2001, 36: 35-37. |
| [7] |
Sawicki W. A validated method for the determination of verapamil and norverapamil in human plasma[J]. J Pharm Biomed Anal, 2001, 25: 689-695. DOI:10.1016/S0731-7085(00)00585-9 |
| [8] |
Resztak M, Glowka FK. Stereoselective CZE method for analysis of verapamil and norverapamil in human plasma[J]. Acta Pol Pharm, 2013, 70: 395-401. |
| [9] |
Rui JZ, Zhou XD, Ling SS, et al. Simultaneous determination of the enantiomers of verapamil and norverapamil in plasma by high performance capillary electrophoresis[J]. Acta Pharm Sin (药学学报), 1998, 33: 517-522. |
| [10] |
SinghalI P, Yadav M, Winter S, et al. Enantiomeric separation of verapamil and its active metabolite, norverapamil, and simultaneous quantification in human plasma by LC-ESI-MS-MS[J]. J Chromatogr Sci, 2012, 50: 839-848. |
| [11] |
Stagni G, Gillespie WR. Simultaneous analysis of verapamil and norverapamil enantiomers in human plasma by high-performance liquid chromatography[J]. J Chromatogr B Biomed Appl, 1995, 667: 349-354. DOI:10.1016/0378-4347(95)00019-F |
| [12] |
Liu XQ, Cao YP, Tan L, et al. Simultaneously pharmacokinetic modeling of verapamil and its major metabolite in healthy volunteers[J]. J China Pharm Univ (中国药科大学学报), 1996, 27: 601-604. |
| [13] |
Li S, Liu G, Jia J, et al. Simultaneous determination of ten antiarrhythic drugs and a metabolite in human plasma by liquid chromatography-tandem mass spectrometry[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2007, 847: 174-181. DOI:10.1016/j.jchromb.2006.10.013 |
| [14] |
Hedeland M, Fredriksson E, Lennernas H, et al. Simultaneous quantification of the enantiomers of verapamil and its N-demethylated metabolite in human plasma using liquid chromatography-tandem mass spectrometry[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2004, 804: 303-311. DOI:10.1016/j.jchromb.2004.01.026 |
| [15] |
Richter OV, Eichelbaum M, Schonberger F, et al. Rapid and highly sensitive method for the determination of verapamil, [2H7] verapamil and metabolites in biological fluids by liquid chromatography-mass spectrometry[J]. J Chromatogr B Biomed Sci Appl, 2000, 738: 137-147. DOI:10.1016/S0378-4347(99)00508-3 |
| [16] |
Chinese Pharmacopoeia Commission.Guiding Principles for Quantitative Analysis of Biological Samples [S]//Pharmacopoeia of the People's Republic of China (中华人民共和国药典). 2015 ed. Beijing: China Medical Science Press, 2015.
|
 2020, Vol. 55
2020, Vol. 55


