脑卒中是由脑组织缺血、缺氧所引起的一种急性脑血管疾病, 包括出血性脑卒中和缺血性脑卒中两种类型, 其中缺血性脑卒中占总患病率的75%~85%[1]。缺血性脑卒中是由脑部血管的暂时或永久性的阻塞, 促使局部脑组织供血不足, 最终导致神经细胞发生不可逆转的损伤, 是世界范围内致死和终身残疾的主要原因。目前对于缺血性脑卒中的治疗主要集中于两个方面:一是以溶栓、抗血小板聚集、扩张血管等为目的促进缺血区域的血液供应, 包括溶栓药物、抗血小板聚集药物、抗凝和降纤药物[2]。另一方面是以保护脑神经细胞的功能与结构为治疗目的, 减轻由于缺少血液供应而导致的神经细胞损伤或凋亡[3], 主要有抗氧化应激药物、抗兴奋性毒性药物、炎症反应抑制剂等。面对临床上常用的改善脑部供血药物存在治疗时间窗窄以及神经保护剂治疗效果不突出等诸多问题[4], 研发出一类具有改善脑部供血功效的神经保护剂对于缺血性脑卒中的治疗具有重要意义。
丁苯酞(3-n-butylphthalide, NBP, 图 1)是从芹菜籽中提取出的一种苯并呋喃酮类化合物, 于2002年上市用于脑卒中的治疗[5]。丁苯酞可以通过提高脑血管内皮一氧化氮和前列腺素2的水平, 抑制神经元细胞凋亡; 改善局部脑血流量和脑微循环, 减轻由脑缺血引起的脑水肿症状; 抗血栓形成和抗血小板的聚集, 改善神经功能缺失, 减少脑梗死面积等[6]。尽管丁苯酞能够对脑缺血的多个病理环节有治疗作用, 但其自身的总体疗效不高, 常与其他药物联合使用[7]。基于丁苯酞以多通路、多靶点治疗脑卒中的特性, 以丁苯酞为先导化合物研发新型的神经细胞保护剂, 倍受药物化学家们的青睐。

|
图 1 The design of 3-n-butylphthalide derivatives |
阿魏酸(ferulic acid, 图 1)是活血化瘀药当归的主要有效成分[8]。药理学研究表明, 阿魏酸还能抑制由缺血缺氧所导致的兴奋性氨基酸的神经毒、胞内钙超载、氧自由基损伤等作用, 对缺血损伤产生耐受及自身保护作用, 进而减少脑梗死面积[9, 10]。此外, 阿魏酸能够选择性抑制血栓素合成酶的活性, 促PGI2/TXA2的比值升高, 抑制血小板聚集[11]。因此, 阿魏酸作为治疗脑卒中的活性小分子, 具有进一步研发的潜力。
基于丁苯酞与阿魏酸都具有改善脑循环和神经细胞保护作用, 将二者的结构进行拼合, 是否能够获得一类具有改善脑循环功效的神经细胞保护剂呢?因此, 本研究将丁苯酞的烷烃链与阿魏酸上的酚羟基进行连接, 设计合成12个新型丁苯酞衍生物(图 1), 通过大鼠神经元细胞的缺氧缺糖损伤模型考察其体外保护活性, 并对保护活性最好的化合物进行抗血小板聚集活性评测。此外, 对该系列化合物的构效关系进行了初步探讨。
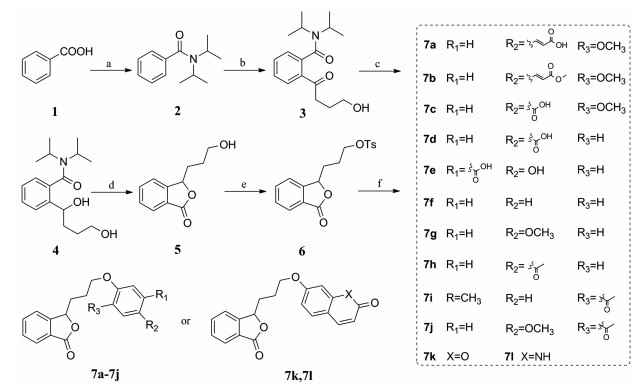
结果与讨论 1 化学合成目标化合物的合成如合成路线1所示。以市售苯甲酸为原料, 二异丙胺保护羧基, 在叔丁基锂的作用下与γ-丁内酯进行亲核取代反应生成化合物3。经还原、酯化反应后得到化合物5, 羟基经对甲基苯磺酰氯活化后与阿魏酸及其衍生物取代获得目标化合物7a~ 7l, 其中化合物7b用高效液相检色谱测其纯度。所有目标化合物结构均经1H NMR、13C NMR和ESI-MS确证, 其熔点以及波谱数据见表 1。
| 表 1 Properties and spectral data of compounds 7a-7l |
|
Scheme 1 Synthetic route of target compounds. Reagents and conditions:a:DCM, DMF, (COCl)2, 20℃; DCM, 0℃, Et3N; b:t-BuLi, gamma-butyrolactone, THF, -78℃, 1 h; c:NaBH4, MeOH, r.t., 12 h; d:TsOH, toluene, reflux, 24 h; e:Triethylamine, 4-dimethylamino pyridine, dichloromethane, r.t., 12 h; f:K2CO3, KI, CH3CN, 50℃, 8 h |
以丁苯酞为阳性对照药, 以浓度为0.1、1、10 μmol·L-1三种剂量, 检测丁苯酞衍生物对氧糖剥夺诱导大鼠脑皮层神经元损伤的保护作用(动物实验经安徽中医药大学实验动物伦理委员会批准), 细胞存活率见表 2。结果表明, 与模型组对比, 合成的12个丁苯酞衍生物均具有一定的细胞保护活性, 且化合物的细胞保护活性与浓度呈正相关性。其中化合物7b和7e的细胞保护活性最为突出, 在剂量为1 μmol·L-1时, 细胞保护活性显著优于阳性药丁苯酞, 引起进一步研究的兴趣。
| 表 2 Neuroprotective effects of target compounds against OGD/R-induced neurotoxicity in rat cortical neurons. NBP:3-n-Butylphthalide. **P < 0.01 vs Model; #P < 0.05, ##P < 0.01 vs NBP |
分析7b与7e的结构发现, 与丁苯酞连接的另一片段分别是阿魏酸和水杨酸的类似物, 由此可进一步推断化合物7b与7e在具有出众的细胞保护活性同时还能改善脑部的血液循环。因此, 采用Bron比浊法测定化合物7b与7e由花生四烯酸(AA)及二磷酸腺苷(ADP)诱导的血小板聚集的抑制活性。结果如表 3所示, 在由AA诱导的血小板聚集试验中, 化合物7b与7e的抑制活性略低于阳性药阿司匹林; 而在由ADP诱导血小板聚集的抑制活性试验中, 7b与7e的抑制血小板聚集活性要略好于阳性药。另外, 化合物7b在两种诱导剂诱导的抗血小板聚集活性实验中均表现出良好的抑制活性。
| 表 3 In vitro anti-platelet aggregation activities of the target compounds. AA:Arachidonic acid; ADP:Adenosine diphosphate |
以剂量1 μmol·L-1初步探讨该系列化合物的构效关系, 如图 2所示, 在剂量为1 μmol·L-1的条件下, 化合物7a、7b、7e、7h、7k的细胞保护活性高于丁苯酞。相比较化合物7a、7b而言, 阿魏酸片段上的羧酸替换成甲酯时能够显著提高化合物的细胞保护活性; 此外相对于化合物7c、7d、7e而言, 缺失邻位羟基提供的分子内氢键导致亲水性增强, 化合物的细胞保护活性也显著降低。由此可见苯环上连有亲酯基团对神经元细胞的保护更有利。此外, 对比化合物7a与7c发现连接在苯环上羧酸的碳链较长时保护活性较好; 对比化合物7c和7d发现苯环上邻位连有甲氧基也有助于细胞保护活性的增强。

|
图 2 Neuroprotective effects of target compounds at the dose 1 μmol·L-1. ##P < 0.01 vs NBP |
本研究采用分子杂交策略, 设计合成了12个新型丁苯酞衍生物, 目标化合物均经过1H NMR、13C NMR、ESI-MS确证其结构。采用氧糖剥夺诱导大鼠脑皮层神经元损伤模型对目标化合物进行活性初筛, 获得两个具有良好细胞保护活性的化合物7b与7e。随后, 利用Bron比浊法对化合物7b与7e的抗血小板聚集活性进行评测, 发现化合物7b能够有效抑制由AA和ADP诱导的血小板聚集。基于上述试验结果可知, 化合物7b在具有良好的抑制血小板聚集活性的同时, 还能表现出强效的脑神经细胞活性, 因此认为化合物7b具有开发成治疗缺血性脑卒中药物的潜力。
实验部分LCQ Advantage MAX液质连用质谱仪(美国Finniga公司)、Bruker 400 MHz超导核磁共振仪(瑞士Bruker公司)、SGWX-4显微熔点仪(上海精密科学仪器有限公司)、DF-101S集热式恒温加热磁力搅拌器(巩义予华仪器有限责任公司)、R1001-VN旋转蒸发仪(郑州长城科工贸有限公司); 除特殊说明外, 所用试剂均为市售分析纯或化学纯产品。
1 化合物合成 1.1 中间体2的合成在500 mL干燥的圆底烧瓶中加入化合物1 (24.4 g, 200 mmol), 再加入300 mL二氯甲烷以及5滴N, N-二甲基甲酰胺搅拌溶解。在20℃条件下缓慢滴加草酰氯(38.1 g, 300 mmol), 滴加完全后, 升温至25℃, 搅拌反应2.5 h。停止反应后将反应液减压浓缩, 除去多余的草酰氯, 得黄色稠状液体。将上述油状物溶于200 mL二氯甲烷中, 在0℃条件下, 缓慢加入二丙胺(40.4 g, 400 mmol)与三乙胺(40.4 g, 400 mmol)的混合溶液中, 滴加完全后缓慢升至室温反应8 h。反应结束后向反应液中滴加饱和氯化铵溶液200 mL淬灭反应, 再用二氯甲烷和饱和氯化钠多次萃取, 无水硫酸钠干燥, 抽滤, 减压浓缩反应液, 经柱色谱分离得白色固体33.1 g, 收率80.7%。
1.2 中间体3的合成在250 mL干燥的三颈烧瓶中加入化合物2 (20.5 g, 100 mmol)和100 mL无水四氢呋喃。在氮气保护下冷却反应液至-78℃后, 缓慢滴加叔丁基锂(1.3 mol·L-1, 90 mL, 120 mmol), 滴加完毕后保温反应1 h。缓慢滴加γ-丁内酯(11.2 g, 130 mmol), 滴加完毕后保温反应1 h。反应结束后向反应液中滴加200 mL饱和氯化铵溶液淬灭反应, 再用二氯甲烷和饱和氯化钠多次萃取, 无水硫酸钠干燥, 经柱色谱分离得黄色油状物25.0 g, 收率76.0%。
1.3 中间体4的合成在1 L干燥的圆底烧瓶中, 加入化合物3 (17.0 g, 58.4 mmol)和无水甲醇(400 mL), 在10℃下搅拌溶解后缓慢分批加入硼氢化钠(3.6 g, 94.7 mmol), 升至室温搅拌过夜。反应结束后将反应液移至冰浴条件下, 滴加2 mol·L-1盐酸(300 mL)淬灭反应, 用乙酸乙酯和饱和氯化钠多次萃取, 无水硫酸钠干燥, 减压浓缩后得白色固体17.0 g, 收率89.3%。
1.4 中间体的合成在500 mL干燥的圆底烧瓶中加入化合物4 (8.5 g, 29.0 mmol)、甲苯200 mL后加入一水对甲苯磺酸(0.85 g, 4.5 mmol), 在氮气保护下升温至128℃搅拌反应24 h。反应完全后抽滤反应液并浓缩滤液, 经柱色谱分离得黄色油状物4.3 g, 收率77.8%。
1.5 中间体6的合成在50 mL干燥的圆底烧瓶中, 加入化合物5 (1.78 g, 10.0 mmol)和二氯甲烷50 mL, 随后在冰浴条件下, 依次加入对甲苯磺酰氯(5.09 g, 15.0 mmol)、三乙胺(2.8 mL, 20.0 mmol)、4-二甲氨基吡啶(0.12 g, 1.0 mmol), 在氮气保护下, 升至室温搅拌反应12 h。反应完全后向反应液中加入1 mol·L-1盐酸20 mL, 再用二氯甲烷和饱和氯化钠多次萃取, 无水硫酸钠干燥, 经柱色谱分离得浅黄色固体2.7 g, 收率80.2%。
1.6 7a~7j的合成通法以7a为例, 将化合物6 (0.87 g, 2.5 mmol)溶于N, N-二甲基甲酰胺中, 再向反应液中缓慢加入阿魏酸(0.49 g, 2.5 mmol), 加入碳酸钾(0.7 g, 5 mmol)后升温至65℃搅拌反应。反应完全后冷却反应液至室温, 用50 mL水洗涤, 再用乙酸乙酯和饱和氯化钠多次萃取, 无水硫酸钠干燥, 经柱色谱分离得白色固体0.45 g, 收率49.1%。
1.7 7k、7l的合成通法以7k为例, 将化合物6 (0.87 g, 2.5 mmol)溶于N, N-二甲基甲酰胺中, 再向反应液中缓慢加入对羟基香豆素(0.37 g, 2.5 mmol), 加入碳酸钾(0.7 g, 5 mmol)后升温至65℃搅拌反应。反应完全后冷却反应液至室温, 用50 mL水洗涤, 再用乙酸乙酯和饱和氯化钠多次萃取, 无水硫酸钠干燥, 经柱色谱分离得白色固体0.46 g, 收率54.8%。
2 目标化合物的生物活性评测 2.1 大鼠脑皮层神经元细胞的体外保护活性测定参照文献[12, 13]方法, 将SD大鼠乳鼠的神经元细胞以4×104的细胞密度接种于48孔培养板中, 使用含有相应浓度待测化合物的DMEM培养基(含1% FBS)常规培养24 h。24 h后将培养基更换成不含葡萄糖与血清的DMEM培养基, 并置于含有5% CO2、95% N2三气培养箱中培养2 h; 完成缺氧过程后, 将培养基更换成完全DMEM培养基, 并置于含有5% CO2、20% O2培养箱中培养24 h完成复氧过程。采用MTT法测定线粒体脱氢酶的活性确定细胞活力, 以空白对照组的吸收值设定为100%, 计算不同组别的神经元细胞存活率。公式:存活率=(实验组吸收值/空白对照组吸收值) × 100%。
2.2 抗血小板聚集活性评测[14]采用Bron比浊法测定目标化合物对AA和ADP诱导的血小板聚集的抑制活性。取雄性新西兰家兔(体重1.8~2.2 kg), 皮下注射1%盐酸普鲁卡因注射液局部浸润麻醉, 颈动脉插管取血。将血液与3.8%枸橼酸钠(0.38 g枸橼酸钠溶10 mL生理盐水)以9:1混合, 以1 000 r·min-1离心10 min, 取富血小板血浆(PRP), 剩余部分以3 000 r·min-1离心10 min, 取贫血小板血浆(PPP)。先取PPP 300 μL加入测试孔, 按"PPP"键进行定标。然后取PRP 280 μL加入测试杯中, 加入不同浓度的药液10 μL, 在37 ℃预温槽中预热3 min后放入测试孔, 按"开始"键时立即加入诱导剂10 μL, 测定5 min内最大血小板聚集率, 并计算各化合物的IC50值(半数抑制浓度)。所有实验重复3次, 根据各组聚集率平均值与空白组聚集率均值计算聚集抑制率:抑制率(%)=(空白对照组最大聚集率均值-给药组最大聚集率均值)/空白对照组最大聚集率均值×100%。
| [1] |
Sheng X, Hua K, Yang C, et al. Novel hybrids of 3-n-butylphthalide and edaravone:design, synthesis and evaluations as potential anti-ischemic stroke agents[J]. Bioorg Med Chem Lett, 2015, 25: 3535-3540. DOI:10.1016/j.bmcl.2015.06.090 |
| [2] |
Wang XY, Yu D. Progress in treatment of cerebral ischemic diseases[J]. Chin J Clin (中华临床医师杂志), 2013, 7: 7112-7114. |
| [3] |
Fu Y, Liao Q, Fan DS, et al. Advances in research of neuro protective agents treating is chemic stroke[J]. Chin J New Drugs (中国新药杂志), 2011, 20: 973-977. |
| [4] |
Li Y, Wang X, Fu R, et al. Synthesis and evaluation of nitric oxide-releasing derivatives of 3-n-butylphthalide as anti-platelet agents[J]. Bioorg Med Chem Lett, 2011, 21: 4210-4214. DOI:10.1016/j.bmcl.2011.05.082 |
| [5] |
Yan XF, Zhan J, Huang YN, et al. Pharmacological action and clinical evaluation of butylphthalide[J]. Chin J Hosp Pharm (中国医院药学杂志), 2008, 17: 1498-1500. |
| [6] |
Abdoulaye IA, Guo YJ. A review of recent advances in neuroprotective potential of 3-N-butylphthalide and its derivatives[J]. Biomed Res Int, 2016, 5: 341-343. |
| [7] |
Xu HL, Feng YP. Effects of 3-n-butylphthalide on thrombosis formation and platelet function in rats[J]. Acta Pharm Sin (药学学报), 2001, 36: 329-333. |
| [8] |
Li WX, Guo JM, Tang YP, et al. Pharmacokinetic comparison of ferulic acid in normal and blood deficiency rats after oral administration of Angelica sinensis, Ligusticum chuanxiong and their combination[J]. Int J Mol Sci, 2012, 13: 3583-3597. DOI:10.3390/ijms13033583 |
| [9] |
Cheng CY, Ho TY, Lee EJ, et al. Ferulic acid reduces cerebral infarct through its antioxidative and anti-inflammatory effects following transient focal cerebral ischemia in rats[J]. Am J Chin Med, 2008, 36: 1105-1119. DOI:10.1142/S0192415X08006570 |
| [10] |
Koh PO. Ferulic acid attenuates the down-regulation of MEK/ERK/p90RSK signaling pathway in focal cerebral ischemic injury[J]. Neurosci Lett, 2015, 588: 18-23. DOI:10.1016/j.neulet.2014.12.047 |
| [11] |
Wu YN, Liao FY, Liao WG, et al. Effect of ferulic acid on the brain pharmacokinetics of tetramethylpyrazine in conscious rats[J]. Xenobiotica, 2017, 47: 973-979. DOI:10.1080/00498254.2016.1257835 |
| [12] |
Yin J, Yin ZY, Jiang T, et al. Oxygen-glucose-deprivation/reoxygenation (O/R)-induced autophagic cell death depended on JNK-mediated phosphorylation of Bcl-2[J]. Acta Univ Med Nanjing (Nat Sci) (南京医科大学学报自然科学版), 2016, 38: 1063-1074. |
| [13] |
Gao Y, Liu WD, Ruan BF, et al. Synthesis and neuroprotective activity of resveratrol-3-n-butylphthalide hybrids[J]. Acta Pharm Sin (药学学报), 2019, 54: 1461-1469. |
| [14] |
Liu WD, Zhu PH, Li JM, et al. Design, synthesis, and anti-platelet aggregation activities evaluation of oxiracetam derivatives[J]. Chemistry, 2019, 3: 275-279. |
 2020, Vol. 55
2020, Vol. 55


