治疗性单克隆抗体(mAb)已成为全球制药业的主要焦点之一[1]。目前已有80余个抗体药物获得市场批准, 治疗领域主要为抗肿瘤(如抗CD20的利妥昔单抗用于治疗淋巴瘤, 抗HER2的曲妥珠单抗用于治疗乳腺癌)和自身免疫性疾病(如抗TNF-α的阿达木单抗用于治疗类风湿关节炎、强直性脊柱炎, 抗BLyS的贝利单抗用于治疗系统性红斑狼疮)[2]。新药研发过程中, 药代动力学的研究具有极其重要的意义, 如指导药物的筛选和开发、支持其安全性的评估和临床给药方案的设计。单抗药物与传统的小分子药物相比, 具有极为不同的理化特性, 如其分子质量(≈150 kD)、体积和极性都远大于小分子, 这些特性使得单抗和传统小分子药物在药代动力学特征上具有非常大的差异。抗体药物口服后的生物利用度极低, 因此大部分单抗药物经静脉注射给药, 少部分经皮下或肌肉注射给药, 皮下或肌肉注射的抗体主要经淋巴系统吸收; 抗体分布则主要通过血液-组织液对流和内吞的方式, 单抗药物的稳态表观分布容积通常很小; 抗体无法从肾脏以原形形式排泄, 也无法通过肝脏药物代谢酶进行代谢, 而主要以细胞内酶降解的方式被消除[3]。
建立灵敏、准确和高通量的分析方法, 以支持药代动力学、药效学和毒代动力学研究, 对于抗体药物的开发至关重要[4, 5]。配体结合分析(LBA)和液相色谱-质谱联用(LC-MS, 本文中LC-MS是LC-MS/MS的简化写法)技术是获得抗体药物生物分析数据的主流方法, 其定量性能在以往的报告中得到了全面的综述[6, 7]。传统上, LBA是定量蛋白药物的主要手段, 为各种动力学研究提供足够的灵敏度和通量。然而基质的干扰, mAb修饰/降解和抗药抗体(ADA)都会影响到LBA定量的准确性和特异性[8]。此外, LBA方法开发的过程既费时又昂贵, 这在发现和早期开发阶段尤其成问题[9]。尽管LBA可能仍然被认为是蛋白药物分析的金标准, 但LC-MS法已经成为十分有前景的替代方案, 并已成功地应用于多种抗体的定量分析。与LBA相比, LC-MS在生物分析中的优势在于可以提供快速的方法开发和验证、高特异性和高重现性, 还可以实现多种分析物同时定量[10]。LC-MS方法也更容易在不同的种属和基质之间转移[11-13]。LC-MS技术还可以用于获得生物药物分子的关键信息, 例如残基的氧化或脱酰胺化[14], 而这一点LBA是无法做到的。
虽然前景看好, 但灵敏度、样品制备、方法开发和定量准确度相关的难题亟需解决。本文综述了LC-MS技术在抗体药物的分析中的原理和技术挑战, 总结了最近用于应对这些挑战的策略, 然后举例说明具有代表性的应用。
1 LC-MS技术分析抗体药物的原理自20世纪90年代末以来, LC-MS一直是灵敏、准确和快速分析小分子药物的有力工具。最近, 已经开发了各种LC-MS技术来定量复杂生物基质中的蛋白质[15]。通过LC-MS定量蛋白质, 可以在蛋白质的水解肽和完整的蛋白水平上进行。对完整的蛋白直接进行质谱分析, 由于去除了酶解步骤, 可以使生物分析工作流程更快, 理论上还可以获得更完整的数据[16, 17]。但是受限于仪器, 当前基于LC-MS的抗体定量研究绝大多数都是在肽水平进行的, 肽水平的定量可以提供更高的灵敏度、准确性和重现性。
对抗体的肽水平进行定量, 指的是将目标蛋白酶解之后, 对获得的特征性肽段(signature peptide, SP)进行绝对定量(以稳定同位素标记类似物为内标)。这种以肽为中心的方法, 也被称为自下而上法。与大分子量的蛋白质相比, 肽具有更好的LC-MS兼容性[18]。主要的原因有:①肽段在质谱上的灵敏度远远高于蛋白质; ②大多数MS分析器的m/z检测上限比较低(< 1 500), 无法分析相对较大的蛋白质的多电荷母离子, 而大多数肽段的m/z可以很容易地被几乎所有MS分析器检测到; ③在体内环境中, 蛋白质通常会携带翻译后的修饰, 这会改变蛋白质的质量并引入相当大的分析变异性, 而当在肽段水平上定量蛋白质时, 选定的肽段通常不会发生变化, 从而确保检测分析的可靠度和重现性。
在肽段水平的定量检测, 只需要在低分辨的三重四级杆质谱上即可实现。一般使用的是选择反应监测(SRM)或称为多反应监测(MRM)模式, 与小分子的质谱分析相似, 对肽段的母离子和碰撞产生的子离子进行两次选择。相较于LBA, LC-MS具有更高的灵敏度、更好的定量准确度和更宽的定量动态范围, 并且可以通过切换离子监测的通道, 在一次LC-MS分析中定量多个分析物[19]。由于肽段的母离子一般带有多电荷, 在SRM模式下, 相同的m/z可能指向的并不是同一个肽段, 由此受到了样品中基质的干扰。而肽段被打碎之后, 其产生的碎片所带电荷数变少, 子离子m/z有可能大于母离子的m/z, 如果在定量分析时选择这样的离子对, 可以进一步的提高分析的选择性和灵敏度。例如Duan等[11]在开发抗体的LC-MS法时对肽段的离子对进行优化, 优先选择子离子m/z大于母离子的离子对(图 1)。

|
图 1 Illustration for OAO data processing and evaluation, using the SP candidate A66TIITDTSSNK77. A:Product ion spectrum acquired by the LTQ/Orbitrap for the doubly charged precursor at m/z 575.8. The five abundant product ions (in red) were selected for OAO procedure; B:OAO evaluation in tissue revealed the rank of sensitivity achieved by the five products on an SRM-MS platform, which differs from that by the LTQ/Orbitrap; C:Effect of tube lens offset; D:Individual effect curves of collision energy for each product ion[11] |
当MS优越的选择性与充分的LC分离相结合时, LC-MS便为复杂基质中蛋白质的定量提供了一种通用和强大的工具。LC-MS法定量蛋白的基本流程包括:样品的纯化或富集、目标蛋白的酶解、最后对确定的特征性肽进行检测, 完成蛋白的定量。在这个过程当中, 与小分子的分析类似, 同样用稳定同位素标记的类似物用作内标(IS), 以提高分析的准确度[20]。
以肽为中心自下而上定量目标蛋白, 已经成为目前最广泛使用的LC-MS分析策略。尽管如此, 该技术的发展仍然有其发展瓶颈。从最开始选择合适的肽段开始, 优化酶解条件, 确保酶解的效率和重现性, 最后优化液质参数, 这些步骤都相对复杂和耗时, 由此限制了分析通量。除此之外, 酶解过程可能丢失完整蛋白质的必要信息。以抗体为代表的蛋白质药物, 生物转化表现出比小分子药物更多样化的代谢途径, 包括碳水化合物肝脏介导的清除、溶酶体代谢、抗体Fc介导的清除(通过结晶化)、FcRn结合与抗体的结合, 以及抗药抗体介导的消除等[21]。而在水解肽的水平进行量化时, 肽序列仅部分体现蛋白质的信息, 丢失关于碳水化合物转化和抗药抗体相互作用的信息等。
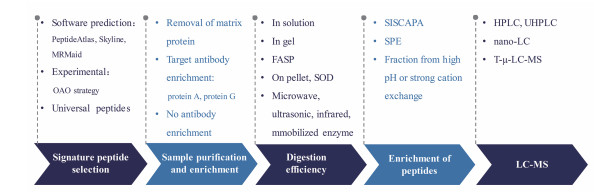
2 抗体LC-MS分析面临的挑战与对策LC-MS技术的出现为LBA固有的缺点提供了良好的替代或补充方案[22, 23], 然而LC-MS方法的广泛应用也受到了一定的限制。对于一些已经具有验证过的工业级LBA方法的生物药物, 可以通过相对简单的LBA实现灵敏且高通量的测定, 因此LBA仍然是这些目标药物的首选策略。尽管LC-MS的优点突出, 但是同时兼具灵敏度、选择性、高通量和重现性的优化分析策略通常较难实现。例如, 虽然已经开发了低流速LC-MS (如nano LC-MS)和免疫亲和(IA)-LC/MS来提高灵敏度, 但代价是降低了重现性和分析通量。本节以下部分将按照实验流程来讨论LC-MS法测定抗体药物时遇到的挑战, 以及研究者们应对这些挑战所做的探索(总结见图 2)。
|
图 2 General workflow for LC-MS quantification of antibody drugs in biomatrices and the summary of recent technical advances improving the performances |
在水解肽水平的分析中, 最重要的第一步就是选择最优的特征性多肽, 作为目标抗体的替代分析物, 以确保定量的灵敏、特异和可重复。替代肽段的选择要求一般是, 特异性高, 选择性好, 灵敏度高, 稳定性好且长度适宜。在酶解得到的众多肽段混合物中选择最佳的特征性多肽, 并不是一件简单的事情, 也是方法开发中最耗时的部分。
为了满足这一需求, 在过去的几年中已经建立了许多电子预测和实验方法, 或两者的组合。通过蛋白分析软件可以对目标蛋白产生的肽段进行预测。目前普遍使用的有PeptideAtlas、Skyline和MRMaid等工具, 将目标分析物的序列信息输入, 即可以用最少的实验来识别和验证离子对[24, 25]。这些方法大大加快和简化了方法开发过程, 然而并不能准确地预测最灵敏、最稳定的肽或与基质相关的参数, 例如可能存在的化学干扰。显然, 通过在实际的基质样品中的酶解实验来选择最佳替代肽段是最可靠的方法。然而, 为了评估混合体系中的候选肽段, 需要为这些肽段都进行质谱条件的优化, 包括最优的离子对, 最优的碰撞能量, 这无疑很具有挑战性。此外, 还需要重视肽段的稳定性, 以防止由于肽稳定性差而引起的变异和偏差。
为了解决这些问题, 有学者设计了一种以实验为基础的流程来促进快速的方法开发[26, 27]。在这种方式下, 首先以实际的酶解实验为基础, 来发现和优化候选肽段, 然后在目标基质中进行评估, 最后确定替代肽段。这个流程包括:①首先通过数据依赖的LC-MS实验产生候选肽段, 以去除含有不稳定氨基酸的多肽、有修饰的多肽或实际上不发生裂解的片段[28]; ②所有候选肽段的最佳LC-MS条件可以通过高通量的动态正交阵列优化(OAO)过程准确地获得, OAO有能力在单个LC-MS运行中开发用于100个候选肽段的SRM条件, 具有高精确度和高重现性; ③确定LC-MS条件后, 在酶解后的基质体系中对所有候选肽段的稳定性和灵敏度进行了彻底的评估; ④在稳定的多肽中, 筛选出两个S/N最高的多肽作为替代肽段, 来自同一蛋白不同结构域的两个SP的使用为定量方法和结果的可靠性提供了一个通用的衡量标准。Duan等[11]将这个流程应用于临床前小鼠多种组织中两种单抗mAb (8c2和cT84.66)的定量(图 1中举例说明方法参数的优化过程), 对8c2的定量选取了重链上的ATIIT DTSSNK和轻链上的TLADGVPSR片段, 对cT84.66的定量选取了重链上的QRPEQGLEWIGR和轻链上的ASNLESGIPVR片段。在不同组织中, 这两个单抗的检测限为0.156~0.312 μg·mL-1, 具有较高的灵敏度。
在对肽段进行稳定性考察这一点上, 笔者认为可以通过在方法开发阶段提高酶反应条件, 如延长反应时间和升高反应温度, 来缩短肽段筛选所需要的时间。即在一开始就用比较剧烈的条件来产生肽段, 这样得到的肽段总数虽然会减少, 但是有利于减少后面优化的工作量, 提高开发效率。在抗CD47单抗SHR-1603的定量研究[29]中, 替代肽段选择阶段将酶解温度升高至60℃并有意延长反应时间, 最终选取的LLIYSGST LQSGVPSR肽段具有很高的稳定性。
除了针对每个抗体药物所特有的序列, Furlong等[30]指出, 可以将从人源抗体的恒定Fc区衍生的"通用肽" (轻链上的TV AAPSVFIFPPSDEQLK和重链上的VVSVLTVLHQDWLNGK), 用于在非人类动物模型中定量人源化的抗体(IgG4亚型), 加快方法开发, 促进临床前动物模型中人源化抗体的研究。
2.2 样品制备如上所述, 灵敏度不足是LC-MS定量抗体最突出的挑战之一。在大多数情况下, 传统的LC-MS灵敏度不及成熟的LBA方法。为了实现LC-MS灵敏和准确的定量, 高效和可重复的样品制备至关重要, 样品制备的优化主要在于样品的纯化与富集, 抗体和肽段稳定高效的回收[31]。
2.2.1 样品的纯化与富集提高灵敏度的最有效方法之一是优先增加生物样品中目标抗体的相对浓度。这主要可以通过两个方向来实现:基质蛋白的去除和目标抗体的富集, 富集在酶解前(蛋白质水平)和酶解后(肽段水平)都可以进行。
酶解之前去除样品中的高丰度的蛋白可以显著增加灵敏度, 不仅增加了样品中目标抗体的含量, 而且也有利于接下来酶解效率的提高, 去除基质干扰, 改善LC-MS分析。这种方法当前主要应用于血浆和血清样品。Shi等[32]建立了串联IgY14-SuperMix耗竭方法, 去除了14个高丰度和60个中丰度的血浆蛋白质, 以便能够分析人血浆中的低丰度蛋白质。Liu等[33]建立了一种简单且具有成本效益的方法, 通过异丙醇和三氯乙酸的混合物沉淀从血浆样品中去除白蛋白, 在此研究中成功地去除了血浆中的白蛋白, 同时保留了靶向治疗蛋白(BMS-C), 将敏感度提高了4~5倍。
亲和富集后的LC-MS分析也是提高灵敏度的有效途径。基于这种原则已经开发了相当多的方法, 这里举例说明几个典型的研究。Dubois等[34]在LC-MS检测之前使用一种特定抗体从人血浆中捕获西妥昔单抗, 可以获得与ELISA方法匹敌的检测限。Li等[12]通过免疫捕获的方式, 实现了对4个IgG1和4个IgG2 mAb的高灵敏度分析。虽然这样的策略有时被称为"杂交LBA-LC-MS", 但与单纯的LBA方法不同的是, 因为下游LC-MS具有高选择性, 此处所选用的亲和捕获试剂不需要具有高选择性(如蛋白A或蛋白G)。因此, 与传统的LBA方法相比, 方法开发需要的成本更低、时间更少。Xu等[35]曾报道过一种免疫捕获的LC-MS方法, 该方法使用捕获试剂成功地定量了人血清中的mAb, 然而同样的试剂在LBA中却不起作用。
尽管蛋白水平的富集可以提高分析灵敏度, 但同时也可能引入偏差和变异, 除非在富集之前加入稳定同位素标记(SIL)的全长蛋白内标。但是SIL蛋白的生产成本很高, 当前没有被广泛应用开来。相较之下, 如果在肽水平上进行富集, SIL的肽段很容易获得, 且可以在富集之前加入。这项技术的一个重要范例是Anderson等[36]开发的"稳定同位素标准和抗肽抗体捕获" (SISCAPA), 使用抗肽抗体来富集酶解之后得到的目标肽段, 研究者之后的几个应用研究也证明了该技术显著提高了灵敏度。尽管肽段的IA富集具有以上优势, 但是由于肽的免疫原性低, 获得有效的抗肽抗体通常比较难[37]。
目前, 无抗体的富集方法也在开发中。其中一种方法是用高pH或强阳离子交换色谱进行分离[38]。虽然可以显著提高灵敏度, 但需要构建更加有力的HPLC分离系统, 限制了通量。Yuan等[39]通过固相萃取(SPE)增加目标肽的丰度。An等[40]则开发了一种利用连续的强阳离子交换和高pH-反相作用, 在同一个SPE柱上进行分离的双重富集方法, 该方法将灵敏度提高了>20倍。
2.2.2 提高酶解效率通过酶解从目标抗体中实现肽段的稳定高回收也是提高灵敏度的重要方式。传统方法的酶解方式包括:溶液内酶解, 凝胶电泳后胶内酶解和过滤辅助样品制备(FASP)。溶液内酶解操作简单, 但是杂质多, 需要后续的清除, 且经常导致肽的损失[41]; 凝胶电泳可以有效地去除基质成分, 然而过程相对比较费力和耗时, 影响通量[42]; 过滤辅助样品制备虽然可以滤去小分子基质成分, 但是无法去除潜在的干扰, 过滤过程也容易导致肽段回收率低[43]。
Duan等[11]开发了一种不需要进行凝胶电泳和过滤操作的方法, 实现了有效的蛋白质变性和样品纯化, 提高了血浆和组织样品中定量肽的产率。简而言之, 首先用高浓度的洗涤剂处理血浆或组织样品, 其不仅有效地增溶样品中的蛋白质以确保高回收率, 而且也是之后蛋白质完全变性以实现有效的还原、烷基化和消化的基础; 然后用冰冷的有机溶剂沉淀混合物, 充分沉淀之后离心并去掉上清液, 只留蛋白沉淀的部分。这有效地减少了非蛋白基质成分, 如脂质或小分子核酸这些可能会对LC-MS分析产生负面影响的成分。沉淀后, 采用颗粒内酶解的方法, 这种方法包括两个阶段:在剧烈的搅拌下, 通过将颗粒蛋白裂解成可溶性的较大的多肽, 这步酶解将蛋白颗粒带入了溶液中; 第二步则将这些不完全裂解的多肽进行隔夜酶解以进行完全的切割。通过这种方式, 研究者认为提供了比在样品基质溶液中直接酶解更高的酶解效率和更干净的样品, 同时提供比凝胶内酶解和过滤辅助样品制备方法更高和更可重复性的肽产率。因此, 该方法可用于血浆和组织中mAb的高通量定量, 具有良好的分析灵敏度和耐用性。最近该实验室在此基础上进行改进[44], 设计了一种优化的表面活性剂辅助沉淀/on-pellet-digestion程序(SOD), 通过快速酶解提供高产和可重复的肽回收。经过改进表面活性剂的广泛变性和沉淀, 37℃下仅45 min便能完成mAb的完全酶解。
传统过夜的酶解比较耗时, 影响分析效率, 市场上已经有更多的技术来加快酶解速度, 例如在微波[45]、超声波和红外辐射[46]的协助下酶解, 以及使用固定化胰蛋白酶加速消化[47]。一些使用固定化胰蛋白酶的产品已经在商业上可以获得, 但是这些新技术的性能仍有待广泛评估。
2.3 低流速LC的应用抗体的LC-MS分析, 在常规液相如HPLC和UHPLC可以实现, 但是分离不足容易受到基质干扰, 灵敏度受到限制, 而利用低流速LC通常会增加LC-MS定量的灵敏度[48]。对于抗体的液质分析, ESI是质谱最常用的接口, 这是一种浓度依赖的检测器, 低流速LC可以通过增加峰浓度和电离效率有效的提高信号强度。
Liu等[49]建立了低流量LC-MS方法, 以50 μL·min-1的流速, 结合亲和富集, 实现了猴血清中重组mAb的灵敏定量。与常规液相比, nano LC可以将LOQ降低30~50倍。Duan等[50]应用nano LC-MS, 以250 nL·min-1的流速在血浆和组织样品中获得了3.2 ng·mL-1的检测下限, 该方法应用于临床前小鼠模型中的cT84.66, 一种嵌合的抗CEA抗体的定量。然而由于nano LC样品负载能力有限, 一般还需要结合凝胶电泳或亲和富集的样品前处理, 以确保稳定分析。为了应对这种情况, Zhang等[51]开发了一种捕集-微流液相-质谱(T-μ-LC-MS)方法, 能够在不超过系统容量的情况下加载大量生物样品。通过选择性的捕获-传递方式, 消除了大多数疏水性和亲水性的基质干扰, 并在下游的微流液相色谱-质谱分析之前浓缩了目标峰。该方法简单明了, 并且实现了可与nano LC-MS相媲美的高灵敏度, 同时兼具与常规流动LC/MS相当的稳定性和通量。研究中对血浆和组织中10种生物药物和生物标志物进行了定量, 每次分析用时为8 min, 与常规LC-MS相比, 灵敏度提高25倍, 分析比nano LC更加稳定(连续进样>1 500次), 可以满足高灵敏大规模的检测要求。
2.4 准确度血浆和组织中药物浓度的正确测量对于抗体药物的研究和发展是必不可少的, 因此定量方法必须有较高的准确度。前文中提到, 当前稳定同位素标记的肽段作为内标(SIL-IS)广泛用于LC-MS定量抗体, 可以大大提高分析的重现性, 在肽段水平可以直接开发方法, 并且SIL标记的肽段可以很容易从商业来源获得。
然而, 当肽段直接用于建立标准曲线时, 并不能保证定量的准确性。将合成的替代肽段作为标准样品, 仅仅解决了LC-MS部分引起的误差, 而不能监控上游步骤, 如样品制备和酶解。Duan等[50]的研究发现, 肽校准法方法开发过程中显示出了严重的负偏差。同样地, 即使Neubert等[52, 53]引入了延伸肽的校正方法(延伸肽包含SIL肽和从N-末端和C-末端延伸的3~6个氨基酸残基), 当定量分子量达到100 kD以上的抗体时, 仍然会导致相当大的负偏差[26]。将SIL全长蛋白质作为IS, 并将蛋白配制为标准样品的校准方法, 理论上可以纠正所有样品前处理和质谱分析中的误差, 然而, SIL全长蛋白的生产成本很高, 而且对于种类繁多的蛋白质来说也是不切实际的。
鉴于此, 有研究者提出了使用"混合"校准策略精确定量血浆和组织中的调节蛋白和蛋白质药物:即目标蛋白直接配制成标准样品, 而使用SIL肽或者SIL延伸肽作为内标的混合校准方法。Nouri-Nigjeh等[26]的研究证明, 只要样品制备过程高度可重复, 混合校准策略就可以实现准确的定量(与全长蛋白校准方法相比, 偏差在10%以内), 可作为蛋白水平校准一种高效益的替代方法。
3 LC-MS技术在抗体药物生物分析中的实例在过去的十几年中, LC-MS法定量抗体的研究蓬勃发展, 本节将介绍一些有代表性的实例。
3.1 血清/血浆中抗体的药动学(PK)研究LC-MS法已被广泛应用于血浆/血清中mAb的定量, 以支持临床前和临床PK研究。Hagman等[54]开发了LC-MS方法来定量食蟹猴血清和人血清中的模型抗体药物。通过前处理将25 μL血清样品中约50%的血清总蛋白去除, 人和食蟹猴样品中模型抗体的定量下限均可以达到2 μg·mL-1。Ouyang等[15]则将颗粒内酶解与LC-MS相结合, 用于猴子血浆中mAb候选药物的分析。
除此之外, 也有学者通过建立不同的LC-MS法或LBA法来检测同样的抗体样品, 对不同的分析方法进行全面的比较。例如Lu等[55]分别采用白蛋白耗竭、蛋白A捕获和抗体捕获3种前处理方式, 对mAb候选物CNTO736进行LC-MS定量。他们所得到的结论是这3种方法都为PK研究提供了足够的灵敏度。Fernández Oca a等[10]建立了LC-MS方法定量人血清中的游离和总的抗MADCAM单抗, 游离mAb由生物素化的抗独特型抗体捕获, 用链霉亲和素磁珠富集, 总mAb则通过蛋白G磁珠富集。
本实验室最近建立了一种LBA分析方法和两种与不同前处理相结合的LC-MS方法[29], 首次对大鼠和食蟹猴血清中抗CD47的mAb候选药物(SHR-1603)进行定量。其中, LBA法所使用的是MSD电化学发光仪器, 通过形成"CD47-单抗药物-标记性二抗"复合物, 检测完整的单抗药物, 测定范围19.5 ng·mL-1~10 μg·mL-1。LC-MS法则使用了两种不同的前处理方式:沉淀颗粒内酶解, 用有机溶剂提取目标抗体, 然后对其进行酶解, 测定范围250 ng·mL-1~500 μg·mL-1; 磁珠亲和富集后酶解, 用抗原CD47包被的磁珠对样品中的目标抗体进行免疫亲和富集, 并在磁珠上完成后续的酶解, 最后都用同样的质谱分析方法来检测特征性替代肽段, 测定范围为100 ng·mL-1~100 μg·mL-1。3种方法都成功应用于临床前PK研究, 最后获得了有显著差异的PK曲线(图 3)。该研究表明3种方法获得的药物浓度在低剂量组中显示出很好的一致性(药物暴露率的比值在1.05~1.11), 而在中剂量和高剂量组中, 使用LC-MS方法测得的药物浓度高于通过ECL方法获得的药物浓度, 这可能是由于所测的抗体形式不同(游离mAb和总mAb)。LC-MS方法对于SHR-1603的PK评估显示出较高的准确性、分析效率和成本效益。

|
图 3 The profiles of mean serum concentrations of SHR-1603 vs time after intravenous injection for both rats and cynomolgus monkeys. (Method 1 stands for the MSD-ECL method, method 2 stands for the straight LC-MS/MS method, method 3 stands for the IA-LC-MS/MS method. A, B, and C are respectively of 10, 30, 90 mg·kg-1 dosage group of rats; D, E, and F are respectively of 5, 15, 45 mg·kg-1 dosage group of cynomolgus monkeys). n =6[29] |
如前文所述, 免疫亲和富集与LC-MS相结合的杂交分析方法, 可以提高抗体定量的灵敏度。这种方法也有助于测量生物基质中除抗体以外的靶标。比如通过将抗体药物本身作为捕获抗体, 用于定量猴和人血浆中存在治疗蛋白的抗药抗体。此外, LBA也可以与LC-MS平行使用, 例如, LBA和LC-MS已经被应用于在抗体偶联药物(ADC)的生物分析中, 测定ADC药物的药物抗体比(DAR)[56]。ADC药物通过mAb的靶向作用, 特异地传递所携带的小分子药物。DAR和药物负荷分布是决定ADC体内疗效和毒性的关键参数, DAR的微小变化会导致靶向部位暴露量的显著变化。Xu等[57]建立了检测一种ADC药物的亲和富集结合LC-MS的分析方法, 成功测量了体外和体内的DAR。
尽管在过去的十几年中, LC-MS法定量抗体的研究蓬勃发展, 但用此方法获得临床PK数据并提交新药研究申请和生物制品许可申请的例子非常少[58]。抗体药物的生物分析试验必须得到验证, 以满足监管的要求。蛋白药物的LC-MS分析应该遵循监管指南的哪些部分, 这一点在2018年FDA颁布的《工业用生物分析方法验证指南》中还未明确[59]。美国药学科学家协会(AAPS)生物分析组的蛋白质LC-MS生物分析小组, 在2015年首次提出在蛋白质LC-MS生物分析方法验证过程中应该评估的方法参数和验收标准, 为蛋白质LC-MS生物分析方法的验证提供一些基本原则[60]。该白皮书侧重的是使用酶解得到替代肽的LC-MS方法, 旨在支持非临床毒代动力学和临床药代动力学研究。该白皮书认为, 由于大蛋白(如抗体)分析的复杂性以及与LBA的结合, LC-MS分析蛋白的接受标准相对于小分子LC-MS应该适当放宽, 验证精密度和准确度应设为20% (LLOQ为25%)。
3.2 组织中抗体的分布研究抗体在组织中的分布情况, 对于评估抗体药物的安全性和有效性有重要意义。尽管LC-MS法已被广泛应用于血浆/血清中mAb的定量, 组织中的mAb定量工作却较少被报道。与在血浆/血清中直接定量相比, 组织样品需要额外的前处理, 开发组织样品提取、清理和酶解的最佳方式。由于抗体的分布容积小, 组织内抗体浓度比体循环普遍低(除非组织抗原的富集), 组织中的残余血液会对定量产生较大干扰, 而有效的清除往往又会导致组织内抗体的损失。Duan等[11]使用nano LC-MS、有效的样品制备和高通量肽段优化策略, 对小鼠7个组织中的两个mAb (8c2和cT84.66)进行定量, 其LOQ为0.156~0.312 μg·g-1组织, 该方法用于评估长期多剂量给药后稳态下mAb的组织分布。
3.3 盒式给药如前所述, LC-MS能够同时定量多个靶蛋白, 因此能对候选药物进行盒式给药研究。对同一组动物注射多种药物的盒式剂量可以极大地减少动物的用量, 提高临床前研究的效率和速度。盒式给药已被普遍用于筛选小分子药物, 现在发现它更适合于候选mAb的初步研究。这是因为多个mAb的研究通常不会带来药物-药物相互作用的风险, 蛋白质的PK不受CYP450和转运蛋白的影响; 且找到多个mAb的最佳的共同配方是相当简单的。Jiang等[13]开发并验证了LC-MS方法同时定量两个共给药的mAb, 该方法对两个靶标都有良好的灵敏度、重现性和准确性。该方法应用于猴体内的毒代动力学研究, LC-MS获得的PK图谱与通过对每个抗体进行单独的LBA分析获得的PK图谱高度吻合。Li等[61]在皮下注射盒式给药的研究中, 血浆中的LOQ为0.1~0.5 μg·mL-1, 该方法在一次研究中可获得4个mAb的PK参数。
4 总结与展望近年来, LC-MS已成为一种强大的抗体分析方法, 广泛地用于定量生物基质中的抗体药物。LC-MS技术是传统LBA的一种很有前景的替代或补充方法, 可以很容易地适应不同种属的不同基质; 具有高特异性和高重现性; 不依赖于关键试剂; 能够在一次分析中同时定量多个蛋白质。此外, LC-MS方法的开发和验证速度快, 成本相对较低, 可以有力地促进药物快速发展。在过去的十几年中, 结合多种先进的样品制备、色谱和质谱技术, LC-MS法定量抗体的研究蓬勃发展, 极大地促进了抗体药物的临床前和临床研究。虽然抗体药物的LC-MS分析仍面临方法开发、样品制备、灵敏度和定量准确性等方面的挑战, 但新的技术正不断涌现来克服这些难题。例如, 已经开发了低流速LC-MS (如nano LC-MS)和免疫亲和(IA)-LC/MS来提高灵敏度; 稳定而高效的样品制备方法也正在涌现; 混合校准方法可以保证分析的准确度和成本效益。
除了杂交LBA-LC-MS, 未来的趋势是各种生化技术与LC-MS的结合。为了在高度复杂的生物系统中获取药物的关键信息, 例如药物的游离与结合、免疫复合物、代谢和分解产物以及修饰形式, LBA、凝胶电泳、亲和色谱等都可以与LC-MS耦合, 以提高对抗体的检测能力。LC-MS法定量抗体的新技术将持续快速发展, 包括但不限于新的样品制备、液相色谱分离和质谱技术, 并更广泛地应用于抗体药物的研发进程中。
| [1] |
Kaplon H, Reichert JM. Antibodies to watch in 2019[J]. Mabs, 2019, 11: 219-238. DOI:10.1080/19420862.2018.1556465 |
| [2] |
Lindsley CW. New 2016 data and statistics for global pharmaceutical products and projections through 2017[J]. ACS Chem Neurosci, 2017, 8: 1635-1636. DOI:10.1021/acschemneuro.7b00253 |
| [3] |
Guo JJ, Wang LL, Zhang Q, et al. Advances in pharmacokinetics of monoclonal antibody drugs[J]. Chin Pharmacol Bull (中国药理学通报), 2016, 32: 29-33. |
| [4] |
Ezan E, Bitsch F. Critical comparison of MS and immunoassays for the bioanalysis of therapeutic antibodies[J]. Bioanalysis, 2009, 1: 1375-1388. DOI:10.4155/bio.09.121 |
| [5] |
Hoofnagle AN, Wener MH. The fundamental flaws of immunoassays and potential solutions using tandem mass spectrometry[J]. J Immunol Methods, 2009, 347: 3-11. DOI:10.1016/j.jim.2009.06.003 |
| [6] |
An B, Zhang M, Qu J. Toward sensitive and accurate analysis of antibody biotherapeutics by liquid chromatography coupled with mass spectrometry[J]. Drug Metab Dispos, 2014, 42: 1858-1866. DOI:10.1124/dmd.114.058917 |
| [7] |
Qu M, An B, Shen S, et al. Qualitative and quantitative characterization of protein biotherapeutics with liquid chromatography mass spectrometry[J]. Mass Spectrom Rev, 2017, 36: 734-754. DOI:10.1002/mas.21500 |
| [8] |
Damen CW, Schellens JH, Beijnen JH. Bioanalytical methods for the quantification of therapeutic monoclonal antibodies and their application in clinical pharmacokinetic studies[J]. Hum Antibodies, 2009, 18: 47-73. DOI:10.3233/HAB-2009-0206 |
| [9] |
Savoie N, Garofolo F, van Amsterdam P, et al. 2010 white paper on recent issues in regulated bioanalysis & global harmonization of bioanalytical guidance[J]. Bioanalysis, 2010, 2: 1945-1960. DOI:10.4155/bio.10.164 |
| [10] |
Fernández Oca a M, James IT, Kabir M, et al. Clinical pharmacokinetic assessment of an anti-MAdCAM monoclonal antibody therapeutic by LC-MS/MS[J]. Anal Chem, 2012, 84: 5959-5967. DOI:10.1021/ac300600f |
| [11] |
Duan X, Abuqayyas L, Dai L, et al. High-throughput method development for sensitive, accurate, and reproducible quantification of therapeutic monoclonal antibodies in tissues using orthogonal array optimization and nano liquid chromatography/selected reaction monitoring mass spectrometry[J]. Anal Chem, 2012, 84: 4373-4382. DOI:10.1021/ac2034166 |
| [12] |
Li H, Ortiz R, Tran L, et al. General LC-MS/MS method approach to quantify therapeutic monoclonal antibodies using a common whole antibody internal standard with application to preclinical studies[J]. Anal Chem, 2012, 84: 1267-1273. DOI:10.1021/ac202792n |
| [13] |
Jiang H, Zeng J, Titsch C, et al. Fully validated LC-MS/MS assay for the simultaneous quantitation of coadministered therapeutic antibodies in cynomolgus monkey serum[J]. Anal Chem, 2013, 85: 9859-9867. DOI:10.1021/ac402420v |
| [14] |
Huang L, Lu J, Wroblewski VJ, et al. In vivo deamidation characterization of monoclonal antibody by LC/MS/MS[J]. Anal Chem, 2005, 77: 1432-1439. DOI:10.1021/ac0494174 |
| [15] |
Wu ST, Ouyang Z, Olah TV, et al. A strategy for liquid chromatography/tandem mass spectrometry based quantitation of pegylated protein drugs in plasma using plasma protein precipitation with water-miscible organic solvents and subsequent trypsin digestion to generate surrogate peptides for detection[J]. Rapid Commun Mass Spectrom, 2011, 25: 281-290. DOI:10.1002/rcm.4856 |
| [16] |
Zhang LY, Vasicek LA, Suchun H, et al. Top-down LC-MS quantitation of intact denatured and native monoclonal antibodies in biological samples[J]. Bioanalysis, 2018, 10: 1039-1054. DOI:10.4155/bio-2017-0282 |
| [17] |
Rago B, Clark T, King L, et al. Calculated conjugated payload from immunoassay and LC-MS intact protein analysis measurements of antibody-drug conjugate[J]. Bioanalysis, 2016, 8: 2205-2217. DOI:10.4155/bio-2016-0160 |
| [18] |
Duncan MW, Aebersold R, Caprioli RM. The pros and cons of peptide-centric proteomics[J]. Nat Biotechnol, 2010, 28: 659-664. DOI:10.1038/nbt0710-659 |
| [19] |
Qu J, Straubinger RM. Improved sensitivity for quantification of proteins using triply charged cleavable isotope-coded affinity tag peptides[J]. Rapid Commun Mass Spectrom, 2005, 19: 2857-2864. DOI:10.1002/rcm.2138 |
| [20] |
Vasicek LA, Spellman DS, Hseih SC, et al. Quantitation of a therapeutic antibody in serum using intact sequential affinity capture, trypsin digestion and LC-MS/MS[J]. Anal Chem, 2017, 90: 866-871. |
| [21] |
Ezan E. Pharmacokinetic studies of protein drugs:past, present and future[J]. Adv Drug Deliv Rev, 2013, 65: 1065-1073. DOI:10.1016/j.addr.2013.03.007 |
| [22] |
Fung EN, Bryan P, Kozhich A. Techniques for quantitative LC-MS/MS analysis of protein therapeutics:advances in enzyme digestion and immunocapture[J]. Bioanalysis, 2016, 8: 847-856. DOI:10.4155/bio.16.24 |
| [23] |
Wang H, Drake SK, Youn JH, et al. Peptide markers for rapid detection of KPC carbapenemase by LC-MS/MS[J]. Sci Rep, 2017, 7: 2531-2540. DOI:10.1038/s41598-017-02749-2 |
| [24] |
Cham Mead JA, Bianco L, Bessant C. Free computational resources for designing selected reaction monitoring transitions[J]. Proteomics, 2010, 10: 1106-1126. DOI:10.1002/pmic.200900396 |
| [25] |
Stergachis AB, MacLean B, Lee K, et al. Rapid empirical discovery of optimal peptides for targeted proteomics[J]. Nat Methods, 2011, 8: 1041-1043. DOI:10.1038/nmeth.1770 |
| [26] |
Nouri-Nigjeh E, Zhang M, Ji T, et al. Effects of calibration approaches on the accuracy for LC-MS targeted quantification of therapeutic protein[J]. Anal Chem, 2014, 86: 3575-3584. DOI:10.1021/ac5001477 |
| [27] |
Keshishian H, Addona T, Burgess M, et al. Quantitative, multiplexed assays for low abundance proteins in plasma by targeted mass spectrometry and stable isotope dilution[J]. Mol Cell Proteomics, 2007, 6: 2212-2229. DOI:10.1074/mcp.M700354-MCP200 |
| [28] |
Picotti P, Bodenmiller B, Mueller LN, et al. Full dynamic range proteome analysis of S. cerevisiae by targeted proteomics[J]. Cell, 2009, 138: 795-806. DOI:10.1016/j.cell.2009.05.051 |
| [29] |
Gao YX, Zhang D, Yang CY, et al. Two validated liquid chromatography-mass spectrometry methods with different pretreatments for the quantification of an anti-CD47 monoclonal antibody in rat and cynomolgus monkey serum compared with an electrochemiluminescence method[J]. J Pharm Biomed Anal, 2019, 175: 112792. DOI:10.1016/j.jpba.2019.112792 |
| [30] |
Furlong MT, Ouyang Z, Wu S, et al. A universal surrogate peptide to enable LC-MS/MS bioanalysis of a diversity of human monoclonal antibody and human Fc-fusion protein drug candidates in pre-clinical animal studies[J]. Biomed Chromatogr, 2012, 26: 1024-1032. |
| [31] |
Qu J, Jusko WJ, Straubinger RM. Utility of cleavable isotope-coded affinity-tagged reagents for quantification of low-copy proteins induced by methylprednisolone using liquid chromatography/tandem mass spectrometry[J]. Anal Chem, 2006, 78: 4543-4552. DOI:10.1021/ac0521697 |
| [32] |
Shi T, Zhou JY, Gritsenko MA, et al. IgY14 and supermix immunoaffinity separations coupled with liquid chromatography-mass spectrometry for human plasma proteomics biomarker discovery[J]. Methods, 2012, 56: 246-253. DOI:10.1016/j.ymeth.2011.09.001 |
| [33] |
Liu G, Zhao Y, Angeles A, et al. A novel and cost effective method of removing excess albumin from plasma/serum samples and its impacts on LC-MS/MS bioanalysis of therapeutic proteins[J]. Anal Chem, 2014, 86: 8336-8343. DOI:10.1021/ac501837t |
| [34] |
Dubois M, Fenaille F, Clement G, et al. Immunopurification and mass spectrometric quantification of the active form of a chimeric therapeutic antibody in human serum[J]. Anal Chem, 2008, 80: 1737-1745. DOI:10.1021/ac7021234 |
| [35] |
Xu K, Liu L, Maia M, et al. A multiplexed hybrid LC-MS/MS pharmacokinetic assay to measure two co-administered monoclonal antibodies in a clinical study[J]. Bioanalysis, 2014, 6: 1781-1794. DOI:10.4155/bio.14.142 |
| [36] |
Anderson NL, Anderson NG, Haines LR, et al. Mass spectrometric quantitation of peptides and proteins using stable isotope standards and capture by anti-peptide antibodies (SISCAPA)[J]. J Proteome Res, 2004, 3: 235-244. DOI:10.1021/pr034086h |
| [37] |
Shen JX, Liu G, Zhao Y. Strategies for improving sensitivity and selectivity for the quantitation of biotherapeutics in biological matrix using LC-MS/MS[J]. Expert Rev Proteomics, 2015, 12: 125-131. DOI:10.1586/14789450.2015.1024225 |
| [38] |
Betancourt LH, De Bock PJ, Staes A, et al. SCX charge state selective separation of tryptic peptides combined with 2D-RP-HPLC allows for detailed proteome mapping[J]. J Proteomics, 2013, 91: 164-171. DOI:10.1016/j.jprot.2013.06.033 |
| [39] |
Yuan L, Aubry AF, Arnold ME, et al. Systematic investigation of orthogonal SPE sample preparation for the LC-MS/MS bioanalysis of a monoclonal antibody after pellet digestion[J]. Bioanalysis, 2013, 5: 2379-2391. DOI:10.4155/bio.13.224 |
| [40] |
An B, Zhang M, Q uY, et al. High-throughput, sensitive LC-MS quantification of biotherapeutics and biomarkers using antibody-free, peptide-level, multiple-mechanism enrichment via strategic regulation of pH and ionic and solvent strengths[J]. Anal Chem, 2019, 91: 3475-3483. DOI:10.1021/acs.analchem.8b05046 |
| [41] |
Olsen JV, Blagoev B, Gnad F, et al. Global, in vivo, and site-specific phosphorylation dynamics in signaling networks[J]. Cell, 2006, 127: 635-648. DOI:10.1016/j.cell.2006.09.026 |
| [42] |
Manza LL, Stamer SL, Ham AJ, et al. Sample preparation and digestion for proteomic analyses using spin filters[J]. Proteomics, 2005, 5: 1742-1745. DOI:10.1002/pmic.200401063 |
| [43] |
Wisniewski JR, Zougman A, Nagaraj N, et al. Universal sample preparation method for proteome analysis[J]. Nat Methods, 2009, 6: 359-362. DOI:10.1038/nmeth.1322 |
| [44] |
An B, Zhang M, Johnson RW, et al. Surfactant-aided precipitation/on-pellet-digestion (SOD) procedure provides robust and rapid sample preparation for reproducible, accurate and sensitive LC/MS quantification of therapeutic protein in plasma and tissues[J]. Anal Chem, 2015, 87: 4023-4029. DOI:10.1021/acs.analchem.5b00350 |
| [45] |
Lesur A, Varesio E, Hopfgartner G. Accelerated tryptic digestion for the analysis of biopharmaceutical monoclonal antibodies in plasma by liquid chromatography with tandem mass spectrometric detection[J]. J Chromatogr A, 2010, 1217: 57-64. DOI:10.1016/j.chroma.2009.11.011 |
| [46] |
Wang S, Zhang L, Yang P, et al. Infrared-assisted tryptic proteolysis for peptide mapping[J]. Proteomics, 2008, 8: 2579-2582. DOI:10.1002/pmic.200800086 |
| [47] |
Krenkova J, Lacher NA, Svec F. Highly efficient enzyme reactors containing trypsin and endoproteinase LysC immobilized on porous polymer monolith coupled to MS suitable for analysis of antibodies[J]. Anal Chem, 2009, 81: 2004-2012. DOI:10.1021/ac8026564 |
| [48] |
Arnold DW, Needham SR. Micro-LC-MS/MS:the future of bioanalysis[J]. Bioanalysis, 2013, 5: 1329-1331. DOI:10.4155/bio.13.31 |
| [49] |
Liu H, Manuilov AV, Chumsae C, et al. Quantitation of a recombinant monoclonal antibody in monkey serum by liquid chromatography-mass spectrometry[J]. Anal Biochem, 2011, 414: 147-153. DOI:10.1016/j.ab.2011.03.004 |
| [50] |
Duan XT, Dai L, Chen SC, et al. Nano-scale liquid chromatography/mass spectrometry and on-the-fly orthogonal array optimization for quantification of therapeutic monoclonal antibodies and the application in preclinical analysis[J]. J Chromatogr A, 2012, 1251: 63-73. DOI:10.1016/j.chroma.2012.06.007 |
| [51] |
Zhang M, An B, Qu Y, et al. A sensitive, high-throughput and robust trapping micro-LC-MS strategy for quantification of biomarkers and antibody biotherapeutics[J]. Anal Chem, 2018, 90: 1870-1880. DOI:10.1021/acs.analchem.7b03949 |
| [52] |
Neubert H, Muirhead D, Kabir M, et al. Sequential protein and peptide immunoaffinity capture for mass spectrometry-based quantification of total human b-nerve growth factor[J]. Anal Chem, 2013, 85: 1719-1726. DOI:10.1021/ac303031q |
| [53] |
Palandra J, Finelli A, Zhu M, et al. Highly specific and sensitive measurements of human and monkey interleukin 21 using sequential protein and tryptic peptide immunoaffinity LC-MS/MS[J]. Anal Chem, 2013, 85: 5522-5529. DOI:10.1021/ac4006765 |
| [54] |
Hagman C, Ricke D, Ewert S, et al. Absolute quantification of monoclonal antibodies in biofluids by liquid chromatography-tandem mass spectrometry[J]. Anal Chem, 2008, 80: 1290-1296. DOI:10.1021/ac702115b |
| [55] |
Lu Q, Zheng X, McIntosh T, et al. Development of different analysis platforms with LC-MS for pharmacokinetic studies of protein drugs[J]. Anal Chem, 2009, 81: 8715-8723. DOI:10.1021/ac901991x |
| [56] |
Kaur S, Xu K, Saad OM, et al. Bioanalytical assay strategies for the development of antibody-drug conjugate biotherapeutics[J]. Bioanalysis, 2013, 5: 201-226. DOI:10.4155/bio.12.299 |
| [57] |
Xu K, Liu L, Saad OM, et al. Characterization of intact antibody-drug conjugates from plasma/serum in vivo by affinity capture capillary liquid chromatography-mass spectrometry[J]. Anal Biochem, 2011, 412: 56-66. DOI:10.1016/j.ab.2011.01.004 |
| [58] |
Neubert H, Olah T, Lee A, et al. 2018 White paper on recent issues in bioanalysis:focus on immunogenicity assays by hybrid LBA/LCMS and regulatory feedback (Part 2-PK, PD & ADA assays by hybrid LBA/LCMS & regulatory agencies' inputs on bioanalysis, biomarkers and immunogenicity)[J]. Bioanalysis, 2015, 7: 3019-3034. DOI:10.4155/bio.15.214 |
| [59] |
FDA. Bioanalytical method validation guidance for industry[S]. MD, USA: 2018[2019-11-19]. https: //www.fda.gov/regulatory-information/search-fda-guidance-documents/bioanalytical-method-validation-guidance-industry.
|
| [60] |
Jenkins R, Duggan JX, Aubry AF, et al. Recommendations for validation of LC-MS/MS bioanalytical methods for protein biotherapeutics[J]. AAPS J, 2015, 17: 1-16. DOI:10.1208/s12248-014-9685-5 |
| [61] |
Li H, Ortiz R, Tran LT, et al. Simultaneous analysis of multiple monoclonal antibody biotherapeutics by LC-MS/MS method in rat plasma following cassette-dosing[J]. AAPS J, 2013, 15: 337-346. DOI:10.1208/s12248-012-9435-5 |
 2020, Vol. 55
2020, Vol. 55


