随着社会经济发展所带来生活方式的改变, 人们的生活压力越来越大, 失眠、抑郁、躁郁等精神问题也越来越突出。2018年, 中国医师协会睡眠医学专业委员会发布了"全球睡眠状况及睡眠认知最新调查数据", 显示全球61%的成年人存在睡眠问题, 我国"90后"超六成睡眠时间不足。近年来, 随着睡眠医学的不断壮大, 睡眠障碍领域也受到了外界越来越多的重视, 新出炉的疾病分类诊断系统ICD-11将"睡眠-觉醒障碍"单独列为一章, 与神经系统疾病及精神行为障碍属于同一级别[1]。
一氧化氮(nitric oxide, NO)是一种内源性生物活性物质, 在机体中广泛存在, 具有脂溶性, 可快速扩散透过生物膜进行信息传递。1998年, 3位科学家Furchgott、Ignarro和Murad由于发现NO是一种可以传递信息的气体, 而荣获诺贝尔医学或生理学奖。近年研究发现, NO参与机体对睡眠觉醒的调节。睡眠剥夺大鼠基底前脑的NO水平显著升高[2]; 感染非洲锥虫病的大鼠会出现嗜睡的现象, 且下丘脑NO含量也显著升高[3]; 敲除神经元型一氧化氮合酶(neuronal nitric oxide synthase, nNOS)小鼠的快动眼睡眠(rapid eye movement, REM)和慢波睡眠(slow-wave sleep, SWS)时间显著缩短[4]; 一氧化氮/不对称二甲基精氨酸/二甲基精氨酸水解酶(NO/ADMA/DDAH)途径与睡眠障碍相关, 连续7天灌胃给予原花青素B2 (15、30和45 mg·kg-1)治疗失眠大鼠, 能够升高大鼠海马、下丘脑和前额叶皮层的NO和nNOS水平, 通过上调NO/ADMA/DDAH信号通路来治疗失眠[5]; 灌胃给予刺五加水醇提取物MS, 可延缓戊四唑、苦毒素、士的宁引起的癫痫发作, 缩短发作时间, 而NOS抑制剂左旋硝基精氨酸(L-NNA)能够拮抗MS的抗惊厥作用[6], 综上可见NO与睡眠觉醒之间息息相关。NO不仅在动物水平上与睡眠觉醒相关, 在人类研究中也有相似的报道。最近, 挪威一项问卷调查研究发现, 工作上暴露于负面行为(例如, 职场欺凌)中的人产生失眠问题的比例比普通人要高。对受试者们进行基因检测, 分析发现miR-146a基因与暴露在负面行为和失眠之间存在间接关系, 其中GG基因型个体比GC/CC基因型个体暴露于负性行为中更易失眠[7]。另一项研究发现miR-146a C等位基因, 能够下调miR-146a基因的表达, 而nNOS是miR-146a基因的直接靶点, miR-146a基因表达下降会增加其目标基因nNOS的表达[8]。nNOS表达低的个体在暴露于消极的社会行为中更容易产生失眠的现象, 这也间接的说明nNOS与睡眠之间有着千丝万缕的联系。
睡眠觉醒分别属于不同的警戒状态, 其中上行网状激活系统能引起以脑电去同步化为特征的"觉醒反应", 如果该结构被破坏, 则会引起嗜睡、昏睡以至昏迷的现象。网状激活系统是位于脑干腹侧中心部分神经细胞和神经纤维相混杂的结构, 该结构有上行投射系统和下行投射系统, 其中上行投射系统接收各种传入冲动, 后经由丘脑的非特异性投射系统到达大脑皮质, 当其受到刺激时, 会观察到自然觉醒或者唤醒现象[9]。因此, 上行网状激活系统的活动与障碍是意识觉醒与昏迷的生理基础。觉醒主要是由脑干和基底前脑的胆碱能和单胺能神经元所介导的, 有两条经典途径:①丘脑是维持觉醒的中枢, 来自脑桥被盖核和背外侧被盖核的胆碱能神经元投射到丘脑, 激活丘脑兴奋性神经元防止进入睡眠模式; ②下丘脑外侧区是促进觉醒的中枢, 来自基底前脑和脑干单胺能神经元投射到下丘脑外侧区, 促进觉醒[10]。NO含量的高低可影响上行网状激活系统神经元的活性, 对睡眠觉醒有着至关重要的调节作用。本文将综述近年来NO在睡眠觉醒方面的研究进展, 进一步阐明NO在睡眠觉醒中的作用, 为睡眠觉醒的研究提供帮助和思路。
1 一氧化氮及一氧化氮合酶NO是一种易产生自由基的无机气体, 在机体内广泛分布, 参与多种生命活动的调控, 在外周和中枢神经系统中都发挥着重要的作用。在心血管系统中, NO可促进环磷酸鸟苷(cyclic guanosine monophosphate, cGMP)和环磷酸腺苷(cyclic adenosine monophosphate, cAMP)合成, 抑制血管平滑肌的增生和舒张血管[11]; 在神经炎症中, 活化的胶质细胞表达诱导型一氧化氮合酶(inducible nitric oxidesynthase, iNOS), 产生NO, NO导致内质网内钙离子的释放, 激活胶质细胞释放谷氨酸, 从而导致神经细胞死亡[12]。目前, 以NO为靶点的药物研究在抗肿瘤、抗炎、抗阿尔兹海默症和保护心血管等方面进展地如火如荼[13]。
20世纪80年代末期发现血管内皮细胞能够将L-精氨酸合成NO作为细胞外信号[14], 但这一发现最初受到大多数生物学家的质疑。然而, 到目前为止, NO的生成途径已经被证实, 它在生物学中的作用也正在被慢慢发现。机体内, L-精氨酸在一氧化氮合酶(nitric oxide synthase, NOS)的作用下生成NO, NO在体内具有较强的反应活性(半衰期3~5 s), 不能储存在囊泡中, 因此其产生水平受NOS表达和活性的控制[15]。NO下游作用途径主要有两条[16, 17]:其一, 作用于鸟苷酸环化酶, 催化三磷酸鸟苷(guanosine triphosphate, GTP)生成cGMP, 导致细胞内cGMP水平升高, 从而触发一系列的生物学效应; 其二, 对蛋白质中特定氨基酸残基亚硝基化或半胱氨酸S-亚硝基化, 进行翻译后修饰。NO在体内的合成过程中需要4种辅酶因子(四氢生物嘌呤BH4、黄素单核苷酸FMN、黄素腺嘌呤二核苷酸FAD和还原型烟酰胺腺嘌呤二核苷酸磷酸NADPH)和钙调蛋白的参与[18]。
NOS在机体内主要有3种类型, 根据其细胞或组织来源以及表达方式, 可分为iNOS、内皮型一氧化氮合酶(endothelial nitric oxide synthase, eNOS)和nNOS。其中eNOS和nNOS合称为结构型一氧化氮合酶(constructive nitric oxide synthase, cNOS), cNOS为钙依赖型, 而iNOS为钙非依赖型。NOS是同源二聚体, 编码nNOS、eNOS和iNOS这3种同工酶的基因分别位于12号、7号和17号染色体上[15]。NOS通过羧基端还原酶结构域的FAD和FMN将NADPH的电子转移到氨基末端加氧酶结构域的Haem基团, 加氧酶结构域与必需的辅助因子BH4、分子氧和L-精氨酸结合[19]。
2 NO/NOS调控睡眠觉醒的作用1994年, Kapás等[20-22]发现在兔子上脑室或静脉注射一种非选择性NOS抑制剂N-硝基-L-精氨酸甲酯(N-nitro-L-arginine-methyl ester hydrochloride, L-NAME), 能够抑制白介素1 (interleukin-1, IL-1)引起的非快动眼睡眠(non-rapid eye movement sleep, NREM)增加的现象; 记录给药后大鼠72 h内的脑电活动, 发现侧脑室注射或腹腔注射L-NAME都会导致快动眼睡眠(rapid eye movement sleep, REM)和NREM时间减少; 侧脑室注射给予NO的供体SNAP和SIN-1均能延长大鼠的NREM睡眠时间。这些研究结果均提示NO具有促睡眠作用。
Dittrich等[23]研究发现睡眠压力与清醒时间成正比。皮层GABA能中间神经元上共表达nNOS和神经激肽1受体(NK1R), 该神经元在睡眠过程中被激活后会表达功能活性标志物Fos, 且Fos的表达量与NREM睡眠量呈正相关。为研究睡眠过程中皮层nNOS的激活程度与NREM睡眠量和睡眠压力之间的关系, 灌胃给予镇静催眠药物(唑吡坦, GABAA受体调节剂; 爱莫勒沙, orexin受体拮抗剂)控制大鼠的睡眠时间, 结果发现皮层nNOS/NK1神经元Fos+的比例与入睡前清醒时间成正比。Gerashchenko等[24]在小鼠皮层nNOS神经元中表达光敏感的视紫红质通道蛋白-2 (ChR2), 使用光遗传方法激活该通道蛋白同时用脑电图描记器记录小鼠大脑皮层活动, 结果发现小鼠皮层慢波活动(slow-wave activity, SWA)增加。上述研究结果提示睡眠剥夺可以激活动物皮层神经元中nNOS, 使皮层GABA含量增多, 进而抑制大脑皮层电活动, 导致动物产生睡意。
Krueger等[25, 26]提出自下而上的睡眠调节模式, 睡眠被看作是大脑中的一个分布式过程, 局部细胞在活动过程中释放NO、腺苷等物质, 引起细胞状态的改变, 导致局部的小回路启动引发级联反应, 从而导致睡眠或觉醒。NO作为信号分子参与睡眠-觉醒稳态的调控, NO增加有助于睡眠, NO下降会促进觉醒。
3 NO参与睡眠觉醒调节的相关脑区睡眠觉醒是一个复杂的过程, 目前, 人们对于睡眠觉醒的认识主要有4种不同理论学说[27]:①体液学说(spanning humoral); ②局部网络学说(local network); ③分布式网络学说(distributed network); ④基于环路的理论(circuit-based theories)。这些理论模型为"全脑睡眠"提供了不同程度的解释。其中, 基于环路的理论提出"flip-flop switches"的概念, 上行网状激活系统和促睡眠中枢互相作用共同调节, 实现对睡眠觉醒的调控。上行网状激活系统包括中缝背核(dorsal raphe nucleus, DRN)的五羟色胺能神经元、蓝斑核(locus coeruleus, LC)的去甲肾上腺素能神经元、脑桥被盖区(laterodorsal and pedunculopontine tegmental nuclei, LdT/PPT)的胆碱能神经元、臂旁内侧核(medial parabrachial nucleus, MPB)的谷氨酸能神经元、腹侧被盖区(ventral tegmental area, VTA)的多巴胺能神经元、基底前脑(basal forebrain, BF)的胆碱能神经元, 位于结节乳头核(tuberomammillary nucleus, TMN)的组胺能神经元, 以及下丘脑外侧区(lateral hypothalamic area, LH)的GABA能神经元和食欲素神经元等[28], 它们在脑中的位置如图 1所示。此系统包括网状结构内、外侧区的感觉传入, 自内侧区向间脑(背侧丘脑板内核)的上行投射, 以及自丘脑核团至大脑皮质广泛区域的投射[29]。NO作为内源性促睡眠因子, 通过影响上行网状激活系统的活性, 调节睡眠稳态。
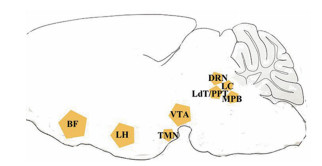
|
图 1 Ascending reticular activiting system associated brain region location. BF:Basal forebrain; LH:Lateral hypothalamic area; TMN:Tuberomammillary nucleus; VTA:Ventral tegmental area; LdT/PPT:Laterodorsal and pedunculopontine tegmental nuclei; DRN:Dorsal raphe nucleus; LC:Locus coeruleus; MPB:Medial parabrachial nucleus |
哺乳动物基底前脑在调控睡眠和觉醒方面发挥着重要作用。荧光成像实验显示, 基底前脑存在谷氨酸能(VGluT2)神经元、胆碱能(ChAT)神经元、小白蛋白阳性(PV+)和生长抑素阳性(SOM+)的GABA能神经元, 分别在ChAT-Cre小鼠、VGluT2-Cre小鼠、PV-Cre小鼠和SOM-Cre小鼠中诱导表达ChR2蛋白, 光遗传激活ChR2蛋白, 分别记录脑电图和肌电图(EEG/EMG), 分析发现谷氨酸能、胆碱能和小白蛋白阳性的GABA能(PV+)神经元与觉醒和REM睡眠相关, 生长抑素阳性的GABA能(SOM+)神经元与NREM睡眠相关[30, 31]。
基底前脑的胆碱能神经元在调节睡眠剥夺所产生的稳态睡眠压力(homeostatic sleep pressure, HSP)方面具有重要作用。采用光遗传方法激活表达ChR2的大鼠基底前脑胆碱能神经元后, 会导致从NREM睡眠到觉醒或REM睡眠的转变增加。对大鼠进行脑室灌注细胞膜透性染料二氨基荧光素-2/二乙酸酯(DAF-2/DA, 能与NO结合产生荧光)发现, 睡眠剥夺会诱导大鼠基底前脑的胆碱能神经元产生iNOS, 且iNOS的诱导强度与睡眠压力呈正相关, 而使用IgG 192-皂甙损伤基底前脑的胆碱能细胞后, 睡眠剥夺期NO、腺苷的含量和剥夺后恢复期NREM睡眠的时间不变, 这表明基底前脑胆碱能细胞在NO调节睡眠稳态压力的过程中发挥着重要的作用[32, 33]。对基底前脑和额叶皮层的微透析液样本进行检测, 发现大鼠睡眠剥夺1 h时基底前脑细胞外液NO浓度显著升高(额叶皮层在睡眠剥夺5 h时细胞外液NO浓度显著升高), 睡眠剥夺2 h时基底前脑细胞外液的腺苷浓度显著升高(额叶皮层在睡眠剥夺6 h时细胞外液腺苷浓度显著升高), 这表明NO和腺苷在促进睡眠产生的过程中存在时间和空间顺序[2]。基底前脑中NO能促进腺苷的释放, 而腺苷作为内源性促睡眠物质, 含量升高会通过腺苷A1受体抑制谷氨酸能神经元对胆碱能、GABA (PV+)能神经元的激活, 从而发挥促睡眠的作用[34]。
3.2 NO在中缝背核中的作用DRN的5-HT能神经元参与机体对睡眠觉醒的调节[29]。DRN由5-HT能、DA能、GABA能和谷氨酸能神经元共同构成, 用化学遗传方法激活SERT-Cre小鼠DRN的5-HT能神经元后, EEG/EMG显示在给予CNO (0.3 mg·kg-1, i.p.)后1 h内, 小鼠NREM显著增加, 睡眠潜伏期缩短[35]; 而对DRN微注射多巴胺受体激动剂(D1和D2受体激动剂, SKF 38393、溴隐亭和喹吡咯)后, REM时间和次数显著减少[36]。提示DRN不同细胞类型对睡眠觉醒具有不同的影响。
DRN中Ca2+对睡眠觉醒的调节起着重要作用, Ca2+浓度升高可激活CaMKⅡ, CaMKⅡ激活后其磷酸化水平会增高。Cui等[37]发现, 睡眠剥夺会使大鼠DRN的p-CaMKⅡ (Thr 286磷酸化)水平下降; 在DRN微注射CaMKⅡ磷酸化抑制剂KN-93 (5, 10 nmol)能使大鼠觉醒时间减少, 同时REM和NREM睡眠时间延长; 在DRN微注射CaCl2 (50 nmol)可使CaMKⅡ磷酸化水平增高, NREM、SWS和REM睡眠时间减少, 提示DRN内Ca2+/CaMKⅡ信号发挥促进觉醒和抑制睡眠的作用。DRN中74%的5-HT能神经元与nNOS共表达, 磷酸化对nNOS的活性起着重要的调节作用, 其中p-CaMKⅡ (Thr286磷酸化)会在Ser847位点磷酸化nNOS, 该位点磷酸化后会抑制Ca2+-CaM的结合从而使nNOS活性降低[38]。在睡眠剥夺过程中, 大鼠DRN的p-CaMKⅡ水平下降, p-CaMKⅡ对nNOS的抑制作用减弱, NO含量升高, 从而促进睡眠的产生。
此外, 5-HT能神经元还受谷氨酸能和GABA能神经元的支配, 通过整合这些神经输入, 5-HT能神经元调节大量的生理功能。Western Blot和电生理结果表明, NO能通过非赖氨酸激酶-脯氨酸丙氨酸Ste20激酶/氧化应激反应激酶1-钾氯共转运体2 (WNK-SPAK/OSR1-KCC2)信号通路增强GABA能神经元对DRN觉醒活动相关神经元的抑制作用, 从而促进大鼠的睡眠[39]; NO还介导DRN区5-HT神经元上谷氨酸突触尖峰定时相关的长时程增强, 通过增加谷氨酸的释放, 增强谷氨酸突触向5-HT能神经元的传递, 参与5-HT能神经元突触功能和可塑性的调节[40]。
3.3 NO在下丘脑外侧区的作用穹窿周围-下丘脑外侧区(PF-LHA)是一个觉醒促进区, LHA富含食欲素(orexin)能神经元, orexin能神经元合成食欲肽, 食欲肽有orexin A和orexin B两种类型, 其中orexin B与orexin-1受体和orexin-2受体亲和力相似, 而orexin A与orexin-1受体亲和力强, 选择性作用于orexin-1受体。
LHA的orexin能神经元内表达nNOS, Yamakawa等[41]用雄性C57BL/6小鼠研究内源性NO对orexin能神经元的作用, 采用免疫组化方法研究发现腹腔注射咖啡因(30 mg·kg-1)能够增加orexin能神经元和表达NOS的硝能神经元内c-Fos的阳性细胞数; 给予盐酸苯海拉明(组胺受体拮抗剂, 能抑制觉醒, 促进睡眠, 10 mg·kg-1, i.p.)后orexin能神经元c-Fos的阳性细胞数目减少, 但是对硝能神经元c-Fos阳性细胞数无显著影响; 单独给予nNOS抑制剂7-NI (25 mg·kg-1, i.p.)能显著增加orexin能神经元c-Fos的阳性细胞数, 且能抑制给予咖啡因诱导的硝能神经元c-Fos阳性细胞数的增加。由此可推知内源性NO对促觉醒的orexin能神经元有负调节作用。对该区域进行NO含量的检测发现:清醒期 > REM睡眠期 > NREM睡眠期, 且随着清醒时间的延长, NO持续增加。NO在NREM睡眠期的含量约为0.4 μmol·L-1, 在清醒期或睡眠剥夺期约为0.6~0.7 μmol·L-1[42]。orexin能神经元在维持觉醒和抑制REM睡眠方面发挥着重要作用, Obukuro等[43]研究发现给小鼠第三脑室注射NO供体NOC18 (50 nmol)能够显著的降低orexin能神经元的数目, NOC18可通过蛋白质二硫异构酶(protein disulfide isomerase, PDI)的S-亚硝基化和失活促使食欲肽形成聚合物, 导致食欲肽的丢失。免疫组化研究发现, 连续7天睡眠剥夺会导致小鼠LHA的orexin能神经元食欲肽聚合物增加、S-亚硝基化的PDI增多, 食欲素能神经元数目减少。在此过程中, nNOS活性随睡眠剥夺时间的延长而升高, 而在nNOS敲除小鼠上未观察到上述睡眠剥夺引起的一系列现象。由此可推知NO在LHA可能通过PDI的S-亚硝基化和失活等途径使食欲肽错误折叠并形成聚集物, 导致orexin能神经元数目下降, 抑制orexin能神经的活性, 从而促进睡眠的产生。
4 总结与展望NO作为信号分子参与机体睡眠觉醒稳态的调节。整体来看, NO是一种内源性促睡眠物质, 在睡眠剥夺过程中, NO抑制上行网状激活系统的多个脑区促觉醒神经元的活性, 从而促进睡眠的产生。基底前脑胆碱能神经元中NO的产生促进了腺苷的释放, 抑制基底前脑与觉醒相关的神经元, 从而促进睡眠的产生; 中缝背核Ca2+/CaMKⅡ信号通路参与调节nNOS的活性, 睡眠剥夺导致中缝背核细胞内p-CaMKⅡ水平降低, 进而减弱对nNOS的抑制作用, nNOS活性升高, 从而促进睡眠; 下丘脑外侧区的NO通过PDI的S-亚硝基化和失活等途径, 使维持觉醒的orexin能神经元丢失, 食欲肽减少, 从而导致嗜睡。
NO除在睡眠觉醒中发挥着重要作用外, 还是心血管、免疫和中枢神经系统中重要信号分子, 对健康和疾病的调控具有重要意义。随着技术的发展, 人们对NO的认识逐渐加深, NO在睡眠稳态中的作用及其机制越来越清晰, 这为深入了解睡眠觉醒这一生命奥秘提供了新的方向。
| [1] |
Li H, Shi L, Lu L. Important advances in sleep disorders in 2018[J]. Chin Med News (中华医学信息导报), 2019, 34: 15-16. |
| [2] |
Kalinchuk AV, McCarley RW, Porkka-Heiskanen T, et al. The time course of adenosine, nitric oxide (NO) and inducible NO synthase changes in the brain with sleep loss and their role in the non-rapid eye movement sleep homeostatic cascade[J]. J Neurochem, 2011, 116: 260-272. DOI:10.1111/j.1471-4159.2010.07100.x |
| [3] |
Amrouni D, Gautier-Sauvigné S, Meiller A, et al. Cerebral and peripheral changes occurring in nitric oxide (NO) synthesis in a rat model of sleeping sickness:identification of brain iNOS expressing cells[J]. PLoS One, 2010, 5: e9211. DOI:10.1371/journal.pone.0009211 |
| [4] |
Chen L, Majde JA, Krueger JM. Spontaneous sleep in mice with targeted disruptions of neuronal or inducible nitric oxide synthase genes[J]. Brain Res, 2003, 973: 214-222. DOI:10.1016/S0006-8993(03)02484-3 |
| [5] |
Xiao HB, Wang YS, Liang L, et al. Procyanidin B2 from lotus seedpod regulate NO/ADMA/DDAH pathway to treat insomnia in rats[J]. Fundam Clin Pharmacol, 2019, 33: 549-557. DOI:10.1111/fcp.12462 |
| [6] |
Fageyinbo MS, Odumeso AO, Rotimi K, et al. Anticonvulsant, anxiolytic and sedative activities of hydro-ethanolic leaf extract of Mitragyna stipulosa[J]. J Herbs Spices Med Plants, 2019, 25: 43-54. DOI:10.1080/10496475.2018.1556373 |
| [7] |
Rajalingam D, Jacobsen DP, Nielsen M, et al. Exposure to workplace bullying, distress, and insomnia:the moderating role of the miR-146a genotype[J]. Front Psychol, 2019, 10: 1204. DOI:10.3389/fpsyg.2019.01204 |
| [8] |
Zhang X, Huo Q, Sun W, et al. Rs2910164 in microRNA-146a confers an elevated risk of depression in patients with coronary artery disease by modulating the expression of NOS1[J]. Mol Med Rep, 2018, 18: 603-609. |
| [9] |
Magoun HW. An ascending reticular activating system in the brain stem[J]. AMA Arch Neurol Psychiatry, 1952, 67: 145-154. DOI:10.1001/archneurpsyc.1952.02320140013002 |
| [10] |
Luppi PH, Fort P. Neuroanatomical and neurochemical bases of vigilance states[J]. Handb Exp Pharmacol, 2019, 253: 35-58. |
| [11] |
Knowles RG, Moncada S. Nitric oxide synthases in mammals[J]. Biochem J, 1994, 298: 249-258. DOI:10.1042/bj2980249 |
| [12] |
Zhou HY, Gao PJ. Research progress of phosphodiesterase and cardiovascular diseases[J]. J Shanghai Jiaotong Univ (Med Sci) (上海交通大学学报医学版), 2009, 29: 216-219. |
| [13] |
Zhang YH, Bang CX. Advances in the study of nitric oxide-donating drugs[J]. Acta Pharm Sin (药学学报), 2009, 44: 1200-1210. |
| [14] |
Yuste JE, Tarragon E, Campuzano CM, et al. Implications of glial nitric oxide in neurodegenerative diseases[J]. Front Cell Neurosci, 2015, 9: 322. |
| [15] |
Lowenstein CJ, Snyder SH. Nitric oxide, a novel biologic messenger[J]. Cell, 1992, 70: 705-707. DOI:10.1016/0092-8674(92)90301-R |
| [16] |
Raju K, Doulias PT, Evans P, et al. Regulation of brain glutamate metabolism by nitric oxide and S-nitrosylation[J]. Sci Signal, 2015, 8: ra68. DOI:10.1126/scisignal.aaa4312 |
| [17] |
Gutiérrez HC, O'Leary A, Freudenberg F, et al. Nitric oxide interacts with monoamine oxidase to modulate aggression and anxiety-like behavior[J]. Eur Neuropsychopharmacol, 2017. DOI: 10.1016/j.euroneuro.2017.09.004.
|
| [18] |
Gautier-Sauvigné S, Colas D, Parmantier P, et al. Nitric oxide and sleep[J]. Sleep Med Rev, 2005, 9: 101-113. DOI:10.1016/j.smrv.2004.07.004 |
| [19] |
F rstermann U, Sessa WC. Nitric oxide synthases:regulation and function[J]. Eur Heart J, 2012, 33: 829-837. DOI:10.1093/eurheartj/ehr304 |
| [20] |
Kapás L, Shibata M, Kimura M, et al. Inhibition of nitric oxide synthesis suppresses sleep in rabbits[J]. Am J Physiol, 1994, 266: R151-157. |
| [21] |
Kapás L, Fang J, Krueger JM. Inhibition of nitric oxide synthesis inhibits rat sleep[J]. Brain Res, 1994, 664: 189-196. DOI:10.1016/0006-8993(94)91969-0 |
| [22] |
Kapás L, Krueger JM. Nitric oxide donors SIN-1 and SNAP promote nonrapid-eye-movement sleep in rats[J]. Brain Res Bull, 1996, 41: 293-298. DOI:10.1016/S0361-9230(96)00227-4 |
| [23] |
Dittrich L, Morairty SR, Warrier DR, et al. Homeostatic sleep pressure is the primary factor for activation of cortical nNOS/NK1 neurons[J]. Neuropsychopharmacology, 2015, 40: 632-639. DOI:10.1038/npp.2014.212 |
| [24] |
Gerashchenko D, Schmidt MA, Zielinski MR, et al. Sleep state dependence of optogenetically evoked responses in neuronal nitric oxide synthase-positive cells of the cerebral cortex[J]. Neuroscience, 2018, 379: 189-201. DOI:10.1016/j.neuroscience.2018.02.006 |
| [25] |
Krueger JM, Huang YH, Rector DM, et al. Sleep:a synchrony of cell activity-driven small network states[J]. Eur J Neurosci, 2013, 38: 2199-2209. DOI:10.1111/ejn.12238 |
| [26] |
Anafi RC, Kayser MS, Raizen DM. Exploring phylogeny to find the function of sleep[J]. Nat Rev Neurosci, 2019, 20: 109-116. |
| [27] |
Anaclet C, Fuller PM. Brainstem regulation of slow-wave-sleep[J]. Curr Opin Neurobiol, 2017, 44: 139-143. DOI:10.1016/j.conb.2017.04.004 |
| [28] |
Luppi PH, Fort P. Neuroanatomical and neurochemical bases of vigilance states[J]. Handb Exp Pharmacol, 2018, 253: 35-58. |
| [29] |
Saper CB, Scammell TE, Lu J. Hypothalamic regulation of sleep and circadian rhythms[J]. Nature, 2005, 437: 1257-1263. DOI:10.1038/nature04284 |
| [30] |
Anaclet C, De Luca R, Venner A, et al. Genetic activation, inactivation, and deletion reveal a limited and nuanced role for somatostatin-containing basal forebrain neurons in behavioral state control[J]. J Neurosci, 2018, 38: 5168-5181. DOI:10.1523/JNEUROSCI.2955-17.2018 |
| [31] |
Xu M, Chung S, Zhang S, et al. Basal forebrain circuit for sleep-wake control[J]. Nat Neurosci, 2015, 18: 1641-1647. DOI:10.1038/nn.4143 |
| [32] |
Kalinchuk AV, McCarley RW, Porkka-Heiskanen T, et al. Sleep deprivation triggers inducible nitric oxide-dependent nitric oxide production in wake-active basal forebrain neurons[J]. J Neurosci, 2010, 30: 13254-13264. DOI:10.1523/JNEUROSCI.0014-10.2010 |
| [33] |
Kalinchuk AV, Porkka-Heiskanen T, McCarley RW, et al. Cholinergic neurons of the basal forebrain mediate biochemical and electrophysiological mechanisms underlying sleep homeostasis[J]. Eur J Neurosci, 2015, 41: 182-195. DOI:10.1111/ejn.12766 |
| [34] |
Yang C, Franciosi S, Brown RE. Adenosine inhibits the excitatory synaptic inputs to basal forebrain cholinergic, GABAergic, and parvalbumin neurons in mice[J]. Front Neurol, 2013, 4: 77. |
| [35] |
Broadhurst RY. The Role of Dorsal Raphe Serotoninergic Neurons in Sleep-Wake Regulation[D]. Boston: Boston University School of Medicine, 2018.
|
| [36] |
Monti JM, Jantos H. The effects of local microinjection of selective dopamine D1 and D2 receptor agonists and antagonists into the dorsal raphe nucleus on sleep and wakefulness in the rat[J]. Behav Brain Res, 2018, 339: 11-18. DOI:10.1016/j.bbr.2017.11.006 |
| [37] |
Cui SY, Li SJ, Cui XY, et al. Phosphorylation of CaMKⅡ in the rat dorsal raphe nucleus plays an important role in sleep-wake regulation[J]. J Neurochem, 2016, 136: 609-619. DOI:10.1111/jnc.13431 |
| [38] |
Zhou L, Zhu DY. Neuronal nitric oxide synthase:structure, subcellular localization, regulation, and clinical implications[J]. Nitric Oxide, 2009, 20: 223-230. DOI:10.1016/j.niox.2009.03.001 |
| [39] |
Kim MJ, Yang HJ, Kim Y, et al. Role of nitric oxide and WNK-SPAK/OSR1-KCC2 signaling in daily changes in GABAergic inhibition in the rat dorsal raphe neurons[J]. Neuropharmacology, 2018, 135: 355-367. DOI:10.1016/j.neuropharm.2018.03.035 |
| [40] |
Haj-Dahmane S, Béï que JC, Shen RY. GluA2-lacking AMPA receptors and nitric oxide signaling gate spike-timing-dependent potentiation of glutamate synapses in the dorsal raphe nucleus[J]. eNeuro, 2017. DOI: 10.1523/eneuro.0116-17.2017.
|
| [41] |
Yamakawa T, Kurauchi Y, Hisatsune A, et al. Endogenous nitric oxide inhibits, whereas awakening stimuli increase, the activity of a subset of orexin neurons[J]. Biol Pharm Bull, 2018, 41: 1859-1865. DOI:10.1248/bpb.b18-00633 |
| [42] |
Darwinkel A, Stanić D, Booth LC, et al. Distribution of orexin-1 receptor-green fluorescent protein-(OX1-GFP) expressing neurons in the mouse brain stem and pons:co-localization with tyrosine hydroxylase and neuronal nitric oxide synthase[J]. Neuroscience, 2014, 278: 253-264. DOI:10.1016/j.neuroscience.2014.08.027 |
| [43] |
Obukuro K, Nobunaga M, Takigawa M, et al. Nitric oxide mediates selective degeneration of hypothalamic orexin neurons through dysfunction of protein disulfide isomerase[J]. J Neurosci, 2013, 33: 12557-12568. DOI:10.1523/JNEUROSCI.0595-13.2013 |
 2020, Vol. 55
2020, Vol. 55


