2016国际脓毒症和感染性休克指南对脓毒症提出新定义(sepsis3.0):脓毒症(sepsis)是感染引起宿主免疫应答失调导致危及生命的器官功能障碍。当患者体内存在感染, 并且全身性感染相关性器官功能障碍评分(sepsis related organ failure assessment, SOFA) ≥ 2分, 可以被诊断为脓毒症, 病死率约为10%。脓毒性休克(septic shock)是严重脓毒症的一种特殊类型, 表现为明显的循环及细胞/代谢功能异常, 可导致多器官衰竭, 显著增加病死率, 其病死率可高达40%~60%[1]。脓毒性休克并发症所引起的器官功能障碍有的甚至为不可逆(如长期的认知和功能缺陷), 存活下来的患者在出院后仍有持续感染与死亡风险[2]。在美国住院患者中2%为严重脓毒症患者, 且其中的一半在重症监护室(ICU)接受治疗, 占所有ICU入院患者的10%[3, 4]。美国每年脓毒症病例数超过75万例, 且发病率还在逐年上升[5]。我国与美国及其他高收入国家具有相似的脓毒症发病率[6]。一项流行病学调查显示, 1979年至2000年间的脓毒症患者中, 感染革兰阳性菌(G+)患者数量超出感染革兰阴性菌(G-)患者。但最近一项研究表明, 75个国家的14 000例脓毒症主要由G-感染引起, 其中62%的患者体内被分离出G-, 47%的患者被分离出G+, 还有19%的患者体内被分离出真菌[7]。
临床脓毒症的治疗非常棘手, 主要以糖皮质激素等非特异性治疗以及防治器官功能衰竭和休克等对症治疗为主。虽然控制感染的治疗方法能缓解脓毒症症状, 延长患者生命, 但治标不治本。脓毒症整个发生发展过程受到炎症及免疫因子等多种因素的影响, 分子病理生理学非常复杂, 这也为治疗提供了诸多分子靶点。本文主要对脓毒症病理生理进程中的潜在治疗靶点及药物研究进展进行综述。
1 抑制过度的促炎应答失控、持续放大的全身性炎症反应综合征(systemic inflammatory response syndrome, SIRS)是脓毒症患者死亡的主要原因, 因此脓毒症治疗的基本策略依然是清除炎性介质, 降低炎性介质峰值浓度, 控制炎症和过度免疫反应。
1.1 中和脂多糖(lipopolysaccharides, LPS)大多数的脓毒症主要由G-感染引起, 而LPS为G-的细胞壁主要成分, 也是引起后续炎症风暴的主要物质。目前多种药物具有直接与LPS结合/中和的能力, 如多黏菌素B可以结合并中和LPS的脂质A组分, 阻止LPS引起细胞因子TNF-α的释放, 能够有效保护被G-感染的宿主[8], 但是由于其肾毒性与神经毒性限制了其临床应用。Centocor公司开发的靶向LPS单克隆抗体Centoxin (Nebacumab, HA-1A), 为史上第一个人源化的单克隆抗体, 能结合于G-中LPS的脂质A, 减轻促炎应答, 拟用于临床治疗G-引起的脓毒症。但HA-1A经过多次临床试验后被证实治疗无效, 在1992年2月被FDA驳回上市申请[9]。抗菌肽LL-37、两性离子壳聚糖(ZWC)、凝血因子VII、IX和X的轻链组分等LPS中和药物处于临床前研究阶段。LL-37具有中和LPS能力, 可降低小鼠腹腔液与血清中IL-1β、IL-6和TNF-α蛋白表达, 并抑制caspase-1活化, 减少LPS/ATP诱导腹腔巨噬细胞焦亡, 静脉注射后可明显改善脓毒症模型小鼠存活率[10]。LL-37及其结构类似物sLL-37均可缓解脓毒症模型小鼠急性肺损伤[11]。ZWC可直接与LPS结合, 抑制p38蛋白磷酸化, 减轻过度促炎应答过程, 明显延长LPS诱导的脓毒症模型小鼠存活时间[12]。凝血因子VII、IX与X的轻链组分可水解G-外膜的LPS, 阻止后续炎症反应, 具有抗感染活性。动物实验表明, 耐药绿脓杆菌或鲍曼不动杆菌感染小鼠后静脉高剂量给予凝血因子VII轻链组分, 小鼠存活率显著提高[13]。凝血因子在脓毒症发生发展中扮演着促凝与抗炎双重作用。在恰当时机给予LPS结合/中和剂, 将有利于脓毒症的临床治疗。
1.2 TLR4受体拮抗剂TLR4为主要天然免疫识别受体之一, 除可识别来自G-外膜的LPS外, 还可与纤维蛋白原、低密度脂蛋白、纤维粘连素、透明质酸、热休克蛋白60和热休克蛋白70等内源性配体结合, 介导机体免疫应答及凝血异常。阻断TLR4信号通路可减少炎症介质表达, 缓解脓毒症病情[14]。目前拮抗TLR4受体的靶向化合物有FP7、L48H37和Eritoran等。FP7和L48H37目前处于临床前研究阶段。FP7能够阻止LPS引起的TLR4受体活化, 减少单核细胞与树突细胞分泌促炎因子IL-6、IL-8和MIP-1β, 降低致命流感病毒感染小鼠的死亡率[15]。L48H37为姜黄素类似物, 通过靶向髓样分化蛋白-2 (myeloid differentiation-2, MD-2)阻断LPS与TLR4受体结合, 抑制LPS诱导的MAPK与NFκB信号通路相关蛋白磷酸化, 是治疗脓毒症的潜在候选药物[16]。在临床Ⅲ期试验阶段被淘汰的Eritoran通过直接与CD14结合而阻止LPS配体蛋白与MD-2结合, 从而发挥拮抗TLR4受体作用[17]。临床Ⅲ期试验显示, Eritoran与安慰剂相比未降低脓毒症患者28天死亡率[18]。因此在脓毒症的治疗过程中, 单一阻断TLR4受体信号通路对脓毒症并不一定能起到有效治疗作用, 尚需其他重要通路的共同干预。
1.3 雌激素受体(estrogenreceptor, ER)激动剂ER激动剂能够抑制促炎基因转录, 展现出抗炎活性。目前WAY-204688、ERB-196与ERB-041等ER激动剂均处于临床前研究阶段。WAY-204688为ER-α受体激动剂, 可阻止NF-κB通路激活。在绿脓杆菌致大鼠全身感染实验研究中, WAY-204688能明显提高大鼠存活率[19]。ERB-196 (WAY-202196)是一种选择性ER-β激动剂, 可以降低大鼠腹腔液中IL-6和TNF-α等炎症因子蛋白水平表达, 提高严重脓毒症大鼠存活率[20]。ERB-041为另一种选择性极高的ER-β激动剂, 可抑制LPS引起iNOS表达增多与NF-κB通路活化, 通过减轻全身与局部炎症反应降低脓毒症小鼠死亡率[21]。ER激动剂具有治疗严重脓毒症潜在活性。
1.4 巨噬细胞迁移抑制因子(macrophage migration inhibitory factor, MIF)抑制剂巨噬细胞迁移抑制因子(MIF)为具有独特结构的多效免疫调节因子, 由造血细胞、上皮细胞、内皮细胞、间充质细胞和神经细胞分泌, 可抑制巨噬细胞从T细胞激活区向外移动, 也可激活附近巨噬细胞使其吞噬作用增强。MIF作为一种潜在促炎因子, 参与脓毒症等多种炎症性疾病的发病过程[22]。针对MIF活性位点设计的抑制剂ISO-1[4, 5-二氢-3-(4-羟基苯基)-5-异恶唑乙酸甲酯]、F11、NbE5和NbE10等目前均处于临床前研究阶段。ISO-1能够与MIF的互变异构酶活性位点结合, 降低MIF促炎活性, 并抑制LPS与盲肠结扎穿孔术(CLP)诱导的脓毒症小鼠体内巨噬细胞释放TNF-α, 对脓毒症小鼠具有明显治疗效果[23]。抗MIF的单克隆抗体F11是具有抗脓毒症活性的高特异性、高亲和力IgG型单克隆抗体, 可显著抑制MIF刺激RAW264.7细胞引起NO释放, 提高脓毒症小鼠存活率[24]。NbE5和NbE10为半衰期较长的新型抗MIF纳米抗体, 可通过与MIF催化口袋结合, 抑制MIF互变异构酶活性。而根据NbE10设计的半衰期更长的纳米抗体NbE10-NbAlb8-NbE10可显著降低脓毒症模型小鼠死亡率[25], 因此MIF活性位点可作为对抗脓毒症的潜在新靶点。
1.5 高迁移率族蛋白B1 (high mobility group protein B-1, HMGB-1)抑制剂HMGB-1属于一种典型的损伤相关分子模式蛋白, 通常储存于细胞核内。当细胞受到炎性介质的刺激后转运至胞浆, HMGB-1通过甲基化、磷酸化和乙酰化等修饰后释放到细胞外, 与多种外源性(细菌内毒素、CG序列-DNA)或内源性(IL-1β、TNF-α)促炎介质相互作用, 发挥促炎活性。HMGB-1作为晚期促炎因子参与脓毒症发病过程, 是脓毒症致死性全身反应的重要晚期炎症介质。重症脓毒症患者血浆高浓度的HMGB-1含量与死亡率呈正相关。氯喹宁、槲皮素与褐藻降钙素等均可抑制HMGB-1活性, 对脓毒症的治疗作用研究均处于临床前研究阶段。抗疟药氯喹宁可抑制巨噬细胞、单核细胞和内皮细胞中HMGB-1释放, 减弱促炎应答, 降低脓毒症模型小鼠死亡率[26]。对TNF-α等致炎介质释放初期的脓毒症动物给予槲皮素治疗, 可使LPS刺激引起损伤组织释放HGMB-1减少, 从而降低动物体内HMGB-1的循环水平。槲皮素可作为治疗脓毒症候选药物[27]。褐藻降钙素可以下调小鼠腹腔巨噬细胞与RAW 264.7细胞iNOS、COX-2、TNF-α、IL-6和HGMB-1 mRNA的表达。在LPS诱导的脓毒症小鼠模型中, 褐藻降钙素能够降低小鼠血清中NO、PGE2和HMGB-1水平, 减轻LPS引起小鼠急性肝、肾损伤, 增加脓毒症小鼠存活率[28], 因此HMGB-1被认为是与脓毒症治疗相关重要靶点。
1.6 其他间变性淋巴瘤激酶(anaplastic lymphoma kinase, ALK)是肿瘤相关受体酪氨酸激酶, 在致死性脓毒症病例中具有调节先天免疫的作用。ALK抑制剂LDK378为2014年美国FDA批准的抗癌新药, 最近的临床前研究显示其能够提高脓毒症小鼠存活率, 缓解脓毒症小鼠肺与小肠组织损伤, 减少炎症因子TNF-α、IFN-β、MCP1和IL-7 mRNA水平的释放, 具有抗炎、抗感染活性[29]。氟伏沙明是一种抗抑郁药, 与内质网上sigma1受体蛋白具有亲和力。氟伏沙明可通过活化sigma1受体抑制细胞因子产生, 降低脓毒症模型小鼠死亡率[30]。某些补体的激活能够使促炎因子表达量增加, 引起炎症损伤[31]。临床前研究药物MEDI7814是抗过敏毒素C5a (补体C5a)的抗体, 可通过与C5aR1和C5aR2受体结合发挥抑制补体C5a活性作用, 抑制剧烈促炎反应, 却不影响其他补体介导的细菌杀伤作用, MEDI7814具有治疗脓毒症潜力[32]。
2 缓解免疫抑制脓毒症后期机体常出现免疫抑制或免疫麻痹状态, 表现为中性粒细胞、巨噬细胞、T细胞和B细胞凋亡, 调节性T细胞和髓系抑制细胞增多[33]。严重免疫抑制(免疫麻痹)状态使患者对原发性致病菌不能有效清除, 甚至出现持续感染或多药耐药细菌、真菌引发的继发感染, 病情更加难以控制, 最终导致患者死亡。最近多项研究表明有针对性的免疫增强(免疫促进、免疫刺激)疗法对免疫抑制状态的脓毒症患者病情有改善作用[34]。
2.1 半胱氨酸蛋白酶(caspase)抑制剂蛋白质GSDMD是caspase-1/-4/-5/-11的底物, 活化的caspase-1/-4/-5/-11可酶切GSDMD蛋白成两部分(GSDMD-N端与GSDMD-C端), GSDMD-N端在巨噬细胞脂质膜上形成气孔, 破坏细胞膜诱导细胞焦亡[35]。Caspase-3可被TNF-α激活, 剪切GSDME蛋白, 使巨噬细胞焦亡[36]。目前靶向caspase的临床前研究药物有VX-166和线性泛素链相关蛋白等。VX-166是一种强效广谱caspase抑制剂, 可明显抑制CLP模型动物胸腺萎缩与淋巴细胞凋亡, 提高CLP模型动物存活率[37]。线性泛素链相关蛋白(Shank-associated RH domain-interacting protein, SHARPIN)为线性泛素链组装复合体(LUBAC)组成成分。脓毒症患者体内SHARPIN含量下降与循环系统中单核细胞内caspase-1的活性增强有关。SHARPIN作为一个内源caspase-1抑制剂, 可以直接与活化的caspase-1四聚体结合, 抑制p20/p10相互作用, 减少IL-1β/18释放, 减少脾脏细胞死亡, 延长脓毒症小鼠存活时间[38]。SHARPIN与caspase-1的相互作用成为脓毒症治疗靶点之一。
2.2 免疫刺激剂免疫刺激或免疫调理可以增强机体的免疫功能, 提高治疗脓毒症临床效果。目前治疗脓毒症的免疫增强剂主要有临床试验药物粒细胞-巨噬细胞集落刺激因子(granulocyte macrophage-colony stimulating factor, GM-CSF)和胸腺素α1 (thymosin alpha 1, Tα1), 以及处于临床前试验研究阶段的抗细胞毒性T淋巴细胞抗原4 (cytotoxic T-lymphocyte associated antigen-4, CTLA-4)抗体等。GM-CSF是组织浸染淋巴细胞与髓样细胞之间的交流渠道, 具有激活免疫细胞活性作用。在对38例单核细胞人白细胞DR抗原(monocytic human leukocyte antigen-DR, mHLA-DR)含量低并伴有免疫抑制的脓毒症患者进行的临床试验显示, 以生物标志物mHLA-DR为导向给予该类患者外源性GM-CSF可使单核细胞免疫功能恢复[39]。对2 380例非中性粒细胞减少的脓毒症患者开展临床试验发现, GM-CSF对脓毒症治疗效果不显著[40], 其治疗范围及疗效仍需大型前瞻性多中心临床试验验证。Tα1是一种免疫调节剂, 可增加人类白细胞DR抗原(human leukocyte antigen-DR, HLA-DR)在单核细胞上的表达, 增加体内淋巴细胞数量, 降低继发性感染的发生率。对2008~2010年间的361例脓毒症患者开展临床试验, 结果表明Tα1治疗脓毒症安全有效[41]。最近一项针对240例严重脓毒症患者的临床试验发现, 体内淋巴细胞数量低的脓毒症患者使用Tα1治疗更加有效[42]。CTLA-4是调节性T细胞(regulatory cells, Tregs)表达的一种抑制早期T细胞活化和增殖的重要因子, 具有阻碍抗原提呈细胞(antigen-presenting cells, APC)抗原递呈与介导靶细胞死亡作用, 具有免疫抑制功效。CTLA-4抗体具有逆转免疫抑制的作用, 低剂量抗CTLA-4抗体可阻止淋巴细胞凋亡, 逆转脓毒症伴随的免疫抑制, 可提高盲肠结扎穿刺与真菌脓毒症模型动物存活率[43]。以上这些免疫刺激剂有望成为治疗脓毒症的有效药物。给予患者免疫刺激剂时间点, 应根据患者的病情以及具体情况确定。
2.3 免疫抑制因子抑制剂免疫抑制导致脓毒症患者血清免疫抑制因子IL-4、IL-10、IL-17、INF-γ和TGF-β等含量升高。这些免疫抑制因子可抑制单核巨噬细胞天然与特异性免疫功能, 引起机体免疫功能缺陷。目前免疫抑制因子抑制剂有临床前研究药物三氯碲酸铵(AS101)和处于临床试验阶段的药物维他命C等。AS101为IL-10的新型抑制剂, 可抑制IL-10在基因转录水平的表达, 增强巨噬细胞免疫功能, 并显著提高脓毒症小鼠存活率[44]。有研究表明, 肠外注射维他命C可抑制脓毒症小鼠体内TGF-β和IL-10等免疫抑制因子的分泌, 抑制调节性T细胞活性, 改善免疫抑制状态, 从而缓解脓毒症小鼠体内多器官功能障碍[45]。但最新临床Ⅲ期试验显示, 静脉注射维他命C不能改善脓毒症患者器官功能障碍评分, 也不能降低血管损伤标志物含量, 但其是否抑制脓毒症患者免疫抑制因子表达尚需进一步研究确证[46]。
3 改善凝血系统异常凝血与炎症有着密不可分的关系, 免疫细胞、细胞因子和趋化因子能激活凝血系统并下调抗凝物质引起凝血。脓毒症过度激活凝血, 血管内正常抗凝状态被破坏, 机体出现高凝状态。伴有弥散性血管内凝血(DIC)脓毒症患者, 会同时出现血栓症状与出血症状(由于凝血因子与血小板过度消耗引起), 进而导致死亡[47]。
3.1 抗凝血酶(antithrombin, AT)处于临床试验阶段的天然强效抗凝血酶Ⅲ (antithrombin Ⅲ, AT Ⅲ)可抑制aFX和凝血酶等促凝物。在脓毒症患者体内AT Ⅲ含量减少, 导致血管内弥漫性微血栓增多与多器官功能障碍。对1997~2000年的2 314例脓毒症患者开展临床Ⅲ期试验表明, 注射高剂量AT Ⅲ并同时添加肝素治疗并不能降低患者28天死亡率, 但是单用高剂量AT Ⅲ组(不注射肝素)患者28天死亡率显著降低[48]。随后在2005年对3 933例脓毒症患者再一次展开临床试验, 发现没有足够证据支持用AT Ⅲ治疗同时不使用肝素可降低伴有DIC脓毒症患者病死率[49]。故AT Ⅲ治疗脓毒症效果不明确, 仍需要大量的随机对照试验(RCT)验证其疗效[50]。
3.2 重组人活化蛋白(recombinant human activated protein C, rhAPC)与重组人可溶性血栓调节蛋白(recombinant human soluble thrombomodulin, rhsTM)脓毒症患者体内内皮细胞可溶性血栓调节蛋白(soluble thrombomodulin, sTM)表达量严重减少, 导致活化蛋白C依赖的抗凝效果降低。rhAPC (又称DrotAA)具有抑制凝血块进一步形成, 增加纤维蛋白溶解的抗凝作用。临床Ⅲ期试验显示, DrotAA治疗脓毒症患者组死亡率比安慰剂组下降了6.6%, 二者具有显著性差异[51]。2001年11月礼来公司研发的DrotAA新药(商品名为Xigris)被美国FDA批准上市, 用于治疗成人脓毒症。2012年的临床Ⅲ期试验(PROWESS-SHOCK试验)表明, DrotAA治疗组脓毒症患者死亡率与安慰剂组比较无显著性差异[52], 因此礼来公司宣布从全球市场撤销该药。临床试验药物rhsTM是一种抗凝剂, 在日本临床上已被许可用于治疗脓毒症引起的弥散性血管内凝血。对2011年至2013年间的3 195例脓毒症患者开展临床研究发现, 伴有DIC症状的脓毒症患者注射rhsTM治疗可降低脓毒症患者病死率, 并不增加出血风险, 而且rhsTM与AT联用疗效更佳[53]。但目前rhTM能否用于脓毒症治疗仍缺少临床数据支撑, 其疗效尚需大规模临床试验进一步证实。
3.3 组织因子通路抑制剂组织因子(tissue factor, TF)在正常人体血管内皮细胞及外周血细胞中不表达, 其作为凝血因子Ⅶ受体启动外源性凝血途径。而脓毒症患者体内, 由于LPS、细胞因子与组织胺等因素刺激, 内皮细胞表达并释放TF, TF与活化凝血因子(activated coagulation factor VIIa, FVIIa)形成TF/FVIIa复合物, 激活凝血因子X (clotting factor X, FX), 导致凝血和纤维蛋白形成。临床试验药物组织因子通路抑制剂(tissue factor pathway inhibitor, TFPI), 属于库尼氏(Kunitz)型丝氨酸蛋白酶抑制剂类, 是一种内源性组织因子相关凝血级联反应抑制剂。TFPI可显著降低严重脓毒症动物死亡率, 并且II期临床试验显示, 在210例严重脓毒症患者中, 接受TFPI治疗的患者28天全因死亡率有相对下降趋势[54]。Chiron公司开发的蒂法金(Tifacogin)为重组人TFPI, 在北美、欧洲、以色列等17个国家的245家医院开展临床Ⅲ期试验, 结果显示其治疗严重脓毒症患者无效[55]。
3.4 抑制纤溶酶原激活物抑制因子1 (plasminogen activator inhibitor 1, PAI-1)活性PAI-1是机体内最重要的纤溶活性调节剂, 通过抑制纤溶酶原激活物(plasminogen activator, PA)调节血管内和血管外纤溶系统。脓毒症患者体内PAI-1过量表达引起纤维蛋白溶解减少从而导致血栓形成。临床试验药物Tiplaxtinin 21、Diaplasinin 22和PAZ-417 23是PAI-1的有机小分子抑制剂, 它们虽然均已进入临床Ⅰ期试验, 但没有更进一步的研究进展[56]。临床前研究药物藏红花素(crocin)是一种天然抗氧化剂, 在内毒素休克大鼠模型中, 能够抑制血小板减少, 降低肝脏和大脑中PAI-1的浓度, 抑制肾小球中纤维蛋白沉积, 缓解内毒素引起的凝血, 改善LPS诱导的器官损伤[57]。临床前研究药物MA-33B8是抗PAI-1的单克隆抗体, 可以有效抑制内毒素诱导新西兰大白兔DIC模型中肾脏PAI-1的表达, 阻止肾脏纤维蛋白沉积, 缓解DIC症状[58]。
4 阻止内皮屏障损伤脓毒症患者体内持续的炎症反应(包括炎症细胞与炎症因子在内组成的复杂网络系统)直接或间接导致内皮细胞过度、持久、广泛的活化, 从而造成内皮屏障损伤, 主要表现为内皮细胞之间血管内皮钙黏蛋白(vascular endothelial cadherin, VE-cadherin)含量减少, 内皮屏障连接紧密性降低, 内皮细胞完整性受到破坏[59]。目前通过阻止内皮损伤治疗脓毒症的临床前研究药物有根赤壳菌素(radicicol)、Slit、降钙素家族成员中介素(intermedin, IMD)和抗菌抗体ABTAA等。Radicicol为Hsp90抑制剂, 可以抑制脓毒症小鼠体内VE-cadherin和β-连环蛋白表达量的降低, 抑制pp60活化与桩蛋白(paxillin)磷酸化, 从而降低内皮屏障高通透性。Radicicol阻止内皮屏障损伤的活性对于伴随内皮功能障碍的脓毒症具有一定治疗作用[60]。内皮细胞特异性可溶性配体Slit, 通过与受体Robo蛋白4结合, 阻止p120-连环蛋白与VE-cadherin解离, 阻止VE-cadherin内化, 增强内皮细胞之间VE-cadherin的作用, 增强内皮屏障功能, 提高混合感染脓毒症模型动物存活率[61]。IMD通过Rab11依赖的通路促进VE-cadherin重新分布, 修复被破坏的内皮屏障, 提高脓毒症模型动物存活率[62]。抗菌抗体ABTAA能与抗血管生成素2 (ANG2)结合, 并激活血管生成素受体TIE2, 增强内皮细胞表面层糖萼, 恢复VE-cadherin表达, 保护内皮屏障完整性, 提高脓毒症模型动物存活率[63]。
5 缓解器官功能障碍脓毒症患者体内多种因素导致组织缺氧, 如形成微血管血栓导致氧气运输量减少、血管内皮屏障损伤引起皮下和体腔水肿使局部氧气供应不足、线粒体损伤引起氧化应激影响氧气利用等。组织缺氧是诱发脓毒性休克、多器官功能障碍的主要原因。目前通过缓解器官功能障碍治疗脓毒症的临床前研究药物包括UCF-101、NaSH和去乙酰化酶3 (sirtuin 3, SIRT3)。UCF-101为Omi/HtrA2 (一种促凋亡的线粒体丝氨酸蛋白酶)的抑制剂, 能够阻止Omi/HtrA2从线粒体向胞浆移动, 并可逆转线粒体内膜复合物I、II、III呼吸作用降低及ATP产量下降, 其对脓毒症大鼠大脑氧化损伤和认知功能损害具有保护作用[64]。NaSH能够缓解脓毒症小鼠心肌细胞线粒体肿胀程度、改善心肌组织与线粒体结构形态、降低cTnI水平、提高细胞内ATP含量, 对脓毒症小鼠心肌线粒体损伤具有保护作用[65]。SIRT3为一种NAD(+)依赖的去乙酰化酶, 对维持线粒体活力至关重要。敲除SIRT3后加剧了脓毒症模型小鼠线粒体损伤、肾脏功能障碍和活性氧自由基(reactive oxygen species, ROS)产生, 说明SIRT 3具有抑制ROS产生、缓解氧化应激与保护肾脏线粒体的作用, 故外源性注射SIRT3可能对脓毒症伴随的肾衰竭具有一定治疗作用[66]。
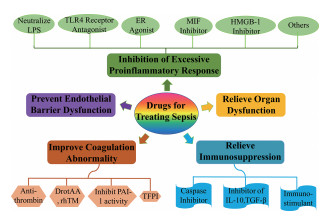
6 总结与展望据估计脓毒症的发病率每年增幅9%, 目前越来越多人认识并关注此病症。脓毒症的病理生理过程复杂, 导致在治疗脓毒症及后续脓毒症引起的休克与多器官衰竭中缺乏有效治疗药物。在治疗脓毒症药物研发中, 抑制过度促炎应答、缓解免疫抑制、改善凝血系统异常、阻止内皮屏障损伤以及缓解器官功能障碍等环节已成为药物设计理想靶位(图 1)。但目前针对这些靶位设计或研发的药物大多处于研究阶段, 很多药物(如HA-1A、eritoran和tifacogin等)在临床试验阶段被淘汰, 仅有的治疗药物DrotAA上市10年后因疗效不佳被撤离市场, 因此仅针对单一靶点可能不会起到快速或持续、有效的治疗作用。在开发治疗脓毒症药物的过程中, 应全面考虑其病理生理过程及其动态变化, 权衡考虑其有效治疗靶位。在脓毒症早期, 应重点关注其免疫细胞过度活化和过度促炎应答过程, 主要针对免疫细胞状态及细胞内一系列信号通路变化, 进行靶点设计并制定治疗方案。在脓毒症中期, 机体主要表现为过度炎症引发的一系列不良后果, 因此设计的新药应重点针对凝血系统异常、内皮屏障损伤、器官功能障碍。在脓毒症后期, 机体内多器官衰竭并且机体的免疫系统严重受到抑制, 此阶段的药物应有效改善免疫抑制状态并防治二重感染。近年来设计多靶点药物是现代药物研究的趋势, 相对于传统药物具有较高安全性及预防耐药性等诸多优点。开发多靶点药物时可采用多种形式:一个药物选择性作用于多个靶点, 即"单药多靶"; 几个单靶点药物联用, 即"多药多靶"; 由于多药联合应用的复杂性, 也可研发"多药多靶固定复方制剂"。在脓毒症治疗过程中, 将机体作为一个整体, 重点关注疾病转归, 根据患者目前所处状态综合考虑诸多因素制定有效治疗方案。本文中提到的一些靶点及相应的在研药物, 希望能对抗脓毒症新药的研发及脓毒症的临床治疗提供帮助。
|
图 1 Drugs for treating sepsis based on pathophysiological processes |
| [1] |
Singer M, Deutschman CS, Seymour CW, et al. The third international consensus definitions for sepsis and septic shock (sepsis-3)[J]. JAMA, 2016, 315: 801-810. |
| [2] |
Hotchkiss RS, Moldawer LL, Opal SM, et al. Sepsis and septic shock[J]. Nat Rev Dis Primers, 2016, 2: 16045. |
| [3] |
Rangel-Frausto MS, Pittet D, Costigan M, et al. The natural history of the systemic inflammatory response syndrome (SIRS):a prospective study[J]. JAMA, 1995, 273: 117-123. |
| [4] |
Angus DC, Linde-Zwirble WT, Lidicker J, et al. Epidemiology of severe sepsis in the United States:analysis of incidence, outcome, and associated costs of care[J]. Crit Care Med, 2001, 29: 1303-1310. |
| [5] |
Lagu T, Rothberg MB, Shieh MS, et al. Hospitalizations, costs, and outcomes of severe sepsis in the United States 2003 to 2007[J]. Crit Care Med, 2012, 40: 754-761. |
| [6] |
Linde-Zwirble WT, Angus DC. Severe sepsis epidemiology:sampling, selection, and society[J]. Crit Care, 2004, 8: 222-226. |
| [7] |
Vincent JL, Relloo J, Marshall J, et al. International study of the prevalence and outcomes of the prevalence and outcomes of infection in intensive care units[J]. JAMA, 2009, 302: 2323-2329. |
| [8] |
Sharp CR, Declue AE, Haak CE, et al. Evaluation of the anti-endotoxin effects of polymyxin B in a feline model of endotoxemia[J]. J Feline Med Surg, 2010, 12: 278-285. |
| [9] |
Luce JM. Introduction of new technology into critical care practice:a history of HA-1A human monoclonal antibody against endotoxin[J]. Crit Care Med, 1993, 21: 1233-1241. |
| [10] |
Hu Z, Murakami T, Suzuki K, et al. Antimicrobial cathelicidin peptide LL-37 inhibits the pyroptosis of macrophages and improves the survival of polybacterial septic mice[J]. Int Immunol, 2016, 28: 245-253. |
| [11] |
Qin X, Zhu G, Huang L, et al. LL-37 and its analog FF/CAP18 attenuate neutrophil migration in sepsis-induced acute lung injury[J]. J Cell Biochem, 2019, 120: 4863-4871. |
| [12] |
Cho EJ, Doh KO, Park J, et al. Zwitterionic chitosan for the systemic treatment of sepsis[J]. Sci Rep, 2016, 6: 29739. |
| [13] |
Chen J, Li X, Li L, et al. Coagulation factors VII, IX and X are effective antibacterial proteins against drug-resistant Gram-negative bacteria[J]. Cell Res, 2019, 29: 711-724. |
| [14] |
Cao C, Chai Y, Shou S, et al. Toll-like receptor 4 deficiency increases resistance in sepsis-induced immune dysfunction[J]. Int Immunopharmacol, 2018, 54: 169-176. |
| [15] |
Perrin-Cocon L, Aublin-Gex A, Sestito SE, et al. TLR4 antagonist FP7 inhibits LPS-induced cytokine production and glycolytic reprogramming in dendritic cells, and protects mice from lethal influenza infection[J]. Sci Rep, 2017, 7: 40791. |
| [16] |
Wang Y, Shan X, Dai Y, et al. Curcumin analog L48H37 prevents lipopolysaccharide-induced TLR4 signaling pathway activation and sepsis via targeting MD2[J]. J Pharmacol Exp Ther, 2015, 353: 539-550. |
| [17] |
Shirey KA, Lai W, Scott AJ, et al. The TLR4 antagonist eritoran protects mice from lethal influenza infection[J]. Nature, 2013, 497: 498-502. |
| [18] |
Opal SM, Laterre P, Francois B, et al. Effect of eritoran, an antagonist of md2-tlr4, on mortality in patients with severe sepsis:the access randomized trial[J]. JAMA, 2013, 309: 1154-1162. |
| [19] |
Opal SM, Palardy JE, Cristofaro P, et al. The activity of pathway-selective estrogen receptor ligands in experimental septic shock[J]. Shock, 2005, 24: 535-540. |
| [20] |
Cristofaro PA, Opal SM, Palardy JE, et al. WAY-202196, a selective estrogen receptor-beta agonist, protects against death in experimental septic shock[J]. Crit Care Med, 2006, 34: 2188-2193. |
| [21] |
Christaki E, Opal SM, Keith JC, et al. Estrogen receptor beta agonism increases survival in experimentally induced sepsis and ameliorates the genomic sepsis signature:a pharmacogenomic study[J]. J Infect Dis, 2010, 201: 1250-1257. |
| [22] |
Jankauskas SS, Wong DWL, Bucala R, et al. Evolving complexity of MIF signaling[J]. Cell Signal, 2019, 57: 76-88. |
| [23] |
Al-Abed Y, Dabideen D, Aljabari B, et al. ISO-1 binding to the tautomerase active site of MIF inhibits its pro-inflammatory activity and increases survival in severe sepsis[J]. J Biol Chem, 2005, 280: 36541-36544. |
| [24] |
Zhang Y, Zeng X, Chen S, et al. Characterization, epitope identification and mechanisms of the anti-septic capacity of monoclonal antibodies against macrophage migration inhibitory factor[J]. Int Immunopharmacol, 2011, 11: 1333-1340. |
| [25] |
Sparkes A, De Baetselier P, Brys L, et al. Novel half-life extended anti-MIF nanobodies protect against endotoxic shock[J]. FASEB J, 2018, 32: 3411-3422. |
| [26] |
Tang D, Kang R, Xiao W, et al. Quercetin prevents LPS-induced high-mobility group box 1 release and proinflammatory function[J]. Am J Respir Cell Mol Biol, 2009, 41: 651-660. |
| [27] |
Yang M, Cao L, Xie M, et al. Chloroquine inhibits HMGB1 inflammatory signaling and protects mice from lethal sepsis[J]. Biochem Pharmacol, 2013, 86: 410-418. |
| [28] |
Yang YI, Woo JH, Seo YJ, et al. Protective effect of brown alga phlorotannins against hyper-inflammatory responses in lipopolysaccharide-induced sepsis models[J]. J Agric Food Chem, 2016, 64: 570-578. |
| [29] |
Zeng L, Kang R, Zhu S, et al. ALK is a therapeutic target for lethal sepsis[J]. Sci Transl Med, 2017, 9: eaan5689.
|
| [30] |
Rosen DA, Seki SM, Fernández-Casta eda A, et al. Modulation of the sigma-1 receptor-IRE1 pathway is beneficial in preclinical models of inflammation and sepsis[J]. Sci Transl Med, 2019, 11: eaau5266.
|
| [31] |
Ward PA. In sepsis, complement is alive and well[J]. Crit Care Med, 2016, 44: 1026-1027. |
| [32] |
Colley CS, Popovic B, Sridharan S, et al. Structure and characterization of a high affinity C5a monoclonal antibody that blocks binding to C5aR1 and C5aR2 receptors[J]. MAbs, 2018, 10: 104-117. |
| [33] |
Angus DC, van der Poll T. Severe sepsis and septic shock[J]. N Engl J Med, 2013, 369: 840-851. |
| [34] |
Boomer JS, To K, Chang KC, et al. Immunosuppression in patients who die of sepsis and multiple organ failure[J]. JAMA, 2011, 306: 2594-2605. |
| [35] |
Shi J, Zhao Y, Wang K, et al. Cleavage of GSDMD by inflammatory caspases determines pyroptotic cell death[J]. Nature, 2015, 526: 660-665. |
| [36] |
Wang Y, Gao W, Shi X, et al. Chemotherapy drugs induce pyroptosis through caspase-3 cleavage of a gasdermin[J]. Nature, 2017, 547: 99-103. |
| [37] |
Weber P, Wang P, Maddens S, et al. VX-166: a novel potent small molecule caspase inhibitor as a potential therapy for sepsis[J]. Crit Care, 2009, 13: R146.
|
| [38] |
Nastase MV, Zeng-Brouwers J, Frey H, et al. An essential role for SHARPIN in the regulation of caspase 1 activity in sepsis[J]. Am J Pathol, 2016, 186: 1206-1220. |
| [39] |
Meisel C, Schefold JC, Pschowski R, et al. Granulocyte-macrophage colony-stimulating factor to reverse sepsis-associated immunosuppression:a double‑blind, randomized, placebo-controlled multicenter trial[J]. Am J Respir Crit Care Med, 2009, 180: 640-648. |
| [40] |
Bo L, Wang F, Zhu J, et al. Granulocyte-colony stimulating factor (G-CSF) and granulocyte-macrophage colony stimulating factor (GM-CSF) for sepsis: a meta-analysis[J]. Crit Care, 2011, 15: R58.
|
| [41] |
Wu J, Zhou L, Liu J, et al. The efficacy of thymosin alpha 1 for severe sepsis (ETASS): a multicenter, single-blind, randomized and controlled trial[J]. Crit Care, 2013, 17: R8.
|
| [42] |
Wang W, Cen Z, Liu L, et al. The efficacy of thymosin alpha 1 for severe sepsis[J]. Chin Crit Care Med, 2016, 36: 783-788. |
| [43] |
Inoue S, Bo L, Bian J, et al. Dose-dependent effect of anti-CTLA-4 on survival in sepsis[J]. Shock, 2011, 36: 38-44. |
| [44] |
Kalechman Y, Gafter U, Gal R, et al. Anti-IL-10 therapeutic strategy using the immunomodulator AS101 in protecting mice from sepsis-induced death:dependence on timing of immunomodulating intervention[J]. J Immunol, 2002, 169: 384-392. |
| [45] |
Gao YL, Lu B, Zhai JH, et al. The parenteral vitamin c improves sepsis and sepsis-induced multiple organ dysfunction syndrome via preventing cellular immunosuppression[J]. Mediators Inflamm, 2017, 2017: 4024672. |
| [46] |
3rd Fowler AA, Truwit JD, Hite RD, et al. Effect of vitamin c infusion on organ failure and biomarkers of inflammation and vascular injury in patients with sepsis and severe acute respiratory failure:the CITRIS-ALI randomized clinical trial[J]. JAMA, 2019, 322: 1261-1270. |
| [47] |
Levi M, van der Poll T. Coagulation and sepsis[J]. Thromb Res, 2017, 149: 38-44. |
| [48] |
Warren BL, Eid A, Singer P, et al. Caring for the critically ill patient. High-dose antithrombin III in severe sepsis:a randomized controlled trial[J]. JAMA, 2001, 286: 1869-1878. |
| [49] |
Allingstrup M, Wetterslev J, Ravn FB, et al. Antithrombin III for critically ill patients:a systematic review with meta-analysis and trial sequential analysis[J]. Intensive Care Med, 2016, 42: 505-520. |
| [50] |
Iba T, Thachil J. Is antithrombin III for sepsis-associated disseminated intravascular coagulation really ineffective?[J]. Intensive Care Med, 2016, 42: 1193-1194. |
| [51] |
Bernard GR, Vincent JL, Laterre PF, et al. Efficacy and safety of recombinant human activated protein C for severe sepsis[J]. N Engl J Med, 2001, 344: 699-709. |
| [52] |
Ranieri VM, Thompson BT, Barie PS, et al. Drotrecogin alfa (activated) in adults with septic shock[J]. N Engl J Med, 2012, 366: 2055-2064. |
| [53] |
Hayakawa M, Yamakawa K, Saito S, et al. Recombinant human soluble thrombomodulin and mortality in sepsis-induced disseminated intravascular coagulation. A multicentre retrospective study[J]. Thromb Haemost, 2016, 115: 1157-1166. |
| [54] |
Abraham E. Tissue factor inhibition and clinical trial results of tissue factor pathway inhibitor in sepsis[J]. Crit Care Med, 2000, 28: S31-S33. |
| [55] |
Abraham E, Reinhart K, Opal S, et al. Efficacy and safety of tifacogin (recombinant tissue factor pathway inhibitor) in severe sepsis:a randomized controlled trial[J]. JAMA, 2003, 290: 238-247. |
| [56] |
Rouch A, Vanucci-Bacqué C, Bedos-Belval F, et al. Small molecules inhibitors of plasminogen activator inhibitor-1-an overview[J]. Eur J Med Chem, 2015, 92: 619-636. |
| [57] |
Tsantarliotou MP, Lavrentiadou SN, Psalla DA, et al. Suppression of plasminogen activator inhibitor-1(PAI-1) activity by crocin ameliorates lipopolysaccharide-induced thrombosis in rats[J]. Food Chem Toxicol, 2019, 125: 190-197. |
| [58] |
Montes R, Declerck PJ, Calvo A, et al. Prevention of renal fibrin deposition in endotoxin-induced DIC through inhibition of PAI-1[J]. Thromb Haemost, 2000, 84: 65-70. |
| [59] |
Flemming S, Burkard N, Renschler M, et al. Soluble VE-cadherin is involved in endothelial barrier breakdown in systemic inflammation and sepsis[J]. Cardiovasc Res, 2015, 107: 32-44. |
| [60] |
Chatterjee A, Snead C, Yetik-Anacak G, et al. Heat shock protein 90 inhibitors attenuate LPS-induced endothelial hyperpermeability[J]. Am J Physiol Lung Cell Mol Physiol, 2008, 294: L755-L763. |
| [61] |
London NR, Zhu W, Bozza FA, et al. Targeting robo 4-dependent slit signaling to survive the cytokine storm in sepsis and influenza[J]. Sci Transl Med, 2010, 2: 23r. |
| [62] |
Xiao F, Wang D, Kong L, et al. Intermedin protects against sepsis by concurrently re-establishing the endothelial barrier and alleviating inflammatory responses[J]. Nat Commun, 2018, 9: 2644. |
| [63] |
Han S, Lee SJ, Kim KE, et al. Amelioration of sepsis by TIE2 activation-induced vascular protection[J]. Sci Transl Med, 2016, 8: 335r. |
| [64] |
Wang P, Hu Y, Yao D, et al. Omi/HtrA2 regulates a mitochondria-dependent apoptotic pathway in a murine model of septic encephalopathy[J]. Cell Physiol Biochem, 2018, 49: 2163-2173. |
| [65] |
Liang D, Huang A, Jin Y, et al. Protective effects of exogenous NaHS against sepsis-induced myocardial mitochondrial injury by enhancing the PGC-1α/NRF2 pathway and mitochondrial biosynthesis in mice[J]. Am J Transl Res, 2018, 10: 1422-1430. |
| [66] |
Zhao WY, Zhang L, Sui MX, et al. Protective effects of sirtuin 3 in a murine model of sepsis-induced acute kidney injury[J]. Sci Rep, 2016, 6: 33201. |
 2020, Vol. 55
2020, Vol. 55


