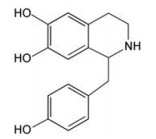
中药附子(Radix Aconiti Lateralis Preparata)为毛莨科植物乌头(Aconite)的子根加工品。在中医临床实践中, 附子被广泛应用于治疗心力衰竭, 心动过缓[1]。去甲乌药碱(higenamine, HG)是中药附子中有效的强心成分。1974年, Kosuge等[2]第一次从日本附子中分离得到, 并鉴定其分子式为C16H17NO3, 结构如图 1所示。HG为苄基异喹啉类生物碱, 白色结晶, 溶于甲醇和水。HG在附子中的含量较少, 为进一步研究其药理作用, 以便用于临床治疗心血管疾病, 1975年中国医学科学院药物研究所用香兰醇为原料合成了HG, 定名为附子I号[3]。2004年, 获国家食品药品监督管理局I类新药临床研究批件[4]。较早的药理学及临床研究证明, HG对心脏有正力性和正时性的强心效应[5]。后期深入研究发现, HG除强心作用外还有多种诸如血管舒张、气管舒张、减少器官缺血再灌的损伤、抗血小板聚集和血栓形成、抗炎及免疫调节等药理作用, 是一个值得深入研究的药物候选物。HG是我国的原创新药, 作为心脏负荷试验药物检测冠心病心肌缺血的3期临床研究已经完成, 目前处于国家药监局审评阶段。因为HG未来可能具有用于临床的潜力, 本文介绍了近年来HG心血管药理的研究进展, 希望为研究人员和临床工作者提供有用的信息。
|
Figure 1 The chemical structure of higenamine (HG) |
总体来看, HG的药动学研究报道较少。Lo等[6]报道了HG在兔体内的药动学特性。新西兰兔静脉注射HG 10、20和30 mg·kg-1后, 血药浓度随着时间变化呈双指数型下降, 平均半衰期为22 min, 说明这种静脉给药方式较适合用于临床; 药时曲线下面积随给药剂量增加而增加, 呈线性关系; 口服HG 50 mg·kg-1 10 min后, 血药浓度迅速达到最大值, 然后迅速下降, 120 min时下降到20 ng·mL-1, 说明HG肠道吸收较好; 静脉与口服给予HG后收集尿液, 均发现24%~33%的葡萄糖醛酸化结合物, 这可能是导致其低生物利用度的原因。Zheng等[7]以纯种Beagle犬为实验动物, 发现静脉注射HG, 代谢符合二室模型, 半衰期为8.6 min, 不同于兔体内的药动学研究结果, 由此提示HG在不同种属动物体内的代谢可能存在差异, 可能导致体内药动学特征参数不同。HG在人体内存在良好的耐受性, 静脉注射最高耐受剂量为24 μg·kg-1[8]。人体静脉给予HG 22.5 μg·kg-1后, 最高血药浓度(Cmax)为15.1~44.0 ng·mL-1, 半衰期为0.133 3 h (0.107~0.166 h), 药时曲线下面积(AUC)为5.39 ng·h·mL-1 (3.2~6.8 ng·h·mL-1)[9]。这也与其他种属动物的药动学参数不同, 提示HG在吸收或代谢环节存在种属差异。
有研究[10]探寻HG低生物利用度的原因及其代谢种属差异对药动学的影响, 采用重组人源化尿苷二磷酸葡醛酸转移酶(uridine diphosphate glucuronic acid transferase, UGTs)与不同种属的肝微粒体进行体外孵育实验, 指出不同人UTG同工酶(UGT 1A6、UGT 1A8、UGT 1A9)参与HG的葡萄糖醛酸化代谢, 推测它的主要代谢器官为肝脏, 并且在肝脏中主要是由UGTlA9代谢; HG在5种不同种属的肝微粒体中葡萄糖醛酸化代谢的清除率不同(豚鼠 > 大鼠 > 小鼠 > 狗 > 人), 表现出不同的酶代动力学特征, 这可能是导致HG在不同种属动物体内的药动学特征不同的原因; 犬与人的葡萄糖醛酸化的酶代动力学特征最为接近, 提示在今后模拟人体代谢的研究中可选用犬为实验动物。HG体内的代谢特征与代谢机制需进一步研究, 为临床安全用药提供基本的理论基础。
2 HG的强心作用一般认为, HG是肾上腺素能受体激动剂, 通过刺激β-肾上腺素能受体(beta-adrenergic receptors, β-AR)产生正力性和正时性效应, 发挥强心作用。在原代培养的新生大鼠心室肌细胞中, HG (10和100 μmol·L-1)可以增加其收缩频率和收缩幅度[11]。在离体实验中[12-15], HG (0.1~800 nmol·L-1)以剂量依赖性方式增加兔左心房张力、豚鼠心室乳头肌、小鼠左心房的收缩力及小鼠右心房的收缩频率; 这些正性变力效应和正性变时效应可被普萘洛尔竞争性阻断, 说明HG是通过β-AR发挥药效的, 其最大反应程度与异丙肾上腺素相当。另外, Liu等[16]对15例心脏病患者进行了HG对左室心功能影响的研究, 发现静脉滴注HG (15~20 μg·min-1)显著增加左心室射血分数及射血速率, 且HG对左心室功能的影响与异丙肾上腺素的反应相似。
研究发现HG除增加心输出量和心率的强心作用外, 还能降低血压和外周血管阻力, 显示出良好的负荷试验药物特性, 具有成为临床心脏负荷试验药物的潜力。Zhang等[17]研究了静脉注射HG (1、2、4 μg·kg-1)各5 min对犬血流动力学及其耐受性和安全性的影响, 以确定其是否可用于心脏负荷试验, 并比较了HG和多巴酚丁胺(dobutamine, DB)的血流动力学效应, 发现HG和DB的血流动力学相近, 还发现HG即使在500 μg·kg-1·min-1的剂量下仍具有显著的耐受性和安全性, 无严重的不良反应。在适当的情况下, HG可以用作DB的替代品。在猪静脉内泵入HG (4 μg·kg-1·min-1), 其正性肌力作用和增强心率作用与DB相比, 起效时间和作用时间更短, HG在不升高血压的同时, 可增加心率、心输出量、心脏耗氧量和冠状动脉血流量[4]。总之, HG在低剂量时显示出良好的负荷试验药物特性, 在高剂量时对实验犬显示出高度耐受性, 可以用于药物负荷试验心肌灌注显像检测心肌是否缺血。目前, 盐酸去甲乌药碱作为我国自主研发的一类新药(心脏负荷试验诊断药物)已完成3期临床研究(2004L02567)。临床研究认为, HG用于诊断心脏功能效果良好。
3 治疗心动过缓HG对治疗心率过缓有显著作用。用甲醛湿敷窦房结区域的方法建立新西兰兔病窦综合征(sick sinus syndrome, SSS)模型。通过边缘耳静脉输注0.04 mg·kg-1 RS-(±)-HG, 在用药前和治疗后20 min分别测定窦房结功能的电生理指标[窦房结恢复时间(sinus node recovery time, SNRT)、矫正窦房结恢复时间(corrected sinus node recovery time, CSNRT)、总窦房传导时间(total sinus atrial conduction time, TSACT)和窦周长(sinus cycle length, SCL)等], 结果发现RS-(±)-HG明显缩短SNRT、CSNRT、TSACT和SCL, 与对照组相比差异有统计学意义。提示外消旋-HG可用于治疗由窦房结损伤引起的心律失常, 其主要电生理机制是提高窦房结自律并改善窦房结和房室传导功能[18]。已经有一些临床研究探索了HG对缓慢性心律失常的影响。中国多中心研究表明, 静脉输注HG 22.5 μg·kg-1可增加心率, 促进窦房结和房室结传导, 增强心肌收缩, 从而改善由不同疾病如冠状动脉疾病、心肌炎、心肌病等导致的缓慢性心律失常患者的窦房结阻滞和房室传导阻滞[19]。总的来说, HG通过调节窦房结功能, 对SSS产生显著的治疗效果。
HG对心脏电生理的直接研究表明, 在治疗心动过缓中, HG可能优于异丙肾上腺素。Yu等[20, 21]通过玻璃微电极技术研究HG (0.4~4 μmol·L-1)对分离的狗浦肯野细胞动作电位的直接影响, 发现HG缩短其动作电位持续时间(action potential duration, APD)及其有效不应期, 并增加Na+和Ca2+电流; 此外, HG可以增加心脏完全阻滞在His束以上患者的心室率。结果提示, 在治疗缓慢性心律失常中, 应用HG似乎比异丙肾上腺素更安全。猪心室肌细胞中, HG (5 μg·mL-1)可以消除由富含K+的溶液诱导的传导阻滞, 在K+浓度为32 mmol·L-1的Tyrode溶液中, 受HG影响动作电位上行显示2个阶段。当添加Mn2+时, 第二阶段消失。结果表明, HG通过激活慢通道并增加缓慢响应纤维中的慢电流, 来增加窦房结的自律性, 并改善窦房传导和房室传导[22]。作者最近研究了HG对豚鼠心脏电生理的直接影响, 发现HG缩短单个心室肌细胞动作电位, 同步性增加心室肌细胞慢激活延迟整流钾电流(IKs, EC50 = 0.27 μmol·L-1)和L-型钙电流(ICa-L, EC50 = 0.64 μmol·L-1); 与异丙肾上腺素不同步的增加IKs和ICa-L而诱发心律失常不同, HG同步增加IKs和ICa-L且没有心律失常发生, 提示HG较异丙肾上腺素安全; HG增加心律, EC50值为0.13 μmol·L-1, 显示窦房结细胞比心室肌细胞对HG更敏感, 提示HG优先作用于窦房结细胞, 推测在治疗缓慢性心律失常中, HG可能比异丙肾上腺素更安全[23]。
4 舒张血管研究显示, HG具有舒张血管作用。在正常麻醉的大鼠体内, 静脉注射HG (0.001~0.3 mg·kg-1)在增加心率的同时也降低了平均动脉压(mean arterial pressure, MAP), 该作用可被选择性β2-AR抑制剂ICI-118, 551或β-AR抑制剂阿替洛尔等所抑制[24]。研究显示, HG (0.01~100 μmol·L-1)可松弛离体大鼠主动脉, 在内皮缺损情况下, HG诱导的大动脉舒张作用减弱; 提示HG对主动脉的作用靶点主要位于血管内皮层, 其通过激活β-AR, 增加cAMP, 诱发血管舒张[25]。最近的研究表明, HG可能是α1-AR的配体, 发挥α1-AR拮抗剂的作用; 在离体实验中, HG介导拮抗肠系膜动脉收缩反应并发挥降压作用; 在正常血压、自发性高血压和苯肾上腺素诱发高血压的动物模型中, 静脉注射HG (0.001~3 mg·kg-1)均有降压作用; 对于其是否确实具有抗高血压作用有待进一步的研究[26]。
5 治疗心力衰竭在临床研究中, 正性肌力药物是治疗心力衰竭的主要药物之一, 已被用于治疗急性心力衰竭伴随射血减少的患者多年[27]。在由氮气饱和的K-H缓冲液诱导豚鼠离体衰竭心脏中, 缓慢和急性输注HG均显著增加心脏收缩; 在注射戊巴比妥钠盐诱导的豚鼠心脏衰竭模型中, 静脉注射HG (10 μg·kg-1)将左室收缩压和收缩速率分别增加了39%和44%[28]。还有研究表明, HG (0.01~10 μmol·L-1)可通过β2-AR抑制豚鼠远端结肠的Na+离子吸收, 刺激电原性K+和Cl-分泌, 调节疾病状态下机体的Na+-H2O滞留, 有利于机体电解质的平衡和心衰的治疗[29]。在血流动力学方面, HG可作为血管扩张剂减少主动脉阻抗和体循环血管阻力从而减少后负荷。此外, HG的作用只维持几分钟, 相对于其他的正性肌力药物也许是一种优势。HG具有显著的血管扩张作用、强效的正性肌力作用及注射后起效快和持续时间短的特点, 对治疗急性心力衰竭和其他低心脏输出疾病非常有价值。
6 减轻心脏缺血/再灌注损伤多种实验研究也表明, HG具有保护心脏和减少心脏缺血/再灌(cardiac ischemia/reperfusion, I/R)损伤的作用。体外新生大鼠心肌细胞模型中, HG (0.5~250 μmol·L-1)治疗可增加多柔比星诱导受损心肌细胞的活力, PI3K抑制剂LY294002则消除HG的细胞保护作用, 提示HG通过激活PI3K/Akt信号通路发挥心脏保护作用[30]。Wu等[1]研究表明, HG可以拮抗原代新生大鼠和成年小鼠心室肌细胞凋亡, 减轻离体和在体小鼠I/R模型中引起的心肌损伤。在新生大鼠和成年小鼠原代心室肌细胞中, HG通过减少细胞凋亡的生化标志物(切割的半胱天冬酶3和9, caspase-3, caspase-9)来抑制细胞凋亡, 该作用可被β2-AR拮抗剂完全抑制; 体内实验中发现, HG在PI3K激活情况下可增加Akt磷酸化水平, 提示HG通过激活β2-AR/PI3K/Akt信号通路, 发挥抗心肌细胞凋亡和I/R损伤的作用。在结扎大鼠左前降支冠状动脉的心肌I/R损伤的模型中, 发现心肌损伤与线粒体依赖性细胞凋亡相关(如细胞色素C释放和caspase-3活性增加)。静脉推注HG显著降低细胞色素C的释放、caspase-3活性和Bax表达水平, 并上调Bcl-2和血红素加氧酶-1 (heme oxygenase-1, HO-1)的表达。此外, DNA链断裂的电泳测定, 免疫组织化学分析和TUNEL染色也支持了HG在I/R损伤中的抗细胞凋亡作用。HO-1酶抑制剂ZnPP IX抑制左心室的HO-1的活性, 同时, HG对心脏的有益作用也被抑制。结果显示, HG通过抗凋亡和增加HO-1的表达来减少心肌I/R诱导的损伤, 并在心肌损伤中起保护作用[31]。总之, HG的抗氧化和抗凋亡能力可能是其发挥保护心脏和减轻缺血/再灌损伤作用的主要机制。
7 抗血小板聚集和抗血栓形成近年来国内外研究表明, HG具有良好的抗血小板聚集作用。体外实验中[32]发现HG分别抑制二磷酸腺苷、胶原蛋白或肾上腺素诱导的人和大鼠血清中血小板聚集, 且对于肾上腺素诱导血小板聚集的抑制作用最强。Pyo等[33]研究发现HG抑制花生四烯酸(arachidonic acid, AA)诱导的血小板聚集, 并在血栓素A2 (thromboxane A2, TXA2)模拟物U46619诱导的血小板聚集的实验中发现HG直接结合TXA2受体(TP受体), 提示HG可竞争性结合TP受体, 拮抗AA诱导的血小板聚集, 发挥抗血小板聚集作用。另外, 研究显示, HG可能与肾上腺素竞争血小板的α2-受体从而抑制其聚集[34, 35]。
在小鼠急性血栓形成模型和大鼠动静脉分流(AV-分流)模型[32]观察到HG抗血栓形成的作用。口服HG可增加小鼠急性血栓形成后的恢复速率, 并降低形成血栓的重量。另外, 在大鼠静脉注射LPS后诱发的弥散性血管内凝血(disseminated intravascular coagulation, DIC)模型中, 发现HG同样发挥抗血栓形成的作用[36, 37]。结果显示, 口服HG可显著改善DIC, 降低血浆中纤维蛋白原水平, 增加纤维蛋白降解产物水平, 延长前凝血时间; 抑制部分凝血酶激活时间的延长, 可致血小板计数降低, 并且明显抑制血清天冬氨酸氨基转移酶和血尿素氮的增加, 防止肝脏和肾脏功能恶化。上述结果提示, HG对治疗DIC和/或伴随多器官衰竭可能具有潜在的临床应用价值。血小板聚集是血栓形成的主要原因。HG主要通过抑制血小板聚集和减少凝血酶原时间的延长来发挥抗血栓作用。因此, HG更少地导致出血, 但其抗血栓形成的机制仍需进一步研究。
8 结论综上所述, 随着研究的深入, 学者们发现HG的多种心血管药理作用并阐明了其部分作用机制(图 2)。HG有正力性和正时性的强心作用, 舒张血管的功能, 传统上用于治疗心力衰竭和心动过缓, 近期已将其作为心脏负荷试验诊断药物。HG可优先作用于窦房结细胞, 用于治疗缓慢性心律失常较异丙肾上腺素安全。HG的抗氧化、抗凋亡作用可以用于保护心脏, 减轻心脏缺血再灌损伤。另外, HG能够抑制转录因子NF-κB的活性, 从而抑制iNOS mRNA的表达及对LPS诱导的NO产物具有抑制作用, 对血小板聚集和血栓形成也有抑制作用, 对动物实验性感染性休克具有改善作用[38]; 提示类似于HG这样具有正性肌力作用并能够抑制iNOS表达的药物, 对感染性休克等疾病诱发心力衰竭的患者可能具有一定的应用前景。总之, HG是极具研究价值和开发前景的药用化合物, 加强对HG药理机制的研究, 有助于HG药物的开发及临床应用。

|
图 2 Schematic diagram of the pharmacology and mechanisms of HG. β-AR: β-Adrenergic receptor; α-AR: α-Adrenergic receptor; TXA2: Thromboxane A2; PI3K: Phosphatidyl inositol-3 kinase; Akt: Protein kinase B; HO-1: Heme oxygenase-1 |
| [1] |
Wu MP, Zhang YS, Zhou QM, et al. Higenamine protects ischemia/reperfusion induced cardiac injury and myocyte apoptosis through activation of beta2-AR/PI3K/AKT signaling pathway[J]. Pharmacol Res, 2016, 104: 115-123. DOI:10.1016/j.phrs.2015.12.032 |
| [2] |
Kosuge T, Yokota M. Letter:studies on cardiac principle of Aconite root[J]. Chem Pharm Bull (Tokyo), 1976, 24: 176-178. DOI:10.1248/cpb.24.176 |
| [3] |
Huang LZ, Zhang DY, Wang CY. Synthesis of higenamine[J]. Acta Pharm Sin (药学学报), 1981, 12: 931-933. |
| [4] |
Zheng YL, Shen R, Yang MF, et al. Experimental study of pharmaceutic stress myocardial perfusion imaging with higenamine[J]. Chin J Cardiol (中华心血管杂志), 2005, 33: 473-475. |
| [5] |
Zhou SJ, Du GY. Effects of higenamine on the cardio-circulatory system[J]. China J Chin Mater Med (中国中药杂志), 2003, 28: 910-913. |
| [6] |
Lo CF, Chen CM. Pharmacokinetics of higenamine in rabbits[J]. Biopharm Drug Dispos, 1996, 17: 791-803. DOI:10.1002/(SICI)1099-081X(199612)17:9<791::AID-BDD993>3.0.CO;2-T |
| [7] |
Zheng YL, Zhang Z, Chen BL, et al. Determinationof higetamine in plasma by HELP-ECD and study on its pharmacokinetics[J]. Chin Pharm J (中国药学杂志), 2004, 52-54. |
| [8] |
Du YR, Li F, Xu RY, et al. Tolerability of higenamine hydrochloride in healthy volunteers[J]. Chin J Clin Pharmacol (中国临床药理学杂志), 2007, 258-260. |
| [9] |
Feng S, Hu P, Jiang J, et al. Determination of higenamine in human plasma and urine using liquid chromatography coupled to positive electrospray ionization tandem mass spectrometry[J]. J Chromatogr B Analyt, 2011, 879: 763-768. DOI:10.1016/j.jchromb.2011.02.019 |
| [10] |
Dong LN. (Oxidation) Matrine and Norepineine Pharmacokinetics and Metabolic Mechanism[(氧化)苦参碱和去甲肾上腺素的药代动力学和代谢机制][D]. Guangzhou: Southern Medical University, 2013.
|
| [11] |
Han HW, Wang JZ, Sun FL, et al. Effect of dl-demethylcoclaurine on cultured rat heart cells (author's transl)[J]. Acta Pharmacol Sin, 1981, 2: 111-114. |
| [12] |
Park CW, Chang KC, Lim JK, et al. Effects of higenamine on isolated heart adrenoceptor of rabbit[J]. Arch Int Pharmacodyn Ther, 1984, 267: 279-288. |
| [13] |
Kimura I, Makino M, Takamura Y, et al. Positive chronotropic and inotropic effects of higenamine and its enhancing action on the aconitine-induced tachyarrhythmia in isolated murine atria[J]. Jpn J Pharmacol, 1994, 66: 75-80. DOI:10.1254/jjp.66.75 |
| [14] |
Kimura I, Chui LH, Fujitani K, et al. Inotropic effects of (+/-)-higenamine and its chemically related components, (+)-R-coclaurine and (+)-S-reticuline, contained in the traditional sino-Japanese medicines "bushi" and "shin-i" in isolated guinea pig papillary muscle[J]. Jpn J Pharmacol, 1989, 50: 75-78. DOI:10.1254/jjp.50.75 |
| [15] |
Kimura I, Islam MA, Kimura M, et al. Potentiation by higenamine of the aconitine-induced positive chronotropic effect in isolated right atria of mice:the effects of cholera toxin, forskolin and pertussis toxin[J]. Biol Pharm Bull, 1996, 19: 1032-1037. DOI:10.1248/bpb.19.1032 |
| [16] |
Liu XJ, Wagner HN, Tao S, et al. Measurement of effects of the Chinese herbal medicine higenamine on left ventricular function using a cardiac probe[J]. Eur J Nucl Med, 1983, 8: 233-236. DOI:10.1007/BF00522511 |
| [17] |
Zhang Z, Liu X, Tao Z, et al. Effects of higeramine on hemodynamics and its tolerability and safety, an experimental study[J]. Nat Med J China (中华医学杂志), 2002, 82: 352-355. |
| [18] |
Yu F, Kong L, Wang S. Influence of racemic higenamine on the sinus node[J]. Exp Ther Med, 2013, 5: 591-595. DOI:10.3892/etm.2012.813 |
| [19] |
Zhang N, Lian Z, Peng X, et al. Applications of higenamine in pharmacology and medicine[J]. J Ethnopharmacol, 2017, 196: 242-252. DOI:10.1016/j.jep.2016.12.033 |
| [20] |
Yu GR, Qiao SY, Zheng DS, et al. Effect of higenamine on action potential of Purkinje's cells and ventricular myocardial cells in dogs[J]. J Tradit Chin Med, 1984, 4: 133-140. |
| [21] |
Yu GR, Chia SY, Zhen DS, et al. Effect of higenamine on action potential of Purkinje and ventricular myocardial cells[J]. Acta Cardiol, 1985, 40: 409-420. |
| [22] |
Yu GR, Wang BY, Zheng DS, et al. Effect of higenamine on action potential of ventricular myocardial cells[J]. J Electrocardiol, 1985, 18: 97-103. DOI:10.1016/S0022-0736(85)80040-6 |
| [23] |
Wang Y, Geng J, Jiang M, et al. The cardiac electrophysiology effects of higenamine in guinea pig heart[J]. Biomed Pharmacother, 2019, 109: 2348-2356. DOI:10.1016/j.biopha.2018.10.022 |
| [24] |
Praman S, Mulvany MJ, Williams DE, et al. Hypotensive and cardio-chronotropic constituents of Tinospora crispa and mechanisms of action on the cardiovascular system in anesthetized rats[J]. J Ethnopharmacol, 2012, 140: 166-178. DOI:10.1016/j.jep.2012.01.006 |
| [25] |
Wong KK, Lo CF, Chen CM, et al. Endothelium-dependent higenamine-induced aortic relaxation in isolated rat aorta[J]. Planta Med, 1997, 63: 130-132. DOI:10.1055/s-2006-957628 |
| [26] |
Zhang N, Qu K, Wang M, et al. Identification of higenamine as a novel alpha1-adrenergic receptor antagonist[J]. Phytother Res, 2019, 33: 708-717. DOI:10.1002/ptr.6261 |
| [27] |
Tariq S, Aronow WS. Use of inotropic agents in treatment of systolic heart failure[J]. Int J Mol Sci, 2015, 16: 29060-29068. DOI:10.3390/ijms161226147 |
| [28] |
Liu WH, Zhou YP, Zeng GY, et al. Effects of DL-demethylcoclaurine on experimental heart failure[J]. Acta Pharm Sin (药学学报), 1988, 23: 81-85. |
| [29] |
Liu W, Sato Y, Hosoda Y, et al. Effects of higenamine on regulation of ion transport in guinea pig distal colon[J]. Jpn J Pharmacol, 2000, 84: 244-251. DOI:10.1254/jjp.84.244 |
| [30] |
Chen YL, Zhuang XD, Xu ZW, et al. Higenamine combined with[J]. Evid Based Complement Alternat Med, 2013, 2013: 1-14. |
| [31] |
Lee YS, Kang YJ, Kim HJ, et al. Higenamine reduces apoptotic cell death by induction of heme oxygenase-1 in rat myocardial ischemia-reperfusion injury[J]. Apoptosis, 2006, 11: 1091-1100. DOI:10.1007/s10495-006-7110-y |
| [32] |
Yun-Choi HS, Pyo MK, Park PM, et al. Anti-thrombotic effects of higenamine[J]. Planta Med, 2001, 67: 619-622. DOI:10.1055/s-2001-17361 |
| [33] |
Pyo MK, Kim JM, Jin JL, et al. Effects of higenamine and its 1-naphthyl analogs, YS-49 and YS-51, on platelet TXA2 synthesis and aggregation[J]. Thromb Res, 2007, 120: 81-86. DOI:10.1016/j.thromres.2006.07.006 |
| [34] |
Yun-Choi HS, Kim MH. Higenamine reduced mortalities in the mouse models of thrombosis and endotoxic shock[J]. Yakhak Hoeji, 1994, 38: 191-196. |
| [35] |
Yun-Choi HS, Parik SW, Lee JR, et al. Platelet anti-aggregating activities of higenamine analogs[J]. Yakhak Hoeji, 1986, 30: 245-252. |
| [36] |
Yun-Choi HS, Pyo MK, Chang KC, et al. The effects of higenamine on LPS-induced experimental disseminated intravascular coagulation (DIC) in rats[J]. Planta Med, 2002, 68: 326-329. DOI:10.1055/s-2002-26741 |
| [37] |
Pyo MK, Lee DH, Kim DH, et al. Enantioselective synthesis of (R)-(+)- and (S)-(-)-higenamine and their analogues with effects on platelet aggregation and experimental animal model of disseminated intravascular coagulation[J]. Bioorg Med Chem Lett, 2008, 18: 4110-4114. DOI:10.1016/j.bmcl.2008.05.094 |
| [38] |
Park JE, Kang YJ, Park MK, et al. Enantiomers of higenamine inhibit LPS-induced iNOS in a macrophage cell line and improve the survival of mice with experimental endotoxemia[J]. Int Immunopharmacol, 2006, 6: 226-233. DOI:10.1016/j.intimp.2005.08.007 |
 2020, Vol. 55
2020, Vol. 55


