2. 湖北康沁药业股份有限公司, 湖北 荆门 448000
2. Hubei Kangqing Pharmaceutical Co., Ltd., Jingmen 448000, China
“疫毒袭肺证”是北京市中医管理局印发的《北京市新型冠状病毒感染的肺炎中医药防治方案》中对新型冠状病毒感染肺炎的中医病证分类。国家卫生健康委员会及国家中医药管理局发布的第5版、第6版《新型冠状病毒感染的肺炎诊疗方案》中提出, 根据其临床特点和流行病学状况, 本病属中医疫病范畴, 根据不同分期及轻重程度, 可分为“寒湿郁肺证”、“湿毒郁肺证”和“寒湿阻肺证”等证型; Miao等[1]分析认为新型冠状病毒从根本上是由“疫”邪引起, 但以“湿”邪为重要特征。因此, 本研究首次在中医寒湿证的基础上结合西医的感染性病原, 采用寒湿刺激+人冠状病毒229E (HCoV-229E)感染小鼠病证结合模型, 复制了与新型冠状病毒相似病理改变的动物模型。此模型的建立不仅可为临床治疗新型冠状病毒肺炎提供推荐用药, 也可为正在进行的临床试验提供临床前数据支持, 对现阶段抗击新型冠状病毒肺炎具有重要意义。
苦参是豆科植物苦参(Sophora flavescens Ait.)的干燥根, 味苦, 性寒, 其主要功效为化热、调元、燥“黄水”、表疹, 治疗瘟病初期、风热、麻疹及风湿性关节炎等病症[2]。《神农本草经》记载苦参可清热燥湿、利尿等。《本草正义》记载“苦参, 大苦大寒, 退热泄降, 荡涤湿火”。Li等[3]详细阐述了苦参抗新型冠状病毒的中医药理论及可能机制。苦参碱是苦参中含量最高的主要活性成分之一, 其分子式为C15H24N2O (图 1A), 属于四环噻嗪啶类。苦参碱具有抗病毒、抗炎、抗肿瘤和抗纤维化等作用, 对治疗小儿肺炎、扁桃体炎和妇科病等病毒引起的相关疾病都具有显著的疗效, 对RNA病毒和DNA病毒也有抑制作用[4-6]。以苦参碱为主要成分的苦参碱氯化钠注射液为抗肿瘤辅助用药, 用于预防肿瘤患者发生恶液质, 改善肿瘤患者生存质量。在湖北省荆州市胸科医院、荆州市中心医院将其用于新型冠状病毒肺炎的临床救治。本研究以病毒复制、宿主淋巴细胞百分比和宿主炎性损伤等环节为切入点, 采用多种药理学和分子生物学技术, 从整体、细胞和分子水平阐明苦参碱氯化钠注射液对人冠状病毒肺炎寒湿疫毒袭肺证小鼠病证结合模型的治疗作用及机制, 为临床用药提供参考。
|
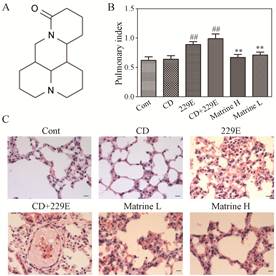
Figure 1 Molecular structure of matrine (A). Inhibition effect of matrine sodium chloride injection on lung index in mice (B). n = 8, x± s. ##P < 0.01 vs Cont group; **P < 0.01 vs CD+229E group. Effects of matrine sodium chloride injection on histological changes in the lung tissues of mice, scale bar: 20 μm (C). Cont: Control; CD: The model of cold-dampness syndrome; 229E: The model of 229E infection; CD+229E: The model combining cold-dampness stimulation with 229E infection; Matrine H: Matrine sodium chloride injection (36.67 mL·kg-1·d-1) treatment after cold-dampness stimulation and 229E infection; Matrine L: Matrine sodium chloride injection (18.33 mL·kg-1·d-1) treatment after cold-dampness stimulation and 229E infection |
动物 Balb/c小鼠, SPF级, 体重(14 ± 1) g, 由北京维通利华实验动物技术有限公司提供, 动物许可证号: SCXK (京) 2016-0011。实验中所有操作均遵循美国国立卫生研究院(NIH)及北京市实验动物伦理委员会的规定, 并经过中国中医科学院中药研究所动物伦理委员会批准。
病毒毒株 人类冠状病毒(HCoV-229E)由中国医学科学院医药生物技术研究所提供, 本实验室传代, -80 ℃冰箱保存备用。
药物及试剂 苦参碱氯化钠注射液, 批号: 181104, 规格: 100 mL/瓶, 苦参碱80 mg与氯化钠0.9 g, 由湖北康沁药业股份有限公司提供。Mouse IL6 Valukine TM ELISA Kit (批号: 951928)、Mouse IL10 Valukine TM ELISA Kit (批号: 185314)、Mouse TNF-α ELISA Kit (批号: 266117)、Mouse INF-γ ELISA Kit (批号: 352764) (美国Bio-Techne公司); Mouse MTL ELISA Kit (批号: 02/2020)、Mouse GAS ELISA Kit (批号: 02/2020) (上海酶联生物技术有限公司); PerCP-Cyanine5.5标记抗小鼠CD4 (RM4-5, 批号: 65-0042)、APC标记抗小鼠CD8a (53-6.7, 批号: 20-0081)、PE标记抗小鼠CD19 (1D3, 批号: 50-0193) (美国Tonbo Biosciences公司); Human Coronavirus (HCoV-229E) Real Time RT-PCR kit (批号: P20191201, 上海之江生物科技股份有限公司); QIAamp病毒RNA纯化试剂盒(163052733, 凯杰企业管理上海有限公司)。
仪器与设备 MSC1.8 A2型生物安全柜、MSC1.2 A2型生物安全柜(美国Thermo公司); QuantStudio 5型Real-Time PCR Instrument (Applied Biosystems公司); Enspire型多功能酶标仪(德国PerkinElmer公司); Accuri C6 Plus型流式细胞仪(美国BD公司)。
人冠状病毒肺炎寒湿疫毒袭肺证小鼠病证结合模型的制备及给药 取Balb/c小鼠48只, 雌雄各半, 按体重等级随机分为6组, 每组8只。动物分组及造模给药方法如下。
正常对照组(Cont) 小鼠置于独立送风隔离笼具, 标准实验室条件下(温度: 22 ± 1 ℃, 相对湿度60%)饲养, 并于第5天开始腹腔注射生理盐水0.04 mL·g-1, 每日1次, 连续3天。
单纯病毒感染模型对照组(229E) 小鼠置于独立送风隔离笼具, 标准实验室条件下(温度: 22 ± 1 ℃, 相对湿度60%)饲养, 于第5、第6天用乙醚轻度麻醉后, 以100TCID50 HCoV-229E病毒液滴鼻感染, 50 μL/只, 并于第1次感染当天开始腹腔注射生理盐水0.04 mL·g-1, 每日1次, 连续3天。
单纯寒湿刺激模型对照组(cold and dampness, CD) 小鼠每天持续置于(90 ± 3) %相对湿度, 无风, 温度4 ± 2 ℃的人工气候箱中, 4 h刺激后取出, 连续7天, 并于第5天开始腹腔注射生理盐水0.04 mL·g-1, 每日1次, 连续3天。
寒湿疫毒袭肺病证结合(寒湿+感染)模型对照组(CD+229E) 小鼠每天持续置于(90 ± 3) %相对湿度, 无风, 温度4 ± 2 ℃的人工气候箱中, 4 h刺激后取出, 连续7天, 于寒湿刺激第5、第6天用乙醚轻度麻醉后, 以100TCID50 HCoV-229E病毒液滴鼻感染, 50 μL/只, 并于第1次感染当天开始腹腔注射生理盐水0.04 mL·g-1, 每日1次, 连续3天。
苦参碱氯化钠注射液高剂量治疗组(36.67 mL·kg-1·d-1, Matrine H) 小鼠每天持续置于(90 ± 3) %相对湿度, 无风, 温度4 ± 2 ℃的人工气候箱中, 4 h刺激后取出, 连续7天, 于寒湿刺激第5、第6天用乙醚轻度麻醉后, 以100TCID50 HCoV-229E病毒液滴鼻感染, 50 μL/只, 并于第1次感染当天开始腹腔注射苦参碱氯化钠注射液, 剂量36.67 mL·kg-1·d-1, 体积0.04 mL·g-1, 每日1次, 连续3天。
苦参碱氯化钠注射液低剂量治疗组(18.33 mL·kg-1·d-1, Matrine L) 小鼠每天持续置于(90 ± 3) %相对湿度, 无风, 温度4 ± 2 ℃的人工气候箱中, 4 h刺激后取出, 连续7天, 于寒湿刺激第5、第6天用乙醚轻度麻醉后, 以100TCID50 HCoV-229E病毒液滴鼻感染, 50 μL/只, 并于第1次感染当天开始腹腔注射苦参碱氯化钠注射液, 剂量18.33 mL·kg-1·d-1, 体积0.04 mL·g-1, 每日1次, 连续3天。
一般状态观察 造模后, 从小鼠活动度、活跃程度、皮肤毛发状态和大便状态等方面每日观察各组小鼠状态。
小鼠外周血T淋巴细胞亚群及B淋巴细胞比例流式检测 感染后第4天, 小鼠摘眼球取血, 将3滴血滴入10 mL磷酸盐缓冲液(PBS)中, 离心后加红细胞裂解液裂解, 用含5%胎牛血清(FBS) PBS封闭30 min后加入流式抗体避光染色30 min, 再加入PBS 1 mL, 2 000 r·min-1、4 ℃离心5 min, 弃上清后, 用含2% FBS的PBS 200 μL重悬细胞, 转移至流式管中, Accuri C6 Plus型流式细胞仪检测。
小鼠肺指数及肺指数抑制率计算 感染后第4天, 小鼠称重后解剖, 取肺组织称重, 按以下公式计算肺指数及肺指数抑制率[7, 8]。
| $ 肺指数 = \frac{{肺湿重}}{{体重}} \times 100 $ | (1) |
| $ \begin{array}{l} 肺指数抑制率 = \\ \;\;\;\;\;\frac{{模型对照组肺指数 - 给药组肺指数}}{{模型对照组肺指数 - 正常对照组肺指数}} \times 100\% \end{array} $ | (2) |
小鼠肺组织中核酸检测(RT-PCR法) 小鼠肺组织称重后, 取部分分装置于-80 ℃低温冰箱中保存; 实验前用液氮研磨, 加核酸提取试剂提取后, 按照HCoV-229E Real Time RT-PCR试剂盒说明书进行检测。
小鼠肺组织中炎性因子检测 小鼠取肺组织称重后, 收集肺组织, 使用超声细胞破碎仪匀浆, -4 ℃离心(1 000 r·min-1, 10 min)备用。按照ELISA各试剂盒说明书进行检测, 使用多功能酶标仪检测450 nm处的吸光度值。
小鼠血清中胃动素(MTL)和胃泌素(GAS)检测 小鼠摘眼球取血, 使血样室温自然凝固20 min, 3 000 r·min-1、4 ℃离心10 min, 仔细吸取上清液。按照ELISA试剂盒说明书进行检测, 使用多功能酶标仪检测450 nm处的吸光度值。
小鼠肺组织HE染色 取小鼠肺组织, 梯度乙醇脱水, 二甲苯透明, 浸蜡包埋, 切片, HE染色, 中性树胶封片, 光学显微镜下观察小鼠肺组织病变。
统计学方法 数据符合正态分布者用x±s表示, 采用SPSS 17.0统计软件进行处理, 方差齐采用t检验, 方差不齐采用X2检验, P < 0.05表示有显著性差异。
结果 1 苦参碱氯化钠注射液对人冠状病毒寒湿疫毒袭肺证小鼠病证结合模型一般状态的改善作用小鼠置于智能人工气候箱寒湿刺激4天后, 出现扎堆不动, 活动度下降、活跃程度降低, 皮肤毛发潮湿打结, 大便增多黏腻等现象。寒湿刺激第5天至感染后第4天, 小鼠仍有上述行为特征及状态, 说明寒湿证模型稳定。229E组小鼠自感染后开始出现活动度下降表现, 皮毛不泽干枯、大便颜色变深变干等特点; 寒湿+229E组小鼠扎堆不动表现更为显著, 皮毛仍然存在潮湿打结表现, 大便出现增多黏腻挂壁表现, 与单纯寒湿组比较, 活跃程度降低更为显著; 苦参碱氯化钠注射液两个剂量组与寒湿+229E组比较, 小鼠活动度和反应能力均显著增加, 皮毛状态有一定程度改善。
2 苦参碱氯化钠注射液对人冠状病毒寒湿疫毒袭肺证小鼠病证结合模型的治疗作用229E组和寒湿+229E组小鼠肺指数均明显增加, 与正常对照组比较有显著性差异(P < 0.01), 寒湿模型组肺指数与正常对照组无显著差异; 将苦参碱氯化钠注射液腹腔注射给药3天后, 高剂量组(36.67 mL·kg-1·d-1)和低剂量组(18.33 mL·kg-1·d-1)肺指数均明显降低, 与寒湿+229E组比较有显著性差异(P < 0.01), 肺指数抑制率分别为86.86%和76.53%, 且有良好的量效相关性。结果见图 1B。病理检测结果(图 1C)显示, 正常对照组小鼠肺部组织未见肿胀, 间质未见明显瘀血及炎性渗出, 结构正常; 寒湿+229E组小鼠肺内组织有大面积片状出血性红染, 病变似毛玻璃样, 肺泡急性衰亡, 肺间质内有大量不同程度渗出性炎症, 细胞破碎较多, 各种细胞成倍分裂, 有部分细胞失去原有状态。肺间质有明显大面积瘀血, 组织水肿, 以及间质黏液渗出; 苦参碱氯化钠注射液两个剂量组与模型组相比肺间质渗出性炎性水肿、瘀血及周围炎性渗出等病变有不同程度减轻。
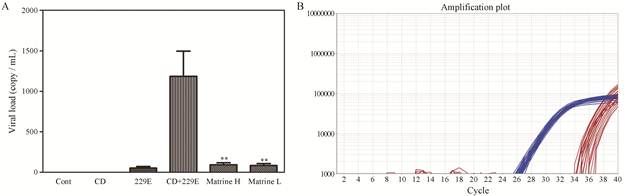
3 苦参碱氯化钠注射液对小鼠肺组织中病毒核酸载量的影响正常组动物肺组织中无HCoV-229E核酸表达; 采用HcoV-229E感染小鼠后, 小鼠肺组织中有明显核酸表达; 苦参碱氯化钠注射液两个剂量组均可明显降低肺组织中病毒核酸载量。结果见图 2。
|
Figure 2 Inhibition effect of matrine sodium chloride injection on virus replication in lung tissue of mice. n = 6, x± s. **P < 0.01 vs CD+229E group |
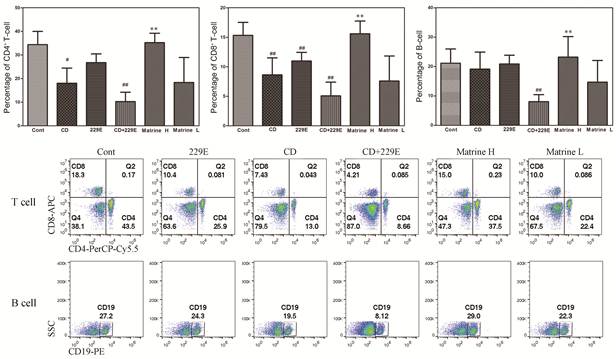
寒湿+229E组小鼠外周血中免疫细胞CD4+ T细胞、CD8+ T细胞及B细胞的百分比均明显降低, 与正常对照组比较有显著性差异(P <0.01);苦参碱氯化钠注射液高剂量组能显著升高外周血中淋巴细胞百分比, 与寒湿+229E组比较有显著性差异(P <0.01)。结果见图 3。
|
Figure 3 The regulating effect of matrine sodium chloride injection on the percentage of CD4+ T cell, CD8+ T cell and B cell in peripheral blood (PB) of mice. n = 6, x± s. #P < 0.05, ##P < 0.01 vs Cont group; **P < 0.01 vs CD+229E group |
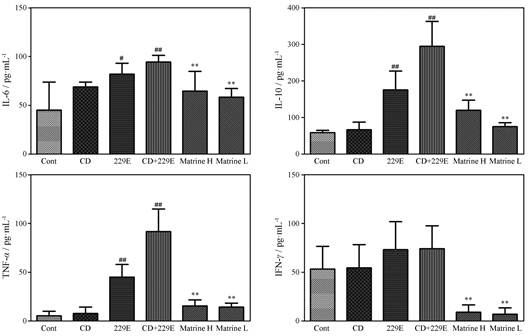
寒湿+229E组小鼠肺组织中炎性因子IL-6、IL-10、TNF-α及IFN-γ均明显增高, 其中IL-6、IL-10及TNF-α的生成量与正常对照组比较有显著性差异(P <0.01);苦参碱氯化钠注射液两个剂量组均能降低炎性因子的生成, 与模型对照组比较有显著性差异(P <0.01)。结果见图 4。
|
Figure 4 The regulating effect of matrine sodium chloride injection on inflammatory factor in lung tissue of mice. n = 6, x± s. #P < 0.05, ##P < 0.01 vs Cont group;**P < 0.01 vs CD+229E group |
MTL和GAS是寒湿证模型小鼠的重要检测指标, 图 5结果显示, 寒湿组和寒湿+229E组小鼠血清中MTL含量显著增高, GAS含量显著降低, 与正常对照组比较有显著性差异(P <0.01);苦参碱氯化钠注射液两个剂量组均能在不同程度上调节MTL和GAS的生成, 与模型对照组比较有显著性差异(P <0.05)。

|
Figure 5 The regulating effect of matrine sodium chloride injection on motilin (MTL) and gastrin (GAS) in serum of mice. n = 6, x± s. ##P < 0.01 vs Cont group; *P < 0.05 vs CD+229E group |
新型冠状病毒肺炎患者临床以发热、乏力和干咳为主要表现。重症患者多在发病1周后逐渐出现呼吸困难、急性呼吸窘迫综合征、脓毒症休克及难以纠正的代谢性酸中毒和出血、凝血功能障碍; 轻症病例可无发热; 部分患者病情危重, 甚至死亡。引起本次疫情的新型冠状病毒, 是迄今发现的第7种可感染人类的冠状病毒, 也是继严重急性呼吸综合征(SARS)和中东呼吸道综合征(MERS)外, 在过去20年间导致大流行和严重呼吸道疾病的第3种冠状病毒[9, 10]。虽然针对新型冠状病毒肺炎的疫苗研究正在各国开展, 但由于疫苗研制过程一般需数月甚至几年, 距离其临床应用可能尚需时日。而临床用药方面, 虽已有近百项与新型冠状病毒相关的临床试验在国家临床试验注册中心注册, 但截至目前, 仍未有特效治疗药物, 也未发现有明确疗效的预防性药物[11]。鉴于疫苗研发的滞后性及临床尚缺乏针对新型冠状病毒肺炎治疗的特效药物及有效手段, 推进实验室新型冠状病毒相关体内外模型的建立、抗病毒药物筛选及机制研究, 为临床提供推荐用药及为现有临床用药提供实验室数据, 对现阶段抗击新型冠状病毒肺炎具有重要意义。
根据《中华人民共和国传染病防治法》规定, 新型冠状病毒肺炎属乙类传染病, 按甲类传染病管理和控制, 其相关实验室研究需在三级生物安全(BSL-3)以上级别实验室进行, 且由于血管紧张素转移酶2 (ACE2)受体在不同种属之间的差异, 新型冠状病毒相关动物模型的建立也局限于灵长类动物及转基因小鼠, 大大限制了抗新型冠状病毒药物的筛选及研究。人类冠状病毒HCoV-229E和新型冠状病毒SARS-CoV-2同属冠状病毒科, 分别为α属和β属, 都具有典型的冠状病毒结构[12, 13]。HCoV-229E与SARS-CoV-2均具有较强传染性, 致病性广泛, 人群普遍易感, 免疫低下人群及有基础疾病人群病症较重。据报道, 在美国, HCoV-229E每2~3年引起一次大流行且一般倾向于波及全美国[14, 15]。
本实验室在中医证候的基础上结合了西医的感染性病原, 采用寒湿刺激+HCoV-229E感染小鼠病证结合模型, 复制了与新型冠状病毒相似病理改变的动物模型, 避免了P3/P4实验条件的限制, 可用于抗新型冠状病毒药物筛选研究。本研究结果显示, 寒湿+229E组小鼠肺指数显著升高, 小鼠肺组织有大面积片状出血性红染, 病变似毛玻璃样, 肺间质有明显大面积瘀血, 组织水肿, 以及间质黏液渗出; 苦参碱氯化钠注射液能显著降低小鼠肺指数, 改善小鼠肺组织病理学损伤。以上结果说明, 寒湿+229E感染造成的人冠状病毒寒湿疫毒袭肺证小鼠病证结合模型稳定, 符合新型冠状病毒性肺炎临床特征, 且苦参碱氯化钠注射液对模型小鼠具有显著的治疗作用。
Liu等[16]通过对临床患者的生化指标分析, 发现淋巴细胞计数减少, 淋巴细胞百分比和中性粒细胞百分比降低, C反应蛋白和乳酸脱氢酶水平升高以及CD8细胞计数降低等可作为新型冠状病毒肺炎严重程度的预测指标。有临床研究表明苦参碱注射液联合常规化疗能够有效促进中晚期口腔癌患者细胞免疫功能恢复, 调节CD4+ T细胞、CD8+ T细胞和IFN-γ等的生成[17]。本实验通过对小鼠外周血淋巴细胞百分比流式细胞术检测发现, 苦参碱氯化钠注射液高剂量组能显著升高模型小鼠CD4+ T细胞、CD8+ T细胞及B细胞的百分比降低, 提示苦参碱氯化钠注射液治疗新型冠状病毒肺炎的机制可能与调节免疫细胞百分比有关。
大量临床研究结果显示, 新型冠状病毒感染患者血清中IL-1β、IFN-γ和单核细胞趋化因子-1 (MCP-1)等炎症因子水平升高, 与非重症加强护理病房(ICU)患者相比, ICU患者血清中趋化因子配体CXCL-10、MCP-1、TNF-α、巨噬细胞炎性蛋白-1 (MIP-1)、IL-2、IL-7和IL-10等因子水平显著升高[18]。多数参与一线救治的临床专家分析认为新型冠状病毒感染重症患者病情迅速进展, 出现急性呼吸窘迫综合征的可能原因与“细胞因子风暴”有关[19, 20], 引起了社会各界的广泛关注。“细胞因子风暴”是指当病毒感染机体后, 可迅速激活病原性T细胞, 产生粒细胞-巨噬细胞集落刺激因子(GM-CSF)和IL-6等因子, 进一步激活多种细胞因子和化学趋化因子, 从而诱导产生失控过激的炎症反应, 阻塞肺泡与毛细血管间的气体交换, 引起急性呼吸窘迫综合征和多器官衰竭[21]。Liu等[22]通过分子对接和药理实验研究发现TNF-α是苦参碱发挥抗炎作用的靶标之一。Lu等[23]发现苦参碱可显著降低糖尿病肾病患者血清IL-6和TNF-α水平, 在治疗糖尿病肾病中具有抑制炎症反应的作用。本研究结果显示, 寒湿+229E组小鼠肺组织匀浆液中IL-6、IL-10和TNF-α生成量显著增加, 与正常对照组比较有显著差异, IFN-γ生成量有一定程度升高, 但与正常对照组比较无显著差异; 苦参碱氯化钠注射液高、低剂量组均能显著降低小鼠肺组织中IL-6、IL-10、TNF-α和IFN-γ的含量, 说明苦参碱氯化钠注射液可通过抑制炎症因子生成发挥对人冠状病毒肺炎寒湿疫毒袭肺证病证结合模型小鼠的治疗作用。
综上所述, 本研究结果表明, 苦参碱氯化钠注射液对冠状病毒肺炎寒湿疫毒袭肺病证结合小鼠模型具有显著的治疗作用, 对模型组小鼠肺指数抑制率高达86.86%和76.53%, 其机制与抑制病毒复制、调节免疫功能和抑制炎症因子释放有关。本研究为苦参碱氯化钠注射液作为临床救治新型冠状病毒肺炎药物提供了极具价值的实验室数据, 也为防治新型冠状病毒肺炎药物筛选提供了可推广的示范性研究。
| [1] |
Miao Q, Cong XD, Wang B, et al. TCM understanding and thinking of pneumonitis infected by SARS-CoV-2[J]. J Tradit Chin Med (中医杂志), 2020. |
| [2] |
He H, Shang XY, Song SJ. Research progress of matrine and its preparations[J]. World Sci Technol Mod Tradit Chin Med Mater Med (世界科学技术——中医药现代化), 2016, 18: 1099-1107. |
| [3] |
Li Z, Yu KX. Study on the mechanism of Sophora flavescens multi-pathway against coronavirus[J]. Chin Tradit Herb Drugs (中草药), 2020. |
| [4] |
Cao J, Wei RJ, Deng RY, et al. Research progress and prospect on the mechanism of matrine and oxymatrine inhibiting tumor[J]. Chin Tradit Herb Drugs (中草药), 2019, 50: 753-760. |
| [5] |
Zhao X, Sun N, Bai XY, et al. Inhibitory effect and mechanism of matrine on PRRSV in vitro[J]. Chin J Vet Med (中国兽医杂志), 2013, 33: 808-812. |
| [6] |
Quan X. Study on Matrine Against Bovine Papilloma Virus-infected C127 Cells (苦参碱抗牛乳头状瘤病毒感染C127细胞研究)[D]. Harbin: Northeast Agricultural University, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10224-1015397032.htm
|
| [7] |
Bao YY, Gao YJ, Cui XL. Effect of Shufeng Jiedu capsules as a broad-spectrum antibacterial[J]. BioSci Trends, 2016, 10: 74-78. DOI:10.5582/bst.2015.01172 |
| [8] |
Yao RM, Mao X, Cui XL, et al. Effect of Chuankezhi injection on prevention and treatment of H1N1 influenza virus in mice[J]. Chin J Exper Tradit Med Formulae (中国实验方剂学杂志), 2019, 25: 43-49. |
| [9] |
Munster VJ, Koopmans M, Doremalen NV, et al. A novel coronavirus emerging in china-key questions for impact assessment[J]. New Engl J Med, 2020. DOI:10.1056/NEJMp2000929 |
| [10] |
Elisabeth M. China coronavirus:what do we know so far?[J]. Brit Med J, 2020. |
| [11] |
Wang HR, Wang Q. Research progress of novel coronavirus related drugs and biological products[J]. Acta Pharm Sin (药学学报), 2020. DOI:10.16438/j.0513-4870.2020-0137 |
| [12] |
Myint SH. Human coronavirus infections[M]. New York: Springer US, 1995.
|
| [13] |
Catharine IP, Hilary DM, Anthony SF. Coronavirus infections-more than just the common cold[J]. Am Med Assoc, 2020. DOI:10.1001/jama.2020.0757 |
| [14] |
Shuai X, Wei X, Qian W, et al. Peptide-based membrane fusion inhibitors targeting HCoV-229E spike protein HR1 and HR2 domains[J]. Int J Mol Sci, 2018, 19: 487. DOI:10.3390/ijms19020487 |
| [15] |
Bertram S, Dijkman R, Habjan M, et al. TMPRSS2 activates the human coronavirus 229E for cathepsin-independent host cell entry and is expressed in viral target cells in the respiratory epithelium[J]. J Virol, 2013, 87: 6150-6160. DOI:10.1128/JVI.03372-12 |
| [16] |
Liu YX, Yang Y, Zhang C, et al. Study on clinical and biochemical indicators related to lung injury in patients with new coronavirus (2019-nCoV) infection[J]. Sci Sin Vitae (中国科学生命科学), 2020. |
| [17] |
Zhao WP, Li HF, Ma YM, et al. Effects of matrine injection on immune function and prognosis in patients with advanced oral cancer[J]. Hebei Med J (河北医药), 2019, 41: 3385-3388. |
| [18] |
Huang C, Wang Y, Li X, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China[J]. Lancet, 2020. DOI:10.1016/S0140-6736(20)30183-5 |
| [19] |
Chen N, Zhou M, Don X, et al. Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China:a descriptive study[J]. Lancet, 2020. DOI:10.1016/S0140-6736(20)30211-7 |
| [20] |
Zhang JW, Hu X, Jin PF. Cytokine storm induced by SARS-CoV-2 and the drug therapy[J]. Chin Pharm J (中国药学杂志), 2020. |
| [21] |
Ren Y, Yao MC, Huo XQ, et al. Study on treatment of "cytokine storm" by anti-SARS-CoV-2 prescriptions based on arachidonic acid metabolic pathway[J]. China J Chin Mater Med (中国中药杂志), 2020. DOI:10.19540/j.cnki.cjcmm.20200224.405 |
| [22] |
Liu X, Liang YH, Zhao XQ, et al. Synthesis, anti-inflammatory activity evaluation and molecular docking of matrine TNF-α inhibitors[J]. Comput Appl Chem, 2016, 33: 521-524. |
| [23] |
Lu YH, Yi H, Ji QQ. Effects of matrine on serum IL-6, TNF-α levels and insulin sensitivity in patients with diabetic nephropathy[J]. Chin J Clinic (Elect Ed)[中华医师杂志(电子版)], 2015, 9: 4585-4588. |
 2020, Vol. 55
2020, Vol. 55


