2. 中国医学科学院、北京协和医学院药物研究所, 新药作用机制研究与药效评价北京市重点实验室, 北京 100050
2. Beijing Key Laboratory of New Drug Mechanisms and Pharmacological Evaluation Study, Institute of Materia Medica, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100050, China
自2019年12月引起新型冠状病毒肺炎(novel coronavirus pneumonia, NCP) (WHO将该疾病命名为" Coronavirus Disease 2019" , COVID-19)的病原已被确认为SARS-CoV-2 (severe acute respiratory syndrome coronavirus 2), 该病毒与SARS-CoV和中东呼吸道综合征冠状病毒(Middle East respiratory syndrome-related coronavirus, MERS-CoV)类似, 都属于网巢病毒目(Nidovirales)冠状病毒科(Coronaviridae)冠状病毒属(Coronavirinae) β冠状病毒。流行病学研究显示, 截至2020年2月20日24时, 中国内地累积报告确诊病例75 465例, 现存疑似病例5 206例, 累计死亡病例2 236例[1]。
随着对疾病认识和诊疗经验的积累, 国家卫生健康委员会和国家中医药管理局颁发的《新型冠状病毒肺炎诊疗方案》已经推出了试行第六版, 根据所公布的阶段性临床研究结果, 《方案》将第五版提出的“目前仍然没有确认有效的抗病毒治疗药物”去除, 并提出了明确的药物推荐。在疫情突发, 且确诊人数众多的情况下, 快速发现并确认治疗SARS-CoV-2感染药物是当务之急。通过检索中国临床试验注册中心和美国临床试验数据库(Clinicaltrials.gov)数据, 截至2020年2月14日, 共检索到148项(中国平台115项, 美国平台33项)与COVID-19治疗相关注册临床试验, 其中属于化学药物的临床治疗方案共30项(中国平台19项, 美国平台11项), 共涉及14种药物。通过对这14种药物进行分析, 作者认为开展COVID-19临床试验药物的遴选可能是基于如下原则, 即已上市或临床在研安全性较高的药物, 其中大部分有明确的抗冠状病毒活性报道。本文在简要介绍SARS-CoV-2感染过程的基础上, 梳理并对这些药物的研究基础进行系统调研, 试图较全面地总结并分析为应对此次新冠肺炎紧急疫情各研究机构采用化学药物治疗SARS-CoV-2感染患者的科学依据。需要指出, 目前多数用于治疗COVID-19的临床试验尚在启动阶段, 其中有些临床试验的患者招募尚未启动, 因此希望业界关注这些试验的进展, 期待通过科学正规的试验设计、实施及数据统计, 尽快确认有明确治疗效果的药物, 为尽早结束疫情提供治疗手段, 也为未来出现疫情时快速合理拓展药物适应症提供线索。
1 冠状病毒及其感染细胞的过程SARS-CoV-2与SARS-CoV和MERS-CoV同为单正链RNA病毒, 可编码至少8种蛋白, 其中包括4种结构蛋白:表面刺突蛋白S (spike, 蛋白S)、外壳蛋白(envelope, 蛋白E)、膜蛋白(membrane, 蛋白M)和核衣壳蛋白(nucleocapsid, 蛋白N); 4种非结构蛋白: 3-胰凝乳蛋白酶样蛋白酶(3-chymotrypsin-like protease, 3CLpro)、木瓜蛋白酶样蛋白酶(papain-like protease, PLpro)、解旋酶(helicase)及RNA依赖性RNA聚合酶(RNA-dependent RNA polymerase, RdRp)。有研究显示, 与SARS-CoV类似, SARS-CoV-2蛋白S可识别并结合宿主表面受体血管紧张素转移酶2 (angiotensin-converting enzyme 2, ACE2)[2], 使病毒吸附于细胞表面。一般认为, 冠状病毒进入宿主细胞是经pH依赖途径, 即当病毒吸附在细胞表面后, 细胞膜内陷, 病毒被内化, 经内体酸化, 病毒包膜与溶酶体膜融合, 病毒RNA释放至胞浆。此后, 病毒RdRp首先被合成, 该聚合酶识别冠状病毒基因组正链RNA并以其为模板合成负链RNA, 然后再以负链RNA为模板合成亚基因组小片段正链RNA和正链基因组RNA。在胞浆内, 核糖体以亚基因组小片段正链RNA为模板, 翻译生成前体蛋白。此后, 蛋白N与新合成的基因组RNA结合, 在蛋白M的参与下, 到达内质网, 与蛋白S整合并从内质网膜释放。同时, 蛋白酶对子代病毒前体蛋白切割, 成为成熟蛋白。此后, 子代病毒由高尔基体转移至细胞膜并释放至细胞外[3]。理论上, 对SARS-COV-2生命周期任何环节予以干预都可阻断病毒的感染过程, 如阻断病毒进入(与受体识别或融合过程)、抑制病毒复制过程(抑制RNA聚合酶)或干预病毒蛋白成熟过程(蛋白酶抑制剂)等。
2 治疗新冠肺炎注册临床试验中所涉及的化学药物通过检索中国临床试验注册中心和美国临床试验数据库数据, 截止到2020年2月14日, 共检索到148项用于治疗COVID-19相关注册临床试验, 其中涉及化学药物的临床治疗方案共30项, 共14种药物, 其化学结构见图 1。本文将逐一对它们的原适应症、已有抗病毒研究结果, 特别是抗冠状病毒的数据进行总结和分析, 以期理解该药物用于新冠肺炎治疗的科学依据。
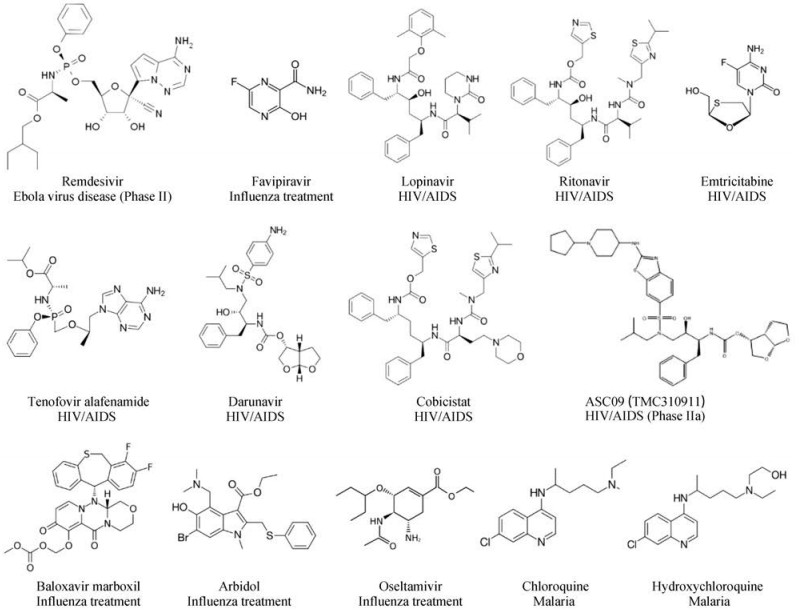
|
Figure 1 Name, structure, and original indication of chemical drugs in clinical trials to treat Coronavirus Disease 2019 (COVID-19) |
瑞德西韦是吉利德公司(Gilead Science, Inc.)研发的核苷类广谱抗病毒药物, 该药物最初是针对西非爆发的埃博拉和马尔堡疫情研发的靶向丝状病毒RdRp的病毒复制抑制剂[4]。瑞德西韦是前药, 通过静脉给药, 入血后被代谢为GS-441524。GS-441524是一种腺苷核苷酸类似物, 被磷酸激酶三磷酸后成为活性代谢物(见下图), 从而抑制RNA病毒的RdRp。研究显示, 除对丝状病毒有效外, 该药物对沙粒病毒、亨尼帕病毒及冠状病毒也都有较好活性。
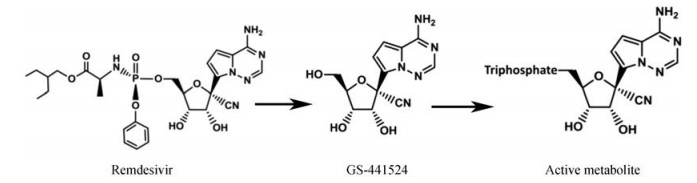
|
瑞德西韦对冠状病毒活性研究数据较完整, 该药物可抑制SARS-CoV复制(EC50: 0.01~0.069 μmol·L-1), 皮下给药50 mg·kg-1可显著降低感染SARS-CoV小鼠体内病毒载量, 并改善肺功能[5]; 同时, 瑞德西韦对MERS-CoV体外感染也有抑制作用(EC50: 0.03~0.58 μmol·L-1)[5]。最新研究显示, 在恒河猴体内感染MERS-CoV 12 h后静脉注射瑞德西韦(5 mg·kg-1), 可显著降低猴肺部病毒载量, 对病毒感染引起的肺病变有显著减缓作用[6]。
此次新冠状病毒疫情爆发后, 瑞德西韦得到了广泛关注, 学界普遍预期瑞德西韦可能通过抑制SARS-CoV-2 RdRp阻断负链RNA、亚基因组mRNA和子代病毒基因组RNA的合成, 最终实现对病毒复制的抑制, 而此后的药效学研究也证实了人们的想法。研究结果显示, 瑞德西韦对SARS-CoV-2体外半数抑制浓度为0.77~1.76 μmol·L-1[7]。鉴于瑞德西韦在抗埃博拉临床试验中表现出的高安全性, 我国于2020年2月5日和6日分别批准了瑞德西韦用于轻度/中度SARS-CoV-2感染患者(NCT04252664)和重度感染患者(NCT04257656), 两个临床试验都采用随机双盲给药, 受试患者首日静脉给予200 mg瑞德西韦, 此后8天每天100 mg, 对照组为安慰剂。预期2020年4月临床试验结束。目前业界对瑞德西韦寄予厚望, 若临床试验结果能证明其有效性, 则对缓解此次疫情将有重大作用和意义。
2.2 法匹拉韦(favipiravir)法匹拉韦也是核苷类广谱抗病毒药物, 由富士胶片富山化学株式会社(FUJIFILM Toyama Chemical Co., Ltd.)研发。法匹拉韦是前药, 入血后被代谢成为其活性代谢物法匹拉韦呋喃核糖核酸-5′-三磷酸酯(favipiravir-ribofuranosyl-5'-triphosphate, favipiravir-RTP) (见下图), 该活性代谢物对RNA病毒RdRp有抑制作用。该药物最初适应症定位于抗流感病毒[8], 后续研究显示该药物对几乎所有RNA病毒都有抑制活性, 如西尼罗河病毒、黄热病病毒、肠病毒和埃博拉病毒等[9]。
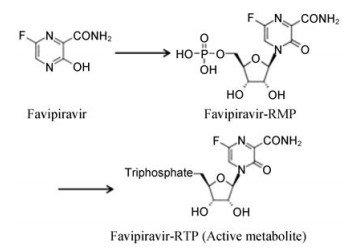
|
与瑞德西韦有明确的对冠状病毒(SARS-CoV和MERS-CoV)复制抑制的研究数据不同, 虽然很多研究论文中都提出过法匹拉韦可能对冠状病毒有效, 但经查询, 并未检索到法匹拉韦抗SARS-CoV或MERS-CoV试验数据。此次疫情爆发后, 科学家检测了法匹拉韦体外抗SARS-CoV-2的活性, 其半数有效浓度为61.88 μmol·L-1[7], 高于其体外抗流感病毒半数有效浓度(EC50: 3~20 μmol·L-1)[10]。截至2020年2月14日, 共有3项关于法匹拉韦用于治疗新冠肺炎的临床试验被注册。
2.3 洛匹那韦/利托那韦(lopinavir/ritonavir, LPV/r)洛匹那韦/利托那韦片(商品名:克力芝)是艾伯维(AbbVie Inc.)研发的抗艾滋病药物, 在我国已上市。洛匹那韦是人类免疫缺陷病毒(human immunodeficiency virus, HIV)蛋白酶抑制剂, 可以阻断Gag-Pol前体蛋白被切割为成熟蛋白, 最终导致产生未成熟的、无感染力的病毒颗粒; 利托那韦是针对HIV-1和HIV-2天冬氨酰蛋白酶的活性拟肽类抑制剂, 通过抑制HIV蛋白酶使该酶无法切割Gag-Pol前体蛋白, 导致生成非成熟形态的HIV颗粒, 从而无法启动新的一轮感染。利托那韦可通过抑制细胞色素P450 3A (cytochrome P450 family 3, subfamily A, CYP3A)将洛匹那韦暴露量保持在较高水平[11]。
洛匹那韦/利托那韦抗冠状病毒的研究始于2003年非典疫情, 当时为应对疫情, 科学家也采用了“老药新用”的理念, 希望在短时间内发现可用于临床的药物。当人们以SARS-CoV的3CLpro作为靶点进行筛选时, 发现HIV蛋白酶抑制剂洛匹那韦与SARS-CoV 3CLpro有高亲和力, 体外药效学实验也显示洛匹那韦可抑制SARS-CoV导致的细胞病变, 半数抑制浓度为1.6~12.8 μmol·L-1[12, 13]。随后, 多项临床试验显示, 使用激素和利巴韦林的SARS-CoV患者同时服用洛匹那韦/利托那韦片剂(每12小时口服洛匹那韦400 mg +利托那韦100 mg)较仅用激素和利巴韦林患者的死亡率显著降低[14]。2012年MERS-CoV出现后, 科学家又采用非人灵长类动物模型评价了洛匹那韦/利托那韦药效学, 结果显示, 给予感染MERS-CoV的狨猴洛匹那韦/利托那韦(每公斤体重每天口服洛匹那韦12 mg +利托那韦3 mg)可显著改善动物临床指标, 减缓肺组织病变及降低病毒载量[15]。2014年一项研究对比了洛匹那韦/利托那韦在SARS-CoV和MERS-CoV的体外半数有效浓度, 分别为17.1和8.0 μmol·L-1[16], 该值在艾滋病患者血药浓度范围(8~24 μmol·L-1)内。遗憾的是, 目前尚未检索到该药物抗SARS-CoV-2的活性数据。2016年关于应对冠状病毒的综述也认为该药开展冠状病毒临床试验具有可行性[17]。2020年1月26日我国学者提出, 洛匹那韦/利托那韦可以作为一种试验性疗法用于新冠肺炎(尤其是新发感染者)的抗病毒治疗, 并建议尽快开展临床研究[18]。
洛匹那韦/利托那韦被列入中华人民共和国国家卫生健康委员会于2020年1月22日发布的《新型冠状病毒感染的肺炎诊疗方案(试行第三版)》, 也是首个被写入诊疗方案中的抗HIV药物, 截至2月14日, 中国临床试验注册平台注册洛匹那韦/利托那韦相关抗SARS-CoV-2临床试验共13项, 是所有抗SARS-CoV-2化学药物临床试验中注册项目最多且普遍被作为对照组的一种药物。
2.4 恩曲他滨(emtricitabine)和丙酚替诺福韦(tenofovir alafenamide)恩曲他滨是核苷类逆转录酶抑制剂, 是艾滋病治疗药物, 它通过抑制逆转录酶阻断HIV的逆转录过程, 该药物通常与丙酚替诺福韦联用。有研究显示, 恩曲他滨也可有效抑制乙型肝炎病毒(hepatitis B, HBV)逆转录过程。临床试验显示, 恩曲他滨对乙肝患者肝组织病变、病毒载量及生化指标均有改善作用[19]。
丙酚替诺福韦也是核苷类逆转录酶抑制剂, 临床一般与其他抗逆转录病毒药物联合使用治疗艾滋病。丙酚替诺福韦对HBV复制也显示较好的抑制作用, 2016年获批用于慢性乙型肝炎患者的治疗[20]。
经检索, 除HIV和HBV外, 未见有关恩曲他滨和丙酚替诺福韦抗其他病毒活性的报道。在此次治疗新冠肺炎临床试验方案中, 有一项将恩曲他滨/丙酚替诺与洛匹那韦/利托那韦联用(ChiCTR2000029468)用于COVID-19的治疗。
2.5 达芦那韦/考比司他(darunavir/cobicistat)达芦那韦/考比司他(商品名:普泽力)是西安杨森研发治疗艾滋病药物, 2018年7月在我国上市, 用于与其他抗逆转录病毒药物联合使用治疗HIV感染成年患者。达芦那韦是HIV-1蛋白酶二聚化和催化活性抑制剂, 可选择性抑制病毒感染细胞中HIV编码的Gag-Pol前体蛋白被切割, 从而阻断成熟的、具有感染性病毒颗粒形成[21]。考比司他对CYP3A介导的代谢具有抑制作用, 可增加CYP3A底物达芦那韦的暴露量。经检索, 在此次疫情发生前, 未见关于达芦那韦和/或考比司他抗冠状病毒感染的活性报道。
此次疫情发生后, 李兰娟团队开展了该药物抗新冠病毒的体外活性研究, 发现达芦那韦在300 μmol·L-1浓度下能显著抑制病毒复制, 与未用药物处理组比较, 抑制效率达280倍[22]。此外, 另有一项基于机器学习运算模型的研究, 预测达芦那韦可用于治疗新型冠状病毒的感染, 其对SARS-CoV-2螺旋酶的Kd值为90.38 nmol·L-1[23]。2020年2月3日和5日, 两项关于达芦那韦/考比司他治疗新冠肺炎的临床试验被注册, 将分别在武汉(ChiCTR2000029541)和上海(NCT04252274)开展临床研究。
2.6 ASC09 (TMC310911)ASC09是HIV蛋白酶抑制剂, ASC09/利托那韦复方片(ASC09F)由歌礼药业开发, 用于治疗艾滋病, 目前Ⅱa期临床试验已结束。经检索, 未见关于ASC09抗冠状病毒活性研究数据。目前有4项关于ASC09用于新冠肺炎临床试验注册, 其中3项的干预措施为联合α-干扰素雾化吸入(ChiCTR2000029759, ChiCTR2000029603)和联合奥司他韦(NCT04261270)。
2.7 阿比朵尔(arbidol)阿比朵尔, 也称阿比多尔, 是1993年由Trofimov等[24]合成并由前苏联Moscow-based Masterlek™药厂研发的抗流感药物, 用于甲型和乙型流感病毒引起的呼吸道疾病[25]。在我国阿比朵尔也作为人用药和兽药用于流感的预防和治疗[26]。有报道显示, 阿比朵尔对49株甲型和乙型流感病毒体外感染均有抑制作用, 其半数抑制浓度为7.2~23 μmol·L-1[27]。除抗流感病毒活性外, 研究还发现阿比朵尔对多种RNA病毒的感染也有阻断作用, 如副粘病毒科的呼吸道合胞病毒[28]、小核糖核酸病毒科的脊髓灰质炎病毒、鼻病毒和柯萨奇病毒[29, 30]、本扬病毒科的汉坦病毒、披盖病毒科的基孔肯亚病毒、肝DNA病毒科的乙型肝炎病毒[31]、黄病毒科的丙型肝炎病毒[32]等。现有研究显示, 阿比朵尔是通过干扰网格蛋白(clathrin)通路阻断病毒进入过程[33]。
关于冠状病毒进入机制的研究首先是在SARS-CoV开展的, 研究显示SARS-CoV进入宿主细胞的过程确实与网格蛋白内化途径相关[34]。2008年, 关于阿比朵尔抗冠状病毒的活性首次被报道, 研究显示, 当阿比朵尔的终浓度为50 μmol·L-1时, 对SARS-CoV体外感染有显著抑制作用[35]。经检索, 未能获得关于阿比朵尔对SARS-CoV或MERS-CoV体内药效学研究数据。此次疫情出现后, 2020年2月4日李兰娟团队[22]通过新闻发布, 该研究团队初步研究结果显示, 阿比朵尔(10~30 μmol·L-1)可抑制新冠病毒感染, 并对病毒致细胞病变也有抑制作用。截至2020年2月14日, 共6项关于阿比朵尔用于治疗新冠肺炎的临床试验被注册。
2.8 奥司他韦(oseltamivir)奥司他韦(商品名:达菲)是罗氏(Roche)原研抗流感病毒药物, 1999年和2001年分别在瑞士和我国上市。该药物通过特异性抑制流感病毒神经氨酸酶, 抑制成熟的流感病毒颗粒从宿主细胞表面释放, 对感染人的甲型和乙型流感病毒及禽流感病毒均有效。2003年非典疫情期间, 人们最初认为病原可能是流感病毒, 因此临床上有采用奥司他韦治疗患者的方案。一项对感染SARS-CoV的幸存者治疗期间服用或未服用奥司他韦的长期随访研究显示, 两组患者临床结果没有显著差异[36]。
目前已知的所有冠状病毒本身均不表达神经氨酸酶。虽然有研究显示人体神经氨酸酶可能作为一些冠状病毒的辅受体[37]参与了病毒进入宿主细胞的过程, 但尚无研究结果显示奥司他韦对冠状病毒感染有抑制活性; 此外, SARS-CoV体外活性实验显示, 奥司他韦(终浓度10 mmol·L-1)对SARS-CoV致细胞病变未见显著抑制作用[38]。法国在应对中东呼吸道综合征疫情时, 发现疑似感染MERS-CoV患者中感染流感病毒比例较大, 因此针对疑似感染MERS-CoV患者给予奥司他韦治疗, 但当核酸检测结果确认该患者非流感病毒感染时, 停止使用奥司他韦[39]。
2020年2月3日, 据泰国网站报道, 该国临床专家使用大剂量奥司他韦联合抗HIV药物的“鸡尾酒疗法”对一位70岁来自武汉的中国女性SARS-CoV-2感染患者进行治疗, 快速并显著改善了患者临床症状, 在用药48 h后病毒监测呈现阴性[40]。我国《新型冠状病毒肺炎诊疗快速指南(第一版)》奥司他韦被推荐为经验性抗微生物治疗用药, 但随后多版诊疗方案未再提及该药物。经检索, 有两项涉及奥司他韦治疗COVID-19临床试验注册(NCT04255017和NCT04261270)。
2.9 巴洛沙韦酯(baloxavirmarboxil)巴洛沙韦酯是塩野义制药公司(Shionogi & Co., Ltd.)和罗氏制药共同研发的新型抗流感药物, 2018年获FDA批准上市, 用于治疗出现流感症状不超过48 h的甲型和乙型流感病毒感染患者, 此外针对重症流感适应症的临床试验(NCT03684044)正在进行。巴洛沙韦酯作用机制是通过选择性抑制流感病毒cap依赖型核酸内切酶(cap-dependent endonuclease)阻断流感病毒聚合酶催化活性, 最终抑制流感病毒mRNA的生成, 阻断病毒的复制。冠状病毒并无cap依赖型核酸内切酶表达, 目前未检索关于巴洛沙韦酯抗冠状病毒活性的报道。针对COVID-19, 共有两项涉及使用巴洛沙韦酯的临床试验被注册(ChiCTR2000029548和ChiCTR2000029544)。
2.10 氯喹(chloroquine)氯喹是一种口服抗疟药, 1934由汉斯·安德萨格(Hans Andersag)发明[41]。氯喹对卵形疟原虫和三日疟原虫(P. malariae)血液期, 以及敏感的间日疟原虫和恶性疟原虫(P. falciparum)具有抑制活性。目前认为氯喹通过抑制红细胞聚合酶, 使疟原虫不能分解和利用血红蛋白, 从而抑制疟原虫繁殖[42]。此外, 氯喹也用于治疗肠道外阿米巴原虫症、类风湿性关节炎及红斑狼疮[43]。
由于氯喹的低成本、高安全性和免疫调节活性, 科学家对氯喹开展了深入研究, 发现氯喹对HIV-1和HIV-2体外感染具有抑制活性, 半数抑制浓度为3 μmol·L-1[44]; 临床Ⅰ期、Ⅱ期研究显示, 每日口服氯喹800 mg, 可降低艾滋病患者病毒载量[45, 46]。此外, 多个体外抗病毒研究显示, 氯喹对多种病毒复制有抑制活性, 如甲型流感病毒[47]、寨卡病毒[48]、登革热病毒[49]和埃博拉病毒[50]等。
在氯喹抗冠状病毒研究方面, 早在20世纪80和90年代就有氯喹抗小鼠肝炎病毒(mouse hepatitis virus, MHV)[51, 52]和抑制牛冠状病毒(bovine coronavirus, BCoV)复制[53]的报道。SARS-CoV出现后, 研究显示氯喹对SARS-CoV体外感染有抑制活性(EC50: 0.1~8.8 μmol·L-1[54, 55]); 体内药效学结果显示, 氯喹对SARS-CoV感染引起的高炎症反应有缓解作用, 但不会显著降低SARS-CoV载量[56]。对于氯喹抑制SARS-CoV复制的机制, 有研究认为氯喹可影响宿主细胞的糖基化转移酶或糖基修饰酶的活性, 从而干扰ACE2正确糖基化过程, 最终阻断了SARS-CoV与其受体ACE2的结合[55]。2014年, 人们开展了氯喹抗MERS-CoV的研究, 体外药效学结果显示氯喹可抑制MERS-CoV感染, 其半数抑制浓度为3.0~6.275 μmol·L-1[16, 57], 但未见关于氯喹用于治疗冠状病毒感染临床试验数据可供参考[58]。在此次新冠疫情发生后, 科研工作者测试了氯喹体外抗SARS-CoV-2药效学, 结果显示其半数抑制浓度为1.13 μmol·L-1, EC90为6.90 μmol·L-1[7]。截止到2020年2月14日, 共有4项单独或联合使用氯喹治疗新冠肺炎的临床试验被注册。
2.11 羟氯喹(hydroxychloroquine)羟氯喹也是一种抗疟药, 1955年被批准上市, 其研发是基于氯喹抗疟活性, 临床适应症与氯喹大致相同, 仅相较于氯喹更多用于类风湿性关节炎和红斑狼疮的治疗[59]。
当氯喹展现了抗病毒活性后, 也有科学家关注了羟氯喹, 除有报道羟氯喹用于辅助治疗艾滋病患者外[46, 60], 还有研究显示羟氯喹对埃博拉病毒[61]、寨卡病毒[62]和登革病毒[63]体外感染具有抑制作用。对于冠状病毒体外感染, 羟氯喹也表现出抑制作用, 其中抑制SARS-CoV活性为EC50: 8.0~34 μmol·L-1[57, 64], 对MERS-CoV半数抑制浓度为8.279 μmol·L-1[57], 对猫冠状病毒(feline coronavirus)半数抑制浓度为28 μmol·L-1[64]。经检索, 未见关于羟氯喹用于治疗冠状病毒感染临床试验数据可供参考[58], 也未见羟氯喹抗SARS-CoV-2活性数据报道。截至2月14日, 共有5项使用羟氯喹治疗新冠肺炎的临床试验被注册。
以上14种药物单独或联合其他药物用于治疗COVID-19临床试验的情况归纳于表 1。
| Table 1 Chemical drugs in clinical registration to treat Corona Virus Disease 2019(COVID-19). SARS-CoV-2: Severe acute respiratory syndrome coronavirus 2; MERS-CoV: Middle East respiratory syndrome-related coronavirus. The information is retrieved from the Chinese Clinical Trial Registry (http://www.chictr.org.cn/index.aspx) and Clinicaltrials.gov as of February 14th, 2020 of which without ethics review is excluded |
进入新世纪以来, 由冠状病毒引发的重大疫情已经出现3次, 而其中两次发生在我国, 这也提示我国应加大针对冠状病毒基础研究、流行病学研究和药物研究力度。通过对14个申请COVID-19临床试验药物机制进行分析, 它们分属为RdRp抑制剂、HIV逆转录酶抑制剂、HIV蛋白酶抑制剂、抗流感病毒药物和已证实对冠状病毒有抑制活性的抗疟药。除基于机制相似(如RdRp抑制剂或pH依赖病毒进入广谱抑制剂)的理念外, 既往针对冠状病毒药效学或临床数据成为了申报治疗COVID-19临床试验的重要依据。在抗病毒药物研究领域, 开展病毒实验条件的特殊性制约抗病毒新药的研发和对“老药”抗病毒活性的确认, 所以当疫情出现时, 可供临床应用的药物和参考数据较少。为了应对未来可能出现的疫情, 建议国家建立规模化抗病毒药效学评价平台, 为我国抗冠状病毒和其他高传染性/致病性病毒药物研发提供大规模的活病毒药效学评价服务。
从抗病毒药物的临床应用上看, 药物通常是在特定的病程阶段发挥作用, 如奥司他韦仅在流感患者出现症状48 h内应用有效, 但不能用于治疗流感病毒肺炎。从现有临床资料分析, COVID-19疾病发展与其他呼吸道病毒感染疾病有差异, 且患者个体间病程差异大, 提示该病毒致病情况相对复杂。因此建议在设计临床试验时, 在参考科学研究的基础上, 结合疾病和患者临床特征, 制定个体化给药方案; 目前多个COVID-19临床试验方案也对此加以关注, 在患者群体的选择和治疗方案上进行了个体化设计。
另外, 从药物的安全性角度进行分析, 虽然“老药”的临床安全性已得到证实, 但其中一些药物存在较严重的不良反应, 如《新型冠状病毒感染的肺炎诊疗方案(试行第六版)》明确指出“注意洛匹那韦/利托那韦相关腹泻、恶心、呕吐、肝功能损害等不良反应”, 奥司他韦也在上市后多年被FDA提出警告可能致幻。此外, 2个用于COVID-19的临床试验药物(瑞德西韦和ASC09)的原适应症尚处于临床试验阶段。还有一些药物上市时间也较短, 因此需要在此次临床试验中格外关注“新适应症”下的安全性。
自COVID-19疫情爆发后, 科研和临床专家迅速启动体外活性评价及百余项临床试验, 体现了我国基础与临床研究的实力及科研、医疗人员的努力。希望COVID-19患者能从这些临床试验中受益, 更希望通过科学的试验设计、实施和数据统计, 发现有明确疗效的抗SARS-CoV-2药物, 为此次疫情的早日结束及将来可能出现的致病冠状病毒治疗提供依据和方案。
| [1] |
National Health and Health Commission of the people's Republic of China. Update on the 2019 Novel Coronavirus in China 02/20/202024: 00[EB/OL]. 2020[2020-02-20]. http://www.nhc.gov.cn/xcs/yqfkdt/202002/ac1e98495cb04d36b0d0a4e1e7fab545.shtml.
|
| [2] |
Zhou P, Yang XL, Wang XG, et al. A pneumonia outbreak associated with a new coronavirus of probable bat origin[J]. Nature, 2020. |
| [3] |
Masters PS. The molecular biology of coronaviruses[M]//Karl Maramorosch AS. Advances in Virus Research.Vol 66. New York: Academic Press, 2006: 193-292.
|
| [4] |
Warren TK, Jordan R, Lo MK, et al. Therapeutic efficacy of the small molecule GS-5734 against Ebola virus in rhesus monkeys[J]. Nature, 2016, 531: 381-385. DOI:10.1038/nature17180 |
| [5] |
Sheahan TP, Sims AC, Graham RL, et al. Broad-spectrum antiviral GS-5734 inhibits both epidemic and zoonotic coronaviruses[J]. Sci Transl Med, 2017, 9. |
| [6] |
de Wit E, Feldmann F, Cronin J, et al. Prophylactic and therapeutic remdesivir (GS-5734) treatment in the rhesus macaque model of MERS-CoV infection[J]. Proc Natl Acad Sci, 2020, 201922083. |
| [7] |
Wang M, Cao R, Zhang L, et al. Remdesivir and chloroquine effectively inhibit the recently emerged novel coronavirus (2019-nCoV) in vitro[J]. Cell Res, 2020, 30: 1-3. DOI:10.1038/s41422-019-0249-1 |
| [8] |
Sidwell RW, Barnard DL, Day CW, et al. Efficacy of orally administered T-705 on lethal avian influenza A (H5N1) virus infections in mice[J]. Antimicrob Agents Chemother, 2007, 51: 845-851. DOI:10.1128/AAC.01051-06 |
| [9] |
Furuta Y, Takahashi K, Shiraki K, et al. T-705(favipiravir) and related compounds:novel broad-spectrum inhibitors of RNA viral infections[J]. Antiviral Res, 2009, 82: 95-102. DOI:10.1016/j.antiviral.2009.02.198 |
| [10] |
Baranovich T, Wong SS, Armstrong J, et al. T-705(favipiravir) induces lethal mutagenesis in influenza A H1N1 viruses in vitro[J]. J Virol, 2013, 87: 3741-3751. DOI:10.1128/JVI.02346-12 |
| [11] |
Guo J, Guo Y. The in vitro HAART pharmacodynamics study with dolutegravir as the "anchor"[J]. Acta Pharm Sin (药学学报), 2015, 50: 50-58. |
| [12] |
Chen F, Chan KH, Jiang Y, et al. In vitro susceptibility of 10 clinical isolates of SARS coronavirus to selected antiviral compounds[J]. J Clin Virol, 2004, 31: 69-75. |
| [13] |
Chu CM, Cheng VCC, Hung IFN, et al. Role of lopinavir/ritonavir in the treatment of SARS:initial virological and clinical findings[J]. Thorax, 2004, 59: 252-256. DOI:10.1136/thorax.2003.012658 |
| [14] |
Stockman LJ, Bellamy R, Garner P. SARS:systematic review of treatment effects[J]. PLoS Med, 2006, 3: e343. DOI:10.1371/journal.pmed.0030343 |
| [15] |
Chan JFW, Yao Y, Yeung ML, et al. Treatment with lopinavir/ritonavir or interferon-β1b improves outcome of MERS-CoV infection in a nonhuman primate model of common marmoset[J]. J Infect Dis, 2015, 212: 1904-1913. DOI:10.1093/infdis/jiv392 |
| [16] |
de Wilde AH, Jochmans D, Posthuma CC, et al. Screening of an FDA-approved compound library identifies four small-molecule inhibitors of middle east respiratory syndrome coronavirus replication in cell culture[J]. Antimicrob Agents Chemother, 2014, 58: 4875-4884. DOI:10.1128/AAC.03011-14 |
| [17] |
Zumla A, Chan JFW, Azhar EI, et al. Coronaviruses-drug discovery and therapeutic options[J]. Nat Rev Drug Discov, 2016, 15: 327-347. DOI:10.1038/nrd.2015.37 |
| [18] |
Jiang H, Deng HF, Wang Y, et al. The possibility of using Lopinave/Litonawe (LPV/r) as treatment for novel coronavirus 2019-nCoV pneumonia:a quick systematic review based on earlier coronavirus clinical studies[J]. Chin J Emerg Med (中华急诊医学杂志), 2020, 29: 182-186. |
| [19] |
Lim SG, Ng TM, Kung N, et al. A double-blind placebo-controlled study of emtricitabine in chronic hepatitis B[J]. Arch Intern Med, 2006, 166: 49-56. DOI:10.1001/archinte.166.1.49 |
| [20] |
USDHHS. FDA approves Vemlidy® (tenofovir alafenamide) for chronic hepatitis B in adults[EB/OL]. 2016[2016-11-21]. https://www.hhs.gov/hepatitis/blog/2016/11/21/fda-approves-vemlidy-tenofovir-alafenamide-for-chronic-hepatitis-b-in-adults.html.
|
| [21] |
Lascar RM, Benn P. Role of darunavir in the management of HIV infection[J]. HIV AIDS (Auckl), 2009, 1: 31-39. |
| [22] |
Hubei Daily (湖北日报). "Abidol and darunavir appears to effectively supress coronavirus": Prof. Lanjuan Li and her team in Wuhan[EB/OL]. 2020[2020-02-05]. http://wjw.hubei.gov.cn/bmdt/ztzl/fkxxgzbdgrfyyq/jkkp/202002/t20200205_2019431.shtml.
|
| [23] |
Beck BR, Shin B, Choi Y, et al. Predicting commercially available antiviral drugs that may act on the novel coronavirus (2019-nCoV), Wuhan, China through a drug-target interaction deep learning model[J]. bioRxiv, 2020. DOI:10.1101/2020.01.31.929547 |
| [24] |
Trofimov FA, Tsyshkova NG, Zotova SA, et al. Synthesis of a new antiviral agent, arbidole[J]. Pharm Chem J, 1993, 27: 75-76. DOI:10.1007/BF00772858 |
| [25] |
Boriskin YS, Leneva IA, Pecheur EI, et al. Arbidol:a broad-spectrum antiviral compound that blocks viral fusion[J]. Curr Med Chem, 2008, 15: 997-1005. DOI:10.2174/092986708784049658 |
| [26] |
Berendsen BJA, Wegh RS, Essers ML, et al. Quantitative trace analysis of a broad range of antiviral drugs in poultry muscle using column-switch liquid chromatography coupled to tandem mass spectrometry[J]. Anal Bioanal Chem, 2012, 402: 1611-1623. DOI:10.1007/s00216-011-5581-3 |
| [27] |
Leneva IA, Burtseva EI, Yatsyshina SB, et al. Virus susceptibility and clinical effectiveness of anti-influenza drugs during the 2010; 2011 influenza season in Russia[J]. Int J Clin Infect Dis, 2016, 43: 77-84. DOI:10.1016/j.ijid.2016.01.001 |
| [28] |
Shi L, Xiong H, He J, et al. Antiviral activity of arbidol against influenza A virus, respiratory syncytial virus, rhinovirus, coxsackie virus and adenovirus in vitro and in vivo[J]. Arch Virol, 2007, 152: 1447-1455. DOI:10.1007/s00705-007-0974-5 |
| [29] |
Brooks MJ, Burtseva EI, Ellery PJ, et al. Antiviral activity of arbidol, a broad-spectrum drug for use against respiratory viruses, varies according to test conditions[J]. J Med Virol, 2012, 84: 170-181. DOI:10.1002/jmv.22234 |
| [30] |
Zhong Q, Yang Z, Liu Y, et al. Antiviral activity of arbidol against Coxsackie virus B5 in vitro and in vivo[J]. Arch Virol, 2009, 154: 601-607. DOI:10.1007/s00705-009-0346-4 |
| [31] |
Zhao C, Zhao Y, Chai H, et al. Synthesis and in vitro anti-hepatitis B virus activities of some ethyl 5-hydroxy-1H-indole-3-carboxylates[J]. Bioorg Med Chem, 2006, 14: 2552-2558. DOI:10.1016/j.bmc.2005.11.033 |
| [32] |
Pécheur EI, Lavillette D, Alcaras F, et al. Biochemical mechanism of hepatitis C virus inhibition by the broad-spectrum antiviral arbidol[J]. Biochemistry, 2007, 46: 6050-6059. DOI:10.1021/bi700181j |
| [33] |
Blaising J, Lévy PL, Polyak SJ, et al. Arbidol inhibits viral entry by interfering with clathrin-dependent trafficking[J]. Antiviral Res, 2013, 100: 215-219. DOI:10.1016/j.antiviral.2013.08.008 |
| [34] |
Wang H, Yang P, Liu K, et al. SARS coronavirus entry into host cells through a novel clathrin- and caveolae-independent endocytic pathway[J]. Cell Res, 2008, 18: 290-301. DOI:10.1038/cr.2008.15 |
| [35] |
Khamitov RA, Loginova SY, Shchukina VN, et al. Antiviral activity of arbidol and its derivatives against the pathogen of severe acute respiratory syndrome in the cell cultures[J]. Vopr Virusol, 2008, 53: 9-13. |
| [36] |
Guo YH, Li J, Chen QF, et al. Long-term outcomes in patients with severe acute respiratory syndrome treated with oseltamivir:a 12-year longitudinal study[J]. Int J Clin Exp Med, 2019, 12: 12464-12471. |
| [37] |
Li W, Hulswit RJG, Widjaja I, et al. Identification of sialic acid-binding function for the Middle East respiratory syndrome coronavirus spike glycoprotein[J]. Proc Natl Acad Sci, 2017, 114: E8508-E8517. DOI:10.1073/pnas.1712592114 |
| [38] |
Tan ELC, Ooi EE, Lin CY, et al. Inhibition of SARS coronavirus infection in vitro with clinically approved antiviral drugs[J]. Emerg Infect Dis, 2004, 10: 581-586. DOI:10.3201/eid1004.030458 |
| [39] |
Bleibtreu A, Jaureguiberry S, Houhou N, et al. Clinical management of respiratory syndrome in patients hospitalized for suspected Middle East respiratory syndrome coronavirus infection in the Paris area from 2013 to 2016[J]. BMC Infect Dis, 2018, 18: 331. DOI:10.1186/s12879-018-3223-5 |
| [40] |
Physicians Weekly. Cocktail of flu, HIV drugs appears to help fight coronavirus: Thai doctors[EB/OL]. 2020[2020-02-03]. https://www.physiciansweekly.com/cocktail-of-flu-hiv/.
|
| [41] |
Scott HH. Manson's tropical diseases[J]. Br Med Bull, 1951, 7: 217-218. DOI:10.1093/oxfordjournals.bmb.a073839 |
| [42] |
Hempelmann E. Hemozoin biocrystallization in Plasmodium falciparum and the antimalarial activity of crystallization inhibitors[J]. Parasitol Res, 2007, 100: 671-676. DOI:10.1007/s00436-006-0313-x |
| [43] |
Drugs.com. Chroloquine[EB/OL]. https://www.drugs.com/mtm/chloroquine.html.
|
| [44] |
Savarino A, Gennero L, Chen HC, et al. Anti-HIV effects of chloroquine:mechanisms of inhibition and spectrum of activity[J]. AIDS, 2001, 15: 2221-2229. DOI:10.1097/00002030-200111230-00002 |
| [45] |
Savarino A, Shytaj IL. Chloroquine and beyond:exploring anti-rheumatic drugs to reduce immune hyperactivation in HIV/AIDS[J]. Retrovirology, 2015, 12: 51-60. DOI:10.1186/s12977-015-0178-0 |
| [46] |
Sperber K, Louie M, Kraus T, et al. Hydroxychloroquine treatment of patients with human immunodeficiency virus type 1[J]. Clin Ther, 1995, 17: 622-636. DOI:10.1016/0149-2918(95)80039-5 |
| [47] |
Ooi E, Chew J, Loh J, et al. In vitro inhibition of human influenza A virus replication by chloroquine[J]. Virol J, 2006, 3: 39-41. DOI:10.1186/1743-422X-3-39 |
| [48] |
Delvecchio R, Higa L, Pezzuto P, et al. Chloroquine, an endocytosis blocking agent, inhibits Zika virus infection in different cell models[J]. Viruses, 2016, 8: 322-336. DOI:10.3390/v8120322 |
| [49] |
Borges MC, Castro LA, Fonseca BALD. Chloroquine use improves dengue-related symptoms[J]. Mem Inst Oswaldo Cruz, 2013, 108: 596-599. DOI:10.1590/S0074-02762013000500010 |
| [50] |
Darryl F, David S, Joseph BP, et al. Lack of protection against Ebola virus from chloroquine in mice and hamsters[J]. Emerg Infect Dis, 2015, 21: 1065. DOI:10.3201/eid2106.150176 |
| [51] |
Mizzen L, Hilton A, Cheley S, et al. Attenuation of murine coronavirus infection by ammonium chloride[J]. Virology, 1985, 142: 378-388. DOI:10.1016/0042-6822(85)90345-9 |
| [52] |
Krzystyniak K, Dupuy JM. Entry of mouse hepatitis virus 3 into cells[J]. J Gen Virol, 1984, 65: 227-231. DOI:10.1099/0022-1317-65-1-227 |
| [53] |
Payne HR, Storz J, Henk WG. Initial events in bovine coronavirus infection:analysis through immunogold probes and lysosomotropic inhibitors[J]. Arch Virol, 1990, 114: 175-189. DOI:10.1007/BF01310747 |
| [54] |
Vincent MJ, Bergeron E, Benjannet S, et al. Chloroquine is a potent inhibitor of SARS coronavirus infection and spread[J]. Virol J, 2005, 2: 69-78. DOI:10.1186/1743-422X-2-69 |
| [55] |
Savarino A, Di Trani L, Donatelli I, et al. New insights into the antiviral effects of chloroquine[J]. Lancet Infect Dis, 2006, 6: 67-69. DOI:10.1016/S1473-3099(06)70361-9 |
| [56] |
Barnard DL, Day CW, Bailey K, et al. Evaluation of immunomodulators, interferons and known in vitro SARS-CoV inhibitors for inhibition of SARS-CoV replication in BALB/c mice[J]. Antiviral Chem Chemother, 2006, 17: 275-284. DOI:10.1177/095632020601700505 |
| [57] |
Dyall J, Coleman CM, Hart BJ, et al. Repurposing of clinically developed drugs for treatment of Middle East respiratory syndrome coronavirus infection[J]. Antimicrob Agents Chemother, 2014, 58: 4885-4893. DOI:10.1128/AAC.03036-14 |
| [58] |
Mo Y, Fisher D. A review of treatment modalities for Middle East respiratory syndrome[J]. J Antimicrob Chemother, 2016, 71: 3340-3350. DOI:10.1093/jac/dkw338 |
| [59] |
Hydroxychloroquine[M]//LiverTox: Clinical and Research Information on Drug-Induced Liver Injury. Bethesda: National Institute of Diabetes and Digestive and Kidney Diseases, 2012.
|
| [60] |
Paton NI, Goodall RL, Dunn DT, et al. Effects of hydroxychloroquine on immune activation and disease progression among HIV-infected patients not receiving antiretroviral therapy:a randomized controlled trial[J]. JAMA, 2012, 308: 353-361. |
| [61] |
Madrid PB, Panchal RG, Warren TK, et al. Evaluation of Ebola virus inhibitors for drug repurposing[J]. ACS Infect Dis, 2015, 1: 317-326. DOI:10.1021/acsinfecdis.5b00030 |
| [62] |
Shiryaev SA, Mesci P, Pinto A, et al. Repurposing of the anti-malaria drug chloroquine for Zika virus treatment and prophylaxis[J]. Sci Rep, 2017, 7: 15771. DOI:10.1038/s41598-017-15467-6 |
| [63] |
Wang LF, Lin YS, Huang NC, et al. Hydroxychloroquine-inhibited dengue virus is associated with host defense machinery[J]. J Interferon Cytokine Res, 2014, 35: 143-156. |
| [64] |
Biot C, Daher W, Chavain N, et al. Design and synthesis of hydroxyferroquine derivatives with antimalarial and antiviral activities[J]. J Med Chem, 2006, 49: 2845-2849. DOI:10.1021/jm0601856 |
 2020, Vol. 55
2020, Vol. 55


