2. 海军军医大学药学院, 上海 200433;
3. 西宁联勤保障中心药品仪器监督检验站, 甘肃 兰州 730050
2. School of Pharmacy, Naval Medical University, Shanghai 200433, China;
3. Drug Instrument Supervision and Inspection Station, Xining Joint Logistics Support Center, Lanzhou 730050, China
随着疾病谱和病菌谱的扩展, 临床上对抗真菌药物(以白念珠菌为代表)的需求愈加迫切。白念珠菌(Candida albicans)是一种机会性致病真菌, 通常共生于健康个体中, 对机体不产生侵害, 但偶尔会引起健康个体的黏膜(口腔/阴道)表面感染, 极少数情况下会引起皮肤或指甲的感染。但是, 在免疫功能低下的宿主中它可能引起危及生命的系统性和血液性感染[1-3], 死亡率高达50%[4], 它是严重真菌感染以及医院感染的常见原因[5]。临床高发病率、致死率与耐药率促使找寻新药的脚步不断加快。当前对于抗白念珠菌药物的筛选主要基于96孔板, 采用美国临床和实验室标准协会(Clinical and Laboratory Standards Institute, CLSI)建立的最新标准M27-A3中的微量液基稀释法进行。然而, 传统孔板法需要配制不同浓度药物溶液, 需要细胞铺板、给药、标记等一系列繁杂费时的操作过程, 所以亟需建立更快速的抗真菌药物筛选新方法。
微流控芯片的通道尺度多是微米级, 雷诺数很小, 液体处于层流状态[6], 两种或多种不同试剂能够保持各自流型不变流入同一通道, 只在相与相接触面上发生分子扩散或反应。基于层流扩散和混合原理, 目前出现了很多浓度梯度微流控芯片[7-11], 这些芯片形成的浓度梯度具有较高的稳定性和重现性, 且通过改变通道构型设计、流体进样流量比、初始浓度设置以及组合顺序, 可以获得一系列复杂的浓度梯度[12, 13], 简化了繁杂的操作过程, 显著减少了细胞和试剂消耗量, 同时可以进行高通量筛选。该技术目前已广泛应用于细胞培养[14-16]、模式生物趋化[17]、基因分析[18]、药物筛选[19-21]等研究领域。
课题组在前期研究中, 通过液滴微流控芯片所生成的液滴, 水相由单一成分组成, 一次实验通常只能考察一种实验条件[22], 为了提高药物筛选的通量, 本研究在课题组前期工作的基础上, 在水相引入了浓度梯度生成器, 自行研制了一种浓度梯度液滴微流控芯片作为筛选平台, 以阿尔玛蓝作指示剂, 分别测试了氟康唑、两性霉素B、特比萘芬等临床常用抗真菌药物的活性, 并采用孔板法验证该方法的可靠性与适用性。
材料与方法菌株 白念珠菌SC5314菌株由海军军医大学药学院新药研究中心提供。
仪器 TJ-2A微量推拉注射泵、LSP04-1A四通道单推注射泵(保定兰格公司), Olympus IX-71倒置显微镜、Olympus SZX7体视镜、Olympus DP73数码彩色照相机(日本Olympus公司), ORCA-Flash 4.0 LT C11440-42U数字CMOS相机(日本Hamamatsu公司), Kylin-Bell Vortex-5旋涡混合器(海门其林贝尔公司), 爱国者数码观测王GE-5 (北京华旗公司), HZ-2111K-B恒温振荡器(太仓华利达公司), Infinite M 200多功能酶标仪(瑞士Tecan公司)。
药品与试剂 卡泊芬净、5-氟胞嘧啶、特比萘芬(上海陶素生化科技有限公司, 纯度均 > 98%), 氟康唑(≥98%)、两性霉素B (80%) (美国Aladdin公司)。SU-8 3025光刻胶(美国Microchem公司), 硅单面抛光片和显影液(苏州汶颢芯片科技有限公司), SYLGARD®184 PDMS预聚体和固化剂(美国Dow Corning公司), HFE-7500、Scotch隐形无痕胶带(美国3M公司), 全氟化聚醚-聚乙二醇嵌段高分子表面活性剂(PFPE-PEG block-copolymer surfactant, EA-surfactant) (美国Ran Biotechnology公司)。阿尔玛蓝(大连美仑生物技术有限公司), 蛋白胨、琼脂、酵母浸膏(美国Bacto公司), 葡萄糖(上海强顺化学试剂有限公司), NaOH、NaHCO3等无机盐(国药集团化学试剂有限公司), 苋菜红染料粉末(上海生工生物工程股份有限公司)。所有化学试剂除特殊说明外均为分析纯。
储备液配制 阿尔玛蓝溶于纯水中配制成10 mg·mL-1的储备液, 4 ℃避光保存。氟康唑、两性霉素B、卡泊芬净、5-氟胞嘧啶、特比萘芬、伊曲康唑、伏立康唑和泊沙康唑溶于DMSO中分别配制成3.2、0.8、0.8、6.4、3.2、3.2、3.2和3.2 mg·mL-1的母液, 储存于-20 ℃冰箱备用。
培养基配制 沙堡葡萄糖琼脂(Sabouraud dextrose agar, SDA)固体培养基:蛋白胨10.0 g、葡萄糖40.0 g、琼脂18.0 g, 加入三蒸水900 mL溶解, pH值用NaOH调整至7.0, 三蒸水定容至1 L, 高温高压灭菌后在超净台内倒出适量于培养皿中, 紫外照射待凝固后, 倒扣于超净台内吹干上盖的水珠后储存于4 ℃备用。酵母浸出粉胨葡萄糖(yeast extract peptone dextrose, YPD)培养基:酵母浸膏10.0 g、蛋白胨20.0 g、葡萄糖20.0 g, 三蒸水定容至1 L, 高温高压灭菌后分装, 4 ℃储存备用。
白念珠菌的培养 从-80 ℃冻存的菌株中挑取少许于YPD液体培养基中活化, 30 ℃、200 r·min-1振荡培养24 h后, 吸取10 μL于新的1 mL YPD液体培养基中, 继续在30 ℃、200 r·min-1振荡培养16 h, 用SDA固体培养基划板, 30 ℃培养48 h, 待长出大量单克隆菌落后, 4 ℃储存备用。实验时挑取SDA平板上的单克隆菌落于1 mL YPD液体培养基中, 30 ℃、200 r·min-1振荡培养16 h, 使其处于对数生长后期用于后续实验[23]。
菌悬液制备 将培养至对数生长后期的菌液转移至离心管中离心去上清, 并用PBS缓冲液洗涤3次去除残余培养基, 然后将细胞重悬于1640培养基, 计数后调整菌液至实验所需浓度。
浓度梯度微流控芯片的设计与制作 采用AutoCAD 2015软件进行芯片结构设计, 芯片掩膜二维设计如图 1。芯片含两个水相入口、两个油相入口、四个出口, 浓度梯度生成器采用经典的“圣诞树”结构, 其形成浓度梯度的机制是基于微通道的层流的扩散混合效应, 芯片主通道宽设计为100 μm, 高为45 μm, 流体在通道内呈现层流特性, 并在蛇形微通道内发生快速混合与扩散传质形成浓度梯度。T字形流动聚集处宽为20 μm。芯片采用标准软光刻技术[24]制作而成。

|
Figure 1 Design of the concentration gradient microfluidic chip |
浓度梯度表征 为了验证芯片是否形成了浓度梯度并找到通入溶液的最佳流速, 采用染料荧光素钠和苋菜红对芯片的药物浓度梯度进行定性表征, 并通过HPLC对药物浓度定量从而对芯片的药物浓度梯度进行定量表征。
染料定性表征浓度梯度 选用50 mg·mL-1苋菜红溶液和20 μg·mL-1的荧光素钠水溶液作两种水相, 结合课题组前期对液滴微流控芯片研究成果[22]与该芯片系统使用条件的考察, 水相流速在80~120 μL·h-1时能够形成尺寸均一、大小适宜的液滴。因此, 实验考察两水相流速分别为100/80、100/100、100/120 μL·h-1的条件下, 芯片浓度梯度形成情况以及液滴生成形态, 并通过荧光显微镜采集通道内荧光图像。
HPLC定量表征浓度梯度 选用氟康唑进行芯片药物浓度梯度定量表征, 参考2015版中国药典中氟康唑注射液的定量方法进行测定。
色谱条件 色谱柱为Inertsil ODS-3 (250 mm×4.6 mm, 5 μm)的色谱柱; 柱温40 ℃; 紫外检测器检测波长为260 nm; 流动相为乙腈-0.063%甲酸铵水溶液(20:80);进样量20 μL。
储备液和工作液配制 精密称取氟康唑对照品4.20 mg, 用流动相溶解定容至20 mL, 配制成浓度为210 μg·mL-1的溶液作为母液, 用流动相稀释至浓度为100、50、25、10、5和1 μg·mL-1的标准曲线系列工作液。
为了考察氟康唑药物在芯片内的四种浓度梯度生成情况, 将油相入口封堵, 水相则以空白流动相作为A相, 100 μg·mL-1工作溶液作为B相, A:B相流速比分别为1:2、1:1和2:1进样生成浓度梯度, 浓度梯度生成后直接在出口处收集30 min水相溶液, 将收集的溶液进行HPLC定量。
浓度梯度微流控芯片的系统考察 在芯片应用前, 对芯片系统的适用条件和液滴稳定性进行考察。根据课题组前期研究选用HFE-7500作为油相, 考察不同水相流速(40~100 μL·h-1)、油相流速(40~200 μL·h-1)以及流速比(1:1、1:2)下液滴生成情况, 以在较短时间内生成稳定且大小均一适中的液滴。将生成的液滴收集至离心管中, 从收集当天(0天)至第5天每天将其涂布于载玻片上观察其形态和尺寸以考察其稳定性。
液滴包裹白念珠菌考察 活死染色是一种常用的细胞标记的方法, 通过对液滴内的白念珠菌染色可以观察液滴内白念珠菌的分布情况[25]。
两水相分别为菌液相和空白水相。菌液相按照试剂盒使用说明书用RPMI 1640培养基配制100 μL含活死染料的白念珠菌溶液(菌浓度为0.5×103~2.5×103 CFU·mL-1)、空白水相为RPMI 1640溶液(无菌), 在水相流速为100 μL·h-1、油相流速为200 μL·h-1条件下, 生成浓度梯度并包裹形成液滴。
浓度梯度微流控芯片实验 分别配制含药水相溶液100 μL和含菌液水相溶液100 μL, 其中含药水相溶液包含药液、阿尔玛蓝(终浓度250 μg·mL-1), 含菌液水相溶液包含白念珠菌(终浓度0.5×103~2.5×103 CFU·mL-1)、阿尔玛蓝(终浓度250 μg·mL-1)。根据CLSI的M27-A3, 各待测药物的起始浓度分别为:氟康唑64 μg·mL-1、两性霉素B 16 μg·mL-1、卡泊芬净8 μg·mL-1、5-氟胞嘧啶64 μg·mL-1、特比萘芬32 μg·mL-1、伊曲康唑32 μg·mL-1、伏立康唑32 μg·mL-1、泊沙康唑32 μg·mL-1。设定无药阳性对照组(含菌)和空白对照组(无菌)。油相为HFE-7500 (含1% EA-surfactant)。用微量注射泵以100 μL·h-1的流速向芯片水相入口1引入抗白念珠菌药物、水相入口2引入白念珠菌, 以200 μL·h-1的流速向两油相入口引入油相, 采用多浓度梯度微流控芯片生成液滴后收集到灭菌的0.2 mL离心管内, 于30 ℃条件下孵育2 h, 取少量液滴涂布于载玻片显微镜下观察荧光情况。
孔板实验验证 分别以两性霉素B、氟康唑、伊曲康唑、伏立康唑、泊沙康唑、特比萘芬、5-氟胞嘧啶、卡泊芬净为试药进行十级倍比稀释, 在96孔板中进行药敏实验, 采用直接观察法判断实验结果。氟康唑的浓度为64~0.13 μg·mL-1, 伊曲康唑、伏立康唑、泊沙康唑和特比萘芬的给药浓度为32~0.063 μg·mL-1, 两性霉素B的浓度为: 16~0.031 μg·mL-1, 5-氟胞嘧啶的给药浓度为8~0.016 μg·mL-1, 卡泊芬净的浓度为0.8~0.007 8 μg·mL-1, 菌的终浓度为(0.5~2.5)×103 CFU·mL-1。每种试药设两个复孔, 用于平行对照, 30 ℃培养箱孵育24 h后将孔板对光从孔板底部观察实验结果, 以孔内产生浑浊的前一个孔的浓度为MIC。
结果 1 染料定性表征浓度梯度随着荧光素钠与苋菜红流速比的增加, 荧光素钠成分在通道中所占比例逐渐增加。当流速比 < 1时, 苋菜红在4个通道中含量较高(图 2A~D); 当流速比 > 1时, 荧光素钠在4个通道中含量较高, 不利于拉开浓度差异, 形成浓度梯度(图 2I~L、M~P); 当两水相流速比为1时(即流速均为100 μL·h-1), 芯片可以生成较好的浓度梯度, 接近于线性浓度梯度(图 2E~H)。同时, 结果可以看出当流速差异较大时, 两水相分界清晰, 流体在流动过程中不能充分扩散(图 2I~L、M~P)。所以选择两水相流速均为100 μL·h-1作为后续药物筛选实验时的水相流速。

|
Figure 2 Fluorescence diagram of concentration gradient formation under different flow rates. A, E, I, M (Channel 1): NaFL; B, F, J, N (Channel 2): NaFL + Amaranth; C, G, K, O (Channel 3): Amaranth + NaFL; D, H, L, P (Channel 4): Amaranth; Water phase flow rate: Amaranth 100 μL·h-1, NaFL 80 μL·h-1 (A-D); Amaranth 100 μL·h-1, NaFL 100 μL·h-1 (E-H); Amaranth 100 μL·h-1, NaFL 120 μL·h-1 (I-L); Amaranth 100 μL·h-1, NaFL 180 μL·h-1 (M-P) |
氟康唑在1~100 μg·mL-1内线性良好, 回归方程为f = 1 769.3×C - 1 507.3 (r = 0.999 7)。空白溶液与100 μg·mL-1氟康唑溶液流速比1:2、1:1、2:1, 分别收集4个通道样本进行检测, 结果见表 1。当流速为1:2和2:1时, 溶液流速差异大, 高流速溶液流经同样距离所需时长越短, 横向扩散距离也较短, 分支中溶液混合情况差, 难以形成线性浓度梯度。当空白溶液与工作溶液流速比为1:1时, 各分支溶液能够较充分混匀从而能够获得更加接近线性的浓度梯度, 与荧光素钠对芯片浓度梯度定性结果一致。
| Table 1 Concentration gradient distribution of fluconazole solution obtained under three flow rate conditions |
为了生成大小均匀、形状稳定的液滴, 考察了芯片上的水油两相流速, 见图 3。结果表明, 水相流速100 μL·h-1、油相流速200 μL·h-1时, 液滴大小均一, 形态良好, 液滴直径约为47 μm, 体积约54 pL, 生成速度约为每秒2.6×104个。收集的液滴涂布于载玻片上观察, 液滴形态比较稳定, 尺寸均一, 放置3天, 液滴仍能保持形态完好, 稳定性高, 完全满足实验要求。
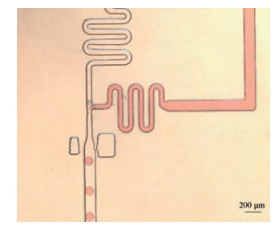
|
Figure 3 The generation of droplets |
白念珠菌菌液与空白培养基作为两水相包裹形成液滴后, 涂片于载玻片, 显微镜下拍照观察。对液滴直径进行测量和标记, 结果发现液滴直径基本为46.64 μm, 尺寸大小基本保持一致, 液滴均一性良好。白念珠菌经活死染料标记, 可以清晰地观察到大多数液滴为空液滴, 而包裹了白念珠菌的液滴基本为单包裹。由于白念珠菌浓度为0.5×103~2.5×103 CFU·mL-1, 菌液浓度相对较低, 分散到每个液滴内的白念珠菌基本为1个或没有, 因此液滴绝大多数为单包裹(图 4)。在单细胞包裹液滴中, 当药物抑制或者杀灭真菌细胞时, 无荧光亮液滴, 显示与空液滴一样的背景色。当药物浓度低于MIC时, 真菌细胞有生长活性, 指示剂转化产生荧光亮液滴, 而空液滴保持不变。由此可以判断药物的MIC[22]。因此, 通道内白念珠菌的浓度梯度分布不影响后续的药物筛选实验。

|
Figure 4 Droplets observed under a fluorescent microscope |
分别测试高低浓度的两性霉素B的抗白念珠菌作用, 高浓度组水相分别为含16.0 μg·mL-1两性霉素B的药物溶液和含终浓度为0.5×103~2.5×103 CFU·mL-1白念珠菌的溶液, 低浓度组两性霉素B浓度为4.0 μg·mL-1, 其余组成相同。16.0 μg·mL-1两性霉素B浓度梯度微流控芯片抗真菌活性实验结果见图 5。空白对照组中液滴只包裹了药物溶液(无菌), 可见液滴颜色均匀一致为背景的红色, 液滴无荧光(图 5A); 生长对照组(无药), 荧光亮液滴较多(图 5D), 图 5B~C中液滴无荧光, 表明白念珠菌的活力被两性霉素B抑制, 无法有效转化荧光指示剂产生荧光。
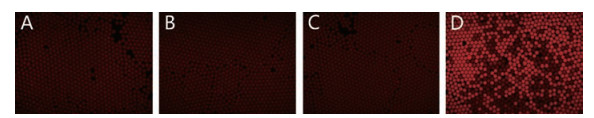
|
Figure 5 Drug screening test results of 16 μg·mL-1 amphotericin B against Candida albicans. A: Channel 1 (16.0 μg·mL-1 amphotericin B); B: Channel 2 (6.6 μg·mL-1 amphotericin B+Candida albicans); C: Channel 3 (2.0 μg·mL-1amphotericin B+Candida albicans); D: Channel 4 (Candida albicans) |
4.0 μg·mL-1两性霉素B液滴实验结果见图 6, A~D分别为通道1、通道2、通道3、通道4出口处收集液滴孵育2 h后的结果。根据氟康唑浓度梯度定量表征结果推算, 图 6A~D中两性霉素B分别为4.0、1.6、0.5和0 μg·mL-1。A为空白对照组, 无荧光亮液滴; D为正常生长对照组, 产生大量亮液滴。图 6B中所示为药物溶液与菌溶液混合后的液滴作用情况, 液滴中无明显荧光信号产生, 表明该浓度条件两性霉素B可以有效抑制白念珠菌生长, 两性霉素B浓度约为1.6 μg·mL-1; 图 6C中可以看到液滴存在明显的明暗区别, 表明液滴内包裹的白念珠菌未能被有效抑制, 而两性霉素B浓度约为0.50 μg·mL-1, 因此可以得出两性霉素B的MIC值在0.50~1.60 μg·mL-1内, 与CLSI所建议的两性霉素B对白念珠菌的MIC≤1 μg·mL-1相一致。结果表明本研究建立的浓度梯度微流控芯片平台可以用于快速测定抗真菌候选化合物的MIC, 通过一次实验获得化合物的MIC范围(表 2)。
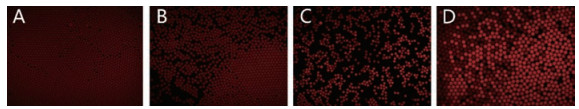
|
Figure 6 Drug screening test results of 4 μg·mL-1 amphotericin B against Candida albicans. A: Channel 1 (4.0 μg·mL-1 amphotericin B); B: Channel 2 (1.6 μg·mL-1 amphotericin B + Candida albicans); C: Channel 3 (0.5 μg·mL-1 amphotericin B + Candida albicans); D: Channel 4 (Candida albicans) |
| Table 2 MIC values of eight drugs against Candida albicans SC5314 |
氟康唑、卡泊芬净、特比萘芬等药物结果与96孔板法一致。图 7显示了16 μg·mL-1特比萘芬抗白念珠菌药物筛选实验结果。其中, 7B~D中均有荧光亮液滴, 说明两种浓度的特比萘芬均不能有效抑制该批次白念珠菌的活性, 该批次白念珠菌对特比萘芬产生了耐药的现象。有文献[26]报道, 在临床获得的白念珠菌样品中, 对特比萘芬的耐药比例达94.93%, 而伊曲康唑和咪康唑的耐药率则只有15.21%和5.99%。本研究所建立的抗白念珠菌药物筛选的方法也可以应用于临床耐药菌株的药物筛选研究。
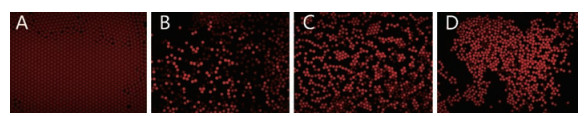
|
Figure 7 Drug screening test results of 16 μg·mL-1 terbinafine against Candida albicans. A: Channel 1 (16.0 μg·mL-1 terbinafine); B: Channel 2 (6.6 μg·mL-1 terbinafine + Candida albicans); C: Channel 3 (2.0 μg·mL-1 terbinafine + Candida albicans); D: Channel 4 (Candida albicans) |
在微流控芯片上生成浓度梯度具有自动化、微型化、高通量的优点, 因此被广泛应用于药物筛选、细胞生物学等研究领域。本研究采用液滴微流控技术结合浓度梯度生成的芯片包裹白念珠菌进行抗真菌药物活性快速高效测试。通过荧光示踪剂荧光素钠和苋菜红色素考察芯片上两水相流速比对浓度梯度形成结果的影响, 并对芯片浓度梯度进行了定性表征, 结合HPLC对通道内氟康唑浓度的定量从而对芯片浓度梯度进一步进行定量表征。浓度梯度定性与定量结果一致表明, 当两水相流速比为1 : 1时, 流速为100 μL·h-1时, 芯片内浓度梯度分布更加均匀, 浓度梯度分布接近线性, 适用于后续药物筛选实验。通过活死染色考察芯片上浓度梯度生成器对白念珠菌在通道中分布及液滴内包裹白念珠菌情况的影响, 结果发现液滴内白念珠菌基本为单包裹, 药物作用对象保持一致。
采用本实验室设计制作的浓度梯度液滴微流控芯片, 测试了8种临床常用药物的抗白念珠菌作用效果。通过对两性霉素B、氟康唑及特比奈芬等药物的作用效果考察发现, 芯片结果与孔板法一致, 并与M27-A3标准所认定的MIC值相符, 表明本研究建立的多浓度梯度液滴生成芯片平台可以用于抗真菌活性化合物的快速筛选及临床耐药菌株的筛选研究。传统孔板法药敏实验需要耗费大量人力物力, 难以实现高通量分析。
近年来, 浓度梯度微流控芯片技术逐渐兴起, 出现大量能够产生线性和非线性浓度梯度的微流控芯片, 但其结构网络较为复杂、制作要求较高, 芯片稳定性和重现性易受影响。本文建立的浓度梯度液滴微流控芯片平台将浓度梯度生成器和液滴生成结构组合在一起, 浓度梯度生成器采用经典的“圣诞树”结构, 可通过简单地增加分支数目而获得更多的浓度梯度分布, 结构简单易于制作, 并且芯片稳定性高, 易于操作, 能够快速生成较为精确、稳定的浓度梯度。将该平台应用于抗真菌药物筛选, 可以省去配制多种不同药物浓度溶液的繁冗过程, 同时简化了细胞铺板、给药、标记等过程。在短时间内可以生成大量液滴, 每个液滴作为独立微反应器, 作用结果互不干扰, 增加了实验结果的可靠性与准确性。后期通过改进芯片“圣诞树”结构浓度梯度分支数目, 增加芯片的浓度梯度生成数量, 可以将一次实验所获得的浓度梯度间隔划分的更小, 有望通过一次实验获得精确的MIC值; 通过改变浓度梯度生成器结构, 可以产生正交浓度梯度用于联合用药的研究[27]。
| [1] |
Kullberg BJ, Arendrup MC. Invasive candidiasis[J]. N Engl J Med, 2015, 373: 1445-1456. DOI:10.1056/NEJMra1315399 |
| [2] |
Quindos G. Epidemiology of candidaemia and invasive candidiasis. A changing face[J]. Rev Iberoam Micol, 2014, 31: 42-48. DOI:10.1016/j.riam.2013.10.001 |
| [3] |
Arendrup MC. Epidemiology of invasive candidiasis[J]. Curr Opin Crit Care, 2010, 16: 445-452. DOI:10.1097/MCC.0b013e32833e84d2 |
| [4] |
Lohse MB, Gulati M, Johnson AD, et al. Development and regulation of single- and multi-species Candida albicans biofilms[J]. Nat Rev Microbiol, 2018, 16: 19-31. DOI:10.1038/nrmicro.2017.107 |
| [5] |
Gow NAR, Yadav B. Microbe profile: Candida albicans:a shape-changing, opportunistic pathogenic fungus of humans[J]. Microbiology, 2017, 163: 1145-1147. DOI:10.1099/mic.0.000499 |
| [6] |
Saadi W, Wang SJ, Lin F, et al. A parallel-gradient microfluidic chamber for quantitative analysis of breast cancer cell chemotaxis[J]. Biomed Microdevices, 2006, 8: 109-118. DOI:10.1007/s10544-006-7706-6 |
| [7] |
Gu Y, Hegde V, Bishop KJM. Measurement and mitigation of free convection in microfluidic gradient generators[J]. Lab Chip, 2018, 18: 3371-3378. DOI:10.1039/C8LC00526E |
| [8] |
Li Y, Xuan J, Hu R, et al. Microfluidic triple-gradient generator for efficient screening of chemical space[J]. Talanta, 2019, 204: 569-575. DOI:10.1016/j.talanta.2019.06.018 |
| [9] |
Jeon J, Choi N, Chen H, et al. SERS-based droplet microfluidics for high-throughput gradient analysis[J]. Lab Chip, 2019, 19: 674-681. DOI:10.1039/C8LC01180J |
| [10] |
Tang M, Huang X, Chu Q, et al. A linear concentration gradient generator based on multi-layered centrifugal microfluidics and its application in antimicrobial susceptibility testing[J]. Lab Chip, 2018, 18: 1452-1460. DOI:10.1039/C8LC00042E |
| [11] |
Khoo BL, Grenci G, Jing T, et al. Liquid biopsy and therapeutic response:circulating tumor cell cultures for evaluation of anticancer treatment[J]. Sci Adv, 2016, 2: e1600274. DOI:10.1126/sciadv.1600274 |
| [12] |
Lee K, Kim C, Ahn B, et al. Generalized serial dilution module for monotonic and arbitrary microfluidic gradient generators[J]. Lab Chip, 2009, 9: 709-717. DOI:10.1039/B813582G |
| [13] |
Somaweera H, Ibraguimov A, Pappas D. A review of chemical gradient systems for cell analysis[J]. Anal Chim Acta, 2016, 907: 7-17. DOI:10.1016/j.aca.2015.12.008 |
| [14] |
Xiong B, Ren K, Shu Y, et al. Recent developments in microfluidics for cell studies[J]. Adv Mater, 2014, 26: 5525-5532. DOI:10.1002/adma.201305348 |
| [15] |
Gonzalez-Suarez AM, Pena-Del Castillo JG, Hernandez-Cruz A, et al. Dynamic generation of concentration- and temporal-dependent chemical signals in an integrated microfluidic device for single-cell analysis[J]. Anal Chem, 2018, 90: 8331-8336. DOI:10.1021/acs.analchem.8b02442 |
| [16] |
Ma Y, Pan JZ, Zhao SP, et al. Microdroplet chain array for cell migration assays[J]. Lab Chip, 2016, 16: 4658-4665. DOI:10.1039/C6LC00823B |
| [17] |
Salek MM, Carrara F, Fernandez V, et al. Bacterial chemotaxis in a microfluidic T-maze reveals strong phenotypic heterogeneity in chemotactic sensitivity[J]. Nat Commun, 2019, 10: 1877. DOI:10.1038/s41467-019-09521-2 |
| [18] |
Ben Yehezkel T, Rival A, Raz O, et al. Synthesis and cell-free cloning of DNA libraries using programmable microfluidics[J]. Nucleic Acids Res, 2016, 44: e35. DOI:10.1093/nar/gkv1087 |
| [19] |
Mulholland T, McAllister M, Patek S, et al. Drug screening of biopsy-derived spheroids using a self-generated microfluidic concentration gradient[J]. Sci Rep, 2018, 8: 14672. DOI:10.1038/s41598-018-33055-0 |
| [20] |
Wu J, Chen Q, Liu W, et al. A simple and versatile microfluidic cell density gradient generator for quantum dot cytotoxicity assay[J]. Lab Chip, 2013, 13: 1948-1954. DOI:10.1039/c3lc00041a |
| [21] |
Li L, Li Y, Shao Z, et al. Simultaneous assay of oxygen-dependent cytotoxicity and genotoxicity of anticancer drugs on an integrated microchip[J]. Anal Chem, 2018, 90: 11899-11907. DOI:10.1021/acs.analchem.8b02070 |
| [22] |
Zheng Z, Chen Y, Li WH, et al. Study on droplet microfluidic chips for drug screening against Candida albicans[J]. Acta Pharm Sin (药学学报), 2017, 52: 1884-1889. |
| [23] |
Bi S, Hu GH, Hu DD, et al. Evaluation of antifungal drugs using a Caenorhabditis elegans-Candida albicans infection model[J]. Chin J Mycol (中国真菌学杂志), 2016, 11: 135-139. |
| [24] |
McDonald JC, Duffy DC, Anderson JR, et al. Fabrication of microfluidic systems in poly(dimethylsiloxane)[J]. Electrophoresis, 2000, 21: 27-40. DOI:10.1002/(SICI)1522-2683(20000101)21:1<27::AID-ELPS27>3.0.CO;2-C |
| [25] |
Wang C, Yang Z, Peng Y, et al. Application of 460 nm visible light for the elimination of Candida albicans in vitro and in vivo[J]. Mol Med Rep, 2018, 18: 2017-2026. |
| [26] |
Ma YM, Zhu YJ, Lin WJ, et al. The resistance of Candida albicans to common antifungal drugs and its expression of CDR1 and CDR2 gene[J]. Matern Child Health Care China (中国妇幼保健), 2010, 25: 3620-3623. |
| [27] |
Kim S, Masum F, Kim JK, et al. On-chip phenotypic investigation of combinatory antibiotic effects by generating orthogonal concentration gradients[J]. Lab Chip, 2019, 19: 959-973. DOI:10.1039/C8LC01406J |
 2020, Vol. 55
2020, Vol. 55


