盐酸美西律属于抗心律失常类药物, 除具有抗心律失常外, 还具有抗惊厥以及局部麻醉的作用, 对人体心肌的抑制作用较小。临床上主要用于治疗急、慢性的室性心律失常(如室性早搏、室性心动过速、心室颤动以及洋地黄苷中毒引起的心律失常等)[1-3]。该药常见的不良反应主要表现在胃肠道方面(如恶心、呕吐等)和神经方面(如头晕、震颤、嗜睡、昏迷、精神失常、失眠等)。由于美西律的治疗窗较窄, 安全范围较小, 最小中毒剂量与有效剂量较接近, 因此, 当用量不当时, 易引起诸多不良反应, 肝、肾功能的变化以及药物间的相互作用均会影响到该药在人体内的代谢[4]。为了尽量减少患者用药的不良反应, 把握用药剂量显得十分重要, 故对药物中的准确含量进行快速检测有着一定意义。目前, 国内外对盐酸美西律的检测方法主要是高效液相色谱法[5-10], 也见液-质联用法[11, 12]、气相色谱法[13]、毛细管电泳法[14]、荧光法[15]和紫外-可见分光光度法[16, 17]等的报道。《中国药典》 (二部), 2005年版采用高氯酸非水滴定法[18], 此法除操作烦琐、费时外, 还需加入对环境有污染的乙酸汞; 2010年版修订为紫外分光光度法, 但此法灵敏度不高, 选择性欠佳(辅料存在不同程度的干扰); 2015年版除紫外分光光度法[17]外, 增补了一种高效液相色谱法[5], 此法前处理工作非常麻烦、费时, 且日常维护费用较高, 文献[6]~[10]虽有高的准确度、精密度及专属性, 但线性范围和灵敏度欠佳。Zhang等[11]和Yang等[12]采用液-质联用技术实现了盐酸美西律的测定, 方法除专属性强、灵敏度高外, 还有高的准确度和精密度及较宽的线性范围, 但操作较繁, 成本较高。Han等[13]采用气相色谱法实现了盐酸美西律的测定, 方法专属性强、准确、可靠, 但线性范围欠佳。其他方法(文献[14]~[17])近年报道很少, 有的选择性欠佳或灵敏度不高或条件要求苛刻等。鉴于此, 有必要进一步研究简便、快速、高灵敏、高选择性的检测盐酸美西律的方法。本工作采用双波长共振光散射(dual-wavelength resonance light scattering, DWO-RLS)技术(共振光散射技术是近年新发展起来的一种高灵敏分析技术, 在药物、食品及环境方面已有较多应用[19-21], 但双波长共振光散射技术的灵敏度比一般单波长法更高[22], 目前应用较少), 以虎红作探针, 溴代十六烷基吡啶作增敏剂, 研究药物中盐酸美西律的定量检测方法, 尚未见文献报道。本法与文献[6]~[10]、[13]~[17]报道的各种方法相比, 本法具有更高的灵敏度(检出限为0.001 8 mg·L-1)和更宽的线性范围(0.004~0.65 mg·L-1), 与文献[12] (液-质联用法)相比, 灵敏度和线性范围相当, 但本法更为简便、快速, 成本低(只需一般的荧光分光光度计), 样品处理简单、安全。方法用于实际药物检测, 结果满意。
材料与方法药品和试剂 盐酸美西律(mexiletine hydrochloride, MXL, 中国食品药品检定研究院, 纯度: 99.9%, 对照品批号: 100218-201504)、溴代十六烷基吡啶(cetylpyridinium bromide, CPB, 上海麦克林生化科技有限公司, 纯度: 98%)、虎红(rose Bengal, ROS, 成都点纯科技有限公司, 纯度: 99%)、盐酸(HCl, 重庆华东化工有限公司, 分析纯)、三羟甲基氨基甲烷(Tris, 成都贝斯特试剂有限公司, 分析纯)、盐酸美西律片(石药集团欧意药业有限公司, 批号: 377150701, 编为1#;批号: 377150801, 编为2#)、超纯水(由成都优普超纯水仪制备)。
仪器 F-2500型荧光分光光度仪, 测定狭缝5 nm, λex=λem=220 nm, 日本日立公司; pHS-3C型酸度计, 上海虹益有限公司。
标准溶液和试剂溶液的配制 盐酸美西律标准溶液:准确称取适量经105 ℃干燥2 h后的盐酸美西律, 用水溶解完全后定量移入量瓶中, 用水稀至刻度, 配成浓度为215.8 mg·L-1标准贮备液, 取贮备液稀释100倍配成浓度为2.158 mg·L-1操作液, 均保存于4 ℃冰箱中。溴代十六烷基吡啶溶液: 4.00×102 mg·L-1。虎红溶液: 0.100 mmol·L-1。盐酸溶液: 1.00×102 mmol·L-1。Tris溶液: 2.00×102 mmol·L-1。Tris-盐酸溶液: pH 3.8~9.2 (用pH计测定Tris和盐酸溶液的混合液)。
样品溶液的制备 取1#和2#盐酸美西律片各10粒, 分别用水溶解、搅拌、超声15 min, 过滤, 滤液移入量瓶中, 用水稀至2 L。取该液10.00 mL, 用水稀至1 L, 即制得1#和2#待测液, 保存于4 ℃冰箱中。
RLS强度测定方法 于10 mL比色管中, 准确加入盐酸美西律标准操作液0.00~3.00 mL、虎红溶液2.50 mL、Tris-盐酸溶液(pH 5.27) 1.00 mL及溴代十六烷基吡啶溶液0.30 mL, 用水稀至刻度, 混匀。10 min后, 于荧光仪上扫描RLS光谱, 用双波长共振光散射(DWO-RLS)法在372 nm和596 nm测定溶液的RLS强度IRLS(372 nm+596 nm)和试剂空白的I0(372 nm+596 nm), 计算ΔIRLS=IRLS(372 nm+596 nm)-I0(372 nm+596 nm)。
反应条件的选择
酸度 于数支10 mL比色管中, 分别加入盐酸美西律标准操作液1.00 mL、虎红溶液2.00 mL和溴代十六烷基吡啶溶液0.20 mL, 再加入不同pH值的Tris-HCl溶液, 用水稀至刻度。按RLS测定方法中所设定的条件, 扫描RLS光谱, 根据谱图, 求得最大(372 nm)和次大(596 nm) RLS波长处体系及试剂空白的RLS强度IRLS及I0, 计算出ΔIRLS, 作ΔIRLS-pH曲线图, 即可确定反应的最佳酸度。同理, 在其他条件不变的情况下, 改变所选定的最佳pH用量, 根据光谱曲线求得最大和次大RLS波长处IRLS及I0, 计算出ΔIRLS, 作ΔIRLS-V最佳pH曲线图, 即可确定所选定pH的最佳用量。
虎红溶液浓度 在标准溶液浓度、溴代十六烷基吡啶溶液浓度及上述确定的最佳酸度条件不变的情况下, 改变虎红溶液浓度, 按RLS测定方法中所设定的条件, 扫描RLS光谱。依据谱图, 求出测定波长下的IRLS及I0, 计算出ΔIRLS, 作ΔIRLS-cROS曲线图, 即可确定虎红溶液的最佳浓度。
溴代十六烷基吡啶浓度 在上述选定的条件及其他条件不变的情况下, 改变溴代十六烷基吡啶溶液浓度, 扫描RLS光谱。依据谱图, 求测定波长下的IRLS及I0, 计算ΔIRLS, 作ΔIRLS-cCPB曲线图, 即可确定溴代十六烷基吡啶溶液的最佳浓度。
试剂加入顺序 在上述选定的各项最佳条件下, 改变各物质的加入顺序, 扫描RLS光谱。依据谱图中RLS强度的大小, 即可确定各物质的最佳加入顺序。
反应速度及缔合物的稳定性 在上述选定最优条件下, 扫描不同反应时间(t)下的RLS光谱, 作ΔIRLS-t曲线图, 即可确定反应的最佳测定时间及生成的缔合物的稳定时间范围。
方法学考察 从方法的选择性、标准曲线、检出限、准确度、精密度、稳定性等方面对建立的方法进行验证。
选择性 取盐酸美西律标准操作液1.00 mL、虎红溶液2.50 mL、Tris-盐酸溶液(pH 5.27) 1.00 mL及溴代十六烷基吡啶溶液0.30 mL于10 mL比色管中, 另加适量其他常见有机物、无机物或临床联合用相关药物, 用水定容。用DWO-RLS法考察其共存物质对盐酸美西律的测定是否存在干扰情况。
标准曲线 于数支10 mL比色管中分别加入0、0.50、1.00、1.50、2.00、2.50和3.00 mL盐酸美西律标准操作液, 再按测定方法加入其他试剂溶液, 配成盐酸美西律的标准系列溶液, 用DWO-RLS法测定系列溶液的RLS强度, 以ΔIRLS为纵坐标, 盐酸美西律的质量浓度为横坐标作图, 得标准曲线, 拟和线性后即可得该方法的一元线性回归方程及相关系数。
检出限 在最佳条件下, 配制试剂空白溶液11份, 按RLS测定方法测其RLS强度, 再按3Sb/S求出检出限。
稳定性 取盐酸美西律片的待测液适量, 按RLS强度的测定方法, 在1天内每隔2 h测定一次体系的ΔIRLS (n=5), 计算各次测定的样液中盐酸美西律的含量, 求出各样品的RSD%。再按RLS测定方法, 将置于4 ℃冰箱中的样液, 于3天内, 每天测定1次体系的ΔIRLS, 求各次测定的样液中盐酸美西律的含量, 并计算RSD%。根据各次测得值判断日内及日间样液的稳定性。
准确度及精密度 取盐酸美西律片10粒(n=3), 分别加入高、中、低3种浓度水平的盐酸美西律标准溶液后, 按样液的制备方法, 配制待测液。取适量待测液(n=5), 按RLS强度测定方法中的条件配制溶液并扫描RLS光谱, 依据DWO-RLS法的标准曲线或回归方程求得各溶液中盐酸美西律的含量, 再由加入的高、中、低3种浓度水平的盐酸美西律即可求出回收率, 从而判断方法的准确度。再由各平行测定结果求出RSD%, 从而判断方法的精密度。
数据处理 条件实验采用单波长共振光散射(SWO-RLS)法和DWO-RLS法测定, 样品测定采用DWO-RLS法。所有数据图采用Origin软件制作。
结果 1 反应条件 1.1 酸度及用量图 1为室温下不同酸度的Tris-盐酸溶液对MXL-ROS-CPB体系灵敏度(或ΔIRLS)的影响。结果表明, 最适Tris-盐酸酸度为pH 5.27, 适宜用量为1.00 mL; DWO-RLS法测定的灵敏度比单波长法高。
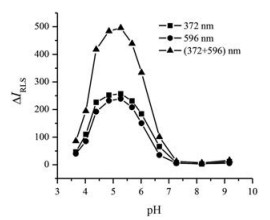
|
Figure 1 Effect of the acidity on ΔIRLS |
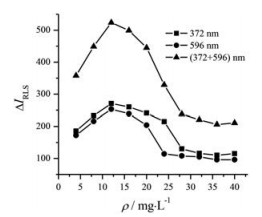
图 2为室温下不同浓度的虎红溶液对MXL-ROS-CPB体系灵敏度(或ΔIRLS)的影响。结果表明, 虎红溶液的最适浓度为0.025 0 mmol·L-1 (即实验应加入0.100 mmol·L-1虎红溶液2.50 mL); DWO-RLS法测定的灵敏度比单波长法高。
|
Figure 2 Effect of rose Bengal (ROS) concentration on ΔIRLS |
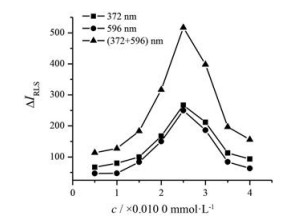
图 3为室温下不同浓度的溴代十六烷基吡啶溶液对MXL-ROS-CPB体系灵敏度(或ΔIRLS)的影响。结果表明, 溴代十六烷基吡啶的最适浓度为12.0 mg·L-1 (即实验应加入4.00×102 mg·L-1溴代十六烷基吡啶溶液0.30 mL); DWO-RLS法测定的灵敏度比单波长法高。
|
Figure 3 Effect of cetylpyridinium bromide (CPB) concentration on ΔIRLS |
表 1是室温下体系中各物质不同加入顺序对MXL-ROS-CPB体系灵敏度(或ΔIRLS)的影响。结果表明, 用DWO-RLS法测定时各物质的最佳加入顺序为:盐酸美西律、虎红、Tris-HCl、溴代十六烷基吡啶。
| Table 1 Effect of reagent addition sequence on ΔIRLS. MXL: Mexiletine hydrochloride |
图 4为室温下物质反应速度对MXL-ROS-CPB体系灵敏度(或ΔIRLS)的影响。结果表明, 体系中三物质间的反应在10 min内能进行完全, 反应达10 min时, ΔIRLS达最大, 灵敏度最高。10~80 min内, ΔIRLS基本稳定。80 min后ΔIRLS有下降趋势。故实验选择在反应10~80 min内进行测定, 缔合物的稳定时间至少1 h。

|
Figure 4 Effect of reaction time on ΔIRLS |
在选定的最佳条件下, 按RLS测定方法中各物质的浓度及用量配制的自身溶液及混合溶液的RLS扫描结果为:单独的虎红溶液、盐酸美西律溶液、溴代十六烷基吡啶溶液、虎红的弱酸性溶液、溴代十六烷基吡啶的弱酸性溶液及盐酸美西律与虎红的结合物的RLS均很微弱(图 5曲线1~6)。而在虎红的弱酸性溶液中加入溴代十六烷基吡啶溶液后, RLS信号显著增强, 并产生强度相当的2个RLS特征散射峰, 他们分别位于372和596 nm (图 5曲线7)。当在虎红-溴代十六烷基吡啶的弱酸性溶液中加入不同浓度的盐酸美西律标准溶液后, 两波长处的RLS强度(或RLS增强强度ΔIRLS)随着不大于0.647 mg·L-1盐酸美西律的质量浓度的增加呈线性增强(图 5曲线7~13), 故可在线性范围内用SWO-RLS法定量分析盐酸美西律。由于RLS强度具有加和性, 因此在372和596 nm处用DWO-RLS法测定时, 体系的RLS增强强度ΔIRLS与盐酸美西律的质量浓度(不大于0.647 mg·L-1范围内)仍具有很好的线性关系。DWO-RLS法测定中, 由于ΔIRLS值的增大, 大大提高了方法的灵敏度(约为单波长法的2倍)。故本工作选择用DWO-RLS法来定量检测盐酸美西律。

|
Figure 5 The resonance light scattering spectra of ROS-MXL-CPB. 1: ROS (0.025 0 mmol·L-1); 2: MXL (0.216 mg·L-1); 3: CPB (12.0 mg·L-1); 4: ROS (0.025 0 mmol·L-1), pH 5.27; 5: CPB (12.0 mg·L-1), pH 5.27; 6: MXL (0.216 mg·L-1)-ROS (0.025 0 mmol·L-1), pH 5.27; 7-13: MXL (0.00、0.108、0.216、0.324、0.432、0.540、0.647 mg·L-1)-ROS (0.025 0 mmol·L-1)-CPB (12.0 mg·L-1), pH 5.27 |
可能的反应机制及RLS增强原因:体系中各物质的结构式见图 6。可知, 在pH 5.27的实验条件下表面活性剂溴代十六烷基吡啶形成带阳离子的十六烷基吡啶阳离子预胶束聚集态与以一价阴离子形式的虎红分子通过静电结合形成分子体积更大的复杂聚集体导致共振光散射强度显著增强, 当有盐酸美西律存在时美西律分子中具有带孤对电子的伯氨基上氮原子和醚氧基上氧原子, 可以与聚集体上虎红分子的酚羟基形成氢键从而形成三元缔合物使聚集体分子体积进一步增大形成摩尔质量和体积更大的新的聚集体, 导致共振光散射强度增强。

|
Figure 6 Structural formula |
室温下, 相对误差不大于±5%时, 300倍的L-白氨酸、甘氨酸、蔗糖、麦芽糖、葡萄糖、Mg2+、K+、NH4+、Al3+、Na+、Ba2+、Zn2+、Cu2+、Mn2+、Fe2+、I-、Cl-、NO3-、柠檬酸三钠; 200倍的L-亮氨酸、L-丙氨酸、L-谷氨酸、L-色氨酸、尿素、S2O32-、SO32-; 100倍L-赖氨酸、L-组氨酸、L-异亮氨酸、Ca2+、Sn2+、Fe3+; 50倍的Sr2+、C2O42-、盐酸普萘洛尔、盐酸索他洛尔、阿替洛尔、美托洛尔、盐酸维拉帕米及淀粉等不干扰盐酸美西律(0.216 mg·L-1)的测定。实验结果表明, 常见阴离子、阳离子、氨基酸、糖类及几种抗心血管药物均不干扰盐酸美西律的测定。故该方法有好的选择性(即有好的专属性)。
3.2 标准曲线及检出限盐酸美西律的质量浓度与ΔIRLS的标准曲线见图 7, 检出限、回归方程、线性范围等见表 2。从图 7和表 2可知, SWO-RLS法和DWO-RLS法除有很好的线性关系、较宽的线性范围外, 还有很高的灵敏度, 尤其是DWO-RLS法的灵敏度约为SWO-RLS法的2倍。与表 2中所列文献相比, 本法有更高的灵敏度和更宽的线性范围。故作为盐酸美西律的定量分析, 本法是一种相对较好的分析方法。
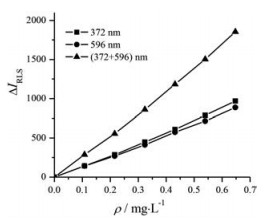
|
Figure 7 The standard curves of MXL |
| Table 2 Related parameters of standard curves |
一天内每隔2 h测定一次体系样液的ΔIRLS (n=5), 各次测定结果基本一致, 1#样品的RSD%=2.3%, 2#样品的RSD%=2.1%。将置于4 ℃冰箱中的样液, 于3天内, 每天测1次体系的ΔIRLS, 每日测定结果基本一致, 1#样液的RSD%=2.4%, 2#样液的RSD%=2.1%。实验表明, 无论日内还是日间, 保存于冰箱(4 ℃)中的样液至少在3天内具有稳定性。
3.4 样品分析、准确度和精密度取1#和2#待测液各1.00 mL (各配制5份), 分置于10 mL比色管中, 加入最优条件下的其他试剂溶液, 用水稀至刻度。按RLS测定方法测定各样液中盐酸美西律的含量, 并求出1#和2#药片中盐酸美西律的含量(mg/片), 结果见表 3。从加标回收实验(n=5)结果可知, 回收率为98.5%~103%, 相对标准偏差为2.0%~2.7%, 故本方法有良好的准确度和精密度。
| Table 3 Analytical results of samples and recovery tests (n=5, x ± s) |
从虎红和盐酸美西律的分子结构(图 6)可知, 虎红以一价阴离子形式存在于溶液中, 盐酸美西律主要以分子形式存在于溶液中, 尽管可结合生成二元缔合物, 但图 5曲线6已表明其RLS强度仍很低, 故该虎红与盐酸美西律的二元反应不能用于盐酸美西律的定量分析。从图 5曲线7可知, 溴代十六烷基吡啶可以增敏虎红, 使RLS信号显著增强, 增强原因为溴代十六烷基吡啶是一种阳离子表面活性剂, 在实验条件下, 分子结构上的Br-离去后以阳离子预胶束聚集体形式存在于溶液中; 而虎红以带1个负电荷的阴离子形式存在于溶液中。带负电荷的虎红可聚集在带正电荷的溴代十六烷基吡啶聚集体的表面形成新聚集体, 从而导致RLS信号急剧增强; 盐酸美西律加入后以美西律分子与上述聚集体上虎红分子靠氢键构筑新的分子体积更大、摩尔质量更大的新的缔合颗粒, 使RLS信号显著增强(图 5曲线8~13所示)。
尽管372 nm和596 nm均可选作定量测定盐酸美西律的测定波长, 但由于双波长法的灵敏度约是单波长法的2倍, 故选择采用灵敏度高的双波长共振光散射法进行各项测定。
从表 2数据可知, 新方法的测定结果与药典法[12]接近, 与标示量比较, 其含量在允许误差范围内; 准确度和精密度均满足痕量分析要求。
借助MXL-ROS-CPB三元体系, 用DWO-RLS技术定量检测药物中盐酸美西律, 除具有高灵敏度(检出为1.8 ng·mL-1)和选择性外, 还具有操作简便、快速的优点, 适于药物中痕量盐酸美西律的定量分析。
| [1] |
Shibuya K, Misawa S, Kimura H, et al. A single blind randomized controlled clinical trial of mexiletine in amyotrophic lateral sclerosis:efficacy and safety of sodium channel blocker phase Ⅱ trial[J]. Amyotro Lat Scl Frontotemp Deg, 2015, 16: 353-358. DOI:10.3109/21678421.2015.1038277 |
| [2] |
Zheng B, Zhou XH. Effect analysis of amiodarone combined with mexiletine hydrochloride in treatment of ICU high risk tachyarrhythmia[J]. China Mod Med (中国当代医药), 2014, 21: 63-65. |
| [3] |
Zeng Q, Zhang Y, Li YH. The combination of mexiletine hydrochloride and metoprolol tartrate tablets in treating premature ventricular beat caused by left ventricular false chordae tendineae[J]. J Pract Electrocardiol, 2015, 24: 204-205. |
| [4] |
Yu L, Hong Y, Li L, et al. Enantioselective drug-protein interaction between mexiletine and plasma protein[J]. J Pharm Pharmacol, 2012, 64: 792-801. DOI:10.1111/j.2042-7158.2012.01487.x |
| [5] |
Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典)[M]. 2015 Ed. Part Ⅱ. Beijing: China Medical Science Press, 2015: 1042.
|
| [6] |
Jin WH, Chen H, Zhang M, et al. Preparationand quality control of mexiletine hydrochloride suppository[J]. Pharm J Chin PLA (解放军药学学报), 2017, 33: 247-249. |
| [7] |
Liu HL, Han XJ, Yan K. Determination of mexiletine hydrochloride tablets by HPLC[J]. China Pharm (中国药业), 2012, 21: 20-21. |
| [8] |
Han XJ, Zhang YH, Pang WZ. Determination of mexiletine hydrochloride in tablets by HPLC[J]. West China J Pharm Sci (华西药学杂志), 2011, 26: 77-78. |
| [9] |
Dragan MM, Zoran BT. Development and application of a validated HPLC method for the analysis of dissolution samples of mexiletine hydrochloride capsules[J]. J Serb Chem Soc, 2010, 75: 975-985. DOI:10.2298/JSC090728065M |
| [10] |
Zhang H, Yu C, Liu GY, et al. HPLC-fluorescent spectrometric determination of serum mexiletine concentration after derivatization with fluram[J]. Acta Pharm Sin (药学学报), 2003, 38: 215-217. |
| [11] |
Zhang DD, Sun MJ, Ouyang HZ, et al. Pharmacokinetics of mexiletine hydrochloride tablets in rats[J]. Drugs Clin (现代药物与临床), 2017, 32: 2309-2312. |
| [12] |
Yang M, Cui Y, Wu W. Content determination of mexiletine hydrochloride tablets by HPLC-MS/MS[J]. China Pharm (中国药业), 2017, 26: 35-37. |
| [13] |
Han XJ, Du ZH, Wang M. Determination of mexiletine hydrochlorideand 2, 6-dimethylphenol by GC[J]. China Pract Med (中国实用医药), 2010, 5: 1-2. DOI:10.1186/1749-8546-5-1 |
| [14] |
Sun Y, Peng HD, Wei HY, et al. Determination of mexiletine hydrochloride in tablets by microchip capillary electrophoresis with laser induced fluorescence detection[J]. Chin J Anal Lab (分析实验室), 2012, 31: 13-17. |
| [15] |
Gao XJ, Zhang PP, Zheng QX, et al. Determination of mexiletine hydrochloride in mexiletine hydrochloride tablets by fluorescence spectrophotometry[J]. Chem Res Appl (化学研究与应用), 2017, 29: 94-98. |
| [16] |
Zhang LB, Wu H, Du LM. Determination of mexiletine hydrochloride by derivative-ionic liquid extraction spectrophotometry[J]. J Anal Sci (分析科学学报), 2012, 28: 173-176. |
| [17] |
Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典)[M]. 2015 Ed. Part Ⅱ. Beijing: China Medical Science Press, 2015: 1043.
|
| [18] |
Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典)[M]. 2005 Ed. Part Ⅱ. Beijing: Chemical Industry Press, 2005: 551.
|
| [19] |
He SH, Zeng QR, Chen YZ, et al. Determination of aztreonam in drug and urine sample by high sensitive resonance light scattering technique[J]. J Anal Sci (分析科学学报), 2019, 35: 393-396. DOI:10.2116/analsci.18P435 |
| [20] |
Jiang H, Pang XD, Wu XY, et al. Studies on detecting carbamazepine residues in food using high sensitive resonant light scattering technique[J]. Food Ferment Ind (食品与发酵工业), 2019, 45: 206-210. |
| [21] |
Pang XD, Jiang H, He TT, et al. Determination of trace zinc (Ⅱ) in landfill leachate by resonance light scattering method with azo chlorination Ⅲ-hexadecylpyridinium bromide after sulfhydryl cotton separation and preconcentraction[J]. Environ Monit China (中国环境监测), 2018, 34: 127-131. |
| [22] |
Jiang H, Wang F, Wu ZZ, et al. Determination of Cu in food by dual-wavelength rayleigh light scattering technique[J]. Food Sci (食品科学), 2018, 39: 323-327. |
 2020, Vol. 55
2020, Vol. 55


