2. 哈尔滨医科大学药化教研室, 省部共建生物医药工程重点实验室, 黑龙江 哈尔滨 150081;
3. 沈阳药科大学中药学院, 辽宁 沈阳 110016;
4. 深圳弘汇生物医药有限公司, 广东 深圳 518118
2. Department of Medicinal Chemistry and Natural Medicine Chemistry(State-Province Key Laboratories of Biomedicine-Pharmaceutics of China), Harbin Medical University, Harbin 150081, China;
3. School of Traditional Chinese Materia Medica, Shenyang Pharmaceutical University, Shenyang 110016, China;
4. Shenzhen Honghui Biopharmaceutical Co., Ltd., Shenzhen 518118, China
伞形科(Apiaceae)阿魏属(Ferula)植物全世界有150余种, 主要分布于中西亚地区, 我国有26种和1变种, 主要分布于新疆[1]。阿魏属植物广泛应用于药品、食品、化妆品等行业, 文献[2-5]报道阿魏属植物中化学成分主要有倍半萜类、香豆素类、倍半萜香豆素类、三萜类、木脂素类、挥发油类等。
格蓬脂为伞形科植物格蓬阿魏(Ferula galbaniflua Boissier et Bubse)的乳状胶脂, 维吾尔药名为加吾西尔, 产于伊朗、土耳其等地, 具有祛寒散风、利尿退肿、补胃除胀、止咳平喘、通经止痛等功效, 主治湿寒性或黏液质性疾病, 如瘫痪、癫痫、肠梗阻、尿闭水肿、胃虚腹胀、咳嗽哮喘、闭经痛经等[6]。目前国内外对其化学成分及药理活性的研究欠缺, 为揭示格蓬脂的药效物质基础, 丰富格蓬脂的化学成分研究, 本文对格蓬脂中的化学成分进行系统研究, 从中分离得到8个三萜类化合物(图 1), 其中化合物1为新化合物, 其他7个化合物为首次从该科中分离得到。运用改进Ellman法对化合物1~8进行胆碱酯酶抑制活性筛选, 化合物1表现出较强的胆碱酯酶抑制活性, 提示Trp82、His438、Phe329及Ala328等4个氨基酸残基是化合物1与丁酰胆碱酯酶结合的关键位点。

|
图 1 Chemical structures of compounds 1-8 |
化合物1为白色羽状结晶(甲醇), 易溶于二氯甲烷、甲醇、乙腈等有机溶剂, 10%硫酸-香草醛显色剂显紫红色。HR-ESI-MS给出m/z 489.361 2 [M+H]+ (Calcd. 489.361 0, C30H49O5+), 计算化合物的分子式为: C30H48O5, 不饱和度为7。IR谱中, 3 409、1 709、1 630 cm-1吸收带显示其含有羟基、羧基和双键。
1H NMR (400 MHz, C5D5N)谱中(表 1)给出7个角甲基质子信号: δH 0.96 (3H, s), 1.06 (3H, s), 1.11 (3H, s), 1.20 (3H, s), 1.26 (3H, s), 1.54 (3H, s), 1.67 (3H, s); δH 3.47 (1H, dd, J = 11.3, 4.9 Hz), 3.87 (1H, dd, J = 6.6, 2.9 Hz), 4.03 (1H, br s)为3个连氧次甲基上的氢质子信号, δH 5.64 (1H, m)为1个双键上的氢质子信号。
| 表 1 The 1H (400 MHz) and 13C (100 MHz) NMR data for compound 1 in C5D5N |
13C NMR (100 MHz, C5D5N)给出30个碳信号, 其中包括: 1个羰基碳信号(δC 181.0), 2个环内双键碳信号(δC 124.3, 144.8), 3个连氧次甲基碳信号(δC 75.8, 78.6, 84.8)。根据HSQC谱, 将所有氢信号和相关的碳信号归属, 再次确认化合物中含有1个羧基、1个双键、3个连氧次甲基和7个甲基等结构片段, 推测该化合物为三位羟基取代的齐墩果烯型三萜酸类化合物[7]。化合物1的1H NMR和13C NMR数据与化合物3相似[8], 化合物1在C-21多一个羟基, 可由HMBC谱中H-21 (δH 4.03)与C-17 (δC 46.6)、C-19 (δC 84.8)、C-20 (δC 39.9)相关得以确证。
此外, HMBC谱(图 2)中, CH3-23 (δH 1.26)和CH3-24 (δH 1.06)与C-3 (δC 78.6)、C-4 (δC 39.9)、C-5 (δC 56.4)相关, CH3-29 (δH 1.20)和CH3-30 (δH 1.54)与C-19 (δC 84.8)、C-20 (δC 39.9)、C-21 (δC 75.8)相关, 提示CH3-23和CH3-24、CH3-29和CH3-30是连在同一碳上的偕甲基; H-3 (δH 3.47)与C-2 (δC 28.6)、C-4 (δC 39.9)、C-23 (δC 29.3)、C-24 (δC 17.0)相关, H-19 (δH 3.87)与C-17 (δC 46.6)、C-21 (δC 75.8)相关, 提示3, 19位存在羟基; H-12 (δH 5.64)分别与C-9 (δC 48.8)、C-11 (δC 24.6)、C-14 (δC 42.8)、C-18 (δC 44.7)相关, 推测三取代双键在12, 13位碳上; H2-16 (δH 2.52, 2.96)、H-18 (δH 3.82)、H2-22 (δH 2.55, 2.64)分别与C-28 (δC 181.0)相关, 由以上数据, 进一步确定化合物的平面结构。
|
图 2 Key HMBC (→) and NOESY (⇠⇢) correlations of compound 1 |
化合物的相对构型通过NOESY谱(图 2)和1H NMR谱的峰型及耦合常数确定。在NOESY谱中, H-3/H-5, H-3/ CH3-23, H-5/H-9, H-9/CH3-27, CH3-27/H-16α, H-16α/H-22α, H-22α/CH3-29; CH3-24/CH3-25, CH3-25/CH3-26, CH3-26/H-18, H-18/H-19, H-19/CH3-30, CH3-30/H-21, 由3位氢的峰型及耦合常数可以推测H-3为α构型, 即OH-3为β构型[9], 从而确定H-5、H-9、CH3-27、CH3-29为α构型, H-18、H-19、H-21、CH3-24、CH3-25、CH3-26、CH3-30为β构型, 即OH-19、OH-21均为α构型, 最终确定该化合物为3β, 19α, 21α-三羟基-12-烯-28-油酸(3β, 19α, 21α-trihydroxyl-12-en-28-oic acid)。经Scifinder检索, 为一未见报道的新化合物。
2 胆碱酯酶抑制活性测试采用改进的Ellman法对化合物1~8进行了乙酰胆碱酯酶及丁酰胆碱酯酶活性测试, 石杉碱甲及Iso-OMPA作为阳性对照。结果显示, 化合物1~8对乙酰胆碱酯酶抑制活性较弱, 对丁酰胆碱酯酶抑制活性较强。其中化合物1、3和5表现较强的丁酰胆碱酯酶抑制活性。结构上这3个化合物3位和19位均为羟基, 对比化合物2, 推测19位羟基取代有利于活性提高。化合物1中, 21位也被羟基取代, 其20 μmol·L-1时抑制率达到88%, 说明E环羟基的取代对丁酰胆碱酯酶抑制活性起着重要的作用。
| 表 2 The inhibitory ratio of compounds to AchE and BuChE |
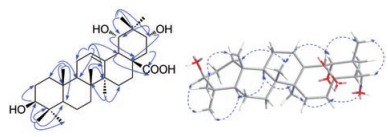
为了考察化合物1与胆碱酯酶的潜在作用模式, 对其进行分子对接研究。结果显示化合物1不能够结合到乙酰胆碱酯酶活性位点(PDB code 4EY5), 而与丁酰胆碱酯酶(PDB code 4TPK)结合较好, 其结果如图 3所示。化合物1深嵌入丁酰胆碱酯酶活性位点, 21位羟基与氨基酸残基Asn289的侧链形成一个保守的氢键, A环进入有Trp82、Phe329形成的疏水口袋。23, 24位两个甲基与Trp82、His438、Phe329及Ala328形成疏水作用。

|
图 3 The molecular docking of compound 1 and BuChE. A: The structure of compound 1; B: The binding site of compound 1; C: A detailed show of interaction between compound 1 and BuChE; D: The 2D show of interactions |
Bruker AVANCE Ⅲ HD-400核磁共振谱仪和Bruker IFS-55光谱仪(德国Bruker公司), Perkin-Elmer 241 MC旋光仪(美国Perkin-Elmer公司), 日立液相色谱仪(日本日立株式会社), Waters LCT Premier XE TOF-MS (美国Waters公司)。薄层色谱硅胶GF254和柱色谱硅胶(200~300目, 青岛海洋化工有限公司生产), ODS (30~80 μm, 天津市化学试剂厂色谱技术开发公司生产), 所有试剂若无特别说明, 级别为分析纯或色谱纯(山东禹王实业有限公司生产)。
格蓬脂购于新疆乌鲁木齐市药材市场, 经石河子大学药学院朱芸副教授鉴定为伞形科(Apiaceae)植物格蓬阿魏(Ferula galbaniflua Boissier et Bubse)的乳状胶脂, 标本(SN0208)保存于沈阳药科大学中药学院天然药化实验室。
1 提取与分离格蓬脂(200 g)经粉碎后, 以甲醇2 L超声提取3次, 每次1 h, 减压浓缩至干, 得到浸膏168 g。取浸膏150 g进行硅胶柱色谱分离, 以石油醚-丙酮系统(100:0~0:100)进行梯度洗脱, 得到10个流份(Fr.1~Fr.10)。流份Fr.3 (12.5 g)经硅胶柱色谱分离, 以石油醚-丙酮系统(100:0, 100:3, 100:5, 100:8, 100:10, 100:20, 100:50)梯度洗脱, 得到7个亚流份(Fr.3.1~Fr.3.7)。Fr.3.4 (3.7 g)经开放ODS柱色谱, 以甲醇-水(10%~100%)梯度洗脱, 得到Fr.3.4.1~Fr.3.4.10, 亚流份Fr.3.4.6 (276 mg)经重结晶得到化合物8 (52.4 mg), Fr.3.4.8 (1.5 g)再经硅胶柱, 石油醚-乙酸乙酯-丙酮系统(100:4:4, 100:5:5, 100:6:6, 100:7:7, 100:20:20)梯度洗脱, 得到5个亚流份(Fr.3.4.8.1~Fr.3.4.8.5), Fr.3.4.8.3 (573 mg)经重结晶得到化合物7 (104.3 mg)。流份Fr.5 (4.9 g)经开放ODS柱色谱, 以甲醇-水(10%~100%)梯度洗脱, 得到Fr.5.1~Fr.5.10, Fr.5.7 (159 mg)经重结晶得到化合物2 (25.7 mg)。Fr.5.8 (1.2 g)再经硅胶柱, 石油醚-乙酸乙酯-丙酮系统(100:4:4, 100:5:5, 100:6:6, 100:7:7, 100:20:20)梯度洗脱, 得到5个亚流份(Fr.5.8.1~Fr.5.8.5), Fr.5.8.3 (101 mg)经重结晶得到化合物6 (23.2 mg)。流份Fr.6 (5.2 g)经开放ODS柱色谱, 以甲醇-水(10%~100%)梯度洗脱, 得到Fr.6.1~Fr.6.10, Fr.6.6 (96 mg)经重结晶得到化合物3 (13.3 mg)。Fr.6.8 (242 mg) RP-HPLC分离, 以乙腈-水(85:15)为流动相(2.0 mL·min-1, 210 nm), 制备得到化合物1 (tR=47.3 min, 50.6 mg)。流份Fr.7 (4.7 g)经开放ODS柱色谱, 以甲醇-水(10%~100%)梯度洗脱, 得到Fr.7.1~Fr.7.10, Fr.7.6 (1.3 g)再经硅胶柱, 石油醚-乙酸乙酯-丙酮系统(100:10:10, 100:12:12, 100:14:14, 100:25:25)梯度洗脱, 得到4个亚流份(Fr.7.6.1~Fr.7.6.4), Fr.7.6.3 (126 mg)经重结晶得到化合物4 (31.1 mg)。Fr.7.7 (242 mg)经RP-HPLC分离, 以乙腈-水(85:15)为流动相(2.0 mL·min-1, 210 nm), 制备得到化合物5 (tR=82.3 min, 48.5 mg)。
2 结构鉴定化合物1 白色羽状结晶(甲醇), [α] -47.6 (c 0.92, CHCl3); IR (KBr) vmax (cm-1): 3 409, 2 938, 2 873, 1 709, 1 630, 1 453, 1 385, 1 288, 1 050, 914, 626; 1H NMR (400 MHz, C5D5N), 13C NMR (100 MHz, C5D5N)见表 1, HR-ESI-MS给出m/z 489.361 2 [M+H]+ (Calcd. 489.361 0, C30H49O5+)。
化合物2 白色固体粉末, HR-ESI-MS m/z 471.347 6 [M-H]- (Calcd. for 471.347 4, C30H47O4-)。1H NMR (400 MHz, C5D5N): δH 0.90 (3H, s, CH3-29), 0.92 (3H, s, CH3-30), 1.07 (6H, s, CH3-23, CH3-26), 1.11 (3H, s, CH3-27), 1.18 (3H, s, CH3-24), 1.30 (3H, s, CH3-25), 3.16 (1H, dd, J = 10.3, 5.8 Hz, H-3), 4.54 (1H, br s, H-6), 5.31 (1H, t, J = 3.4 Hz, H-12); 13C NMR (100 MHz, C5D5N): δC 40.5 (C-1), 27.5 (C-2), 79.3 (C-3), 39.7 (C-4), 55.9 (C-5), 68.8 (C-6), 40.7 (C-7), 36.7 (C-8), 38.6 (C-9), 48.1 (C-10), 23.5 (C-11), 122.9 (C-12), 143.0 (C-13), 42.5 (C-14), 27.8 (C-15), 23.2 (C-16), 46.7 (C-17), 41.1 (C-18), 46.1 (C-19), 30.8 (C-20), 34.1 (C-21), 32.5 (C-22), 28.1 (C-23), 17.2 (C-24), 17.1 (C-25), 26.1 (C-26), 18.4 (C-27), 183.6 (C-28), 33.2 (C-29), 23.7 (C-30)。以上数据与文献对比[10], 确定化合物2为苏门树脂脑酸。
化合物3 白色片状结晶, HR-ESI-MS m/z 471.347 6 [M-H]- (Calcd. for 471.347 4, C30H47O4-)。1H NMR (400 MHz, C5D5N): δH 0.94 (3H, s, CH3-25), 1.04 (3H, s, CH3-24), 1.08 (3H, s, CH3-26), 1.13 (3H, s, CH3-30), 1.20 (3H, s, CH3-29), 1.25 (3H, s, CH3-23), 1.65 (3H, s, CH3-27), 3.44 (1H, dd, J = 10.8, 5.2 Hz, H-3), 5.58 (1H, t, J = 4.0 Hz, H-12); 13C NMR (100 MHz, C5D5N): δC 38.9 (C-1), 28.6 (C-2), 78.3 (C-3), 39.5 (C-4), 56.1 (C-5), 19.1 (C-6), 33.8 (C-7), 40.1 (C-8), 48.5 (C-9), 37.7 (C-10), 24.3 (C-11), 123.5 (C-12), 145.0 (C-13), 42.3 (C-14), 30.0 (C-15), 28.2 (C-16), 46.1 (C-17), 44.9 (C-18), 81.4 (C-19), 35.9 (C-20), 29.0 (C-21), 33.5 (C-22), 29.3 (C-23), 16.6 (C-24), 15.6 (C-25), 17.6 (C-26), 25.0 (C-27), 180.9 (C-28), 29.0 (C-29), 25.0 (C-30)。以上数据与文献对比[8], 确定化合物3为3β, 19α-二羟基-12-烯-28-油酸。
化合物4 白色羽状结晶, HR-ESI-MS m/z 455.353 9 [M-H]- (Calcd. for 455.352 5, C30H47O3-)。1H NMR (400 MHz, C5D5N): δH 0.92 (3H, s, CH3-29), 0.97 (3H, s, CH3-30), 1.03 (3H, s, CH3-23), 1.05 (3H, s, CH3-24), 1.07 (3H, s, CH3-25), 1.27 (3H, s, CH3-26), 1.31 (3H, s, CH3-27), 3.43 (1H, dd, J = 10.7, 5.2 Hz, H-3), 5.53 (1H, br s, H-12); 13C NMR (100 MHz, C5D5N): δC 39.9 (C-1), 28.6 (C-2), 78.6 (C-3), 40.3 (C-4), 56.3 (C-5), 19.3 (C-6), 34.7 (C-7), 42.5 (C-8), 50.2 (C-9), 39.4 (C-10), 24.2 (C-11), 123.1 (C-12), 145.3 (C-13), 42.7 (C-14), 28.8 (C-15), 24.3 (C-16), 47.2 (C-17), 46.9 (C-18), 48.6 (C-19), 31.5 (C-20), 37.9 (C-21), 33.7 (C-22), 29.2 (C-23), 17.0 (C-24), 16.0 (C-25), 17.9 (C-26), 26.7 (C-27), 180.9 (C-28), 33.7 (C-29), 24.3 (C-30)。以上数据与文献对比[11], 确定化合物4为齐墩果酸。
化合物5 白色羽状结晶, HR-ESI-MS给出m/z 489.361 2 [M+H]+ (Calcd. 489.361 0, C30H49O5+)。1H NMR (400 MHz, C5D5N): δH 1.15 (3H, s, CH3-30), 1.21 (3H, s, CH3-29), 1.45 (3H, s, CH3-23), 1.65 (3H, s, CH3-27), 1.67 (3H, s, CH3-26), 1.70 (3H, s, CH3-24), 1.74 (3H, s, CH3-25), 3.49 (1H, dd, J = 11.6, 4.1 Hz, H-3), 3.68 (1H, br s, H-19), 4.87 (1H, br s, H-6), 5.68 (1H, br s, H-12); 13C NMR (100 MHz, C5D5N): δC 39.9 (C-1), 28.9 (C-2), 79.2 (C-3), 41.0 (C-4), 57.3 (C-5), 68.4 (C-6), 42.0 (C-7), 41.5 (C-8), 49.5 (C-9), 37.8 (C-10), 24.7 (C-11), 124.3 (C-12), 144.3 (C-13), 43.1 (C-14), 29.8 (C-15), 28.8 (C-16), 46.6 (C-17), 45.3 (C-18), 81.8 (C-19), 36.8 (C-20), 29.4 (C-21), 34.2 (C-22), 29.6 (C-23), 17.5 (C-24), 18.5 (C-25), 25.4 (C-26), 18.8 (C-27), 181.4 (C-28), 29.1 (C-29), 25.4 (C-30)。以上数据与文献对比[12], 确定化合物5为3β, 6β, 19α-三羟基-12-烯-28-油酸。
化合物6 白色针状结晶, HR-ESI-MS m/z 469.331 3 [M-H]- (Calcd. for 469.331 8, C30H46O4-)。1H NMR (400 MHz, CDCl3): δH 0.77 (3H, s, CH3-26), 0.97 (3H, s, CH3-29), 0.98 (3H, s, CH3-30), 1.04 (3H, s, CH3-24), 1.05 (3H, s, CH3-25), 1.08 (3H, s, CH3-23), 1.26 (3H, s, CH3-27), 3.34 (1H, d, J = 3.7 Hz, H-19), 5.44 (1H, t, J = 3.8 Hz, H-12); 13C NMR (100 MHz, CDCl3): δC 38.8 (C-1), 34.1 (C-2), 217.5 (C-3), 47.5 (C-4), 55.4 (C-5), 19.6 (C-6), 32.0 (C-7), 39.6 (C-8), 47.1 (C-9), 37.0 (C-10), 23.7 (C-11), 124.8 (C-12), 142.7 (C-13), 41.3 (C-14), 28.0 (C-15), 27.4 (C-16), 45.3 (C-17), 43.4 (C-18), 81.5 (C-19), 34.6 (C-20), 28.0 (C-21), 32.4 (C-22), 26.2 (C-23), 21.5 (C-24), 14.7 (C-25), 17.1 (C-26), 24.4 (C-27), 184.7 (C-28), 28.0 (C-29), 24.9 (C-30)。以上数据与文献对比[13], 确定化合物6为19α-羟基齐墩果酮酸。
化合物7 白色针状结晶, HR-ESI-MS m/z 469.331 3 [M-H]- (Calcd. for 469.331 8, C30H46O4-)。1H NMR (400 MHz, C5D5N): δH 0.98 (3H, s, CH3-29), 1.03 (3H, s, CH3-30), 1.28 (3H, s, CH3-27), 1.37 (3H, s, CH3-23), 1.62 (3H, s, CH3-24), 1.68 (6H, s, CH3-25, CH3-26), 4.68 (1H, br s, H-6), 5.59 (1H, t, J = 3.4 Hz, H-12); 13C NMR (100 MHz, C5D5N): δC 41.5 (C-1), 33.7 (C-2), 216.1 (C-3), 47.2 (C-4), 57.4 (C-5), 68.6 (C-6), 42.3 (C-7), 39.7 (C-8), 48.4 (C-9), 37.4 (C-10), 24.2 (C-11), 123.1 (C-12), 144.8 (C-13), 43.3 (C-14), 26.7 (C-15), 24.4 (C-16), 49.8 (C-17), 42.6 (C-18), 46.9 (C-19), 31.5 (C-20), 35.2 (C-21), 34.7 (C-22), 28.8 (C-23), 24.6 (C-24), 16.8 (C-25), 19.2 (C-26), 26.3 (C-27), 180.6 (C-28), 33.8 (C-29), 24.3 (C-30)。以上数据与文献对比[14], 确定化合物7为6α-羟基齐墩果酮酸。
化合物8 白色羽状结晶, HR-ESI-MS m/z 487.349 5 [M+H]+ (Calcd. for 487.348 2, C30H47O5+)。1H NMR (400 MHz, C5D5N): δH 0.79 (3H, s, CH3-30), 0.88 (3H, s, CH3-29), 1.22 (3H, s, CH3-27), 1.41 (3H, s, CH3-23), 1.64 (3H, s, CH3-25), 1.72 (3H, s, CH3-24), 1.83 (3H, s, CH3-26), 3.31 (1H, m, H-11), 3.33 (1H, m, H-12), 3.46 (1H, dd, J = 12.0, 3.9 Hz, H-3), 4.81 (1H, br s, H-6); 13C NMR (100 MHz, C5D5N): δC 40.2 (C-1), 28.4 (C-2), 79.0 (C-3), 41.0 (C-4), 56.5 (C-5), 67.9 (C-6), 41.2 (C-7), 41.6 (C-8), 52.5 (C-9), 37.0 (C-10), 53.6 (C-11), 57.9 (C-12), 88.2 (C-13), 41.8 (C-14), 27.5 (C-15), 22.1 (C-16), 44.6 (C-17), 50.4 (C-18), 38.6 (C-19), 32.0 (C-20), 34.9 (C-21), 28.1 (C-22), 28.4 (C-23), 18.1 (C-24), 19.5 (C-25), 21.8 (C-26), 19.6 (C-27), 179.4 (C-28), 33.5 (C-29), 23.9 (C-30)。以上数据与文献对比[15], 确定化合物8为3α, 6α-二羟基-11R, 12R-环氧齐墩果烷-28, 13α-内酯。
3 胆碱酯酶活性测试将准确质量的待测化合物溶于一定量二甲基亚砜(DMSO)配置成20 mmol·L-1的母液, 取4 μL母液加入500 μL PBS配成400 μmol·L-1的溶液。
丁酰胆碱酯酶抑制活性测定方法:在96孔板上测定样品的BuChE抑制活性。具体操作如下:在96孔酶标板中依次加入PBS (100 mmol·L-1, pH 8.0) 25 μL, BuChE (≥0.04 U·mL-1, pH 8.0 PBS溶解稀释) 25 μL, 样品溶液(400 μmol·mL-1) 25 μL。冰浴5 min后, 依次加入BuSCH (1.6 mmol·L-1, pH 8.0 PBS溶解稀释) 25 μL及DTNB (4.0 mmol·L-1, pH 8.0 PBS溶解稀释) 25 μL, 37 ℃孵育60 min后, 用酶标仪在412 nm下测定其吸光度值。
其中, 标准组用25 μL PBS (pH 8.0)代替25 μL样品溶液; 空白组用25 μL PBS (pH 8.0)代替25 μL样品溶液及25 μL PBS (pH 8.0)代替25 μL BuChE液; 完全抑制组用25 μL Iso-OMPA (16.0 μmol·L-1)代替25 μL样品溶液。
乙酰胆碱酯酶抑制活性测定方法:在96孔酶标板上测定样品的AChE抑制活性。具体操作如下:在96孔酶标板中依次加入PBS (100 mmol·L-1, pH 8.0) 35 μL, AChE (0.132 U·mL-1, pH 8.0 PBS溶解稀释) 25 μL, 样品溶液(400 μmol·L-1) 25 μL, ATCI (4 mmol·L-1, pH 7.0 PBS溶解稀释) 15 μL及DTNB (6 mmol·L-1, pH 8.0 PBS溶解稀释) 15 μL。37 ℃孵育60 min后, 用酶标仪在412 nm下测定其吸光度值。
其中, 标准组用25 μL PBS (pH 8.0)代替25 μL样品溶液; 空白组用50 μL PBS (pH 8.0)代替25 μL样品溶液及25 μL AChE液; 完全抑制组用20 μL石杉碱甲液(0.8 μmol·L-1)代替25 μL样品溶液, 不足100 μL用PBS (pH 8.0)补齐。
酶抑制率的计算方法如下公式:
| $ 抑制率 = \frac{{\left( {标准组 - 空白组} \right) - \left( {样品组 - 样品空白组} \right)}}{{\left( {标准组 - 空白组} \right)}} \times 100\% $ |
本文中分子对接采用Discovery Studio 3.5软件进行[16]。蛋白文件的准备包括添加氢原子, 删除水分子和施加Charmm力场。打分软件采用的是Goldscore, 其他参数采用的是系统默认值。丁酰胆碱酯酶结构从PDB数据库下载[17], 每次对接试验中保留10个最佳的分子构象作为候选, 并且计算RMSD值作为参考标准。
| [1] |
Pavlovic I, Krunic A, Nikolic D, et al. Chloroform extract of underground parts of Ferula heuffelii:secondary metabolites and spasmolytic activity[J]. Chem Biodiv, 2014, 11: 1417-1427. DOI:10.1002/cbdv.201400094 |
| [2] |
Dastan D, Salehi P, Gohari AR, et al. Bioactive sesquiterpene coumarins from Ferula pseudalliacea[J]. Planta Med, 2014, 80: 1118-1123. DOI:10.1055/s-0034-1382996 |
| [3] |
Adhami HR, Fitz V, Lubich A, et al. Acetylcholinesterase inhibitors from galbanum, the oleo gum-resin of Ferula gummosa Boiss[J]. Phytochem Anal, 2014, 10: 82-87. DOI:10.1016/j.phytol.2014.08.023 |
| [4] |
Meng H, Li G, Huang J, et al. Sesquiterpene coumarin and sesquiterpene chromone derivatives from Ferula ferulaeoides (Steud.) Korov[J]. Fitoterapia, 2013, 86: 70-77. DOI:10.1016/j.fitote.2013.02.002 |
| [5] |
Li G, Li X, Cao L, et al. Steroidal esters from Ferula sinkiangensis[J]. Fitoterapia, 2014, 97: 247-252. DOI:10.1016/j.fitote.2014.06.016 |
| [6] |
Chinese Materia Medica Editorial Board. Chinese Materia Medica (Uygur medicine volume) (中华本草:维吾尔药卷)[M]. Shanghai: Shanghai Scientific and Technical Publishers, 2005: 269.
|
| [7] |
Ikuta A, Kamiya K, Satake T, et al. Triterpenoids from callus cultures of Paeonia species[J]. Phytochemistry, 1995, 38: 1203-1207. DOI:10.1016/0031-9422(94)00445-Y |
| [8] |
Yoshihiro M, Masato F, Akihito Y, et al. Triterpene glycosides from the roots of Sanguisorba officinalis[J]. Phytochemistry, 2001, 57: 773-779. DOI:10.1016/S0031-9422(01)00083-8 |
| [9] |
Ahmed E, Malik A, Ferheen S, et al. Chymotrypsin inhibitory triterpenoids from Silybum marianum[J]. Chem Pharm Bull, 2006, 54: 103-106. DOI:10.1248/cpb.54.103 |
| [10] |
Wilfred RC, Veronicas H, Athleean M. Triterpenes from Mzconaz stenostach Ya[J]. J Nat Prod, 1992, 55: 963-966. DOI:10.1021/np50085a020 |
| [11] |
An RB, Kim HC, Jeong GS, et al. Constituents of the aerial parts of Agrimonia pilosa[J]. Nat Prod Sci, 2005, 11: 196-198. |
| [12] |
Adnyana IK, Tezuka Y, Banskota AH, et al. Three new triterpenes from the seeds of Combretum quadrangulare and their hepatoprotective activity[J]. J Nat Prod, 2001, 64: 360-363. DOI:10.1021/np000486x |
| [13] |
Braulio MF, Carmen ED, Nayra Q. Triterpenes from natural and transformed roots of Plocama pendula[J]. J Nat Prod, 2006, 69: 1092-1094. DOI:10.1021/np0680026 |
| [14] |
Nargis A, Abdul M. Oleanene type triterpenes form Plumeria Rubra[J]. Phytochemistry, 1993, 32: 1523-1525. DOI:10.1016/0031-9422(93)85171-M |
| [15] |
Wang F, Hua HM, Pei YH, et al. Triterpenoids from the resin of Styrax tonkinensis and their antiproliferative and differentiation effects in human leukemia HL-60 Cells[J]. J Nat Prod, 2006, 69: 807-810. DOI:10.1021/np050371z |
| [16] |
Wu G, Robertson DH, Vieth M. Detailed analysis of grid-based molecular docking:a case study of CDOCKER-A CHARMm-based MD docking algorithm[J]. J Comput Chem, 2003, 24: 1549-1562. DOI:10.1002/jcc.10306 |
| [17] |
Brus B, Košak U, Turk S, et al. Discovery, biological evaluation, and crystal structure of a novel nanomolar selective butyrylcholinesterase inhibitor[J]. J Med Chem, 2014, 57: 8167-8179. DOI:10.1021/jm501195e |
 2020, Vol. 55
2020, Vol. 55


