铀(uranium, U)是一种广泛存在于地壳中的天然放射性元素, 它作为核工业中重要的核燃料、核动力航母和核潜艇的燃料以及核武器的装料, 已在世界范围内生产和使用, 其副产物贫铀亦被广泛应用于军事领域[1, 2]。一旦发生核事故/核战争/核恐怖活动, 铀化合物可通过呼吸道、消化道和皮肤/伤口进入人体造成体内铀内污染[3]。铀吸收入血后通常以稳定的、可溶性的六价铀酰离子[UO22+, U(Ⅵ)]形式存在于血浆中[4, 5], 主要与转铁蛋白(transferrin, Tf)和碳酸盐结合形成络合物[6, 7], 经血液循环运输到肾脏、骨骼等主要蓄积靶器官, 通过Tf受体介导的细胞内吞作用而进入细胞产生毒性作用[8-10], 甚至诱发癌症[11]。采用螯合剂加速体内U(Ⅵ)排出是其主要的治疗措施, 但目前国内外临床上尚无有效的U(Ⅵ)促排药物, 因此探寻高效低毒的U(Ⅵ)促排螯合剂倍受世界各国所关注, 然而目前主要采用动物实验来筛选螯合剂对U(Ⅵ)的促排效果, 存在实验周期长、通量低、成本高等诸多局限, 亟待建立体外U(Ⅵ)促排药物的筛选模型, 以提高药物研发效率、降低研发成本。
Tf是人体内参与铁代谢的一种β-球蛋白, 是血液中最主要的、非血红素结合铁的铁转运蛋白, 它大部分以去铁转铁蛋白(apotransferrin, apo-Tf)的形式存在于血浆中。研究发现, apo-Tf除与Fe3+络合外, 还可作为内源性配体与内污染人体的锕系和镧系金属离子络合, 促进其在机体内的转运[7], 包括与血浆中以UO22+形式存在的U(Ⅵ)形成稳定的(UO22+)2Tf络合物, 该络合物通过内吞作用被细胞摄取[6, 7, 12], 从而对细胞产生毒性作用。螯合剂若能竞争结合(UO22+)2Tf络合物中UO22+, 则能阻断UO22+被细胞摄取, 从而降低U(Ⅵ)的细胞毒性, 并加速其排出体外。由此可见, 螯合剂与apo-Tf竞争结合U(Ⅵ)的能力是影响螯合剂解毒和排U(Ⅵ)效果的关键因素之一。故本研究拟建立竞争ELISA法以检测螯合剂与apo-Tf竞争结合U(Ⅵ)的能力, 并采用动物实验验证螯合剂促排U(Ⅵ)的效果, 以评价该方法用于体外筛选U(Ⅵ)促排螯合剂的可行性, 为U(Ⅵ)促排新药的研发提供简便、快速、经济和高通量的筛选模型。
材料与方法药品及试剂 去铁转铁蛋白、转铁蛋白抗体(美国Santa Cruz公司); 辣根过氧化物酶(HRP)标记的山羊抗小鼠IgG (江苏碧云天生物技术研究所); 邻苯二胺(OPD, 国药集团化学试剂有限公司); 醋酸铀酰[(UO2(CH3COO)2)·2H2O, 美国Chem-Impex公司]; 邻苯二酚-3, 6二甲撑亚氨基四乙酸(CBMIDA, 复旦大学化学系合成); Tiron (美国Sigma-aldrich公司); DTPA-CaNa3和DTPA-ZnNa3水溶液(复旦大学放射医学研究所配制)。
动物 SPF级ICR小鼠, 雄性, 体重18~20 g, 购自上海杰思捷实验动物有限公司, 动物许可证号: SCXK (沪) 2018-0004。动物实验在复旦大学药学院实验动物中心进行, 遵守复旦大学药学院伦理委员会规程。
仪器 Infinite M200 pro多功能酶标仪(瑞士TECAN公司); 石墨消解仪(广州基创仪器有限公司); X-7电感耦合等离子体质谱仪(ICP-MS, 美国Thermo公司)。
ELISA测定 采用包被缓冲液(0.1 mol·L-1碳酸盐缓冲液, pH 9.6)将1 mg·mL-1的apo-Tf抗原水溶液稀释成一定的质量浓度, 加入96孔酶标板中, 每孔100 μL, 同时设置空白对照孔, 4 ℃包被过夜, 使apo-Tf附着于孔板上。用含0.05% Tween 20的磷酸盐缓冲液(phosphate buffered solution containing Tween 20, PBST)清洗3次, 5 min/次, 洗去未附着的apo-Tf。用含1%牛血清白蛋白(albumin from bovine serum, BSA)的磷酸盐缓冲液(phosphate buffered solution, PBS)作为封闭液, 每孔加200 μL, 4 ℃封闭过夜。封闭结束后, 弃液, 于吸水纸上拍干, 每孔加入Tf抗体100 μL, 37 ℃孵育3 h, 使Tf抗体与附着于孔底的apo-Tf进行特异结合。一抗孵育结束后, PBST清洗3次, 5 min/次, 洗去未结合的一抗。然后每孔加入100 μL一定稀释比例的HRP标记的山羊抗小鼠IgG作为二抗, 37 ℃孵育1 h。二抗孵育结束后, 用PBST清洗3次, 5 min/次, 洗去未结合的二抗。之后每孔加入新鲜配制的OPD底物显色液100 μL, 室温避光显色15 min后, 每孔加入2 mol·L-1 H2SO4溶液50 μL终止反应。于酶标仪490 nm波长处检测吸光度(A)值。
Apo-Tf抗原最佳包被浓度的确定 采用不同质量浓度(0.2、0.4、0.6、0.8、1、2、4 μg·mL-1)的apo-Tf抗原包被96孔酶标板, 与4 μg·mL-1 Tf抗体特异结合, 与1:250稀释的二抗进行免疫反应, OPD显色后测定各孔A值, 以确定本ELISA检测体系包被抗原apo-Tf的最佳工作浓度。
Tf抗体最佳质量浓度的确定 采用0.2 μg·mL-1 apo-Tf抗原包被96孔酶标板, 与不同质量浓度(0.1、0.2、0.5、1.0、2.0、3.0、4.0、6.0、8.0 μg·mL-1)的Tf抗体特异结合, 与1:250稀释的二抗进行免疫反应, OPD显色后测定各孔A值, 以确定本ELISA检测体系Tf抗体的最佳工作浓度。
二抗最佳稀释比例的确定采用0.2 μg·mL-1 apo-Tf抗原包被, 2 μg·mL-1 Tf抗体特异结合和不同稀释比例(1:2 000、1:1 000、1:750、1:500、1:300、1:200、1:150)的二抗进行免疫反应, OPD显色后测定各孔A值, 以确定本ELISA检测体系HRP标记的山羊抗小鼠IgG二抗的最佳稀释比例。
U(Ⅵ)与Tf抗体对apo-Tf的结合反应 采用上述实验确定的包被抗原apo-Tf、Tf抗体和HRP标记的山羊抗小鼠IgG二抗的最佳工作浓度。根据上述ELISA的实验步骤, 于封闭结束后加入0、10、75、150、300、600 μmol·L-1的U(Ⅵ)-碳酸盐溶液[U(Ⅵ)与碳酸钠的摩尔比为1:10, 以1 mol·L-1氢氧化钠调节pH值为约7.4], 每孔100 μL, 37 ℃孵育3 h。U(Ⅵ)处理结束后, 按上述ELISA方法的后续步骤进行, 以确定本实验体系中U(Ⅵ)溶液的最佳工作浓度。
螯合剂与apo-Tf竞争结合U(Ⅵ)的ELISA方法日内和日间精密度测定 采用0.2 μg·mL-1 apo-Tf抗原包被、1% BSA封闭、300 μmol·L-1 U(Ⅵ)孵育后, 分别加入125、250 μmol·L-1的螯合剂CBMIDA和Tiron, 250、500 μmol·L-1的DTPA-CaNa3和DTPA-ZnNa3各50 μL, 以上各孔同时加入4 μg·mL-1 Tf抗体50 μL, 经二抗免疫结合后进行OPD显色, 测定各孔A值。每个样品设置6个平行孔(n = 6), 计算相对标准偏差(relative standard deviation, RSD)以评估方法的稳定性(即日内精密度)。日间精密度测定方法与日内精密度操作相同, 每个样品设置3个平行孔(n = 3), 连续测定5天, 以评估方法的重现性。
螯合剂与apo-Tf竞争结合U(Ⅵ)能力的检测 采用0.2 μg·mL-1 apo-Tf抗原包被、1% BSA封闭、300 μmol·L-1的U(Ⅵ)孵育后, 分别加入125和250 μmol·L-1的CBMIDA和Tiron, 250和500 μmol·L-1的DTPA-CaNa3和DTPA-ZnNa3各50 μL, 以上各孔同时加入4 μg·mL-1 Tf抗体50 μL, 按上述ELISA方法的后续步骤进行。
小鼠U(Ⅵ)促排实验 将小鼠随机分为6组:空白对照组、单纯染U(Ⅵ)组、U(Ⅵ)+CBMIDA组、U(Ⅵ)+Tiron组、U(Ⅵ)+DTPA-CaNa3组和U(Ⅵ)+DTPA-ZnNa3组, 每组小鼠6只。每只小鼠腹腔注射(intraperitoneal injection, ip) 0.2 μg U(Ⅵ)后, 立即肌肉注射(intramuscular injection, im) 25 μmol·kg-1各种螯合剂; 单纯染U(Ⅵ)组小鼠ip U(Ⅵ)后立即im生理盐水; 空白对照组ip生理盐水后立即im生理盐水。将小鼠置于代谢笼中, 收集24 h尿液, 于U(Ⅵ)染毒后24 h麻醉处死小鼠, 解剖取双侧肾脏和股骨, 经硝酸/高氯酸于石墨消解仪120 ℃消解后, 采用ICP-MS检测尿、肾脏和股骨U(Ⅵ)含量, 再乘以稀释倍数, 除以U(Ⅵ)注入量, 计算尿U(Ⅵ)排出量、肾脏和股骨U(Ⅵ)蓄积量占注入量的百分数。
统计学分析 实验数据以均值±标准差表示, 各项ELISA实验至少重复3次。采用SPSS 11.5统计软件进行单因素方差分析。P < 0.05为差异有统计学意义。
结果 1 ELISA间接法检测系统条件的确定为保证实验结果的有效性和可重复性, 首先需要确定最佳的apo-Tf抗原包被浓度、Tf抗体浓度和二抗稀释比例。在一定的Tf抗体浓度、二抗稀释比例的条件下, 随着apo-Tf抗原包被浓度的增加, A值明显增加, 在0.2~4 μg·mL-1内A值达坪台期(图 1A), 故采用A值基本达峰值的0.2 μg·mL-1作为本实验的apo-Tf抗原包被浓度。在一定的apo-Tf抗原包被浓度、二抗稀释比例的条件下, 随着Tf抗体浓度的增加, A值呈线性增加(图 1B), 由于Tf抗体浓度在4 μg·mL-1时所得A值在2.0左右, 处于酶标仪最佳响应范围, 故选择4 μg·mL-1为本检测体系的Tf抗体浓度。在一定apo-Tf抗原包被浓度、Tf抗体浓度的条件下, 随着HRP标记的羊抗鼠IgG二抗浓度的增加, A值逐渐增加, 当二抗稀释比例在1:250~1:150时, A值增加放缓, 几乎达到坪台期(图 1C), 故选择A值基本达峰值的1:250为本检测体系的二抗稀释比例。

|
图 1 Determination of optimal concentration of the coated apo-Tf Ag (A), Tf Ab (B) and the dilution ratio of 2nd Ab (C) for the indirect ELISA assay. A: Absorbance; Apo-Tf Ag: Apo-Tf antigen; Tf Ab: Tf antibody; 2nd Ab: Secondary antibody. n = 3, x ± s |
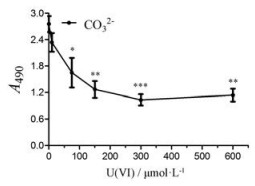
U(Ⅵ)与apo-Tf结合是否会影响apo-Tf抗原与Tf抗体免疫复合物的形成是竞争ELISA建立的基础。由图 2可见, 在碳酸盐存在的条件下, 随着U(Ⅵ)浓度的增加, 该反应体系的A值明显降低, 表明U(Ⅵ)与apo-Tf形成了稳定的络合物, 使Tf发生构象改变, 阻碍了Tf抗体与其免疫位点的结合, 以致反应体系的A值下降。随着U(Ⅵ)浓度的增加, 与U(Ⅵ)结合的apo-Tf越多, A值下降的幅度就越大; 当U(Ⅵ)浓度增加至300~600 μmol·L-1时, U(Ⅵ)与apo-Tf结合基本达到饱和, 反应体系的A值显著降低了约55%, 故选取300 μmol·L-1作为本实验体系的U(Ⅵ)浓度。
|
图 2 Effect of U(Ⅵ) on Tf Ab and apo-Tf Ag combination. n = 3, x ± s. *P < 0.05, **P < 0.01, ***P < 0.001 vs 0 μmol·L-1 U(Ⅵ) |
本实验选择了文献报道的2个阳性U(Ⅵ)促排螯合剂CBMIDA和Tiron, 以及2个阴性U(Ⅵ)促排螯合剂DTPA-CaNa3和DTPA-ZnNa3, 通过测定空白对照组、单纯U(Ⅵ)处理组、U(Ⅵ)+螯合剂组的日内精密度和日间精密度, 考察了方法的稳定性和重现性。由表 1可见, 各组样品6个平行孔所得A值的RSD均小于10%, 连续测定5天的RSD均小于20%, 表明该方法的稳定性和重现性较好, 能够满足生物学检测试验的要求。
| 表 1 The intra- and inter-day precision of the competitive ELISA method for chelating agents competing with U(Ⅵ) binding to apo-transferrin. aThe working concentration was 125 μmol·L-1; bn = 6; cn = 15. CBMIDA: Catechol-3, 6-bis(methyleiminodiacetic acid) |
本实验检测了2个阳性U(Ⅵ)促排螯合剂CBMIDA和Tiron以及2个阴性U(Ⅵ)促排螯合剂DTPA-CaNa3和DTPA-ZnNa3在该体系中与apo-Tf竞争结合U(Ⅵ)的能力。由图 3可见, 该体系经300 μmol·L-1 U(Ⅵ)作用后A值明显降低。在U(Ⅵ)处理后反应体系中含有62.5 μmol·L-1 CBMIDA和Tiron的A值与U(Ⅵ)单独处理组相比无明显差异; 当CBMIDA和Tiron的浓度增加至125 μmol·L-1时, 可使反应体系的A值较U(Ⅵ)单独处理组分别明显增加52%和54%, 而与空白对照组相比无显著差异。反应体系中含有125和250 μmol·L-1的DTPA-CaNa3和DTPA-ZnNa3的A值与U(Ⅵ)单独处理组相比均未见明显变化。以上结果表明, CBMIDA和Tiron能竞争结合与apo-Tf结合的U(Ⅵ), 而DTPA-CaNa3和DTPA-ZnNa3结合U(Ⅵ)的能力小于apo-Tf。

|
图 3 Ability of competitive combination of chelating agent and apo-Tf with U(Ⅵ). n = 3, x ± s. ***P < 0.001 vs blank control; △P < 0.05 vs U(Ⅵ)-treated group alone |
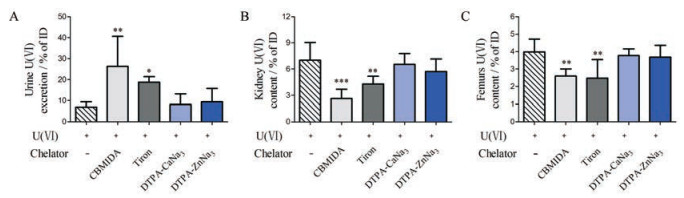
本实验进一步观察了以上4种螯合剂对U(Ⅵ)内污染小鼠的促排效果。25 μmol·kg-1 CBMIDA和Tiron立即给药能显著提高U(Ⅵ)内污染小鼠24 h的尿U(Ⅵ)排出, 分别较单纯U(Ⅵ)染毒组提高了148%和63%;而DTPA-CaNa3和DTPA-ZnNa3立即给药组小鼠的尿U(Ⅵ)排出与单纯U(Ⅵ)染毒组相比无明显差异(图 4A)。25 μmol·kg-1 CBMIDA和Tiron立即给药能显著降低U(Ⅵ)内污染小鼠24 h的肾脏和股骨U(Ⅵ)蓄积, 分别较单纯U(Ⅵ)染毒组降低了62%和37%以及35%和40%;而DTPA-CaNa3和DTPA-ZnNa3立即给药组小鼠的肾脏和股骨U(Ⅵ)蓄积与单纯U(Ⅵ)染毒组相比无显著差异(图 4B、C)。
|
图 4 Effect of chelating agents on urine U(Ⅵ) excretion (A), kidneys U(Ⅵ) accumulation (B) and femurs U(Ⅵ) accumulation (C) in U(Ⅵ)-exposed mice. n = 6, x ± s. *P < 0.05, **P < 0.01, ***P < 0.001 vs U(Ⅵ)-exposed mice alone. ID: Injected dose |
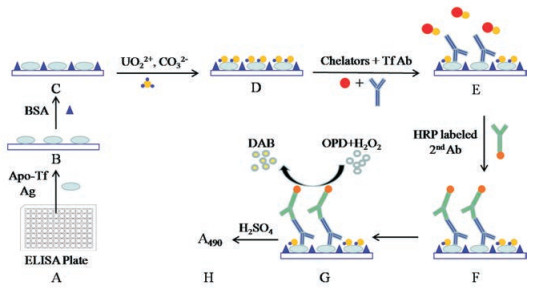
Tf在血浆中含量丰富, 亦存在于胆汁等体液和细胞外液中, 它不仅是血浆中转运U(Ⅵ)的主要蛋白, 而且是介导细胞摄取U(Ⅵ)导致细胞毒性的关键蛋白[6, 7]。许多动物实验表明, 小鼠/大鼠急性U(Ⅵ)染毒后给予某种螯合剂, 可显著降低肾和骨U(Ⅵ)蓄积, 促进U(Ⅵ)自体内排出, 减轻U(Ⅵ)致肾毒性[13-15], 表明螯合剂能竞争螯合apo-Tf结合的U(Ⅵ), 加速其从体内排出。本研究基于螯合剂与apo-Tf竞争结合U(Ⅵ)的作用建立U(Ⅵ)促排螯合剂的体外筛选模型(图 5), 设计思路是以竞争ELISA法为基础, U(Ⅵ)通过与包被于96孔酶标板中的apo-Tf结合形成络合物引起apo-Tf的构象改变, 从而阻碍了apo-Tf的免疫位点与Tf抗体的结合, 使反应体系的A值明显降低。若螯合剂能竞争结合apo-Tf络合的U(Ⅵ), 则可使apo-Tf构象恢复并与Tf抗体结合形成免疫复合物, 使反应体系的A值显著回升, 亦即为螯合剂竞争结合U(Ⅵ)的能力越强, 反应体系的A值回升越明显; 反之, 当螯合剂竞争结合U(Ⅵ)的能力低于apo-Tf时, 反应体系的A值则无明显改变。该实验原理与作者前期报道[16]的螯合剂与金属硫蛋白(metallothionein, MT)竞争结合U(Ⅵ)的竞争ELISA法的实验原理相一致; 不同的是, 两者与U(Ⅵ)形成的络合物的生理功能不同, Tf是介导U(Ⅵ)进入细胞发挥毒性作用的重要蛋白配体[12], 而MT是人体自身存在的可促进U(Ⅵ)自体内排出的U(Ⅵ)解毒剂[17]。因此, 本实验建立的与apo-Tf竞争结合U(Ⅵ)的U(Ⅵ)促排螯合剂体外筛选模型可进一步阐明螯合剂抑制细胞摄取U(Ⅵ)的解毒作用机制。由于本方法是以使U(Ⅵ)处理体系的A值显著回升为指标来判断螯合剂对U(Ⅵ)的螯合能力, 具有简便、快速、易于判断的优点; 不足之处在于该方法仅能定性检测螯合剂对U(Ⅵ)的螯合能力。目前国内外尚未见其他U(Ⅵ)促排螯合剂体外筛选模型的报道。
|
图 5 Schematic illustration of competitive ELISA. A: Prepare a microtiter plate; B: Coating apo-Tf Ag; C: Blocking with BSA; D: Incubating with UO22+; E: Incubating with chelators and Tf Ab; F: Incubating with HRP labeled 2nd Ab; G: Color-developing with O-phenylenediamine (OPD); H: Detecting A490 |
研究已证实, apo-Tf由C端和N端两个高度同源的结构域组成, 每个结构域各包含1个金属离子结合位点[18], 能可逆地结合Fe3+, 形成Fe2Tf络合物[6, 7], 许多其他金属离子包括U(Ⅵ)亦结合到这个位点, 以UO22+形式与apo-Tf结合形成(UO22+)2Tf络合物[6, 7]。值得注意的是, 无论是Fe3+还是U(Ⅵ), 与apo-Tf的金属位点结合时, 均需要碳酸根作为协同阴离子参与, 其中碳酸阴离子的2个氧原子参与UO22+配位, U(Ⅵ)才能与apo-Tf形成稳定的(UO22+)2Tf络合物[19, 20]; 研究还发现, 在生理pH 7.4的条件下, apo-Tf可结合1个或2个Fe3+; 而在细胞胞内体pH 5~6的酸性环境中, 则可诱导Tf构象改变, 并伴随Fe3+的释放[21], 提示pH值也可能对apo-Tf与U(Ⅵ)的亲和力产生重要影响。本实验亦观察到, 用10~600 μmol·L-1 U(Ⅵ)溶液与包被抗原apo-Tf孵育后, 随U(Ⅵ)浓度的增加, A值非但未见下降, 反而显著高于空白对照孔(数据未显示), 可能与U(Ⅵ)溶液的酸度随U(Ⅵ)浓度增加而增加(pH值由6下降至5), 使apo-Tf构象改变从而降低与U(Ⅵ)的亲和力有关。有研究表明, 血浆中的U(Ⅵ)除了与apo-Tf结合外, 还主要与碳酸盐形成络合物[22, 23]。在采用细胞实验研究U(Ⅵ)的细胞毒性和细胞内沉积时, 发现U(Ⅵ)在含重碳酸盐的培养液中实际主要与碳酸根形成稳定的UO2(CO3)34-络合物[10, 24]; 当U(Ⅵ)与重碳酸盐摩尔比为1:10时, 培养液中U(Ⅵ)是可溶性的, 且对细胞的毒性随U(Ⅵ)浓度的增加而增加; 透射电镜则观察到U(Ⅵ)沉淀于细胞质中[25], 表明碳酸根作为U(Ⅵ)的配体在U(Ⅵ)进入细胞致细胞毒性中发挥重要作用。故在本实验体系中, 在pH 7.4和碳酸根存在[碳酸钠与U(Ⅵ)的摩尔比为10:1]的条件下, 观察到U(Ⅵ)能与apo-Tf稳定结合, 显著降低本体系A值, 这为采用竞争ELISA法检测螯合剂与apo-Tf竞争结合U(Ⅵ)的能力奠定了重要的基础。而且, 本文对该竞争ELISA法进行方法学研究进一步验证了其具有较好的稳定性和重现性。
为了检测该体系测定螯合剂与apo-Tf竞争结合U(Ⅵ)能力的可行性, 本实验观察了2个阳性U(Ⅵ)促排螯合剂CBMIDA和Tiron以及2个阴性U(Ⅵ)促排螯合剂DTPA-CaNa3和DTPA-ZnNa3的体外竞争结合U(Ⅵ)的能力。Lan等[26]报道, CBMIDA以人常用剂量的犬等效剂量12.5 mg·kg-1肌肉注射犬后, 其血药浓度Cmax为14.18 μg·mL-1 (即35.45 μmol·L-1)。本实验采用高于此浓度1.8倍(62.5 μmol·L-1)、3.5倍(125 μmol·L-1)和7.1倍(250 μmol·L-1)的螯合剂进行检测, 发现高于此浓度3.5倍的125 μmol·L-1 CBMIDA和Tiron均可使U(Ⅵ)处理体系A值明显回升, 而高于此浓度7.1倍的250 μmol·L-1 DTPA-CaNa3和DTPA-ZnNa3却仍未能引起U(Ⅵ)处理体系A值的增加, 表明CBMIDA和Tiron能与apo-Tf竞争结合U(Ⅵ), 其螯合U(Ⅵ)的能力明显大于apo-Tf, 而DTPA-CaNa3和DTPA-ZnNa3则未显示对apo-Tf结合U(Ⅵ)的竞争作用。由此可见, 这4种螯合剂与apo-Tf竞争结合U(Ⅵ)能力的强弱顺序为: CBMIDA≈Tiron > apo-Tf > DTPA-CaNa3≈DTPA-ZnNa3。
本研究进一步采用动物实验以验证这4种螯合剂的排U(Ⅵ)效果。实验观察到, CBMIDA和Tiron立即给药能显著降低急性U(Ⅵ)染毒小鼠肾脏和股骨U(Ⅵ)蓄积、促进尿U(Ⅵ)排出; 而DTPA-CaNa3和DTPA-ZnNa3立即给药组小鼠的肾脏和股骨U(Ⅵ)蓄积、尿U(Ⅵ)排出与单纯U(Ⅵ)染毒组相比无显著差异。Fukuda等[14, 15]报道, CBMIDA能够促进急性U(Ⅵ)中毒大鼠尿U(Ⅵ)排出, 降低肾脏、股骨和肝脏等组织的U(Ⅵ)蓄积, 该文献报道与本动物实验结果相吻合。本课题组前期细胞实验[27]研究表明, CBMIDA能够降低肾近曲小管上皮HK-2细胞对U(Ⅵ)的摄取, 促进细胞内U(Ⅵ)的释放, 减轻U(Ⅵ)诱导的DNA损伤和细胞损伤, 进一步从细胞水平阐明了CBMIDA促进细胞内U(Ⅵ)排出和降低U(Ⅵ)致细胞毒性的作用。Domingo等[13]报道, Tiron立即给药或U染毒后延迟1 h内给药均能有效促进急性U(Ⅵ)中毒小鼠的尿U(Ⅵ)排出, 降低肾脏和股骨U(Ⅵ)蓄积; 而DTPA-CaNa3则无明显的促排作用, 该文献报道亦与本动物实验结果相一致。因此, 本动物实验进一步证实这4种螯合剂排U(Ⅵ)效果的强弱顺序为: CBMIDA≈Tiron > DTPA-CaNa3≈DTPA-ZnNa3, 与本研究建立的竞争ELISA方法检测螯合剂与apo-Tf竞争结合U(Ⅵ)能力的强弱顺序相吻合。
综上所述, 本研究建立的基于apo-Tf的竞争ELISA法能有效预测螯合剂络合U(Ⅵ)的能力, 可作为初步筛选U(Ⅵ)促排螯合剂的体外模型; 该方法的建立亦为其他放射性核素和重金属促排螯合剂的筛选与发现提供了新思路。
| [1] |
Faa A, Gerosa C, Fanni D, et al. Depleted uranium and human health[J]. Curr Med Chem, 2018, 25: 49-64. DOI:10.2174/0929867324666170426102343 |
| [2] |
Craft E, Abu-Qare A, Flaherty M, et al. Depleted and natural uranium:chemistry and toxicological effects[J]. J Toxicol Environ Health Part B, 2004, 7: 297-317. DOI:10.1080/10937400490452714 |
| [3] |
Bleise A, Danesi PR, Burkart W. Properties, use and health effects of depleted uranium (DU):a general overview[J]. J Environ Radioact, 2003, 64: 93-112. DOI:10.1016/S0265-931X(02)00041-3 |
| [4] |
Wang XM, Ji GX, Shi C, et al. Structural and thermodynamic stability of uranyl-deferiprone complexes and the removal efficacy of U(Ⅵ) at the cellular level[J]. Dalton Trans, 2018, 47: 8764-8770. DOI:10.1039/C8DT01738G |
| [5] |
Averseng O, Hagège A, Taran F, et al. Surface plasmon resonance for rapid screening of uranyl affine proteins[J]. Anal Chem, 2010, 82: 9797-9802. DOI:10.1021/ac102578y |
| [6] |
El Hage Chahine J, Hémadi M, Ha-Duong N. Uptake and release of metal ions by transferrin and interaction with receptor 1[J]. Biochim Biophys Acta, 2012, 1820: 334-347. DOI:10.1016/j.bbagen.2011.07.008 |
| [7] |
Deblonde GJ, Sturzbecher-Hoehne M, Mason AB, et al. Receptor recognition of transferrin bound to lanthanides and actinides:a discriminating step in cellular acquisition of f-block metals[J]. Metallomics, 2013, 5: 619-626. DOI:10.1039/c3mt20237b |
| [8] |
Malard V, Gaillard J, Bérenguer F, et al. Urine proteomic profiling of uranium nephrotoxicity[J]. Biochim Biophys Acta, 2009, 1794: 882-891. DOI:10.1016/j.bbapap.2009.01.010 |
| [9] |
Shaki F, Hosseini M, Ghazi-Khansari M, et al. Toxicity of depleted uranium on isolated rat kidney mitochondria[J]. Biochim Biophys Acta, 2012, 1820: 1940-1950. DOI:10.1016/j.bbagen.2012.08.015 |
| [10] |
Pierrefite-Carle V, Santucci-Darmanin S, Breuil V, et al. Effect of natural uranium on the UMR-106 osteoblastic cell line:impairment of the autophagic process as an underlying mechanism of uranium toxicity[J]. Arch Toxicol, 2017, 91: 1903-1914. DOI:10.1007/s00204-016-1833-5 |
| [11] |
Wagner SE, Burch JB, Bottai M, et al. Ground water uranium and cancer incidence in South Carolina[J]. Cancer Cause Control, 2011, 22: 41-50. DOI:10.1007/s10552-010-9669-4 |
| [12] |
Hemadi M, Ha-Duong N, El Hage Chahine J. Can uranium be transported by the iron-acquisition pathway? Ur uptake by transferrin[J]. J Phys Chem B, 2011, 115: 4206-4215. DOI:10.1021/jp111950c |
| [13] |
Domingo JL, Ortega A, Llobet JM, et al. Effectiveness of chelation therapy with time after acute uranium intoxication[J]. Fundam Appl Toxicol, 1990, 14: 88-95. DOI:10.1016/0272-0590(90)90234-B |
| [14] |
Fukuda S, Ikeda M, Nakamura M, et al. Efficacy of oral and intraperitoneal administration of CBMIDA for removing uranium in rats after parenteral injections of depleted uranium[J]. Radiat Prot Dosim, 2009, 133: 12-19. DOI:10.1093/rpd/ncn318 |
| [15] |
Fukuda S, Ikeda M, Nakamura M, et al. Effects of pH on DU intake and removal by CBMIDA and EHBP[J]. Health Phys, 2007, 92: 10-14. DOI:10.1097/01.HP.0000228931.61447.b3 |
| [16] |
Zhang XX, Bao YZ, Wang MM, et al. Competitive combination with uranium (Ⅵ) between chelating agent and metallothionein[J]. Chin J Radiol Health (中国辐射卫生), 2019, 28: 12-16. |
| [17] |
Hao YH, Huang JW, Liu C, et al. Differential protein expression in metallothionein protection from depleted uranium-induced nephrotoxicity[J]. Sci Rep, 2016, 6: 38942. DOI:10.1038/srep38942 |
| [18] |
Guo M, Lu XW, Ran XY, et al. Molecular transport mechanism of pefloxacin mesylate binding with transferrin[J]. Acta Pharm Sin (药学学报), 2012, 47: 1503-1510. |
| [19] |
Wang M, Ding WJ, Wang DQ. Binding mechanism of uranyl to transferrin implicated by density functional theory study[J]. RSC Adv, 2017, 7: 3667-3675. DOI:10.1039/C6RA26109D |
| [20] |
Benavides-Garcia MG, Balasubramanian K. Structural insights into the binding of uranyl with human serum protein apotransferrin structure and spectra of protein-uranyl interactions[J]. Chem Res Toxicol, 2009, 22: 1613-1621. DOI:10.1021/tx900184r |
| [21] |
Gkouvatsos K, Papanikolaou G, Pantopoulos K. Regulation of iron transport and the role of transferrin[J]. Biochim Biophys Acta, 2012, 1820: 188-202. DOI:10.1016/j.bbagen.2011.10.013 |
| [22] |
Montavon G, Apostolidis C, Bruchertseifer F, et al. Spectroscopic study of the interaction of U(Ⅵ) with transferrin and albumin for speciation of U(Ⅵ) under blood serum conditions[J]. J Inorg Biochem, 2009, 103: 1609-1616. DOI:10.1016/j.jinorgbio.2009.08.010 |
| [23] |
Sutton M, Burastero SR. Uranium(Ⅵ) solubility and speciation in simulated elemental human biological fluids[J]. Chem Res Toxicol, 2004, 17: 1468-1480. DOI:10.1021/tx049878k |
| [24] |
Carrière M, Thiebault C, Milgram S, et al. Citrate does not change uranium chemical speciation in cell culture medium but increases its toxicity and accumulation in NRK-52E cells[J]. Chem Res Toxicol, 2006, 19: 1637-1642. DOI:10.1021/tx060206z |
| [25] |
Mirto H, Barrouillet MP, Henge-Napoli MH, et al. Influence of uranium(Ⅵ) speciation for the evaluation of in vitro uranium cytotoxicity on LLC-PK1 cells[J]. Hum Exp Toxicol, 1999, 18: 180-187. DOI:10.1177/096032719901800308 |
| [26] |
Lan LA, Wu SY, Yu SD, et al. Fast and direct determination of catechol-3, 6-bis(methyleiminodiacetic acid) prototype in beagle dog plasma using liquid chromatography tandem mass spectrometry:a simplified and high throughput in-vivo method for the metal chelator[J]. J Chromatogr A, 2019, 1596: 84-95. DOI:10.1016/j.chroma.2019.03.002 |
| [27] |
Bao YZ, Wang D, Hu YX, et al. Efficacy of chelator CBMIDA-CaNa2 for the removal of uranium and protection against uranium-induced cell damage in human renal proximal tubular cells[J]. Health Phys, 2013, 105: 31-38. DOI:10.1097/HP.0b013e31828911a0 |
 2020, Vol. 55
2020, Vol. 55


