2. 黑龙江中医药大学, 黑龙江 哈尔滨 150040;
3. 长春中医药大学, 吉林 长春 130117
2. Heilongjiang University of Traditional Chinese Medicine, Harbin 150040, China;
3. Changchun University of Traditional Chinese Medicine, Changchun 130117, China
溃疡性结肠炎(ulcerative colitis, UC)是一种病因和发病机制尚不明确的慢性肠道炎症疾病。本病主要以大肠黏膜及黏膜下层发生慢性、非特异性炎症性病变为中心, 黏膜上皮及腺体破坏、增生或萎缩, 淋巴细胞、中性粒细胞和单核细胞浸润, 隐窝脓肿形成, 因而呈现黏膜充血、糜烂、溃疡及增殖性改变[1]。中医将UC归为“肠僻”、“大瘾泄”、“下利”、“痢疾”和“滞下”等范畴, 并认为UC多因感受外邪、内伤饮食、情志失调和脾胃虚弱所致, 病位在脾胃与大小肠。其发病机制为浊邪壅塞肠中, 传导失司, 气机不通, 气血壅滞, 肠络受损, 下痢赤白黏液。《济生方·痢疾论治》“胃者脾之腑, 为水谷之海, 营卫充焉。夫人饮食起居失其宜, 运动劳役失其度, 则脾胃不充, 大肠虚弱, 而风冷暑湿之邪, 得以乘间而入, 故为痢疾。”《类证治裁·痢症》谓“由胃腑湿蒸热壅, 致气血凝结, 夹糟粕积滞, 进入大小腑, 倾刮脂液, 化脓血下注。”
黄芩汤见于《伤寒论辨·太阳病脉证并治》, 该方由黄芩、白芍、大枣、炙甘草4味药组成。方中以黄芩为主, 苦寒坚阴而清里热; 芍药味酸微苦, 敛阴和营, 缓急止痛; 芩芍配伍, 酸苦相济, 调中存阴以止利, 是治热之要药, 炙甘草、大枣益气和中, 调补正气。诸药合用, 共奏清热止痢, 缓急止痛之功。此方以其严谨的理法方药和确切的临床疗效, 对后世产生了深刻的影响。现代药理研究表明, 黄芩汤有非常明显的抑菌、抗炎、解痉、镇痛、解热、增强免疫和镇静等作用[2]。黄芩汤治疗UC在调节免疫功能, 抗氧化应激, 以及通过调节肠道菌群恢复微生态的相对平衡、抑制炎症反应、保护肠黏膜屏障等作用显著。
因中药及其复方具有多成分、多途径、多靶点协同作用的特点, 使得中药药效物质基础不明确、作用机制不清楚, 从整体到组织器官、细胞和分子水平都很难进行全面系统地研究。近年来网络药理学在国际上兴起, 它融合系统生物学、多向药理学、计算生物学和网络分析等多学科的技术和内容, 进行多层次网络的构建, 从整体角度探索药物与疾病间的关联性, 提供了一种从系统水平寻找中药复方潜在活性成分和作用靶点的新策略, 特别适用于反映及阐释中药多成分-多靶点的作用关系, 与中药从整体水平调控机体、发挥治疗作用的观点相吻合[3]。为此, 本研究采用网络药理学方法, 分析黄芩汤治疗UC的药效物质基础和可能的分子作用机制, 建立“有效成分-靶点-通路”之间的关系, 探究该方治疗UC的多成分、多靶点和多途径作用机制, 为后续的研究工作提供思路。
材料与方法黄芩汤活性成分和相关靶点筛选通过TCMSP (http://lsp.nwu.edu.cn/tcmsp.php)寻找黄芩汤中4味中药化学成分, 筛选口服利用度(OB)≥30%且类药性(DL)≥0.18[4]的活性化合物, 获得黄芩汤活性化合物及其所作用的蛋白质靶点。
UC相关靶点的筛选 本研究基于GeneCards (http://www.genecards.org/)、TTD (http://bidd.nus.edu.sg/BIDD-Databases/TTD/TTD.asp)以及OMIM[5] (http://www.omim.org)数据库综合遴选UC相关靶点。将上述疾病靶点与黄芩汤潜在靶点取交集, 共收集到141个基因, 作为疾病和药物的共同潜在靶点。
黄芩汤化合物-靶点网络关系的构建 将筛选后的黄芩汤中活性化合物与上述141个靶点对应关系上传至Cytoseape_v3.7.1软件(http://www.cytoscape.org/)生成体现化合物-靶点相互作用的网络图, 进行拓扑参数[6]分析, 根据介度(betweenness centrality, BC)、紧密度(closeness centrality, CC)以及连接度(Degree)的中位数来分析化合物-靶点网络核心节点。
黄芩汤治疗UC核心靶点分析 将上述141个靶点上传至STRING数据库(https://string-db.org/), 构建黄芩汤治疗UC靶点互作网络, 将网络中节点交互作用关系参数导入Cytoscape软件绘制相互作用网络, 根据BC、CC和Degree值的中位数来分析黄芩汤治疗UC的靶点互作网络核心节点。
分子对接验证 利用分子对接模拟软件AutoDock_Vina, 对Degree≥10的关键药效分子与筛选的10个核心靶点进行受体-配体对接模拟计算, 以阳性药柳氮磺胺吡啶(SASP)与核心靶点对接结果进行对照。完成全部的对接模拟后, 根据关键药效分子和核心靶点最低结合能(binding energy)值做热图。经大量文献查阅[7], 小分子与靶点蛋白最低结合能≤ -5.0 kJ·mol-1表明黄芩汤的关键药效分子与靶点蛋白结合较好。
靶点通路注释分析 利用Bioconductor中的R包clusterprofile version 3.12.0对疾病与药物交集靶点进行GO (gene ontology)生物学过程富集分析和KEGG (KEGG pathway analysis)通路注释分析, 设定阈值P < 0.05[8], 并根据生物学信息筛选与UC有关的通路, 构建化合物-靶点-通路网络图。
结果 1 黄芩汤化合物-靶点网络的构建及核心靶点的筛选根据OB与DL的阈值, 剔除重复化合物和缺少靶点预测的化合物, 并结合多方数据库和文献检索确认, 最终得出128个活性成分, 其中黄芩26个化学成分, 白芍6个化学成分, 大枣15个化学成分, 甘草81个化学成分。利用128个化合物与靶点的关系构建化合物-靶点网络(图 1)。其中天蓝色节点代表甘草, 深蓝色结点代表黄芩, 黄色节点代表大枣, 紫色节点代表白芍, 绿色节点为靶点, 红色节点代表核心节点。在化合物-靶点相互作用网络中, 共包括269个节点(128个化合物节点和141个靶点节点)和72 092条边。每条边则表示化合物分子与靶点之间的相互作用关系。经Network Analyzer计算该化合物-靶点网络中, Degree值中位数2倍为8, BC和CC中位数分别为0.000 890 1和0.709 163 34, 核心节点需满足以上参数的中位数卡值。表 1列出了化合物-靶点网络中核心化合物的Degree值, 从表 1可见, 槲皮素(MOL000098)的潜在靶点155个, 最多; 其次是山柰酚(MOL000422), 51个; β-谷甾醇(MOL000358)潜在靶点36个; 汉黄芩素(MOL000173) 31个; 黄芩素(MOL002714) 22个; 金合欢素(MOL001689) 14个; 异鼠李素(MOL000354)和甘草查尔酮A (MOL000497)各11个。这些Degree值较高的关键有效分子有可能在黄芩汤的药理功能中发挥着相对重要的作用。

|
图 1 Huangqin decoction (HQT) compound-target network diagram. The sky blue nodes represent Gancao, the dark blue nodes represent Huangqin, the yellow nodes represent Dazhao, the purple nodes represent Baishao, the green nodes represent the target point, the red nodes represent key pharmacodynamic molecules, compound number is short for TCMSP-ID |
| 表 1 Network characteristics of key component-target network nodes. BS: Baishao; DZ: Dazhao; GC: Gancao; HQ: Huangqin |
本研究基于STRING数据库分析黄芩汤治疗UC的靶点之间的交互作用, 将黄芩汤治疗UC的141个靶点相互作用关系导入Cytoscape软件进行分析, 根据BC ≥ 0.001 676 35、CC ≥ 0.555 555 56以及Degree ≥ 66 (中位数2倍)条件筛选出23个核心靶点, 如图 2所示。节点的大小和颜色与Degree值正相关, Degree值越大, 节点越大, 颜色越深, 表明靶点在此网络关系越重要。其中Network 1为黄芩汤治疗UC的直接作用靶点, Network 2为黄芩汤治疗UC的间接靶点。表 2列出了23个核心靶点的Degree值, 在黄芩汤治疗UC靶点交互作用网络中, RAC-α丝氨酸/苏氨酸蛋白激酶(AKT1, 110)、白介素6 (IL6, 102)、半胱天冬酶3 (CASP3, 92)、前列腺素G/H合酶2 (PTGS2, 89)、转录因子AP-1 (JUN, 92)、丝裂原激活的蛋白激酶8 (MAPK8, 86)、白介素8 (CXCL8, 84)、丝裂原激活的蛋白激酶1 (MAPK1, 82)、白介素1β (IL1β, 76)和白介素10 (IL10, 73)在黄芩汤治疗UC的直接作用靶点中处于核心位置, 可能在黄芩汤治疗UC中发挥重要作用。
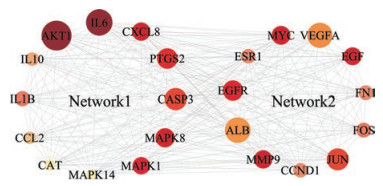
|
图 2 Huangqin decoction (HQT) core target network diagram. The nodes of network 1 represent the direct targets of HQT for ulcerative colitis, and the nodes of network 2 represent the indirect targets of HQT for ulcerative colitis, the color shade and node size represent the position of the network relationship |
| 表 2 Information for 23 core targets of topological analysis |
对14个关键药效分子与10个靶点蛋白对接的最低结合能作图, 如图 3所示。其中横坐标为靶蛋白, 纵坐标为黄芩汤的活性成分, 颜色的深浅代表最低结合能的大小。由图可见, 所有分子与标靶蛋白的最低结合能都小于0, 说明配体与受体可以自发结合, 最低结合能越小说明分子与靶点蛋白结合越好。对接结果显示, 14个活性化合物与蛋白靶点AKTI、IL6、PTGS2、MAPK8、CXCL8、CASP3最低结合能小于-5.0 kJ·mol-1, 说明这些活性化合物与以上靶点蛋白结合较好。表 3列出靶点蛋白基本信息, 包括配体和蛋白的PDB-ID编号及配体ID编号。阳性药物与靶点蛋白对接的最低结合能和黄芩汤中关键药效分子与靶点蛋白的最低结合能相差不大, 验证了靶点蛋白晶体及配体选择的合理性。
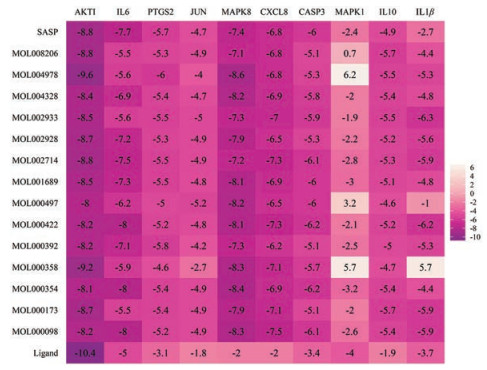
|
图 3 Heat map for binding energy of key targets with active ingredients of HQT. The abscissa represents the target protein, the ordinate represents the active ingredient of the HQT and the shade of the color represents the minimum binding energy |
| 表 3 Information on 10 proteins involved in molecular docking |
利用R包clusterprofile共富集出151个GO条目, 选取P值最小的前20个GO条目作图, 如图 4所示。Y轴代表GO条目, X轴和气泡面积大小代表目标基因集中属于GO的基因数量, 气泡颜色代表富集显著性, 即P值的大小。其中生物学过程辅因子结合、细胞因子受体结合、蛋白质丝氨酸/苏氨酸激酶活性、受体配体活性、细胞因子活性、DNA结合转录激活因子活性、RNA聚合酶Ⅱ特异性和RNA聚合酶Ⅱ转录因子结合富集的基因数排名靠前。

|
图 4 GO enrichment of predicted targets of HQT decoction against ulcerative colitis |
KEGG通路富集共获得151条富集通路, 如图 5所示。Y轴代表pathway名称, X轴和条形面积大小代表目标基因集中属于pathway的基因数量, 条形图颜色代表富集显著性, 即P值的大小。其中与UC有关的33条通路主要包括PI3K-AKT信号通路(PI3K-AKT signaling pathway)、NF-κB信号通路(NF-kappa B signaling pathway)、TNF信号通路(TNF signaling pathway)、Toll样受体信号通路(Toll-like receptor signaling pathway), 表明黄芩汤的有效成分可能通过作用于这些信号通路达到治疗疾病的目的。
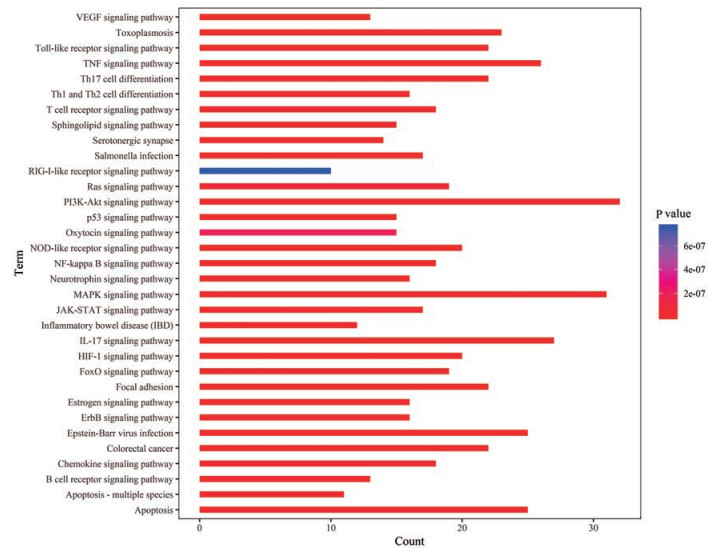
|
图 5 KEGG pathway enrichment of predicted targets of HQT decoction against ulcerative colitis |
采用Cytoscape软件构建“成分-靶点-通路”(图 6), 其中红色节点代表根据生物信息学筛选的通路, 黄色和绿色节点分别代表核心靶点和核心活性化合物。从图中可见, 黄芩汤41个活性成分的作用靶点分布于不同的代谢通路, 共同调节机体水平, 体现了药物多成分、多靶点治疗UC的作用机制。

|
图 6 Ingredients-targets-pathways network of HQT. Red nodes represent pathways, yellow nodes represent core targets, and green nodes represent active compounds |
黄芩汤具有清热止痢, 缓急止痛之功效, 临床用于治疗湿热型UC, 具有较好的临床效果。本研究基于多成分、多靶点作用的研究思路, 应用网络药理学技术, 分析黄芩汤治疗UC作用靶点, 阐述黄芩汤治疗UC潜在作用机制, 为黄芩汤临床应用提供科学依据。
基于黄芩汤活性成分-作用靶点网络分析, Degree值排名前10位的关键药效分子有9个属于黄酮类化合物, 其中包括黄酮类化合物黄芩素(MOL002714)、汉黄芩素(MOL000173)、槲皮素(MOL000098)、山柰酚(MOL000422)、金合欢素(MOL001689)、异鼠李素(MOL000354)、芒柄花黄素(MOL000392)等、二氢黄酮类化合物柚皮素(MOL004328)及查尔酮类化合物甘草查尔酮A (MOL000497)。究其原因, 主要是黄酮类在中草药及天然产物中分布广泛, 并具有抗炎、抗菌和抗氧化活性[9]。
基于STRING交互作用网络数据库构建黄芩汤治疗UC靶点交互作用网络, 筛选出23个核心靶点, 结合分子对接结果, 发现AKT1、IL6、PTGS2、IL10、IL1β、MAPK8、CASP3是黄芩汤治疗UC关键作用靶点, 这7个靶点可能在黄芩汤治疗UC作用的发挥重要作用。分子对接结果显示14个关键药效成分与AKT1、IL6、IL10、PTGS2对接结合能都小于-5.0 kJ·mol-1, 14个活性化合物与以上靶点蛋白结合较好。免疫调节异常是UC的主要发病因素, 其中IL6、IL1β、IL10在免疫细胞的发育、分化、免疫应答及某些细胞的激活过程中有重要调节作用, 并与UC的发生、发展和转归等具有密切相关性[10]。IL6主要由活化的巨噬细胞、淋巴细胞及上皮细胞分泌产生, IL6过度表达使体内环境紊乱, 导致肠上皮细胞的电解质分泌失调, 使其通透性增强, 进而使黏附其上的中性粒细胞游出并浸润到炎症部位[11]。IL1β是IL1的一种, 在免疫与炎症启动中扮演着重要调节作用, 可增加由巨噬细胞所产生的细胞因子如: IL6、TNFα、IL18等, 使得中性粒细胞浸润于肠道病变部位, 引起一系列的肠道炎症病变[12]。KEGG通路富集分析显示, IL6、IL1β与UC有关炎症通路TNF、TLRS和NF-κB信号通路密切相关。TNF信号通路: TNF→TNFR1→NF-κB→IL1β、IL6; TLRs信号通路: TLR1/TLR2→NF-κB→IL1β、IL6, 得出黄芩汤可能作用于信号通路中潜在中心NF-κB, 从而介导下游IL1β及IL6的合成。IL6、IL1β在炎症反应过程中产生协同作用, 与炎症分级密切相关。IL10主要由Th2型细胞分泌, 具有多种生物学作用, 能够通过抑制激活单核细胞、巨噬细胞、粒细胞和T细胞等, 调节免疫功能的一种细胞因子。IL10在黏膜免疫中发挥重要调节作用, 又能很好的稳定肠道黏膜的内环境[13]。文献报道黄芩汤有效成分黄芩素、汉黄芩素[14]、槲皮素[15]和山柰酚[16]能够抑制炎症模型细胞或实验动物IL6、IL1β的表达, Chen等[17]发现黄芩汤辅助柳氮磺胺吡啶可降低结肠炎患者IL6和IL1β, 升高IL10, 进一步说明筛选黄芩汤治疗UC核心靶点结果可靠。
PTGS又称为环氧酶(COX), 是催化花生四烯酸合成各种前列腺素(PGs)和其他二十烷类的关键酶, COX有两种同工酶, 即组成型酶COX1和诱导性酶COX2, 其中COX2可被多种炎性介质及细胞因子诱导, 参与组织炎症过程及细胞的分化增殖过程[18]。研究表明, 正常结肠黏膜不表达COX2, 而炎症黏膜上皮细胞及结肠固有层单核炎性细胞大量表达COX2, 并且在炎症活动期结肠固有层和肌间神经丛中COX2 mRNA表达水平明显高于非活动期[19]。本文分子对接结果显示, 黄芩汤中14个关键药效分子可与PTGS2结合最低能量为-6.0 kJ·mol-1, 14个关键药效分子与10个蛋白靶点的对接最低结合能除β-谷甾醇(MOL000358)外都小于-5 kJ·mol-1, 提示黄芩汤与COX2活性位点结合能力较强, 可推测黄芩汤作用于PTGS2, 调节炎症活动期结肠固有层和肌间神经丛中COX2 mRNA表达, 抑制前列腺素生成, 减少炎性介质的释放。
AKT在黄芩汤治疗UC的关键靶点网络关系中处于核心地位。AKT是一种与蛋白激酶C相关的丝氨酸或苏氨酸激酶, 也被称为蛋白激酶B, 是PI3K下游的直接作用靶点。有研究显示, PI3K通路的异常激活在UC的发病机制中起到了重要作用, PI3K是一系列胞内传导酶家族, 当所有位点被磷酸化, 细胞膜上的AKT被完全激活, AKT从细胞膜释放进入细胞浆或细胞核中进行信号的传输, 执行其生物学功能[20]。因此, AKT的磷酸化可以被作为判断PI3K活性的指标。KEGG通路富集结果显示PI3K/AKT是基因富集最多的一条通路。近年来, PI3K/AKT信号通路在肠道炎症和肿瘤中的作用日益受到重视, PI3K/AKT信号传导通路与细胞因子的调控密切相关, 在肠道炎症反应中发挥着重要作用[21]。PI3K/AKT信号通路可激活NF-κB, 起到多向性的调节作用, 可调节免疫炎症相关的多种细胞的基因表达。在炎症反应的过程中, NF-κB能起到关键的调控作用, 能提高诸如IL1β、IL6等炎症因子的基因转录, 增加IL1β、IL6的表达[22], 加速炎症反应, 增加UC的发生。Jiang等[23]通过体内动物实验和体外细胞实验发现黄芩苷能减轻大鼠UC的炎症反应, 抑制PI3K磷酸化, 下调AKT的活化, 从而抑制TNFα、IL6等炎症因子的分泌, 发挥其抗炎效应, 提示黄芩苷可能通过以抑制AKT的活化、抑制NF-κB的核转位发挥其抗炎的作用。黄芩苷作为黄芩汤有效成分之一, 在体内可被代谢为黄芩素、7-甲氧基黄芩素和5-甲氧基黄芩素等[24], 由此提示, 黄芩汤可能通过抑制PI3K/AKT/NF-κB信号通路的激活而发挥抗炎作用, 减轻UC的炎症反应。
综上所述, 本文采用网络药理学的方法对黄芩汤治疗溃疡性结肠的分子机制进行探讨, 黄芩汤由4种药材配伍组成, 不同的活性成分通过调控不同的靶蛋白, 作用于不同的通路, 对UC起到治疗作用, 体现中药方剂整体性、系统性的特点。本研究发现, 黄芩汤可能从以下3个方面发挥治疗UC的作用: ①作用于PTGS2靶点, 调节炎症活动期结肠固有层和肌间神经丛中COX2 mRNA表达。控制花生四烯酸代谢途径, 抑制前列腺素生成, 减少炎性介质的释放; ②调节IL6、IL1β和IL10等多种细胞因子的表达, 调节UC发生发展, 转归过程中的免疫异常, 稳定肠道黏膜的内环境; ③抑制PI3K/AKT/NF-κB、TNF和TLRs等信号通路的活化, 进而下调IL6、IL1β和COX2等炎性因子的表达而发挥抗炎作用。此次运用网络药理学的方法探究了黄芩汤治疗UC的作用机制, 同时预测的PI3K/AKT/NF-κB信号通路, 为后续实验验证提供依据。预测所得黄芩汤成分疾病靶点与已有文献较为接近, 表明基于网络药理学与分子对接相结合的技术手段探讨其治疗UC的作用机制具有一定的准确性, 同时也揭示了黄芩汤多成分、多靶点的特点, 为后续的相关研究提供参考。
值得注意的是, CASP3和MAPK8的Degree值很高, 处于黄芩汤治疗UC关键靶点的核心位置, 且与黄芩汤的关键药效分子结合较好, 推测黄芩汤可能还影响细胞凋亡、自噬过程, 有待进一步研究。
| [1] |
Xi JS. Clinical Study of Huangqi Tang in the Treatment of Ulcerative Colitis (黄芩汤治疗UC的临床研究)[D]. Beijing: Beijing University of Chinese Medicine, 2006.
|
| [2] |
Zhuang SX. Study on the Antioxidative Stress of HQT on Ulcerative Colitis Through Nrf2 Pathway (黄芩汤调控Nrf2通路对UC的抗氧化应激作用机制研究)[D]. Beijing: China Academy of Chinese Medical Sciences, 2016.
|
| [3] |
Zhang YQ, Mao X, Guo QY, et al. Network pharmacology-based approaches capture essence of Chinese herbal medicines[J]. Chin Herb Med (中草药), 2016, 8: 107-116. DOI:10.1016/S1674-6384(16)60018-7 |
| [4] |
Liu M, Wu FZ, Zhang W, et al. Molecular mechanism of Sini San and Suanzaoren Tang in treatment of insomnia based on network pharmacology:a comparative study[J]. J Beijing Univ Tradit Chin Med (北京中医药大学学报), 2019, 42: 44-50. |
| [5] |
Amberger JS, Bocchini CA, Schiettecatte F, et al. OMIM. org:Online Mendelian Inheritance in Man (OMIM*), an online catalog of human genes and genetic disorders[J]. Nucl Acids Res, 2015, 43: D789-798. DOI:10.1093/nar/gku1205 |
| [6] |
Assenov Y, Ramirez F, Schelhorn SE, et al. Computing topological parameters of biological networks[J]. Bioinformatics, 2008, 24: 282-284. DOI:10.1093/bioinformatics/btm554 |
| [7] |
Liu FH, Chen SJ, Ni WJ. Study on the computer virtual screening of antithrombotic active ingredients in Chuanxiong Rhizoma[J]. J China Pharm (中国药房), 2017, 28: 2182-2186. |
| [8] |
Da WH, Sherman BT, Lempicki RA. Bioinformatics enrichment tools:paths toward the comprehensive functional analysis of large gene lists[J]. Nucleic Acids Res, 2009, 37: 1-13. DOI:10.1093/nar/gkn923 |
| [9] |
Wang TY, Li Q, Bi KS. Bioactive flavonoids in medicinal plants:structure, activity and biological fate[J]. Asian J Pharm Sci, 2018, 13: 14-25. |
| [10] |
Forland DT, Johnson E, Saetre L, et al. Effect of an extract based on the medicinal mushroom Agaricus blazei Murill on expression of cytokines and calprotectin in patients ulcerative colitis and Crohn's disease[J]. Scand J Immunol, 2011, 73: 66-75. DOI:10.1111/j.1365-3083.2010.02477.x |
| [11] |
Unver N, Mcallister F. IL-6 family cytokines:key inflammatory mediators as biomarkers and potential therapeutic targets[J]. Cytokine Growth Factor Rev, 2018, 41: 10-17. DOI:10.1016/j.cytogfr.2018.04.004 |
| [12] |
Zhao R, Zhou H, Su SB. A critical role for interleukin-1β in the progression of autoimmune diseases[J]. Int Immunopharmacol, 2013, 17: 658-669. DOI:10.1016/j.intimp.2013.08.012 |
| [13] |
Drastich P, Frolova-Brizova L, Zanvit P, et al. Spontaneous in vitro IL-6 production in various intestinal segments in patients with inflammatory bowel disease[J]. Folia Microbiol, 2011, 56: 185-190. DOI:10.1007/s12223-011-0018-0 |
| [14] |
Nakamura N, Hayasaka S, Zhang XY, et al. Effects of baicalin, baicalein, and wogonin on interleukin-6 and interleukin-8 expression, and nuclear factor-kappa B binding activities induced by interleukin-1beta in human retinal pigment epithelial cell line[J]. Exp Eye Res, 2003, 77: 195-202. DOI:10.1016/S0014-4835(03)00116-7 |
| [15] |
Gupta RA, Motiwala MN, Mahajan UN, et al. Protective effect of Sesbania grandiflora, on acetic acid induced ulcerative colitis in mice by inhibition of TNF-α and IL-6[J]. J Ethnopharmacol, 2018, 219: 222-232. DOI:10.1016/j.jep.2018.02.043 |
| [16] |
Basu A, Das AS, Sharma M, et al. STAT3 and NF-κB are common targets for kaempferol-mediated attenuation of COX-2 expression in IL-6-induced macrophages and carrageenan-induced mouse paw edema[J]. Biochem Biophy Rep, 2017, 12: 54-61. DOI:10.1016/j.bbrep.2017.08.005 |
| [17] |
Chen YH, Cao QF, Hong QG, et al. Effect of Huangqin decoction combined with sulfasalazine on serum TNF-α and interleukin of colitis gravis patients[J]. Chin Arch Tradit Chin Med (中华中医药学刊), 2017, 35: 246-249. |
| [18] |
Fiorucci S, Meli R, Bucci M, et al. Dual inhibitors of cyclooxygenase and 5-lipoxygenase. A new avenue in anti-inflammatory therapy?[J]. Biochem Pharmacol, 2001, 62: 1433-1438. DOI:10.1016/S0006-2952(01)00747-X |
| [19] |
Shi Z, Ma XD, Wu HY, et al. Study on acupuncture regulating COX-2 and IL-1β in colon tissue of ulcerative colitis in rats[J]. J Jiangxi Univ Tradit Chin Med (江西中医药大学学报), 2004, 16: 38-40. |
| [20] |
Owczarek D, Cibor D, Szczepanek M, et al. Biological therapy of inflammatory bowel disease[J]. Pol Arch Med Wewn, 2009, 119: 84-88. |
| [21] |
Edstrom A, Ekstrom PAR. Role of phosphatidylinositol 3-kinase in neuronal survival and axonal outgrowth of adult mouse dorsal root ganglia explants[J]. J Neurosci Res, 2003, 74: 726-735. DOI:10.1002/jnr.10686 |
| [22] |
Hozumi H, Hokari R, Chie K, et al. Endoscopic finding of spontaneous hemorrhage correlates with tumornecrosis factor alpha expression in colonic mucosa of patients with ulcerative colitis[J]. Int J Colorectal Dis, 2013, 28: 1049-1055. DOI:10.1007/s00384-013-1654-4 |
| [23] |
Jiang Y. Effect of Baicalin on Ulcerative Colitis PI3K/Akt/NF-κB Signaling Pathways and Its Underlying Mechanism (黄芩苷对溃疡性结肠炎PI3K/Akt/NF-kB信号通路的影响及其机制研究)[D]. Nanjing: Nanjing University of Chinese Medicine, 2016.
|
| [24] |
Zhang J, Cai W, Zhou Y, et al. Profiling and identification of the metabolites of baicalin and study on their tissue distribution in rats by ultra-high-performance liquid chromatography with linear ion trap-orbitrap mass spectrometer[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2015, 985: 91-102. DOI:10.1016/j.jchromb.2015.01.018 |
 2020, Vol. 55
2020, Vol. 55


