2. 中国科学技术大学生命科学学院, 安徽 合肥 230031
2. Academy of Life Science, University of Science and Technology of China, Hefei 230031, China
蛋白是由氨基酸构成的生物大分子, 是构建组织的重要原料, 为机体提供能量。蛋白质种类丰富且功能各异, 如运输、防御和调节功能等, 一些纯蛋白制剂可以作为治疗疾病的药物, 例如胰岛素。近几年有些学者对天然蛋白物质进行了研究, 发现其有抗肿瘤、抗炎和免疫的作用, 其中多数天然蛋白是从海洋物质、植物、菌类和昆虫中提取纯化出来[1, 2]。转录组是指特定组织或细胞某一状态下转录出的RNA合集, RNA测序(RNA-seq)技术可以从转录水平检测肿瘤组织或细胞中的变化基因, 肿瘤的发生发展是一个复杂的过程, 其中涉及多种基因调控, 而RNA测序技术可以很好地识别肿瘤发生发展过程中基因的变化, 提供更准确的信息[3, 4]。
本实验是以放置时间2~4年的蒙古黄芪干燥根部为研究材料, 黄芪是豆科黄芪属植物蒙古黄芪Astragalus membranaceus (Fisch.) Bge. var. mongholicus (Bge.) Hsiao或膜荚黄芪Astragalus membranaceus (Fisch.) Bge.的根。黄芪性味甘、微温, 有补气固表、排脓行滞的功效。本课题组前期研究表明, 黄芪糖蛋白对胶原诱导性关节炎小鼠、实验性自身免疫性脑脊髓炎有免疫抑制作用[5, 6]。但目前对黄芪蛋白的抗肿瘤效果研究较少, 因此本实验通过提取黄芪蛋白, 探索其对肝癌细胞株增殖影响, 进一步对其抗肿瘤机制进行研究, 为今后蛋白类化合物抗肿瘤研究提供参考。
材料与方法实验材料 山西道地药材蒙古黄芪为三年生黄芪干燥根部, 采于山西应县, 经山西中医药大学薛慧清教授鉴定为蒙古黄芪Astragalus membranaceus (Fisch.) Bge. var. mongholicus (Bge.) Hsiao的干燥根。肝癌细胞系HepG2为山西中医药大学科研中心细胞室保存。
主要试剂 BCA蛋白质定量试剂盒购于武汉博士德生物工程有限公司。Amicon Ultra-15 10K超滤管(默克密理博公司); 二甲基亚砜(DMSO)、磷酸盐缓冲液(PBS) [生工生物工程(上海)股份有限公司]; 细胞培养基、胰蛋白酶、青-链霉素(Hyclone公司)。
主要仪器 Multiskan FC酶标仪(美国赛默飞世尔科技公司); 流式细胞仪、电泳设备(BD公司); 生物显微镜(Nikon仪器公司)。
黄芪蛋白的提取 干燥的黄芪根粉碎过二号筛, 准确称量干粉30 g, 加入300 mL纯净水常温浸泡过夜, 52 ℃水浴提取2次, 每次1 h, 过程中不断搅拌, 水浴提取后4层纱布过滤, 取上清液于4 ℃下3 000 r·min-1离心30 min, 加入硫酸铵至饱和, 4 ℃过夜, 离心后沉淀用水溶解移至透析袋中, 以纯水为透析液4 ℃下脱盐, 直到1% BaCl2检测硫酸铵已完全脱净, 由此得到黄芪蛋白(HQP)提取液。凝胶电泳检测蛋白分子质量, BCA法检测蛋白含量。
细胞生长曲线的测定 取HepG2细胞数1.8×105个/mL接种于12孔板, 置于37 ℃, 5% CO2培养箱中培养。24 h贴壁后, 去除原培养基, 前期进行CCK8预实验确定HQP浓度(10、50、100 μg·mL-1), HQP经0.22 μm微孔滤膜过滤, 设置3个复孔。实验时间为1周, 每隔一天通过血球计数板计数, 计算细胞存活率。
流式细胞术/PI单染检测细胞死亡率 取HepG2细胞数1.8×105个/mL接种于12孔板。24 h后加入不同浓度的HQP (10、50、100 μg·mL-1)作用48 h, PBS清洗收集细胞。坏死对照组细胞于65 ℃加热处理5 min, PBS清洗, 含2%胎牛血清的PBS收集细胞防止细胞黏连, 去除上清, 每组加入PBS 500 μL和PI染色液1 μL, 避光染色10 min, 离心去除上清再重悬后, 上机检测, 实验重复3次。
Hoechst/PI双染法观察细胞凋亡与坏死 取HepG2细胞接种于6孔板中, 每孔约2.5×105个细胞。24 h后加入HQP (10、50、100 μg·mL-1)作用48 h, 去除原培养基, PBS清洗后加入Hoechst33342染色液1 μL, 置于培养箱中避光染色10 min, PBS洗后加入PI染色液1 μL, 室温避光染色10 min, 荧光显微镜下黄色和蓝紫色激发光观察细胞核染色情况, 拍照记录, 实验重复3次。
Western blot法检测蛋白表达 取HepG2细胞接种于10 cm培养皿中, 待满度50%时加入HQP (10、50、100 μg·mL-1)作用48 h, PBS清洗收集细胞, 采用细胞裂解液冰上裂解1 h, 每隔10 min震荡1次。于12 000 r·min-1离心10 min, 取上清, Bradford法进行蛋白定量, 高温变性后进行SDS-PAGE电泳, 80 V转膜3 h, 5%牛奶(TBST配制)封闭1 h, 4 ℃下一抗过夜, TBST洗膜30 min后二抗孵育2 h, 洗膜后凝胶成像仪显影。实验重复3次。
RNA提取与分析 细胞培养方法同上, HQP处理48 h后根据Trizol法提取总RNA, 经Nanodrop-2000测定总RNA的浓度和纯度, 达到测序要求后送北京诺禾致源公司进行检测。提取的RNA样本进行Illumina建库测序后, 得到原始数据及clean-reads, 将原始基因表达量进行标准化。采用R语言包对差异表达基因进行分析, 通过SangerBox绘制差异表达基因火山图及热图。通过Metascape数据平台对差异表达基因进行KEGG分析。
cDNA合成及qRT-PCR验证 提取出的总RNA满足质检条件后, 根据常规反应体系配制反应混合液置于PCR仪中构建cDNA文库。取足够实验使用体积的对照组及加药组cDNA, 采用SYBR Green实时荧光定量PCR试剂盒配制PCR反应液(18 S作为内参), 根据差异基因上下调表达情况选择候选基因, 设计引物进行扩增, 采用2-△△Ct方法计算趋势表达基因mRNA相对表达量, 设置3次重复。引物序列通过Gene Bank查询, 见表 1。
| 表 1 Differentially expressed gene information |
数据统计与分析 使用统计学软件SPSS 13.0进行分析, 数据均以平均数±标准差表示, 通过t检验比较组间差异。P < 0.05为显著性差异; P < 0.01为极显著性差异。
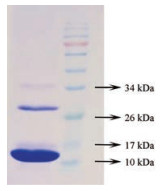
结果 1 HQP对肿瘤细胞增殖影响黄芪经过盐析得到不同分子质量的蛋白, 脱盐后进行凝胶电泳检测, 发现蛋白主要位于35、27和16 kDa, 见图 1。使用不同浓度的黄芪蛋白处理肿瘤细胞, 结果表明不同浓度HQP处理HepG2细胞后, 对细胞增殖抑制作用呈现时间和浓度依赖性, 且相比于对照组有显著性差异(P < 0.05), 细胞生长曲线见图 2。在预实验中, 通过CCK8法检测细胞增殖与毒性, 发现当HQP质量浓度达到1 mg·mL-1时几乎没有活细胞, 因此选择HQP质量浓度10、50、100 μg·mL-1作为低、中、高剂量组用于后续实验。显微镜下观察发现对照组的细胞正常贴壁生长, 细胞紧密连接边界分明, 而HQP处理后的HepG2细胞皱缩变圆, 且随蛋白浓度和时间的增加细胞形态改变更加明显, 细胞存活率更低, 说明HQP对HepG2细胞有抑制增殖的作用。
|
图 1 Result of Huang Qi protein (HQP) gel electrophoresis |

|
图 2 HQP (10, 50, 100 μg·mL-1) inhibits the growth of HepG2 cells |
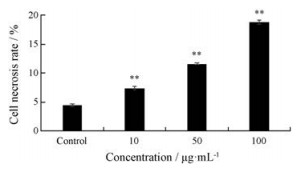
通过流式细胞仪检测细胞凋亡和坏死, 四象限中LR象限代表早期凋亡细胞、UR象限代表晚期凋亡或坏死细胞, Annxin V可以对发生凋亡的细胞进行染色, 而PI不能对细胞膜完整的细胞染色(活细胞和早期凋亡细胞), 所以Annxin V/PI双染并不能明显区分坏死细胞和凋亡细胞, 单染PI可明确区分出坏死细胞。通过PI染色法, 检测出HepG2经不同浓度HQP (10、50、100 μg·mL-1)处理后, 细胞坏死率分别为(7.40 ± 0.27) %、(11.60 ± 0.09) %和(18.78 ± 0.35) %, 坏死率随HQP浓度的升高而增加, 与对照组相比, 均具有显著性差异(P < 0.01), 说明HQP可能通过使HepG2细胞发生坏死来抑制细胞增殖, 结果见图 3。
|
图 3 HQP increases the necrosis rate of HepG2 cells. Cells were incubated with HQP (10, 50, 100 μg·mL-1) for 24 h. n = 3, x ± s. **P < 0.01 vs control group |
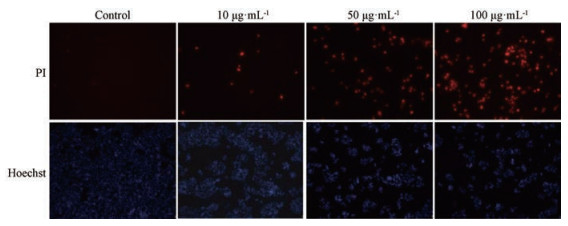
Hoechst 33342和PI都可以与核DNA结合, 其中Hoechst可进入活细胞核, 将其染为淡蓝色。而PI在正常条件下不能穿透活细胞膜, 只有当细胞坏死时膜被破坏, 此时PI穿透细胞膜进入核中与染色体结合将坏死细胞染为红色。为了验证HQP可以通过影响细胞坏死来影响肿瘤细胞增殖, 利用显微镜观察Hoechst/PI双染, 结果发现重复孔之间表达趋势相同, 由图 4可以看出, 与对照组相比, 随着处理浓度的升高红色坏死细胞逐渐增多, 再次证明HQP可以诱导肝癌细胞坏死从而影响细胞增殖。
|
图 4 Single staining of necrosis cells by propidium iodide (PI) |
通过进一步蛋白水平上的验证, 对凋亡标志蛋白caspase-3进行蛋白检测, 如图 5所示, caspase-3成熟体无显著变化同时剪切体并未出现, 说明HQP不能使HepG2发生凋亡, 但细胞死亡现象却很明显。目前对细胞死亡方式主要分为凋亡和坏死, 所以根据流式结果及蛋白水平变化, 推测黄芪蛋白抑制肝癌细胞增殖的作用是使细胞发生坏死。因此, 通过Western blot检测坏死标志蛋白RIP1, 与对照组相比, HQP处理后HepG2细胞中RIP1蛋白水平明显增加, 说明HQP通过诱导HepG2细胞发生程序性坏死导致细胞死亡, 结果重复性良好, 表达趋势一致。

|
图 5 Detection of protein levels in HepG2 |
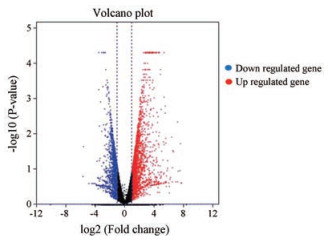
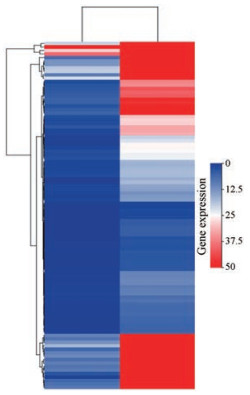
为了进一步探究HQP对肿瘤细胞增殖抑制的机制, 利用转录组学来分析HQP处理肝癌细胞后的基因表达情况。测序得到对照组与加药组转录组数据, 构建差异基因表达谱, 得到受调控基因数2.6万个, 其中筛选出979个受调控差异明显基因。如图 6所示, 652个上调基因位于坐标轴右侧, 327个下调基因位于坐标轴左侧。通过火山图可以看出对照组与加药组之间表达的差异水平分布情况, 横坐标表示基因表达量变化, 纵坐标表示基因表达差异的显著性, 其值越靠上越表明对应的基因差异表达显著。选取TOP 100基因进行的聚类分析, 如图 7所示, 从左到右分别为对照组和给药组, 可以看出两组基因表达水平存在明显差异。
|
图 6 Differentially expressed gene volcano map |
|
图 7 Cluster analysis of differentially expressed gene. The control group is on the left and the dosing group is on the right |
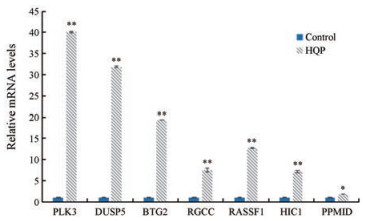
根据Metacape进行KEGG分析部分结果见表 2, 发现HQP对肿瘤细胞转录组主要影响细胞黏附分子黏附、p53下游信号通路、氨基酸合成、内质网应激反应, IκB/NFκB信号和AP1通路等。结果发现, p53信号通路相关基因分布较多, 有73个。已有研究证实, p53可介导程序性细胞坏死的发生[7]。MPTP介导的程序性细胞坏死中p53参与其中。在氧化应激反应中, p53在线粒体中积累, 与调节因子CypD作用激活程序性细胞坏死。其中CypD位于MPTP内膜上, 在钙超载的情况下造成线粒体损伤, ROS增多致使细胞坏死[8]。也有研究表示, 在ROS作用下, p53可能调控PARP1介导的程序性细胞坏死[9, 10]。在敲除p53基因的癌细胞中, 癌细胞会对PARP1介导的程序性坏死起到抵抗作用[11]。因此, 结合文献研究挑选出显著差异基因, 发现与p53相关基因中, PLK3、DUSP5、BTG2、RGCC、RASSF1A、HIC1和PPM1D 7个抑癌基因均出现了显著上调, 见表 1。文献证实PLK1为一种抗癌靶点, 而PLK3为一种潜在的肿瘤抑制因子, 其作用主要对细胞的毒性作用或诱导DNA损伤后影响细胞周期[12]。Ueda等[13]利用cDNA-microarray技术, 发现DUSP5的过表达可以抑制几种人源癌细胞生长, 而内源性p53蛋白直接结合到DUSP5基因的启动子区域。BTG2是p53诱导的抗增殖基因[14]。Tsui等[15]表明BTG2是人膀胱癌细胞p53上调的抑癌基因, 发现BTG2在T24细胞中的过表达抑制了细胞的生长。RASSF1A基因普遍存在于原发性癌组织中的抑癌基因, 在正常组织中也有表达, 研究证实RASSF1A基因可以通过影响细胞周期、细胞凋亡等发挥抑癌作用[16, 17]。Lei等[18]发现下调HPV 16会导致p53介导的RASSF1A下调, 从而诱导SiHa细胞凋亡。HIC1为一种抑癌基因, 与多种肿瘤组织发展过程相关[19]。RNA-seq结果与文献报道一致, 推测HQP可能通过p53信号通路诱导肿瘤细胞发生细胞坏死, 近而对肿瘤细胞增殖发挥抑制作用。
| 表 2 The result of KEGG analysis |
为了验证转录组测序数据的准确性, 将7个差异表达基因进行荧光定量PCR验证。如图 8所示, 差异表达基因相对含量与测序结果趋势相同, 说明转录组测序数据分析可靠, 进一步证实了p53信号通路相关抑癌基因的表达受到了HQP的调控。说明HQP诱导肝癌细胞发生程序性坏死可能与影响p53信号通路有关。
|
图 8 qRT-PCR analysis of differentially expressed genes. n = 3, x ± s. *P < 0.05, **P < 0.01 vs control group |
本研究前期进行了预实验, 筛选不同肿瘤细胞, 最终选择肝癌细胞HepG2为研究对象。细胞坏死参与机体的多种病理过程, 一直以来被认为是被动的细胞死亡方式, 近来研究发现细胞坏死也可以受特定的信号和程序调控。研究表明, 细胞程序性坏死与肿瘤的发展及临床有紧密的联系, 目前关于程序性细胞坏死的研究主要在其上游信号肿瘤坏死因子受体家族及两个关键的功能分子:蛋白激酶RIP1和RIP3[20, 21]。王晓东课题组[22]发现当凋亡受抑制时, Smac/Diablo蛋白类似物可使细胞发生坏死, 此时RIP1和RIP3会形成一个蛋白复合体来抑制细胞坏死途径。韩家淮课题组[23]揭示了ROS通过直接氧化RIP1蛋白上的3个关键半胱氨酸, 特异性增强RIP1自磷酸化从而促进细胞程序性坏死的发生。
本实验通过研究HQP抑制HepG2细胞的增殖作用, 发现HQP可以使HepG2发生细胞程序性坏死, 结合高通量转录技术进行RNA测序分析, 与p53通路相关的基因7个, 荧光定量PCR验证结果显示差异基因表达趋势与测序结果趋势一致。综上所述, HQP可以抑制HepG2细胞的增殖, 使细胞发生程序性坏死, 并且与p53信号通路有关, 这为天然蛋白抗肿瘤的研究提供了一定的实验基础, 而具体作用机制有待于深入探讨。
| [1] |
Wei B, Huang QY, Huang SR, et al. Trichosanthin-induced autophagy in gastric cancer cell MKN-45 is dependent on reactive oxygen species (ROS) and NF-κB/p53 pathway[J]. J Pharmacol Sci, 2016, 131: 77-83. DOI:10.1016/j.jphs.2016.03.001 |
| [2] |
Ying J, Wang J, Ji H, et al. Transcriptome analysis of phycocyanin inhibitory effecrs on SKOV-3 cell proliferation[J]. Gene, 2016, 585: 58-64. DOI:10.1016/j.gene.2016.03.023 |
| [3] |
Danan-Gotthold M, Golan-Gerstl R, Eisenberg E, et al. Identifiaction of recurrent regulated alternative splicing events across human solid tumors[J]. Nucleic Acids Res, 2015, 43: 5130-5144. DOI:10.1093/nar/gkv210 |
| [4] |
Li H, Zhang N, Li YM, et al. High-througuput transcriptomic sequencing of Rheum palmatum L. seedlings and elucidation of genes in anthraquinone biosynthesis[J]. Acta Pharm Sin (药学学报), 2018, 53: 1908-1917. DOI:10.16438/J.0513-4870.2018-0547 |
| [5] |
Zhao JY, Yang XZ, Niu X, et al. Effects of glycoproteins from Astragalus Menbranaceus on proliferation and activation of T cells[J]. Chin Arch Tradit Chin Med (中华中医药学刊), 2015, 33: 49-50. |
| [6] |
Zhang PJ, Guo MF, Xing YX, et al. Immunomodulatory effect of Huangqi glycoprotein on mice with experimental autoimmune encephalomyelitis[J]. Chin J Cell Mol Immunol (细胞与分子免疫学杂志), 2016, 32: 54-58. |
| [7] |
Vaseva AV, Marchenko ND, Ji K, et al. p53 opens the mitochondrial permeability transition pore to trigger necrosis[J]. Cell, 2012, 149: 1536-1548. DOI:10.1016/j.cell.2012.05.014 |
| [8] |
Ying Y, Padanilam BJ. Regulation of necrotic cell death:p53, PARP1 and cyclophilin D-overlapping pathways of regulated necrosis?[J]. Cell Mol Life Sci, 2016, 73: 2309-2324. DOI:10.1007/s00018-016-2202-5 |
| [9] |
Valenzuela MT, Guerrero R, Nunez MI, et al. PARP-1 modifies the effectiveness of p53-mediated DNA damage response[J]. Oncogene, 2002, 21: 1108-1116. DOI:10.1038/sj.onc.1205169 |
| [10] |
Elkholi R, Chipuk JE. How do I kill thee? Let me count the ways:p53 regulates PARP-1dependent necrosis[J]. Bioessays, 2014, 36: 46-51. DOI:10.1002/bies.201300117 |
| [11] |
Montero J, Dutta C, Bodegom D, et al. p53 regulates a non-apoptotic death induced by ROS[J]. Cell Death Different, 2013, 20: 1465-1474. DOI:10.1038/cdd.2013.52 |
| [12] |
Helmke C, Becker S, Strebhardt K. The role of Plk3 in oncogenesis[J]. Oncogene, 2015, 35: 135-147. |
| [13] |
Ueda K, Arakawa H, Nakamura Y. Dual-specificity phosphatase 5(DUSP5) as a direct transcriptional target of tumor suppressor p53[J]. Oncogene, 2003, 22: 5586-5591. DOI:10.1038/sj.onc.1206845 |
| [14] |
Zhang ZM, Chen C, Wang G, et al. Aberrant expression of the p53-inducible antiproliferative gene BTG2 in hepatocellular carcinoma is associated with overexpression of the cell cycle-related proteins[J]. Cell Biochem Biophys, 2011, 61: 83-91. DOI:10.1007/s12013-011-9164-x |
| [15] |
Tsui KH, Chiang KC, Lin YH, et al. BTG2 is a tumor suppressor gene upregulated by p53 and PTEN in human bladder carcinomacells[J]. Cancer Med, 2018, 7: 184-195. DOI:10.1002/cam4.1263 |
| [16] |
Hamilton DW, Lusher ME, Lindsey JC, et al. Epigenetic inactivation of the RASSF1A tumour suppressor gene in ependymoma[J]. Cancer Lett, 2005, 227: 75-81. DOI:10.1016/j.canlet.2004.11.044 |
| [17] |
Sakai N, Saito Y, Fujiwara Y, et al. Identification of protein arginine N-methyltransferase 5(PRMT5) as a novel interacting protein with the tumor suppressor protein RASSF1A[J]. Biochem Biophys Res Commun, 2015, 467: 778-784. DOI:10.1016/j.bbrc.2015.10.065 |
| [18] |
Lei Y, Hu C, Xu H, et al. HPV16 infection regulates RASSF1A transcription mediated by p53[J]. Mol Med Rep, 2013, 8: 413-418. DOI:10.3892/mmr.2013.1529 |
| [19] |
Zhou XG, Zhang P, Han H. Hypermethylated in cancer 1(HIC1) suppresses bladder cancer progression by targeting yes-associated protein (YAP) pathway[J]. J Cell Biochem, 2019, 120: 6471-6481. DOI:10.1002/jcb.27938 |
| [20] |
Khan N, Lawlor KE, Murphy JM, et al. More to life than death:molecular dererminants of necroptotic and non-necroptotic RIP3 kinase signaling[J]. Curr Opin Immunol, 2014, 26: 76-89. DOI:10.1016/j.coi.2013.10.017 |
| [21] |
Nehs MA, Lin CI, Kozono DE, et al. Necroptosis is a novel mechanism of radiation-induced cell death in anaplastic thyroid and adrenocortical cancers[J]. Surgery, 2011, 150: 1032-1039. |
| [22] |
Su DH, Lai W, Lin M, et al. Receptor interacting protein kinase-3 derermines cellular necrotic pesponse to TNF-alpha[J]. Cell, 2009, 137: 1100-1111. DOI:10.1016/j.cell.2009.05.021 |
| [23] |
Zhang D, Shao J, Lin J, et al. RIP3, an energy metabolism regulator that switches TNF-induced cell death from apoptosis to necrdsis[J]. Science, 2009, 325: 332-336. DOI:10.1126/science.1172308 |
 2020, Vol. 55
2020, Vol. 55


