2. 山西医科大学附属人民医院肾内科, 山西 太原 030012
2. Department of Nephrology, the Affiliated People's Hospital of Shanxi Medical University, Taiyuan 030012, China
系膜增生性肾小球肾炎(MsPGN)的主要特征为肾小球系膜细胞增生及不同程度系膜基质增多, 该病是中国最常见的原发性肾小球疾病。据统计, 该型肾炎占成人原发性肾小球疾病肾活检病例的24.7%~30.3%[1]。由于其发病机制不清, 目前尚无特效治疗方法。雷帕霉素(rapamycin, Rapa)为雷帕霉素靶蛋白(mechanistic target of rapamycin, mTOR)抑制剂, mTOR信号通路在细胞分化、增殖、存活和转移中扮演着重要的角色[2]。作者前期研究中发现[3], 雷帕霉素可以有效减少系膜增生性肾小球肾炎——IgA肾病大鼠的蛋白尿, 改善肾功能, 抑制系膜细胞增生, 减少细胞外基质沉积。然而, 雷帕霉素对系膜细胞的具体作用机制, 通过怎样的信号转导通路, 如何调控系膜细胞增殖, 目前尚不清楚。在本实验中, 对血小板衍生生长因子(PDGF)刺激的大鼠系膜细胞采用不同剂量的雷帕霉素进行干预, 观察细胞的增殖情况, 同时检测细胞周期调控蛋白及信号通路蛋白, 探讨其具体作用机制。
材料与方法材料 大鼠肾小球系膜细胞(HBZY-1)购自武汉大学保藏中心; 细胞培养试剂均购自美国Sigma公司; 雷帕霉素(瑞士Adamas-beta公司); MTT, PBS, ECL显影液(北京Solarbio公司); Recombinant PDGF (上海生工公司); 细胞DNA含量检测试剂盒、全蛋白抽提试剂盒、BCA蛋白浓度测定试剂盒(南京凯基生物科技发展有限公司); p27 Kip1 antibody、P70S6 kinase antibody、Phospho-P70S6 kinase (Thr389) antibody (美国Cell Signaling Technology公司); cyclin D1 (H-295) antibody、cyclin E antibody、CDK2 antibody、CDK4 antibody、β-actin antibody、goat anti-rabbit IgG-HRP (美国Santa Cruz Biotechnology公司); TRIzol® Reagen (北京Solarbio公司); PrimeScript® RT Master Mix、SYBR Premix Ex Taq (Perfect Real Time) (大连宝生物工程有限公司)。
细胞培养及实验分组 HBZY-1复苏后用含10%胎牛血清的DMEM培养液, 37 ℃、5% CO2孵箱中传代培养。分组前换用0.5%胎牛血清培养液培养24 h, 使细胞生长同步化。实验分为以下6组:对照组(control): 0.5%胎牛血清+DMEM培养; PDGF组: 0.5% DMEM + PDGF 20 ng·mL-1; Rapa组: 0.5% DMEM + PDGF 20 ng·mL-1 + Rapa 1、10、100或1 000 nmol·L-1。
MTT法检测细胞增殖 将培养的系膜细胞单细胞悬液接种于96孔培养板(5×103个细胞/孔), 分组给予药物干预20和44 h后, 每孔加入5 mg·mL-1 MTT 20 μL孵育4 h; 弃去孔内液体, 再每孔加入二甲基亚砜150 μL, 振荡10 min; 全波长酶标仪检测492 nm波长处吸光度(A)值, 计算抑制率(IR): IR = (1-A药物组/A对照组)×100%。
流式细胞术检测细胞周期 系膜细胞进行分组并给予不同药物干预24 h; 胰酶消化收集各组细胞, 磷酸缓冲盐溶液(PBS)洗涤2次, 调整细胞数为1×106个/mL, 加入70%预冷的乙醇, 4 ℃固定过夜; PBS洗涤, 加RNase A 100 μL于37 ℃水浴30 min, propidium iodide (PI) 400 μL于4 ℃避光30 min; 流式细胞仪检测, 记录激发波长488 nm处荧光。
Western blot检测蛋白表达 各组细胞经胰酶消化收集, 提取细胞总蛋白, BCA法测定样品蛋白浓度; 每组取蛋白样品50 μg, 10%聚丙烯酰胺凝胶电泳分离, 转膜及5%牛血清白蛋白封闭后, 加入一抗4 ℃过夜; 第二天加入辣根过氧化物酶标记的二抗, 室温、摇床孵育2 h, TBST洗3次; 经ECL显色, Quantity One分析系统对条带进行定量, 以β-actin作为内参, 检测蛋白的相对表达量。
Real-time PCR检测mRNA的表达量 采用Trizol抽提总mRNA, 测定浓度后进行反转录; 大鼠p27的cDNA序列和PCR引物符合Gene Bank中的设计原则, 引物由TaKaRa公司设计合成; 配置反应体系, 经95 ℃ 10 min、95 ℃ 15 s、60 ℃ 30 s循环40次, 绘制扩增曲线及溶解曲线; 采用2-ΔΔCt方法计算相对表达量。
统计学方法 实验结果均采用SPSS11.0软件进行分析, 数据均以x±s表示。各组间比较采用单因素方差分析, P < 0.05说明具有显著性差异。
结果 1 雷帕霉素可以显著抑制大鼠系膜细胞HBZY-1的增殖MTT结果显示, 雷帕霉素能显著抑制PDGF刺激系膜细胞引起的增殖, 且呈剂量和时间依赖性, 但随着浓度增加(1~1 000 nmol·L-1), 时间依赖性逐渐减弱。雷帕霉素1 nmol·L-1剂量组的抑制率在48 h远高于24 h (28.2% vs 3.6%, P < 0.01), 但1 000 nmol·L-1剂量组24和48 h的抑制率较100 nmol·L-1剂量组均无明显升高(24 h: 39.1% vs 46.2%; 48 h: 52.9% vs 53.8%; P > 0.05) (图 1)。
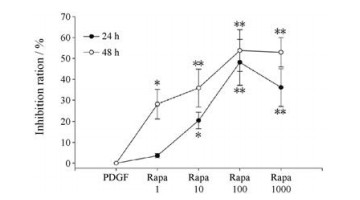
|
Figure 1 The inhibition ratio of rapamycin (Rapa) on MCs in 24 and 48 h. PDGF: Platelet derived growth factor; Rapa 1: Rapamycin 1 nmol·L-1; Rapa 10: Rapamycin 10 nmol·L-1; Rapa 100: Rapamycin 100 nmol·L-1; Rapa 1000: Rapamycin 1 000 nmol·L-1. n = 6, x±s. *P < 0.05, **P < 0.01 vs PDGF |
细胞周期结果显示, PDGF组较对照组, 细胞G0/G1期比例减少, S期细胞比例增加(P < 0.05);而雷帕霉素干预组较PDGF组均表现为G0/G1期细胞比例显著上升, S及G2期细胞比例下降(P < 0.05), 呈剂量依赖性, 但1 000 nmol·L-1剂量组与100 nmol·L-1剂量组比较, 差异无统计学意义(P > 0.05) (图 2, 表 1)。
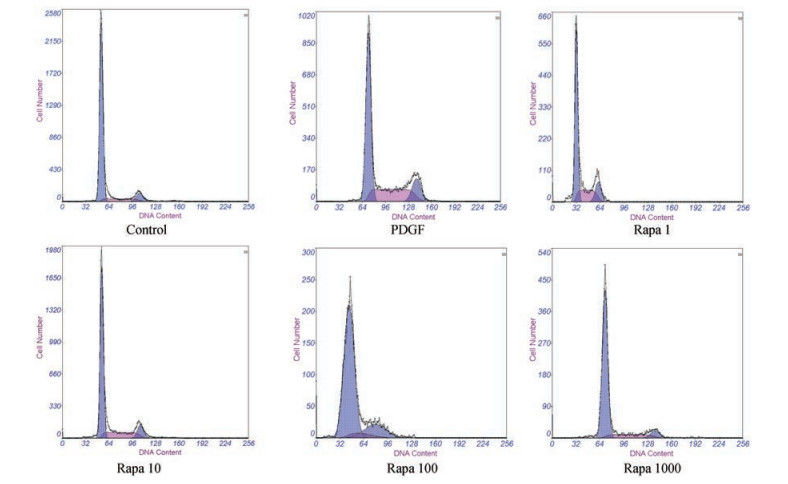
|
Figure 2 The cell cycle assay of MCs stimulated by Rapa |
| Table 1 The cell cycle assay of MCs stimulated by Rapa. n = 6, x±s. #P < 0.05, ##P < 0.01 vs PDGF |
Cyclin-CDKs是cyclin与CDK结合形成的复合物, cyclin-CDKs可以控制细胞周期, 使细胞按照G1、S、G2和M期的顺序进行复制, 用Western blot检测cyclin D1、cyclin E及CDK2、CDK4蛋白表达。由于雷帕霉素100 nmol·L-1剂量组与1 000 nmol·L-1剂量组对细胞周期作用无显著性差异。因此, 后续实验中未选择1 000 nmol·L-1剂量组。此结果可见, 对照组cyclin D1、cyclin E及CDK2、CDK4表达较低, 而PDGF组各蛋白表达均上调, 与对照组比较有显著性差异(P < 0.05)。雷帕霉素10和100 nmol·L-1剂量组与PDGF组比较, 各指标均未见明显改变(P > 0.05), 说明雷帕霉素不影响PDGF对cyclin D1、cyclin E及CDK2、CDK4的上调表达(图 3)。
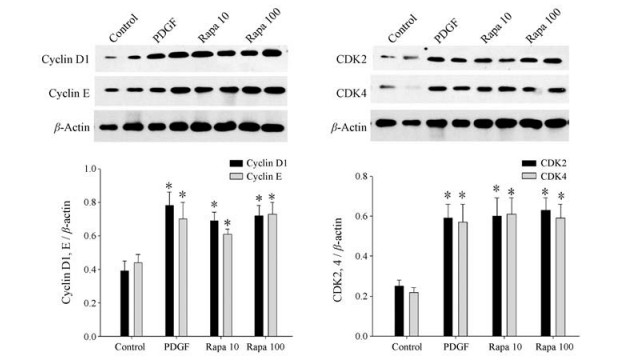
|
Figure 3 Rapa did not affect the expression of cyclin D1, cyclin E and CDK2, CDK4. n = 4, x±s. *P < 0.05 vs control |
Western blot结果显示(图 4A), 与对照组相比, PDGF可导致p27表达水平显著降低(P < 0.01), 而雷帕霉素干预组p27的蛋白表达较PDGF组明显增多, 且100 nmol·L-1剂量组较10 nmol·L-1剂量组效果更为明显(P < 0.05); Real time-PCR检测结果也显示, 雷帕霉素能明显增加p27的mRNA表达, 提示雷帕霉素通过调控其转录而增加蛋白表达(图 4B)。
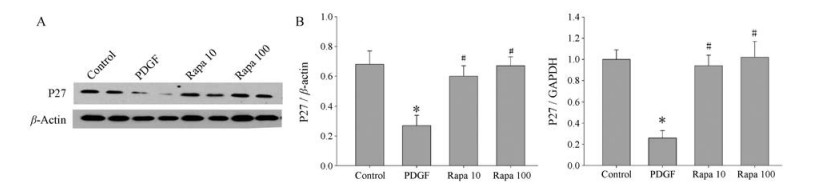
|
Figure 4 Rapamycin up-regulated the expression of p27 protein and mRNA on MCs tested by Western blot (A) and Real-time PCR (B). n = 4, x±s. *P < 0.05 vs control; #P < 0.05 vs PDGF |
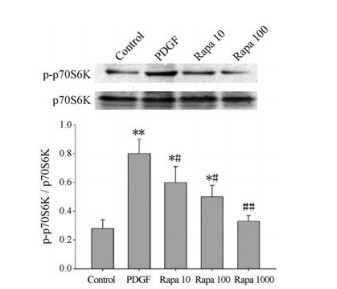
PDGF组p70S6K的磷酸化蛋白较对照组表达明显增高(P < 0.05), 说明PDGF激活了mTOR通路, 促进细胞增殖; 雷帕霉素可有效下调p-p70S6K的表达(P < 0.05)且呈剂量依赖性(图 5), 证明雷帕霉素阻断了mTOR/p70S6K通路的信号转导。
|
Figure 5 Rapa decreased the protein levels of p-p70S6K in a dose dependent manner. n = 5, x±s. *P < 0.05, **P < 0.01 vs control; #P < 0.05, ##P < 0.01 vs PDGF |
系膜细胞异常增殖在肾小球疾病中最先出现, 系膜细胞大量增殖会造成细胞外基质分泌增多并引起各种细胞因子的释放, 最终导致肾小球纤维化[4]。PI3K/Akt/mTOR通路是细胞内十分重要的一条信号转导途径, 在细胞的生长、存活、增殖和凋亡等过程中扮演着极重要的生物学角色[5]。mTOR分布于全身不同类型的细胞中, 影响不同器官及组织中的合成代谢和分解代谢[6]。mTOR也可调控许多信号通路, 包括胰岛素信号、营养传感信号和有丝分裂信号[7]。雷帕霉素属大环内酯类抗生素, 它作用于mTOR蛋白, 减少4E-BP 1 /eIF-4E的表达, 从而将细胞阻断于G1期[8]。研究证明, 雷帕霉素在IgA肾病中可降低蛋白尿水平, 减轻肾小管间质浸润和间质纤维化, 从而改善肾功能[9]。在系膜增生大鼠模型中, 雷帕霉素也可显著减轻肾小球肾炎的各种症状[10]。同时, 低剂量的雷帕霉素可以抑制肾小球系膜细胞增殖[11]。因此, 本实验主要探究雷帕霉素对系膜细胞的影响和作用机制。
通过对系膜细胞进行培养, 药物干预, MTT检测发现, 雷帕霉素能有效抑制系膜细胞的增殖, 且在一定浓度范围内(1~1 000 nmol·L-1)呈剂量依赖性。而细胞增殖是细胞周期不断循环引起细胞分裂的结果, 为了进一步了解雷帕霉素抑制系膜细胞增殖的机制, 检测了细胞周期。流式细胞术检测发现PDGF组G0/G1细胞数量减少, 占细胞总数比例明显下降, 而雷帕霉素干预组可使G0/G1期细胞比例明显增加, 减少处于S、G2期细胞的百分比, 结果提示雷帕霉素能有效阻断细胞从G0/G1期进入S期, 从而抑制系膜细胞的增殖。
细胞周期是DNA和细胞成分加倍并分裂成子细胞的一个过程[12]。各时期特异性的细胞周期蛋白可控制细胞周期有序地进行[13]。细胞周期的调控主要通过cyclin在细胞周期不同时期的合成与降解, CDK有序磷酸化和去磷酸化, 以及CDK抑制因子(CDKI)对细胞周期加以负调控来实现[14]。CDK是一组丝氨酸/苏氨酸蛋白激酶, 它能够和细胞周期蛋白形成活性复合物。这些复合物在调节细胞周期进展和阶段转变中有着十分重要的作用[15]。
Cyclin D在G1早期表达并与CDK2或CDK4结合, 成为细胞周期的启动子; 在G1/S期, cyclin E表达, 并与CDK2结合, 促进细胞通过G1/S限制点而进入S期; 进入S期后, cyclin A表达, cyclin D、cyclin E降解; S晚期、G2早期, cyclin A与CDK2结合, 调节S期进入G2期; cyclin B可与CDKl结合并在G2/M转化期间活性达到最高峰, 促进细胞进入M期[16, 17]。雷帕霉素在低浓度可明显将细胞周期阻断在G0/G1期, 抑制周期进入S期, 所以作者主要检测了cyclin D1、CDK4与cyclin E、CDK2的蛋白表达。结果显示, PDGF组cyclin D1、cyclin E及CDK2、CDK4表达上调, 说明PDGF刺激系膜细胞进入细胞增殖周期。但出乎意料的是, 雷帕霉素并不影响这些蛋白量的表达, 与PDGF组比较并无明显差异。
CDK活性受CDKI控制, CDKI分为两大家族, 分别是INK4家族(p15, p16, p18和p19)及CIP/KIP家族(p21、p24和p57)[18, 19]。CDKI可通过竞争性地抑制cyclin或cyclin-CDK复合物对cyclin-CDKs复合物进行负调控[20, 21]。作者主要关注Cip/Kip家族, 包括p21、p27和p57。p21只在异常肾小球表达, p57只在肾小球上皮细胞表达, p27则在肾小球所有类型的细胞中均有持续表达, 并能直接影响G1/S期限制位点的调控, 广泛抑制cyclin-CDK复合物[22, 23]。p27与CDK结合后可以调节CDK活性, 从而控制从G0/G1期到S期的细胞周期进程。此外, p27还能影响细胞转录和细胞运动[24, 25]。所以在实验中主要关注p27表达量的变化。
Western blot与Real time-PCR检测结果均证实, PDGF可显著降低p27表达水平, 而雷帕霉素可逆转这一现象, 使p27的蛋白及mRNA表达上调。这一结果提示, 雷帕霉素通过调控p27 mRNA转录, 增加p27蛋白表达, 从而影响HBZY-1的细胞周期。目前发现, 多条信号通路均可调节p27, 其中与p27密切相关的两条信号通路为PI3K/Akt/mTOR[26, 27]和MAPK通路[28]。参与p27功能的最重要的信号传导途径是PI3K/AKT。它通过多个配体激活AKT的下游分子PI3K导致p27下调并影响细胞周期进展[29]。细胞中mTOR以mTORC1和mTORC2两种复合物的形式存在[30]。mTORC1和mTORC2在雷帕霉素的敏感性、特异性结合成分、亚细胞定位、下游底物和调节方面都有一定的差别[31]。mTORC1对雷帕霉素敏感, 而mTORC2对雷帕霉素不敏感[32]。mTORC1可以对mRNA翻译、核糖体生物合成、营养代谢和自噬等进行调节, 这一功能已经被证实是通过影响核糖体S6激酶(S ribosomal 6 kinase, S6K)和真核细胞启动因子4E结合蛋白1 (eukaryotic initiation factor 4E binding protein l, 4EBP1)磷酸化实现[33, 34]。雷帕霉素为mTORC1阻断剂, 所以作者检测了p-p70S6K/p70S6K蛋白的表达, 发现雷帕霉素可以呈剂量依赖性抑制p-p70S6K表达量, 证明雷帕霉素通过mTORC1/p70S6K通路调控p27。
综上所述, 雷帕霉素作为mTORC1信号通路的阻断剂, 可以通过mTORC1/p70S6K通路调控p27mRNA转录, 增加其蛋白表达, 从而降低cyclin-CDK的活性, 阻断细胞周期由G0/G1期进入S期, 抑制系膜细胞的增殖。
| [1] |
Stephanie K, Wang Y, Scholl V, et al. Low-dose mTOR inhibition by rapamycin attenuates progression in anti-thy1-induced chronic glomerulosclerosis of the rat[J]. Am J Physiol Renal Physiol, 2008, 294: 440-449. |
| [2] |
Li J, Sang GK, Blenis J. Rapamycin:one drug, many effects[J]. Cell Metab, 2014, 19: 373-379. |
| [3] |
Tian JH, Wang YH, Zhou XS. Rapamycin slows IgA nephropathy progression in the rat[J]. Am J Nephrol, 2014, 39: 218-229. |
| [4] |
Huang K, Li R, Wei W. Sirt1 activation prevents anti-Thy1.1 mesangial proliferative glomerulonephritis in the rat through the Nrf2/ARE pathway[J]. Eur J Pharmacol, 2018, 832: 138-144. |
| [5] |
Yu JS, Cui W. Proliferation, survival and metabolism:the role of PI3K/AKT/mTOR signalling in pluripotency and cell fate determination[J]. Development, 2016, 143: 3050-3060. |
| [6] |
Saxton RA, Sabatini DM. mTOR signaling in growth, metabolism, and disease[J]. Cell, 2017, 168: 960-976. |
| [7] |
Cobbold SP. The mTOR pathway and integrating immune regulation[J]. Immunology, 2013, 140: 391-398. |
| [8] |
Morita M, Prudent J, Basu K. mTOR controls mitochondrial dynamics and cell survival via MTFP1[J]. Mol Cell, 2017, 67: 922-935. |
| [9] |
Bonegio R. Rapamycin ameliorates proteinuria-associated tubulointerstitial inflammation and fibrosis in experimental membranous nephropathy[J]. J Am Soc Nephrol, 2005, 16: 2063-2072. |
| [10] |
Stephanie K, Wang RY, Scholl V. Low-dose mTOR inhibition by rapamycin attenuates progression in anti-thy1-induced chronic glomerulosclerosis of the rat[J]. Am J Physiol Renal Physiol, 2008, 294: 440-449. |
| [11] |
Lock HR, Sacks SH, Robson MG. Rapamycin at subimmunosuppressive levels inhibits mesangial cell proliferation and extracellular matrix production[J]. Am J Physiol Renal Physiol, 2007, 292: 76-81. |
| [12] |
Barnum KJ, O'Connell MJ. Cell cycle regulation by checkpoints[J]. Methods Mol Biol, 2014, 1170: 29. |
| [13] |
Ingham M, Schwartz GK. Biology of neoplasia:cell-cycle therapeutics come of age[J]. J Clin Oncol, 2017, 35: 2949-2959. |
| [14] |
Nurse P. A journey in science:cell-cycle control[J]. Mol Med, 2017, 22: 112-119. |
| [15] |
Lin ZP, Zhu YL, Ratner ES. Targeting cyclin-dependent kinases for treatment of gynecologic cancers[J]. Front Oncol, 2018, 8: 303. |
| [16] |
Kamenz J, Ferrell JE. The temporal ordering of cell-cycle phosphorylation[J]. Mol Cell, 2017, 65: 371-373. |
| [17] |
Kar S. Unraveling cell-cycle dynamics in cancer[J]. Cell Syst, 2016, 2: 8-10. |
| [18] |
Yang CH, Wu CC, Chen WT, et al. Expressions of p16 and p27 in urothelial carcinoma and their prognostic value[J]. Kaohsiung J Med Sci, 2014, 30: 453-458. |
| [19] |
Karimian A, Ahmadi Y, Yousefi B. Multiple functions of p21 in cell cycle, apoptosis and transcriptional regulation after DNA damage[J]. DNA Repair, 2016, 42: 63-71. |
| [20] |
Koepp DM. Cell cycle regulation by protein degradation[J]. Methods Mol Biol, 2014, 1170: 61-73. |
| [21] |
Qiu LQ, Sinniah R, Hsu IH. Role of differential and cell type-specific expression of cell cycle regulatory proteins in mediating progressive glomerular injury in human IgA nephropathy[J]. Lab Invest, 2004, 84: 1112-1125. |
| [22] |
Chu IM, Hengst L, Slingerland JM. The Cdk inhibitor p27 in human cancer:prognostic potential and relevance to anticancer therapy[J]. Nat Rev Cancer, 2008, 8: 253-267. |
| [23] |
Sharma SS, Pledger WJ. The non-canonical functions of p27Kip1 in normal and tumor biology[J]. Cell Cycle, 2016, 15: 1189-1201. |
| [24] |
Su B, Chen X, Zhong C, et al. All-trans retinoic acid inhibits mesangial cell proliferation by up-regulating p21Waf1/Cip1 and p27Kip1 and down-regulating Skp2[J]. J Nephrol, 2012, 25: 1031. |
| [25] |
Suzuki S, Ohashi N, Kitagawa M. Roles of the Skp2/p27 axis in the progression of chronic nephropathy[J]. Cell Mol Life Sci, 2013, 70: 3277-3287. |
| [26] |
Su M, Wang J, Wang C, et al. MicroRNA-221 inhibits autophagy and promotes heart failure by modulating the p27/CDK2/mTOR axis[J]. Cell Death Differ, 2015, 22: 986-999. |
| [27] |
Sha M, Ye J, Luan ZY, et al. Celastrol induces cell cycle arrest by microRNA-21-mTOR-mediated inhibition p27 protein degradation in gastric cancer[J]. Cancer Cell Int, 2015, 15: 101. |
| [28] |
Wang HC, Lee WS. Progesterone-induced migration inhibition in male rat aortic smooth muscle cells through the cSrc/AKT/ERK 2/p38 pathway-mediated up-regulation of p27[J]. Endocrinology, 2014, 155: 1428-1435. |
| [29] |
Chen R, He F, He H, et al. Phosphorylation of P27 by AKT is required for inhibition of cell cycle progression in cholangiocarcinoma[J]. Dig Liver Dis, 2018, 50: 501-506. |
| [30] |
Loewith R, Jacinto E, Wullschleger S, et al. Two TOR complexes, only one of which is rapamycin sensitive, have distinct roles in cell growth control[J]. Mol Cell, 2002, 10: 460-468. |
| [31] |
Shimobayashi M, Hall MN. Making new contacts:the mTOR network in metabolism and signalling crosstalk[J]. Nat Rev Mol Cell Biol, 2014, 15: 155-162. |
| [32] |
Sarbassov DD, Ali SM, Sengupta S, et al. Prolonged rapamycin treatment inhibits mTORC2 assembly and Akt/PKB[J]. Mol Cell, 2006, 22: 159-168. |
| [33] |
Bar PL, Sabatini DM. Regulation of mTORC1 by amino acids[J]. Trends Cell Biol, 2014, 24: 400-406. |
| [34] |
Dibble CC, Cantley LC. Regulation of mTORC1 by PI3K signaling[J]. Trends Cell Biol, 2015, 25: 545-555. |
 2020, Vol. 55
2020, Vol. 55


