2. 复旦大学附属浦东医院, 上海201300;
3. 复旦大学药学院, 上海 201203
2. Fudan University Pudong Medical Center, Shanghai 201300, China;
3. School of Pharmacy, Fudan University, Shanghai 201203, China
口腔黏膜给药(oral transmucosal drug delivery)指药物经口腔黏膜吸收进入体循环而发挥药效[1]。药物直接经口腔内静脉进入颈静脉再进入体循环, 可避免肝脏首过效应和胃肠道内酶代谢, 有利于提高药物生物利用度[2]。例如, 阿塞那平的口服绝对生物利用度小于2%, 开发为舌下片(SAPHRIS®)后绝对生物利用度提高至46%~65%;盐酸司来吉兰1.25 mg口崩片(ZELAPARTM)的AUC与10 mg普通片的AUC相当; 芬太尼舌下喷雾、含片、口腔黏膜贴片等与普通口服制剂相比, 均提高了生物利用度。并且药物经口腔黏膜吸收迅速, 起效快, 适用于防治急性病[3]。
但是临床研究数据表明, 不是所有经口腔黏膜给药的制剂都可以使药物经口腔黏膜吸收并具备吸收迅速、生物利用度提高等特点, 例如酒石酸唑吡坦口崩片(TOVALTTMODT)与酒石酸唑吡坦片(AMBIEN®)的相对生物利用度为103%, 具有生物等效性; 盐酸昂丹司琼口崩片(ZOFRAN®ODT)与盐酸昂丹司琼片(ZOFRAN®)临床上生物等效, 可替换使用。这类口腔黏膜给药制剂开发的主要目的在于改善患者的顺应性, 在老年人、儿童或精神疾病用药方面显示了一定的优势。药物经口腔黏膜的吸收速度和程度与药物、剂型、口腔黏膜相关。建立药物口腔黏膜吸收的模型和方法, 有利于口腔黏膜给药系统的研发。口腔黏膜给药系统的剂型有舌下片、舌下膜、口腔黏膜贴片、颊黏膜黏附膜和口颊黏膜溶液等。
本文分析了口腔黏膜给药系统药物动力学性质的主要影响因素, 介绍了口腔黏膜给药系统药物动力学的研究方法, 包括体外渗透性研究(如离体动物组织模型、细胞模型、人工培养的组织模型和仿生屏障模型)、在体口腔吸收研究、体内药物动力学研究及生理药代动力学(physiologically based pharmacokinetics, PBPK)模型, 分析了不同药物和剂型的口腔黏膜给药的药动学特点、应用现状及研究前景。
1 口腔黏膜生理特点口腔黏膜解剖结构由外到内依次为口腔上皮、基底膜、固有层和黏膜下层[4]。口腔上皮由口腔黏膜外1/4~1/3处排列紧密的鳞状上皮细胞组成, 是口腔黏膜的保护屏障同时也是口腔黏膜给药的主要渗透屏障。上皮细胞可进一步分为角化和非角化细胞。非角化的上皮细胞具有较高的渗透性, 主要分布在颊、舌下、软腭和舌头腹面等被覆黏膜处, 对于口腔黏膜给药具有重要意义[5]。黏膜下层包含丰富的血管, 是药物吸收入血的主要部位。
口腔中唾液主要由腮腺、下颌下腺和舌下腺三大腺体分泌。成人24 h的唾液分泌量为1~1.5 L, pH值为5.5~7.0。唾液的组成及pH值受唾液流速影响, 在高流速下, 腺体导管对钠和碳酸氢盐的重吸收减少, 导致二者浓度增加, pH值升高。唾液的流速与一天中的时间点、所受刺激类型及程度有关。黏液是唾液的一部分, 覆盖在口腔黏膜表面, 厚度在40~300 μm不等, 起润滑及保护口腔上皮的作用。
2 影响口腔黏膜给药系统药物动力学性质的因素 2.1 口腔生理因素影响药物在口腔黏膜吸收的生理屏障为口腔上皮细胞组成的渗透屏障、口腔内黏液和唾液组成的扩散屏障及酶屏障。
渗透屏障主要存在于口腔上皮最外侧200 μm处, 是药物透口腔黏膜的主要生理屏障。扩散屏障主要由黏膜表面覆盖的黏液及口腔内的唾液构成。黏液在正常口腔pH值的环境中带负电, 呈强黏性凝胶结构, 结合到上皮细胞表面形成凝胶层, 发挥屏障作用, 但同时黏液的黏蛋白可以与辅料中聚合物官能团形成络合物, 延长药物在口腔的停留时间, 增加药物在口腔黏膜的吸收[6]。唾液提供了含水的环境, 可以促进药物释放, 但唾液分泌过多及唾液流动会使药物被过早的吞咽, 导致药物损失, 即“唾液冲洗效应”, 影响药物生物利用度。酶屏障由唾液中少量消化酶及上皮细胞胞浆内的酯酶、氨肽酶、羧肽酶等组成, 会导致蛋白类和肽类药物的降解[7]。
2.2 口腔给药部位口腔内不同部位的药物渗透性存在差异。颊黏膜和舌下黏膜是常见给药部位, 但两者厚度、面积和上皮细胞组成等均不同, 影响了药物吸收(表 1)[1, 5, 8-10]。舌下黏膜渗透性好、血管丰富, 药物吸收迅速、起效快, 适用于剂型如用于缓解急性心绞痛发作的硝酸甘油舌下片和舌下喷雾剂。颊黏膜表面积大, 适用于黏附制剂, 可获得缓释效果。
| Table 1 Comparison of properties between buccal and sublingual mucosa |
口腔内不同部位对药物吸收的影响可用于指导制剂开发。罗匹尼罗在兔口腔舌下给药及颊部给药后, 与口服给药相比, AUC0-6 h均提高了约7倍, 但舌下给药与颊部给药的AUC0-6 h和AUC0-∞比较无统计学差异(P > 0.05)[11]。阿塞那平的人颊部给药与舌下给药相比, 药物暴露量增加但不影响临床疗效; 舌上给药与舌下给药相比, 药物暴露量相当; 三者不良反应总体发生率相近[12]。Loprete等[13]研究了西地那非口溶膜舌下给药与舌上给药的人体药物动力学, 结果显示两种给药方式的药物暴露量相当(90% CI 94.9%~110.58%)。
2.3 药物的理化性质药物的理化性质如分子质量、解离度、脂溶性、水溶性和溶解度等会影响药物透口腔黏膜的难易程度及药物在口腔黏膜的吸收途径, 从而影响口腔黏膜给药系统的药物动力学性质。
经口腔黏膜吸收的药物分子质量通常应不高于800 Da, 分子质量越大越难透过口腔黏膜; 药物在口腔pH值(5.5~7.0)条件下未解离分数越高, 药物越容易透过口腔黏膜; 药物需具备一定的脂溶性, 即Log P值(辛醇/水)高于2.0 (药物在辛醇中的溶解度是在水中溶解度的100倍), 同时还需具有一定的水溶性[5]。
药物的脂溶性和水溶性会影响药物在口腔黏膜的吸收方式。药物经口腔黏膜吸收的主要途径为被动扩散[2], 包括细胞旁路途径(paracellular route)和跨细胞膜途径(transcellular route)。细胞旁路途径指通过细胞间隙进入血液循环, 跨细胞膜途径为直接穿透细胞进入血液循环(图 1)。亲水性药物多通过细胞旁路途径被吸收, 这类药物易溶解在细胞间隙的液体中, 如蛋白多肽类药物。由于相邻细胞间存在紧密连接, 经此途径被吸收的药物需使用促渗剂增加药物的渗透能力[1]。跨细胞膜途径吸收的药物要先穿过膜脂质进入细胞, 再穿过细胞的亲水内部, 因而要求药物具有较强脂溶性的同时还具有一定的水溶性。若水溶性较差, 易被保留在浅表上皮层的膜脂质, 无法穿过细胞的亲水内部达到血液循环。可选择水溶性良好的盐形式来改善高亲脂性药物的水溶性, 如高亲脂性的芬太尼(仅微溶于水)用于透皮制剂, 而柠檬酸芬太尼(水中溶解度为25 mg·mL-1)用于口腔黏膜给药系统[5]。

|
Figure 1 Diagrammatic representation of pathways for drug delivery through the oral mucosa |
口腔黏膜给药系统的主要剂型有舌下片、舌下膜、口腔黏膜贴片、颊黏膜黏附膜和口颊黏膜溶液等(表 2)。药物的不同剂型表现出的药物动力学性质不同。芬太尼舌下喷雾(SUBSYSTM)的绝对生物利用度为76%;芬太尼颊黏膜黏附膜(ONSOLIS®) 51%的药量经口腔黏膜吸收, 绝对生物利用度为71%;芬太尼口腔黏膜贴片(FENTORA®) 50%的药量经口腔黏膜吸收, 生物利用度为67%;柠檬酸芬太尼含片(ACTIQ®) 25%的药量通过口腔黏膜吸收, 绝对生物利用度为47%。同剂量的丁丙诺啡/纳洛酮颊黏膜黏附膜(BUNAVAIL)比丁丙诺啡/纳洛酮舌下片(SUBOXONE®)生物利用度高, 4.2 mg/0.7 mg的BUNAVAIL与8 mg/2 mg的SUBOXONE®生物等效。因此, 应根据药物理化性质、剂型的特点及临床需要选择合适的制剂。
| Table 2 Part of commercially available oral transmucosal drug delivery systems |
在处方中, 加入促渗剂、黏膜黏附剂、酶抑制剂及应用纳米技术可以帮助药物克服在口腔黏膜的吸收屏障, 提高药物生物利用度。
促渗剂可以改变上皮细胞间及细胞膜的脂质流动性, 从而促进药物在口腔黏膜的被动转运。常用的促渗剂有表面活性剂、胆酸及其衍生物、氨基酸及其衍生物、阳离子聚合物等。胆酸钠、牛磺胆酸钠、甘氨胆酸钠、硫磺去氧胆酸钠和甘氨去氧胆酸钠修饰的胰岛素脂质体与胰岛素溶液相比, 硫磺去氧胆酸钠在口腔细胞模型的促吸收增强比率最高, 为5.24 (P < 0.001)[14]。氨基酸对胰岛素在口腔细胞模型有明显促渗作用(P < 0.05)且不影响细胞完整性[15]。
黏膜黏附剂可以与口腔黏膜的黏蛋白相互作用, 延长药物在口腔黏膜的停留时间, 增加药物在黏膜的吸收。常用的黏膜黏附剂有阳离子聚合物和硫醇化聚合物[14]。黏液中黏蛋白和聚合物之间的生物黏附行为可以指导聚合物结构的设计及黏附剂的选择。
酶抑制剂如抑肽酶、胆酸盐、纤维素衍生物、谷胱甘肽等可以减少药物在口腔及黏膜的降解, 提高药物生物利用度[7]。
纳米技术的应用(如纳米粒载药)可以提高药物在口腔的稳定性及药物的水溶性, 增加药物在口腔黏膜的吸收[16]。以不同型号的聚甲基丙烯酸酯(Eudragit® RL PO和Eudragit® RS PO)为基材制备的低分子肝素纳米粒在离体猪颊黏膜的2 h药物体外渗透分数分别为(0.1 ± 0.015)%和(0.08 ± 0.018)%, 与低分子肝素溶液相比, 体外渗透性明显增加[17]。疫苗纳米粒纳米纤维黏附膜可以持续地将疫苗纳米粒输送到黏膜下组织并引流至淋巴结部位[18]。胰岛素壳聚糖纳米粒颊黏附膜可显著降低糖尿病大鼠血糖水平[19]。
3 口腔黏膜给药系统的药物动力学研究方法 3.1 体外渗透性研究体外渗透性研究可以评估口腔黏膜对药物的屏障作用, 进而评估药物在口腔黏膜的吸收情况及经口腔黏膜给药的可行性。渗透性研究通常使用易控制环境因素的药物渗透模型进行, 人颊黏膜组织是最理想的模型, 但由于伦理及不易获得而很少采用。研究中多使用与人颊黏膜性质相似的离体动物组织模型、细胞模型、人工培养的组织模型及仿生屏障模型。
3.1.1 离体动物组织模型离体动物组织模型一般通过外科手术将口腔黏膜连同黏膜下层结缔组织从实验动物口腔分离, 再去除结缔组织而获得。实验动物中, 大鼠和仓鼠的颊黏膜是角质化组织; 兔颊黏膜一部分未角化, 但未角化部分与角化部分不好辨别分离; 猴子、狗和猪的颊黏膜组织未角化。其中狗和猴的颊黏膜比人的颊黏膜薄, 药物渗透性较人颊黏膜高。猪的颊黏膜与人颊黏膜最为相似, 且成本低, 是最常用的体外药物渗透动物模型(表 3)[20]。
| Table 3 Comparison of buccal mucosa of different mammals |
儿童用奥美拉唑颊黏膜黏附膜在猪颊黏膜黏附2 h以上, 药物的渗透量为275 μg·cm-2, 证实了其在儿童颊部给药的可行性[21]。伊潘立酮舌下膜在猪舌下黏膜15 min内的药物渗透通量约为117.1 ± 0.35 μg·cm-1·h-2, 是对照药物渗透通量的10倍[22]。处方为羧甲基壳聚糖/聚乙烯醇(1:2)和羧甲基壳聚糖/聚乙烯醇(1:3)的卡维地洛脂质体在猪颊黏膜的5 h药物累积渗透量(Q5 h)分别为15.8和16.5 μg·mL-1, 相比卡维地洛溶液(Q5 h为8.8 μg·mL-1), 药物渗透明显增加[23]。
3.1.2 细胞模型药物体外渗透性实验细胞模型常用TR146细胞, 其操作简单, 具有较好的完整性、均匀性和重现性。TR146细胞是源于人口腔黏膜转移癌的连续细胞系, 生长参数显示饱和密度为2×105 cells·cm-2左右, 翻倍时间为33~49 h。其形态学呈上皮样细胞, 透射电镜(TEM)显示, 在培养第10~50天的TR146细胞中, 有4~7层上皮细胞, 表面细胞呈扁平状, 与下层细胞明显不同。体外培养的TR146细胞具有正常人类颊部上皮的超微结构特征, 如中间丝、微绒毛样突起、多层流体, 细胞间无紧密连接且未完全角化。随培养时间的延长, 细胞器和桥粒增多, 在培养第30天左右达到细胞层的最大完整性, 可以通过测量跨上皮电阻(TEER)和渗透性试验来评估其完整性。
Chen等[23]应用TR146细胞模型研究了以不同比例羧甲基纤维素钠(CMC-Na)、羧甲基壳聚糖(CMCS)与聚乙烯醇(PVA)为基材制得的卡维地洛脂质体的药物渗透情况, 结果显示, 在TR146细胞模型中卡维地洛4 h累积渗透量(Q4 h)为5.75 μg·mL-1, 处方为CMCS/PVA (1:2)的自组装卡维地洛脂质体Q4 h明显增加, 为14.6 μg·mL-1。Bashyal等[14]应用TR146细胞模型研究了不同胆酸衍生物修饰的胰岛素脂质体对胰岛素的促渗作用。Iyire等[15]应用TR146细胞模型研究了氨基酸对胰岛素渗透性的影响。Sander等[24]应用TR146细胞模型研究了二甲双胍在颊上皮细胞间渗透的可行性。
3.1.3 人工培养的组织模型人工培养的组织模型为研究药物体外渗透性提供了一种重复性良好的非动物实验方法。目前使用的多为MatTek公司的EpiOralTM (图 2)。EpiOralTM由正常人口腔上皮细胞构成, 是在特制的无血清培养基中体外培养成的多层、高度分化的人颊表型, 与在体人口腔黏膜组织形态、生长特征具有高度一致性。
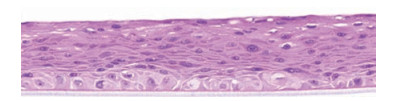
|
Figure 2 EpiOralTM |
EpiOralTM[25]和培养基需在2 ℃~8 ℃的条件下保存, 渗透性实验需在样品收集到48 h内进行, 实验前后需测量组织的跨上皮电阻(TEER)以评估其完整性。将组织置于含培养基的孔板中平衡1 h, 实验前后测其跨上皮电阻(TEER)评估其完整性。在组织上方加入供给液培养30 min后, 依次转移到相应时间的培养孔, 测定各孔接收液中药物浓度计算累计渗透率随时间变化, 或在相应的时间移走接收液补充等量接收液, 测定各个时间移走接收液中药物浓度。在最后一个时间点, 测定供给液药物浓度, 以保证实验中药量恒定(图 3)。Morales等[26]利用EpiOralTM研究了以不同聚合物为基材制得的胰岛素纳米粒黏附膜的体外渗透性, 结果显示聚甲基丙烯酸酯(ERL)膜中的胰岛素透过EpiOralTM的平均通量为0.34 μg·h-1·cm-2, ERL-HPMC膜的胰岛素平均透过通量为0.07 μg·h-1·cm-2, 纳米粒ERL膜具有较好的体外渗透性能。Boateng等[27]利用EpiOralTM和羊颊黏膜研究了自制胰岛素硫代壳聚糖冻干凝胶的体外渗透性, 结果显示, 含抑肽酶的胰岛素硫代壳聚糖冻干凝胶透过EpiOralTM的药量是胰岛素溶液的1.7倍。Giovino等[28]利用EpiOralTM研究了胰岛素纳米粒颊黏膜黏附膜的体外渗透性, 结果显示, 该颊黏膜黏附膜透过EpiOralTM的药量是胰岛素溶液的1.8倍。

|
Figure 3 Permeability experiments procedures |
仿生屏障(biomimetic barrier)是一种近年来新开发的非细胞、非组织的模型, 用于研究被动扩散药物的体外渗透性。其pH值耐受范围大、寿命长、便于运输、操作简单、重现性好。Innome公司开发的磷脂仿生屏障PermeaPad®可以与Franz扩散池连用进行药物的体外渗透性研究(图 4)。PermeaPad®96孔板可以进行药物渗透性筛选(图 5)。Bibi等[29]以美托洛尔为模型药物考察了PermeaPad®用于研究药物经口腔黏膜吸收的可行性, 结果显示, 弱碱性药物美托洛尔在PermeaPad®的渗透性, 在7.4~9.5的pH值范围内随pH值升高而增加, 符合pH值分配学说, 且与文献报道的美托洛尔在TR146细胞、离体猪颊黏膜及迷你猪体内渗透性均具有良好的相关性。目前应用PermeaPad®进行药物在口腔黏膜渗透性的研究较少, 还需大量药物进一步验证。
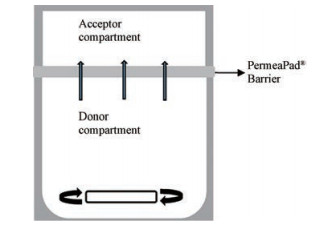
|
Figure 4 Schematic diagram of Franz diffusion cell and PermeaPad® Barrier |
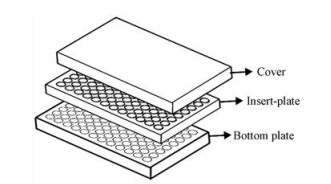
|
Figure 5 Schematic diagram of PermeaPad® Plate |
“口腔吸收试验”是评估药物口腔黏膜吸收最简单的试验方法, 也称“涡流和唾液试验”[30]。将已知药量的药液导入受试者口腔, 受试者将药液在口腔转动一定时间后吐出并漱口, 吐出的药液和漱口液合并, 测定药量。药液中初始药量与最终药量之差, 认为是进入口腔黏膜的药量。该方法操作简单不需采集血样, 但不能简单认为药物减少部分均进入了体循环, 黏膜储留、潜在代谢和无意吞咽等都会导致药量损失。
另一种在体口腔黏膜吸收试验为灌注试验, 是将灌注腔固定在麻醉动物或人的口腔黏膜, 药物溶液在装置中循环, 在不同时间收集药液, 测定浓度, 定期抽取血样生成药物动力学数据。Koland等[31]使用新西兰兔麻醉后进行盐酸昂丹司琼在体口腔黏膜的吸收研究。但灌注试验存在一些局限, 如易发生泄漏、个体间差异较大等。
3.3 体内药物动力学研究通过体外渗透性研究及在体口腔黏膜吸收试验了解药物经口腔黏膜吸收情况及制剂在口腔黏膜递送药物能力后, 还需进行体内药物动力学研究以综合体内生理因素考察口腔黏膜给药系统的药物动力学性质。体内药物动力学研究包括动物体内药物动力学研究及人体内药物动力学研究。
3.3.1 动物体内的药物动力学研究理想的动物体内药物动力学研究所得的实验数据可以为后续人体试验提供依据和指导。兔、狗、猪是口腔黏膜给药系统药物动力学研究的常用动物。
给予兔肾上腺素舌下片30 mg后, 21 min达最大血药浓度(16.7 ± 1.9 ng·mL-1), 与肌肉注射肾上腺素相比无显著性差异(P > 0.05)[32]。盐酸替扎尼定和美洛昔康复方缓释颊黏膜黏附膜给予兔后, 替扎尼定和美洛昔康经颊黏膜吸收, 药物动力学性质明显改善(P < 0.05)[33]。本课题组以马来酸阿塞那平舌下片(SAPHRIS®)为参比制剂, 在比格犬体内进行了自制马来酸阿塞那平舌下膜的药物动力学研究, 结果显示自制膜的相对生物利用度为(106.5 ± 15.2)%[34]。Meng-Lund等[35]在迷你猪体内进行了不同晶型的安定颊黏膜黏附片的药物动力学研究。Sadar等[36]在豚鼠体内进行了丁丙诺啡的静脉给药与口腔黏膜给药的药代动力学研究以确定丁丙诺啡给药剂量。
3.3.2 人体内药物动力学研究人体药物动力学研究可以获得真实准确的药物动力学数据以评估制剂性能并确定后期大规模临床试验的必要性、研究方法和给药方案等。
Sekhar等[37]以健康人为对象研究了马来酸氯苯那敏黏膜黏附剂的药动学, 结果显示其生物利用度是口服制剂的1.46倍。Darwish等[38]以健康人为对象研究了芬太尼口腔黏膜贴片和柠檬酸芬太尼含片的药物动力学, 结果显示芬太尼口腔黏膜贴片的绝对生物利用度为65%, 高于柠檬酸芬太尼含片(绝对生物利用度为47%)。Vasisht等[39]研究了芬太尼颊黏膜黏附膜在健康人体内的药物动力学, 结果显示其绝对生物利用度为71%, 高于口服芬太尼(绝对生物利用度约35%)。
McIntyre等[40]以儿童癫痫患者为研究对象研究咪达唑仑口颊黏膜溶液与直肠给药安定的有效率。结果显示, 咪达唑仑口颊黏膜溶液的治疗成功率为56%, 直肠用安定的治疗成功率为27%, 不同组间呼吸抑制率无差异。对试验中心、年龄、已知诊断、使用抗癫痫药物、既往治疗和治疗前癫痫发作时间进行logistic回归分析, 咪达唑仑口颊黏膜溶液比直肠用安定更有效。Hagen等[41]以癌症患者为对象研究了舌下给予美沙酮溶液治疗癌症疼痛的可行性, 结果显示, 给药后10 min平均疼痛强度下降1.7分(数值为10分), 15 min后平均疼痛强度下降3.2分, 无严重毒性反应, 此研究证实美沙酮溶液舌下给药吸收迅速、有效、安全, 但该方法能否用于大规模随机临床试验还需进一步研究。Goorhuis等[42]以儿童肝移植患者为对象研究他克莫司混悬剂颊部给药的可行性, 结果显示, 肝移植第1周后颊部给药与鼻饲管给药相比可达到相似治疗水平。
3.4 生理药代动力学模型生理药代动力学(PBPK)模型可以综合分析药物理化性质、人体生理因素、制剂处方等对药物动力学的影响[43]。将PBPK模型应用于口腔黏膜给药系统, 有助于了解口腔黏膜给药系统的药物动力学性质, 指导制剂开发及临床应用。常用的PBPK建模软件有GastroPlusTM和Simcyp®等。
3.4.1 GastroPlusTMGastroPlusTM口腔房室吸收转运(OCCAT)模型整合了口腔生理因素及药物在口腔内崩解、溶出以及黏膜吸收等因素对口腔黏膜给药系统药物动力学性质的影响, 模拟血药浓度随时间的变化、药物经口腔黏膜给药后经黏膜吸收分数及速率, 是预测药物经口腔黏膜吸收的有效工具, 有望在药物早期发现和口腔黏膜给药制剂开发阶段进行前瞻性预测以节省时间和金钱成本, 并有望代替部分临床前及临床试验。
Xia等[44]采用GastroPlusTM口腔房室吸收转运(oral cavity compartmental absorption and transit, OCCAT)模型研究了酒石酸唑吡坦舌下片(Intermezzo®)血药浓度随时间的变化及药物在口腔黏膜的吸收分数和速率; 通过模拟浓度与实测浓度间的拟合, 以及关键药物动力学参数(如Cmax、Tmax、AUC)的偏差对模型进行优化及评价; 并进行敏感性分析, 以证明关键建模参数对药物口腔黏膜吸收分数的影响。模型预测结果显示, 药物口腔黏膜吸收分数不仅与药物在上皮组织的扩散速率和游离药物分数有关, 还依赖于药物的理化性质(如溶解度和LogDpH=7.4); Intermezzo®舌下片中约18%的酒石酸唑吡坦通过口腔黏膜途径吸收; 其药物动力学参数Cmax、AUC0-inf、AUC0-20 min和Tmax的预测偏差分别为5.7%、28.0%、11.8%和28.6%, 具有较好的预测精度。
3.4.2 Simcyp®Simcyp®可以将肺部吸入给药模块和胃肠道给药模块结合起来模拟口腔黏膜给药后的吸收部分, 再整合分布、消除部分建立完整的PBPK模型, 该模型综合考虑了药物理化性质、人体生理因素及个体间差异, 可以预测不同给药剂量在不同人群中的药代动力学行为以指导给药方案。
Kalluri等[45]应用Simcyp®软件建立了丁丙诺啡舌下片的PBPK模型, 首先利用静脉注射给药的实验数据拟合并优化分布和消除, 然后以肺部吸入给药结合胃肠道给药作为丁丙诺啡舌下片的吸收部分来建立完整的PBPK模型。此模型可准确预测给药剂量在0.3~32 mg时体内的药物动力学情况, 模型预测丁丙诺啡脑组织暴露量为血浆中的4倍。Shire公司使用Simcyp®模拟了咪达唑仑口颊黏膜溶液不同剂量在不同年龄的儿科人群(新生儿、婴幼儿及儿童)体内的药物动力学行为, 结果显示, 剂量与年龄呈线性关系, 但由于模拟过程中使用的数据为咪达唑仑口颊黏膜溶液在成人体内的药物动力学数据和儿科群体的静脉给药数据, 因此模型不能用于指导儿科给药剂量。
4 结论口腔黏膜给药系统具有提高生物利用度、吸收快速、患者用药顺应性较好等特点。肝脏首过效应明显且口腔黏膜渗透性较好的药物适合开发成口腔黏膜给药制剂, 以提高药物生物利用度, 减少给药剂量, 减少不良反应。很多研究者也在致力于通过离子电渗等物理促渗技术或在处方中添加促渗剂、黏膜黏附剂和酶抑制剂等方法实现生物大分子药物的口腔黏膜给药[46], 从而避免注射疼痛。因此了解口腔黏膜给药系统药物动力学性质的影响因素、建立有效的研究方法对于该类制剂的药物筛选、处方设计及临床应用十分重要。目前标准化、系统化的实验方法还需深入研究并通过临床试验进行验证。
| [1] |
Sattar M, Sayed OM, Lane ME. Oral transmucosal drug delivery-current status and future prospects[J]. Int J Pharm, 2014, 471: 498-506. DOI:10.1016/j.ijpharm.2014.05.043 |
| [2] |
Li YQ, Huang SW. Research progress in the absorption mechanisms of mouth mucosal drug delivery system[J]. Chin New Drugs J (中国新药杂志), 2012, 21: 512-517. |
| [3] |
Brandl M, Bauer-Brandl A. Oromucosal drug delivery:trends in in-vitro biopharmaceutical assessment of new chemical entities and formulations[J]. Eur J Pharm Sci, 2019, 128: 112-117. DOI:10.1016/j.ejps.2018.11.031 |
| [4] |
Salamat-Miller N, Chittchang M, Johnston TP. The use of mucoadhesive polymers in buccal drug delivery[J]. Adv Drug Deliv Rev, 2005, 57: 1666-1691. DOI:10.1016/j.addr.2005.07.003 |
| [5] |
Lam JK, Xu Y, Worsley A, et al. Oral transmucosal drug delivery for pediatric use[J]. Adv Drug Deliv Rev, 2014, 73: 50-62. DOI:10.1016/j.addr.2013.08.011 |
| [6] |
Duggan S, Cummins W, O'Donovan D, et al. Thiolated polymers as mucoadhesive drug delivery systems[J]. Eur J Pharm Sci, 2017, 100: 64-78. DOI:10.1016/j.ejps.2017.01.008 |
| [7] |
Zhong BN, Sheng BD, Shen CY, et al. Research progress of the oral mucosal delivery of biomacromolecules[J]. Chin New Drugs J (中国新药杂志), 2018, 27: 2011-2016. |
| [8] |
Silva BM, Borges AF, Silva C, et al. Mucoadhesive oral films:the potential for unmet needs[J]. Int J Pharm, 2015, 494: 537-551. DOI:10.1016/j.ijpharm.2015.08.038 |
| [9] |
Ramesan S, Rezk AR, Yeo LY. High frequency acoustic permeabilisation of drugs through tissue for localised mucosal delivery[J]. Lab Chip, 2018, 18: 3272-3284. DOI:10.1039/C8LC00355F |
| [10] |
Ling RB, Chen QJ, Qiu HT, et al. Advances in research on oral mucosadhesive drug delivery system[J]. Prog Pharm Sci (药学进展), 2018, 42: 905-912. |
| [11] |
Lai KL, Fang Y, Han H, et al. Orally-dissolving film for sublingual and buccal delivery of ropinirole[J]. Colloids Surf B Biointerfaces, 2018, 163: 9-18. DOI:10.1016/j.colsurfb.2017.12.015 |
| [12] |
Gerrits M, de Greef R, Peeters P. Effect of absorption site on the pharmacokinetics of sublingual asenapine in healthy male subjects[J]. Biopharm Drug Dispos, 2010, 31: 351-357. |
| [13] |
Loprete L, Leuratti C, Frangione V, et al. Pharmacokinetics of a novel sildenafil orodispersible film administered by the supralingual and the sublingual route to healthy men[J]. Clin Drug Investig, 2018, 38: 765-772. DOI:10.1007/s40261-018-0665-x |
| [14] |
Bashyal S, Seo JE, Keum T, et al. Facilitated permeation of insulin across TR146 cells by cholic acid derivatives-modified elastic bilosomes[J]. Int J Nanomed, 2018, 13: 5173-5186. DOI:10.2147/IJN.S168310 |
| [15] |
Iyire A, Alaayedi M, Mohammed AR. Pre-formulation and systematic evaluation of amino acid assisted permeability of insulin across in vitro buccal cell layers[J]. Sci Rep, 2016, 6: 32498. DOI:10.1038/srep32498 |
| [16] |
Morales JO, Brayden DJ. Buccal delivery of small molecules and biologics:of mucoadhesive polymers, films, and nanoparticles[J]. Curr Opin Pharmacol, 2017, 36: 22-28. DOI:10.1016/j.coph.2017.07.011 |
| [17] |
Mouftah S, Abdel-Mottaleb MMA, Lamprecht A. Buccal delivery of low molecular weight heparin by cationic polymethacrylate nanoparticles[J]. Int J Pharm, 2016, 515: 565-574. DOI:10.1016/j.ijpharm.2016.10.039 |
| [18] |
Masek J, Lubasova D, Lukac R, et al. Multi-layered nanofibrous mucoadhesive films for buccal and sublingual administration of drug-delivery and vaccination nanoparticles-important step towards effective mucosal vaccines[J]. J Control Release, 2017, 249: 183-195. DOI:10.1016/j.jconrel.2016.07.036 |
| [19] |
Al-Nemrawi NK, Alsharif SSM, Alzoubi KH, et al. Preparation and characterization of insulin chitosan-nanoparticles loaded in buccal films[J]. Pharm Dev Technol, 2019, 24: 1-26. |
| [20] |
Patel VF, Liu F, Brown MB. Modeling the oral cavity:in vitro and in vivo evaluations of buccal drug delivery systems[J]. J Control Release, 2012, 161: 746-756. DOI:10.1016/j.jconrel.2012.05.026 |
| [21] |
Khan S, Trivedi V, Boateng J. Functional physico-chemical, ex vivo permeation and cell viability characterization of omeprazole loaded buccal films for paediatric drug delivery[J]. Int J Pharm, 2016, 500: 217-226. DOI:10.1016/j.ijpharm.2016.01.045 |
| [22] |
Londhe V, Shirsat R. Formulation and characterization of fast-dissolving sublingual film of iloperidone using box-behnken design for enhancement of oral bioavailability[J]. AAPS PharmSciTech, 2018, 19: 1392-1400. DOI:10.1208/s12249-018-0954-y |
| [23] |
Chen J, Duan H, Pan H, et al. Two types of core/shell fibers based on carboxymethyl chitosan and sodium carboxymethyl cellulose with self-assembled liposome for buccal delivery of carvedilol across TR146 cell culture and porcine buccal mucosa[J]. Int J Biol Macromol, 2019, 128: 700-709. DOI:10.1016/j.ijbiomac.2019.01.143 |
| [24] |
Sander C, Nielsen HM, Jacobsen J. Buccal delivery of metformin:TR146 cell culture model evaluating the use of bioadhesive chitosan discs for drug permeability enhancement[J]. Int J Pharm, 2013, 458: 254-261. DOI:10.1016/j.ijpharm.2013.10.026 |
| [25] |
Products: EpiOralTM & EpiGingival[EB/OL]. Ashland: MatTek Corporation, 2019[2019-07-25]. https://www.mattek.com/products/epioral-epigingival/.
|
| [26] |
Morales JO, Huang S, Williams RO, et al. Films loaded with insulin-coated nanoparticles (ICNP) as potential platforms for peptide buccal delivery[J]. Colloids Surf B Biointerfaces, 2014, 122: 38-45. DOI:10.1016/j.colsurfb.2014.05.025 |
| [27] |
Boateng JS, Mitchell JC, Pawar H, et al. Functional characterisation and permeation studies of lyophilised thiolated chitosan xerogels for buccal delivery of insulin[J]. Protein Pept Lett, 2014, 21: 1163-1175. DOI:10.2174/0929866521666140805124403 |
| [28] |
Giovino C, Ayensu I, Tetteh J, et al. An integrated buccal delivery system combining chitosan films impregnated with peptide loaded PEG-b-PLA nanoparticles[J]. Colloids Surf B Biointerfaces, 2013, 112: 9-15. DOI:10.1016/j.colsurfb.2013.07.019 |
| [29] |
Bibi HA, Holm R, Bauer-Brandl A. Use of permeapad (R) for prediction of buccal absorption:a comparison to in vitro, ex vivo and in vivo method[J]. Eur J Pharm Sci, 2016, 93: 399-404. DOI:10.1016/j.ejps.2016.08.041 |
| [30] |
Beckett AH, Triggs EJ. Buccal absorption of basic drugs and its application as an in vivo model of passive drug transfer through lipid membranes[J]. J Pharm Pharmacol, 1967, 19:Suppl: 31S-41S. |
| [31] |
Koland M, Charyulu RN, Vijayanarayana K, et al. In vitro and in vivo evaluation of chitosan buccal films of ondansetron hydrochloride[J]. Int J Pharm Investig, 2011, 1: 164-171. DOI:10.4103/2230-973X.85967 |
| [32] |
Rachid O, Rawas-Qalaji M, Simons KJ. Epinephrine in anaphylaxis:preclinical study of pharmacokinetics after sublingual administration of taste-masked tablets for potential pediatric use[J]. Pharmaceutics, 2018. DOI:10.3390/pharmaceutics10010024 |
| [33] |
Zaman M, Hanif M, Shaheryar ZA. Development of tizanidine HCl-meloxicam loaded mucoadhesive buccal films:In-vitro and in-vivo evaluation[J]. PLoS One, 2018, 13: e0194410. DOI:10.1371/journal.pone.0194410 |
| [34] |
Chen F, Yang LL, Zhou Z, et al. Preparation and in vitro/in vivo evaluation of asenapine maleate sublingual films[J]. Chin J Pharm (中国医药工业杂志), 2015, 46: 843-849, 855. |
| [35] |
Meng-Lund E, Jacobsen J, Mullertz A, et al. Buccal absorption of diazepam is improved when administered in bioadhesive tablets -an in vivo study in conscious Gottingen mini-pigs[J]. Int J Pharm, 2016, 515: 125-131. DOI:10.1016/j.ijpharm.2016.09.084 |
| [36] |
Sadar MJ, Knych HK, Drazenovich TL, et al. Pharmacokinetics of buprenorphine after intravenous and oral transmucosal admi-nistration in guinea pigs (Cavia porcellus)[J]. Am J Vet Res, 2018, 79: 260-266. DOI:10.2460/ajvr.79.3.260 |
| [37] |
Sekhar KC, Naidu KV, Vishnu YV, et al. Transbuccal delivery of chlorpheniramine maleate from mucoadhesive buccal patches[J]. Drug Deliv, 2008, 15: 185-191. DOI:10.1080/10717540801952639 |
| [38] |
Darwish M, Kirby M, Robertson P, et al. Absolute and relative bioavailability of fentanyl buccal tablet and oral transmucosal fentanyl citrate[J]. J Clin Pharmacol, 2007, 47: 343-350. DOI:10.1177/0091270006297749 |
| [39] |
Vasisht N, Gever LN, Tagarro I, et al. Evaluation of the single- and multiple-dose pharmacokinetics of fentanyl buccal soluble film in normal healthy volunteers[J]. J Clin Pharmacol, 2010, 50: 785-791. DOI:10.1177/0091270010361354 |
| [40] |
McIntyre J, Robertson S, Norris E, et al. Safety and efficacy of buccal midazolam versus rectal diazepam for emergency treatment of seizures in children:a randomised controlled trial[J]. Lancet, 2005, 366: 205-210. |
| [41] |
Hagen NA, Moulin DE, Brasher PM, et al. A formal feasibility study of sublingual methadone for breakthrough cancer pain[J]. Palliat Med, 2010, 24: 696-706. DOI:10.1177/0269216310375999 |
| [42] |
Goorhuis JF, Scheenstra R, Peeters PM, et al. Buccal vs nasogastric tube administration of tacrolimus after pediatric liver transplantation[J]. Pediatr Transpl, 2006, 10: 74-77. DOI:10.1111/j.1399-3046.2005.00402.x |
| [43] |
Liu HR, Chen F, Xiang XQ, et al. Application of physiologically based pharmacokinetic modeling in pharmaceutic[J]. Chin J Pharm (中国医药工业杂志), 2019, 50: 383-391. |
| [44] |
Xia B, Yang Z, Zhou H, et al. Development of a novel oral cavity compartmental absorption and transit model for sublingual administration:illustration with zolpidem[J]. AAPS J, 2015, 17: 631-642. DOI:10.1208/s12248-015-9727-7 |
| [45] |
Kalluri HV, Zhang H, Caritis SN, et al. A physiologically based pharmacokinetic modelling approach to predict buprenorphine pharmacokinetics following intravenous and sublingual administration[J]. Br J Clin Pharmacol, 2017, 83: 2458-2473. DOI:10.1111/bcp.13368 |
| [46] |
Yang TZ, Chen DB, Wang LR, et al. Effect of enzymes in buccal mucosa on insulin buccal absorption[J]. Acta Pharm Sin (药学学报), 2001, 36: 932-936. |
 2020, Vol. 55
2020, Vol. 55


