2. 江苏省中医药研究院和中国中医科学院江苏分院中药代谢组研究室, 江苏 南京 210028;
3. 延边大学, 吉林 延吉 133000
2. Department of Metabolomics, Jiangsu Province Academy of Traditional Chinese Medicine and Jiangsu Branch of China Academy of Traditional Chinese Medicine, Nanjing 210028, China;
3. Yanbian University, Yanji 133000, China
中链脂肪酸(medium-chain fatty acids, MCFAs)和短链脂肪酸(short-chain fatty acids, SCFAs)是指碳原子数为1~12的脂肪酸[1]。粪便中的MCFAs和SCFAs是肠道微生物群主要代谢产物, 由膳食纤维、抗性淀粉、低聚糖等不易消化的糖类在结肠受乳酸菌、双歧杆菌等厌氧菌酵解而产生, 主要包括甲酸、乙酸、丙酸、丁酸、异丁酸、戊酸、异戊酸等[2]。SCFAs具有氧化供能, 维持水电解质平衡, 降低结肠内环境pH值, 减少有害菌的生长, 改善肠道功能, 调节免疫、抗肿瘤和调控基因表达等重要作用[3, 4]。MCFAs亦是炎症性肠病等疾病的重要代谢生物标志物[5], 可降低肠道pH值, 改善肠道微生物群[6], 降低炎症因子表达, 保护肠屏障功能[7], 影响体内胆汁酸和胆固醇代谢[8]等。因此, 快速、准确的中短链脂肪酸定性定量表征方法是肠道菌与机体功能等相关研究深入开展的重要手段。
目前, 中短链脂肪酸含量测定方法主要包括气相色谱-质谱(GC-MS)[9-11]、高效液相色谱-三重四极杆质谱(LC-TQ-MS)[12]等, 其中针对SCFAs的方法研究较多, 而同时涵盖MCFAs和SCFAs的方法较少, 且LC-TQ-MS方法虽然检测灵敏度较高, 但复杂基质中目标化合物的准确鉴定仍然是主要挑战。由于脂肪酸挥发性较强, 在样品前处理过程中容易逸失, 会影响测定结果的准确性; SCFAs极性也较强, 在液相色谱柱上难保留或很难实现良好的分离, 目前常采用硅烷化、腙化等衍生化方法进行样品预处理, 以提高其准确度和分离度[13]。超高效液相色谱-串联四级杆飞行时间质谱(UHPLC-QTOF-MS/MS)具有快速、高分离效能, 以及高分辨率、灵敏度和准确度, 能对分析物进行准确鉴定, 可以实现复杂基质样品中分析物的同时定性和定量分析[14], 故更适合粪便样本中MCFAs和SCFAs的测定。因此, 本研究拟通过系统优化衍生化条件, 采用UHPLC-QTOF-MS/MS技术, 建立粪便内MCFAs和SCFAs的同时定性定量分析方法, 并用于评价抗生素处置前后小鼠粪便内MCFAs和SCFAs的变化, 考察抗生素对肠道菌群脂肪酸类代谢物的影响。
材料与方法仪器 AT201十万分之一电子天平(瑞士Mettler公司); Waters ACQUITY UPLCTM液相色谱仪、Waters SYNAPT G2-S Q-TOF质谱仪(美国Waters公司); Milli-Q型纯水器(美国Millipore公司); Sorvall™ Legend™ Micro 21R微量离心机(美国Thermo Fisher公司); KQ-500D型数控超声波清洗器(昆山市超声仪器有限公司)。
试剂与药品 甲醇(德国Merck公司); 甲酸(美国ROE Scientific INC公司); 超纯水(美国Millipore公司); 对照品甲酸、乙酸、丙酸、丁酸、异丁酸、戊酸、异戊酸、三甲基乙酸、己酸、2-甲基戊酸、4-甲基戊酸、庚酸、2-甲基己酸、乳酸、丙酮酸、甲基丙二酸、丁二酸(上海阿拉丁生化科技股份有限公司, 纯度均 > 98%); 3-硝基苯肼盐酸盐(3-nitrophenylhydrazine hydrochloride, 3-NPH·HCl) [梯希爱(上海)化成工业发展有限公司]; 吡啶、1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐[N-(3-dimethylaminopropyl)-N'-ethylcarbodiimide hydrochloride, EDC·HCl] (上海国药集团化学试剂有限公司); 万古霉素、亚胺培南-西司他丁钠、新霉素(大连美仑生物技术有限公司)。
实验动物 C57BL/6小鼠, SPF级, 雄性, 18~20 g, 购自扬州大学比较医学中心[合格证编号SCXK (苏) 2017-0007], 实验期间饲养环境温度为(22 ± 2) ℃, 湿度为(57 ± 2) %, 12 h明暗交替光照, 自由饮食。实验前适应性饲养1周。动物实验获得江苏省中医药研究院动物实验伦理委员会的批准[审查编号AEWC-20180725-41]。
小鼠联合抗生素处置方法
联合抗生素溶液的配制 万古霉素(500 mg·L-1)、亚胺培南-西司他丁钠(500 mg·L-1)和新霉素(1 g·L-1)水溶液, 双蒸水配制, 每隔1天配制一次[15]。
动物分组及喂养 将小鼠随机分为两组, 每组8只。对照组每天给予正常饮水, 实验组每天给予联合抗生素饮用水, 自由饮用, 实验周期持续3周。实验结束时收集小鼠新鲜粪便, 检测粪便内SCFAs和MCFAs的含量变化。
UHPLC-QTOF-MS/MS分析条件
色谱条件 色谱柱: Waters ACQUITY HSS T3 (2.1 mm×100 mm, 1.8 μm)色谱柱; 柱温: 35 ℃; 流动相: 0.01%甲酸溶液(A)-0.01%甲酸乙腈(B); 流速: 0.35 mL·min-1; 梯度洗脱: 0~2 min, 15% B; 2~10 min, 15%~30% B; 2~18 min, 30%~40% B; 18~23 min, 40%~55% B; 23~24 min, 55%~100% B; 24~27 min, 100% B; 27~28 min, 100%~15% B; 28~30 min, 15% B; 进样量5 μL。
质谱条件 电喷雾离子源, 负离子扫描模式; 毛细管电压2.5 kV; 锥孔电压40 V; 脱溶剂气温度400 ℃; 离子源温度110 ℃; 锥孔气流速50 L·h-1; 脱溶剂气流速900 L·h-1; 碰撞能为30~60 V; 质量扫描范围m/z 50~600 Da; 采用亮氨酸-脑啡肽(leucine-enkephaLin, ESI-: m/z 554.261 5)溶液为校正液。
混合对照品溶液的配制 对照品甲酸、乙酸、丙酸、丁酸、异丁酸、戊酸、异戊酸、三甲基乙酸、己酸、4-甲基戊酸、庚酸、2-甲基己酸、乳酸、丙酮酸、甲基丙二酸、丁二酸分别用60%乙腈配制为1 mol·L-1, 倍半稀释至10 mmol·L-1, 移取该浓度对照品溶液各50 μL混合, 60%乙腈定容至10 mL, 得50 μmol·L-1混合对照品溶液。
衍生化试剂的配制[16] 200 mmol·L-1 3-NPH·HCl:称取37.92 mg 3-NPH·HCl用1 mL 60%乙腈溶解, 现用现配。600 mmol·L-1 EDC·HCl和7.5%吡啶溶液适量混合, 混合后浓度分别为120 mmol·L-1 EDC·HCl和6%吡啶。
衍生化条件的优化 单因素考察不同乙腈浓度(30%、40%、50%、60%和70%)、不同3-NPH用量(5、10、20、40和80 μL)、不同EDC浓度(20、70、120、170和220 mmol·L-1)、不同吡啶浓度(4%、5%、6%、7%和8%)、不同反应温度(20、30、40、50和60 ℃)及反应时间(10、20、30、40和50 min)对衍生化效率的影响。
内标溶液的配制 吸取1 mmol·L-1的2-甲基戊酸200 μL与200 mmol·L-1 3-NPH·HCl 100 μL和120 mmol·L-1 EDC·HCl-6%吡啶溶液100 μL混合, 30 ℃水浴30 min, 立即冷却1 min, 最后用10%乙腈定容至10 mL, 即得。
粪便样品衍生化供试液的制备 称取粪便(湿重) 20 mg, 加入60%乙腈200 μL, 涡旋3 min, 成均质混悬液, 14 000 ×g、4 ℃离心10 min, 取上清, 即得粪便样品溶液。取粪便样品溶液40 μL与200 mmol·L-1 3-NPH·HCl溶液20 μL混合, 随后向上述溶液中加入120 mmol·L-1 EDC·HCl-6%吡啶溶液20 μL的混合溶液, 30 ℃水浴30 min, 立即冷却1 min, 10%乙腈定容至2 mL, 14 000 ×g离心10 min, 移取上清, 即得粪便样品衍生化溶液。进样分析前, 内标50 μL与衍生化溶液950 μL混合, 即得供试液。
粪便内中短链脂肪酸的定性分析方法 通过对照品化合物的分子式、精确质量数、相对保留时间、质谱裂解情况以及其腙化物的相应数据对MCFAs和SCFAs衍生化产物进行指认鉴定。
粪便内中短链脂肪酸的定量分析方法学验证
线性、检测限、定量限 精密吸取50 μmol·L-1混合对照品的溶液适量, 稀释为25、12.5、6.25、3.13和1.56 μmol·L-1以及781.25、390.63、195.31、97.66、48.83、24.41、12.21和6.10 nmol·L-1的对照品溶液。按最佳衍生化反应条件反应, 精密吸取与内标混合后的对照品溶液各5 μL, 注入UPLC-QTOF-MS/MS, 全扫描模式检测, 计算峰面积。以各脂肪酸与内标浓度之比为横坐标(X), 峰面积之比为纵坐标(Y), 绘制标准曲线, 得回归方程。以信噪比(signal-to-noise ratio, S/N) 3:1及10:1时注入仪器的浓度确定检测限(limit of detection, LOD)和定量限(limit of quantification, LOQ)。
精密度 按最佳反应条件制备粪便供试品溶液, 连续进样6次, 测定峰面积, 得日内精密度, 以相对标准偏差RSD表示。将上述供试品溶液连续3天进样, 每天2针, 测定峰面积, 得日间精密度, 以相对标准偏差RSD表示。
稳定性 按最佳反应条件制备粪便供试品溶液, 分别于0、2、8、10、18、24和36 h测定, 测定峰面积, 以相对标准偏差RSD表示。
重复性 按最佳反应条件制备粪便供试品溶液6份, 测定峰面积, 以相对标准偏差RSD表示。
加样回收率 取粪便溶液20 μL, 分别加入相应量50%、100%、150%的对照品, 按最佳反应条件制备粪便供试品溶液, 测定峰面积, 计算加样回收率, 以相对标准偏差RSD表示。
样品分析方法 吸取供试品溶液5 μL进样, 记录内标及各衍生物峰面积, 将衍生物与内标的峰面积比代入回归方程计算中短链脂肪酸的含量。
数据处理 数据应用GraphPad Prism 6软件进行统计分析。实验数据以均数±标准差(x± s)表示, 两组间比较采用t检验。
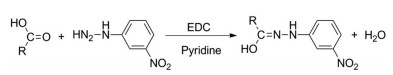
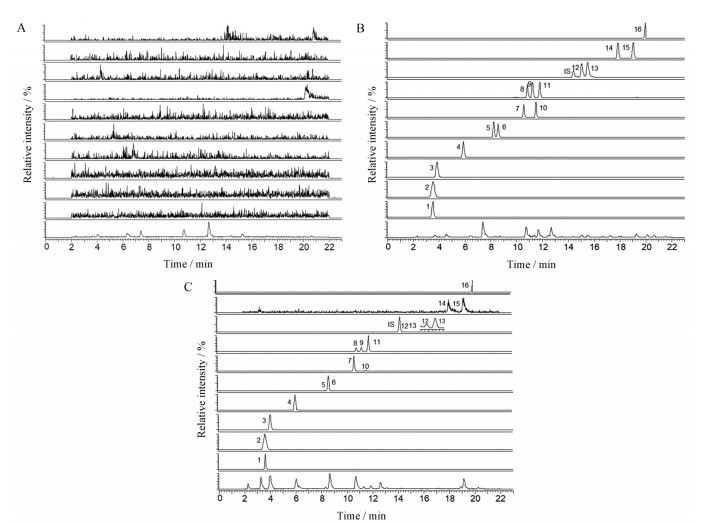
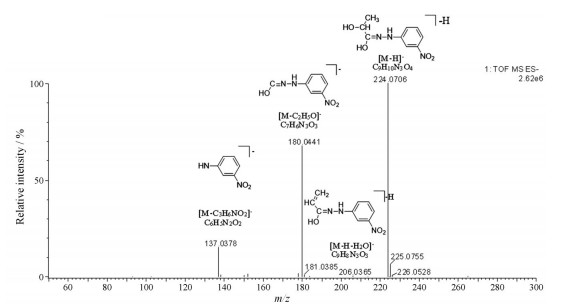
结果 1 样品中MCFAs和SCFAs的定性分析MCFAs和SCFAs中羧基和3-NPH中的氨基在EDC和吡啶催化下发生加成反应, 生成苯腙类衍生物(路线1)。对照品和样品的总离子流图见图 1。该类脂肪酸衍生物在负离子条件下生成准分子离子[M-H]-, 在高能量条件下, 产生m/z 137 ([C6H5N2O2]-)和180 ([C7H6N3O3]-)特征碎片离子峰, 同时也可能脱水产生[M-H-H2O]-的特征离子峰, 以乳酸为例, 其裂解规律见图 2。根据对照品裂解规律及保留时间, 对小鼠粪便样品中16个MCFAs和SCFAs进行鉴定, 分别是乳酸、甲酸、乙酸、丙酸、异丁酸、丁酸、丁二酸、三甲基乙酸、异戊酸、甲基丙二酸、戊酸、4-甲基戊酸、己酸、2-甲基己酸、庚酸、丙酮酸(表 1)。
|
Scheme 1 Chemical reaction for the derivatization of 3-nitrophenylhydrazine (3-NPH) with medium-chain fatty acids (MCFAs) and short-chain fatty acids (SCFAs) |
|
图 1 BPI chromatograms and extraction ion chromatograms of blank (A), reference (B) and sample (C). 1: Lactate; 2: Formate; 3: Acetate; 4: Propionate; 5: Isobutyrate; 6: Butyrate; 7: Succinate; 8: Pivalate; 9: Isovalerate; 10: Methylmalonate; 11: Valerate; 12: 4-Methylvalerate; 13: Hexanoate; 14: 2-Methylhexanoate; 15: Heptanoate; 16: Pyruvate; Internal standard (IS): 2-Methylvalerate |
|
图 2 Product ion mass spectra of 3-NPH derivative of lactate |
| 表 1 Qualitative characterization of MCFAs and SCFAs by UHPLC-QTOF-MS/MS |
乙腈浓度在60%时甲酸、甲基丙二酸响应最强, 而对其他化合物响应影响不明显; 3-NPH用量为20 μL时大部分化合物尤其是甲酸响应达最大值; EDC浓度在120 mmol·L-1时各化合物响应均达到峰值并趋于平稳; 吡啶浓度对各化合物的准分子离子峰响应差别不明显, 以中间浓度6%作为反应浓度; 反应温度为30 ℃时大部分化合物响应达到最大值; 反应时间对化合物响应影响不明显, 以30 min为反应时间。结果见图 3。

|
图 3 Effect of different factors on the peak response of each analyte |
各对照品峰面积与浓度线性关系良好(R2 > 0.99)。日内日间精密度RSD均小于10%, 表明方法精密度良好。重复性实验结果表明, 峰面积RSD均小于6%, 且在36 h内RSD均小于7%, 表明方法重复性和稳定性良好。加样回收率介于80%~120%之间, 表明方法准确度良好。结果见表 2和表 3。
| 表 2 Regression equation, correlation coefficient, linear range, limit of detection, and limit of quantification of MCFAs and SCFAs |
| 表 3 Stability, repeatability, precision, and recovery of MCFAs and SCFAs. n = 6, x± s |
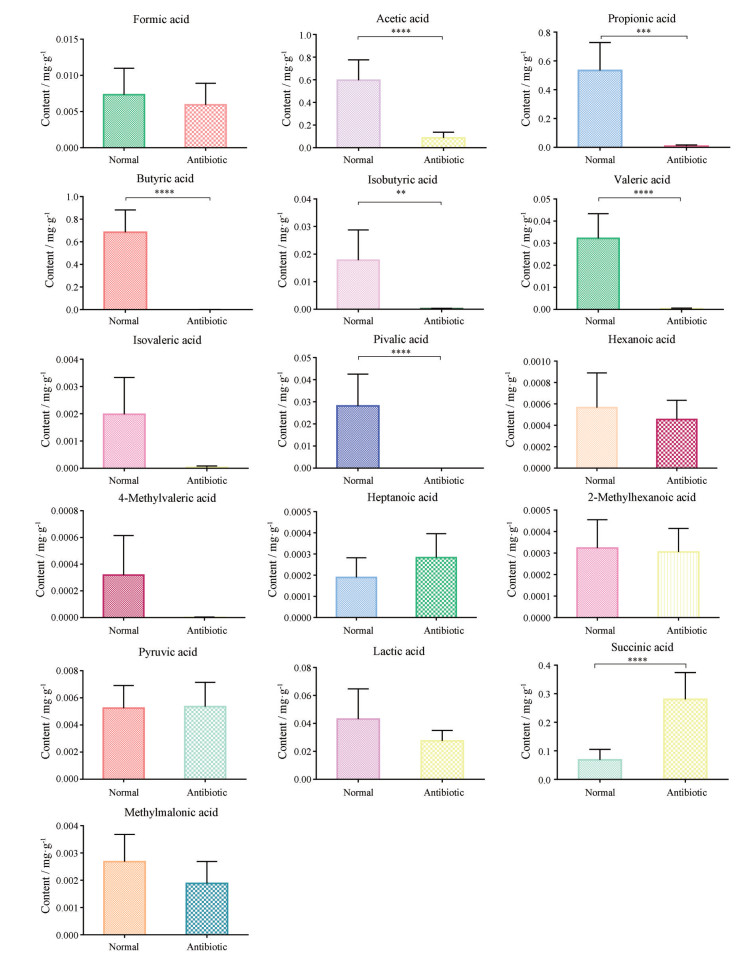
采用建立的方法测定了抗生素处理前后小鼠粪便内MCFAs和SCFAs的含量, 结果如图 4, 5。由图可知, 抗生素处理组中MCFAs和SCFAs总含量明显低于正常组, 其中乙酸、丙酸、丁酸、异丁酸、戊酸、三甲基乙酸水平显著性降低, 甲酸、异戊酸、己酸、4-甲基戊酸、乳酸、甲基丙二酸略有降低; 但庚酸和丁二酸的含量经抗生素处理后明显增加。
|
图 4 Contents of individual SCFAs and MCFAs in mouse feces. n = 6, x± s. **P < 0.01, ***P < 0.001, ****P < 0.000 1 vs Normal |

|
图 5 Total contents of SCFAs and MCFAs in mouse feces |
本文建立了柱前衍生化UHPLC-QTOF-MS/MS法表征小鼠粪便内MCFAs和SCFAs的方法, 相比于已有的LC-TQ-MS方法, LC-QTOF-MS优势在于其高分辨率可以做到对分析物的准确定性; 同时通过对质谱参数的优化, 获得较理想的检测灵敏度, 加之与UHPLC联用, 最终实现对分析样品的同时高效、准确的定性和定量。
柱前衍生化反应条件优化是脂肪酸定量分析的关键因素。本实验曾比较了不同的衍生化试剂, 包括3-硝基苯肼盐酸盐、4-硝基苯肼(4-NPH)、2, 4-二硝基苯肼(2, 4-NPH)、2-硝基苯肼(2-NPH)、2-硝基苯肼盐酸盐(2-NPH·HCl)、1- (2-嘧啶基)哌嗪(PP)、2-硝基苯胺(2-NAL), 发现3-NPH·HCl为最佳衍生化试剂。以峰面积为指标, 对衍生化试剂浓度、催化剂浓度、反应温度、反应时间等进行单因素考察, 得到最优衍生化反应条件; 通过对色谱和质谱的条件优化, 在20 min内实现了各MCFAs和SCFAs的有效分离; 同时对其线性、精密度、稳定性、重复性、加样回收率等进行考察, 验证了定量方法准确可靠。
本方法成功应用于对抗生素处理小鼠粪便内MCFAs和SCFAs的定性和定量表征, 发现使用抗生素后MCFAs和SCFAs含量均发生变化。显然, 这些MCFAs和SCFAs水平的改变与肠道菌群有关, 这两者之间具体的对应关系还有待与菌群多样性等研究结果结合加以阐释。
| [1] |
Schonfeld P, Wojtczak L. Short-and medium-chain fatty acids in energy metabolism:the cellular perspective[J]. J Lipid Res, 2016, 57: 943-954. DOI:10.1194/jlr.R067629 |
| [2] |
Chambers ES, Morrison DJ, Frost G. Control of appetite and energy intake by SCFA:what are the potential underlying mechanisms[J]. Proc Nutr Soc, 2015, 74: 328-336. DOI:10.1017/S0029665114001657 |
| [3] |
Shao YJ, Shen H, Xu JD, et al. Advance in determination of short-chain fatty acids of gut bacterial metabolites in feces[J]. Chin J Pharm Anal (药物分析杂志), 2019, 39: 967-974. |
| [4] |
Tan J, Mckenzie C, Potamitis M, et al. The role of short-chain fatty acids in health and disease[J]. Adv Immunol, 2014, 121: 91-119. DOI:10.1016/B978-0-12-800100-4.00003-9 |
| [5] |
De Preter V, Machiels K, Joossens M, et al. Faecal metabolite profiling identifies medium-chain fatty acids as discriminating compounds in IBD[J]. Gut, 2015, 64: 447-458. DOI:10.1136/gutjnl-2013-306423 |
| [6] |
Zentek J, Ferrara F, Pieper R, et al. Effects of dietary combinations of organic acids and medium chain fatty acids on the gastrointestinal microbial ecology and bacterial metabolites in the digestive tract of weaning piglets[J]. J Anim Sci, 2013, 91: 3200-3210. DOI:10.2527/jas.2012-5673 |
| [7] |
Lee SI, Kang KS. Function of capric acid in cyclophosphamide-induced intestinal inflammation, oxidative stress, and barrier function in pigs[J]. Sci Rep, 2017, 7: 16530. DOI:10.1038/s41598-017-16561-5 |
| [8] |
Liu Y, Zhang Y, Zhang X, et al. Medium-chain fatty acids reduce serum cholesterol by regulating the metabolism of bile acid in C57BL/6J mice[J]. Food Funct, 2017, 8: 291-298. DOI:10.1039/C6FO01207H |
| [9] |
Lotti C, Rubert J, Fava F, et al. Development of a fast and cost-effective gas chromatography-mass spectrometry method for the quantification of short-chain and medium-chain fatty acids in human biofluids[J]. Anal Bioanal Chem, 2017, 409: 5555-5567. DOI:10.1007/s00216-017-0493-5 |
| [10] |
Zhang S, Wang H, Zhu MJ. A sensitive GC/MS detection method for analyzing microbial metabolites short chain fatty acids in fecal and serum samples[J]. Talanta, 2019, 196: 249-254. DOI:10.1016/j.talanta.2018.12.049 |
| [11] |
He L, Prodhan M, Yuan F, et al. Simultaneous quantification of straight-chain and branched-chain short chain fatty acids by gas chromatography mass spectrometry[J]. J Chromatogr B, 2018, 1092: 359-367. DOI:10.1016/j.jchromb.2018.06.028 |
| [12] |
Jiang R, Jiao Y, Zhang P, et al. Twin derivatization strategy for high-coverage quantification of free fatty acids by liquid chromatography-tandem mass spectrometry[J]. Anal Chem, 2017, 89: 12223-12230. DOI:10.1021/acs.analchem.7b03020 |
| [13] |
Liu M, Wei F, Xie Y, et al. Progress on analysis of free fatty acids by chromatography-mass spectrometry based on chemical derivatization[J]. J Instrum Anal (分析测试学报), 2017, 36: 1269-1278. |
| [14] |
Zou YT, Xu JD, Long F, et al. Evaluation of chemical consistency of triterpene acids in ethanol extracts of Poria and acetic ether extracts thereof by UPLC-QTOF-MS/MS with full scan and mimic MRM mode[J]. Acta Pharm Sin (药学学报), 2019, 54: 130-137. |
| [15] |
Iida N, Dzutsev A, Stewart CA, et al. Commensal bacteria control cancer response to therapy by modulating the tumor microenvironment[J]. Science, 2013, 342: 967-970. DOI:10.1126/science.1240527 |
| [16] |
Jin YY, Shi ZQ, Chang WQ, et al. A chemical derivatization based UHPLC-LTQ-Orbitrap mass spectrometry method for accurate quantification of short-chain fatty acids in bronchoalveolar lavage fluid of asthma mice[J]. J Pharm Biomed Anal, 2018, 161: 336-343. DOI:10.1016/j.jpba.2018.08.057 |
 2020, Vol. 55
2020, Vol. 55


