兽药广泛用于动物养殖过程中, 规范使用兽药可有效减少动物病患, 但若违规超量超范围使用兽药, 将对食品药品安全带来风险。目前, 动物源性食品中兽药残留带来的安全风险已成为共识, 政府及社会给予的重视程度较高。但动物源性中药材, 在动物养殖过程中滥用兽药的情况同样存在, 针对此类基质的检测方法研究及限量规定目前仍为空白, 急需引起关注和加深研究, 从源头进行有效控制。
熊胆粉为熊胆汁的干燥品。在黑熊胆囊手术引流胆汁过程中, 需使用塞拉嗪等镇静剂、青霉素等抗生素; 术后恢复过程使用氧氟沙星等抗生素。另外, 对某基地的黑熊喂养饲料进行检测, 检出土霉素、四环素、喹乙醇等兽药。因此有必要对熊胆粉的多种兽药残留进行监控。
针对动物源性食品的兽药残留检测研究较多, 相关国标(GB/T 22338-2008、GB/T 21317-2007、GB/T 21312-2007等)多按化合物类别分别检测; 文献[1-8]方法大多研究多种兽药残留的快速测定方法。文献报道的食品中兽药残留检测的前处理方法有液液萃取法[1]、载体辅助液液萃取法[2]、固相萃取法[3, 4]、QuEChERS法[5, 6]等, 检测技术有高效液相色谱法[7]、高效液相色谱串联三重四极杆质谱法[5, 6]、高效液相色谱串联四极杆飞行时间质谱法[8]、高效液相色谱串联三重四极杆线性离子阱质谱法[9]、高效液相色谱串联四极杆静电场轨道阱质谱法[10]等。
动物类中药材基质复杂, 多为干物质, 药效成分多, 不易净化, 较食品检测更为困难。本文研究对象熊胆粉, 牛磺熊去氧胆酸和牛磺鹅去氧胆酸等胆汁酸占44%~61%[11], 与多数弱酸性小分子药物化学结构有相似性, 因去除困难而对检测带来较强干扰; 其他成分还包括胆红素、蛋白质、氨基酸和微量元素等, 是基质非常复杂特殊的动物类中药材。因此需根据中药材的特殊性质, 针对性地研究开发与食品不同的前处理方法和检测条件。
根据农业部235号公告[12]及相关国标, 结合市场调研以及实际样品中的检测情况, 本文采用QuEChERS法对熊胆粉样品进行前处理, 以超高效液相色谱串联三重四极杆质谱法定性测定熊胆粉药材中的兽药残留共检测169种兽药, 主要包括: β-受体激动剂与拮抗剂、抗生素(青霉素类、头孢菌素类、磺胺类、喹诺酮类、氯霉素类、四环素类、硝基咪唑类、大环内酯类、聚醚类等)、抗病毒药、驱虫药(苯并咪唑类等)、甾体激素、非甾体抗炎药和镇静剂。
材料与方法仪器与试剂 Agilent 1290/6495超高效液相色谱串联三重四极杆质谱仪(美国Agilent公司), N-EVAPTM 112型氮吹仪(美国Organomation公司); IKA KS260C振荡器和IKA MS 2涡旋混合器(德国IKA公司)。
兽药对照品:青霉素G采购自中国食品药品检定研究院, 其余167种购自A Chemtek公司, 见表 1; 乙腈、甲醇、乙酸均为色谱纯(美国MERCK公司); 醋酸, 分析纯(中国医药集团上海化学试剂公司); 甲酸、甲酸铵、氟化铵, 色谱纯(美国Sigma-Aldrich公司); 吸附剂: N-丙基乙二胺(PSA)、石墨化炭黑(GCB)、十八烷基键合硅胶(C18)、硫酸镁均购于天津博纳艾杰尔科技有限公司。实际样品由上海凯宝药业股份有限公司购自其熊胆粉药材供货商。
| 表 1 Information of the 169 reference compounds and LODs. a: Methanol; b: Acetonitrile; c: 25% Acetonitrile; d: 1% Formic acid-methanol; e: Methanol-dichloromethane (4:1); f: Methanol-water-acetonitrile (7:2:1); g: Acetonitrile-methanol (1:1); h: 1% Formic acid-acetonitrile |
色谱和质谱条件 Agilent Zorbax Eclipse plus C18 (3.0 mm×150 mm, 1.8 μm)为色谱柱, 以0.2%甲酸(含5 mmol·L-1甲酸铵和0.5 mmol·L-1氟化铵)溶液为流动相A, 以0.2%甲酸乙腈溶液为流动相B, 梯度洗脱程序: 0~0.5 min, 2% B; 0.5~1.8 min, 2% B~15% B; 1.8~3.5 min, 15% B~20% B; 3.5~6 min, 20% B~25% B; 6~7 min, 25% B~30% B; 7~11 min, 30% B~35% B; 11~16 min, 35% B~100% B; 16~26 min, 100% B。柱温40 ℃, 流速0.5 mL·min-1, 进样量1 μL。
离子源:电喷雾离子(ESI)源; 离子源温度: 200 ℃; 毛细管电压: 4 kV; 干燥气流量: 12 L·min-1; 雾化气压力: 25 psi (1 psi≈6.9 kPa); 鞘气温度: 250 ℃; 鞘气流量: 10 L·min-1; 喷嘴电压: 500 V; 采用多反应监测(MRM)方式检测。各化合物质谱参数见表 2。
| 表 2 MS parameters of the 169 veterinary drugs |
标准溶液制备方法 对照品储备溶液(100 μg·mL-1):精密称取各对照品适量, 根据溶解性, 加适宜溶剂(表 1)制成每1 mL含100 μg的溶液, 即得。
混合对照品溶液(1 μg·mL-1):精密量取对照品储备溶液(100 μg·mL-1)适量, 用15%乙腈制成每mL含1 μg的溶液, 即得。
基质混合对照品溶液的制备:取空白熊胆粉样品(未检出上述169种兽药残留)适量, 研细, 混匀, 取约0.1 g, 精密称定, 置于50 mL聚苯乙烯具塞离心管中, 精密加入混合对照品溶液(1 μg·mL-1) 100 μL, 同供试品溶液的制备方法处理, 即得。
供试品溶液制备方法 取熊胆粉样品适量, 研细, 混匀, 取约0.1 g, 精密称定, 置于50 mL聚苯乙烯具塞离心管中, 加0.1 mol·L-1 Na2EDTA-McIlvaine缓冲液(称取2.9 g柠檬酸一水合物、10.9 g磷酸氢二钠十二水合物、37.2 g乙二胺四乙酸二钠二水合物, 加水至900 mL, 用1 mol·L-1氢氧化钠溶液调至pH 4.0, 用水定容至1 L) 10 mL, 摇匀, 涡旋使充分浸润。精密加入5%冰醋酸乙腈10 mL, 涡旋使混匀, 置振荡器上剧烈振荡(500次·min-1) 10 min。加入无水氯化钠-硫酸钠(1:4)混合粉末5 g, 再置振荡器上剧烈振荡(500次·min-1) 3 min, 离心5 min, 使分层。吸取上清液6 mL, 置已预先装有净化材料的分散固相萃取净化管[硫酸镁300 mg, 十八烷基硅烷键合硅胶300 mg, N-丙基乙二胺(PSA) 1 800 mg]中, 涡旋使充分混匀, 再置振荡器上剧烈振荡(500次·min-1) 5 min使净化完全, 离心5 min, 精密吸取上清液2 mL, 置氮吹仪上于40 ℃水浴浓缩至干, 精密加0.2 mL 15%乙腈, 涡旋1 min, 超声1 min, 混匀, 离心, 取上清液, 即得。
定性判定方法 供试品溶液若检出与对照品保留时间相同的色谱峰, 且所选择的离子丰度比与对照品溶液的离子丰度比一致(相对比例 > 50%, 允许±20%偏差; 相对比例20%~50%, 允许±25%偏差; 相对比例10%~20%, 允许±30%偏差; 相对比例 < 10%, 允许±50%偏差), 可判定具有该成分。
方法学验证专属性 取空白样品适量, 同供试品溶液的制备方法处理, 进样测定。
检出限 取熊胆粉空白样品适量, 研细, 混匀, 取约0.1 g, 一式7份, 精密称定, 置于50 mL聚苯乙烯具塞离心管中, 分别精密加入混合对照品溶液(100 ng·mL-1) 1、10、50、100、250、500和1 000 μL, 同供试品溶液的制备方法处理, 进样测定。采用目视评价法, 以真实最低检出浓度作为检出限。
重复性 在加样(1 000 μg·kg-1)水平进行重复性实验, 一式6份, 进样测定。
结果 1 方法学验证 1.1 专属性空白样品未检出上述兽药残留, 表明空白基质对测定无干扰。
1.2 检出限上述169种化合物检出限为1~1 000 μg·kg-1, 详见表 1。熊胆粉由熊胆汁干燥而得, 产率约10%。按农业部235号公告暂定熊胆汁中兽药残留限量, 并以产率折算至熊胆汁中, 本方法检出限能够满足定性筛查的需要。
1.3 重复性在加样(1 000 μg·kg-1)水平进行重复性实验, 一式6份, 均检出上述兽药。各化合物MRM色谱图见图 1。
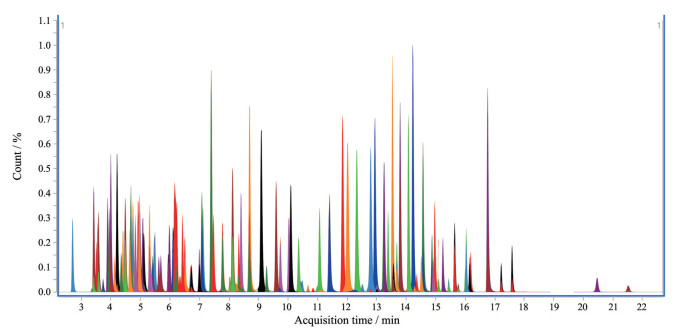
|
Figure 1 MRM chromatograms of the 169 veterinary drugs |
检测44批熊胆粉样品, 其中17批检出, 检出率38.6%, 共检出19种兽药残留, 具体情况见表 3。
| 表 3 The detection results of positive results |
其中, 由药材基地提供规范养殖的40批样品, 13批检出, 检出兽药种类少, 主要包括氧氟沙星、3-甲基喹噁啉-2-羧酸(喹乙醇代谢物)、阿苯达唑亚砜(阿苯达唑代谢物)、4-乙酰胺基安替比林(安替比林代谢物), 含量均较低。推测氧氟沙星为黑熊术后恢复用药, 喹乙醇为饲料带入。而购自市场的4批劣质药材, 均检出多种兽药残留, 且含量很高。可见中药材规范养殖或种植的必要性。
讨论目前, 多兽药残留同时测定的前处理方法主要包括EMR-Lipid固相萃取法和QuEChERS法。但EMR-Lipid固相萃取法对长链结构物质具较强吸附力, 能有效降低肉类等高脂肪食品的基质干扰[13], 但不适用于熊胆粉此类的以小分子成分占多数的中药材。
以能代表各类别结构类型的15种化合物作为指标, 考察优化QuEChERS法各步骤。①提取水相:考察NaOH溶液、Na2EDTA-McIlvaine缓冲液和1%醋酸溶液, 结果表明必须使用Na2EDTA-McIlvaine缓冲液方能将四环素类从水层提取出来; ②提取有机相:考察乙腈、5%醋酸乙腈溶液和15%醋酸乙腈溶液的提取效率, 结果表明, 多数化合物使用5%醋酸乙腈溶液的峰面积稍高; ③净化材料:因熊胆粉基质中胆汁酸含量较高, 且成分复杂, 考察PSA、PAX (强阴离子交换)、GCB (石墨化炭)等多种吸附材料及其比例, 最终确定硫酸镁、C18、PSA (1:1:6)作为吸附材料, 可最大程度的吸附酸性基质, 降低基质效应。
于流动相水相(0.2%甲酸溶液)中加入5 mmol·L-1甲酸铵, 可缓冲熊胆粉基质的酸性, 减少样品中部分化合物保留时间与对照品的差异; 加入0.5 mmol·L-1氟化铵可极大优化四环素类化合物的峰形。因此流动相水相最终确定为0.2%甲酸(含5 mmol·L-1甲酸铵和0.5 mmol·L-1氟化铵)溶液。
综上, 本研究采用QuEChERS前处理方法, 建立了超高效液相色谱串联质谱法定性筛查熊胆粉中169种兽药残留。本文方法为其他动物药材提供了借鉴思路。可以该方法为基础, 结合具体基质的特点, 从提取方法、净化技术、色谱条件等多个方面进行研究和优化, 以尽可能去除干扰和基质效应, 将方法扩展应用至不同基质中。比如, 本研究团队调整了净化填料, 已成功建立了山羊角中173种兽药残留的定性筛查方法, 以及药用辅料炼蜜和含炼蜜的中成药中41种兽药残留的定性筛查方法。
由于基质的复杂性, 同时建立近两百种化合物的定量测定方法较为困难, 部分化合物回收率较低。未来将在定性筛查并初步定量的基础上, 进行安全风险评估, 针对安全风险较高的兽药品种(如熊胆粉中氧氟沙星、甲硝唑、安替比林和喹乙醇等)建立专属性定量检测方法, 并制定合理限度, 用标准倒逼源头养殖的规范化, 全面控制动物源性中药材的安全性风险。
| [1] |
Zhan J, Zhong Y, Yu X, et al. Multi-class method for determination of veterinary drug residues and other contaminants in infant formula by ultra performance liquid chromatography-tandem mass spectrometry[J]. Food Chem, 2013, 138: 827-834. DOI:10.1016/j.foodchem.2012.09.130 |
| [2] |
Li S, Chen SB, Li LQ, et al. System of simultaneous extraction and cleaning of 99 veterinary drugs in food[J]. Chin J Chromatogr (色谱), 2018, 36: 506-517. |
| [3] |
Wang JQ, Ma LL, Cao YH, et al. UPLC-MS/MS high-throughput detection of 56 veterinary drug residues in food products of animal origin[J]. Chin J Anal Lab (分析实验室), 2018, 37: 306-310. |
| [4] |
Hao J, Jiang J, Yu JL, et al. Simultaneous determination of multi-veterinary drug residues in animal-origin food by solid phase extraction coupled with ultra performance liquid chromatography-tandem mass spectrometry[J]. Food Sci (食品科学), 2017, 38: 266-272. |
| [5] |
Fang CR, Gao J, Wang YX, et al. Determination of 125 veterinary drugs residues in eggs by QuEChERS-ultra-high performance liquid chromatography-tandem mass spectrometry[J]. Chin J Chromatogr (色谱), 2018, 36: 1119-1131. DOI:10.3724/SP.J.1123.2018.06007 |
| [6] |
Qin L, Dong YL, Wang GL, et al. Determination of 42 veterinary drug residues in common animal derived food by dispersive solid phase extraction coupled with liquid chromatography-tandem mass spectrometry[J]. Chin J Chromatogr (色谱), 2018, 36: 880-888. DOI:10.3724/SP.J.1123.2018.04024 |
| [7] |
Li D, Wang HJ, Zhang YJ, et al. Determination of quinolones residues in egg by QuEChERS and high performance liquid chromatography-fluorescence detection[J]. J Food Saf Qual (食品安全质量检测学报), 2018, 9: 4916-4920. |
| [8] |
Song W, Zhao MY, Han F, et al. Determination of 39 veterinary drug residues in procambarusclarkii by ultra-high performance liquid chromatography-quadrupole-time of flight mass spectrometry[J]. Chin J Chromatogr (色谱), 2018, 36: 1261-1268. DOI:10.3724/SP.J.1123.2018.08037 |
| [9] |
Xue H, Jin Y, Yu YL. Simultaneous determination of 33 veterinary drugs in pork by ultra performance liquid chromatography-tandem tripe-quadrupole linear ion trap mass spectrometry[J]. J Anal Sci (分析科学学报), 2018, 34: 387-392. DOI:10.2116/analsci.34.387 |
| [10] |
Li R, Yang LQ, Zhang PY, et al. Determination of 64 veterinary drug residues in aquatic products by ultra-high performance liquid chromatography-quadrupole/electrostatic field orbitrap high-resolution mass spectrometry[J]. Chin J Chromatogr (色谱), 2017, 35: 1266-1275. DOI:10.3724/SP.J.1123.2017.08021 |
| [11] |
Wang J, Xiong AZ, Cheng RR, et al. Systematical analysis of multiple components in drainage bear bile powder from different sources[J]. China J Chin Mater Med (中国中药杂志), 2018, 43: 2326-2332. |
| [12] |
Ministry of Agriculture. No. 235 Bulletin of the Ministry of Agriculture of the People's Republic of China[EB/OL]. 2002[2019-08-20]. http://www.moa.gov.cn/govpublic/SYJ/201006/t20100606_1535491.htm.
|
| [13] |
Huang ZW, Min YH, Du G, et al. Rapid screening and confirmation of 55 kinds of veterinary drug residues in pork by QuEChERS EMR-Lipid technology and LC/MS/MS[J]. Sci Technol Food Ind (食品工业科技), 2019, 40: 270-276. |
 2020, Vol. 55
2020, Vol. 55


