2. 中国医学科学院、北京协和医学院医药生物技术研究所, 北京 100050
2. Institute of Medicinal Biotechnology, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100050, China
黄皮[Clausena lansium (Lour.) Skeels]为芸香科(Rutaceae)黄皮属(Clausena)植物, 原产于我国南部, 现在两广地区广泛栽培, 资源非常丰富, 是一种果树兼作药用植物。其根、叶、果均可入药, 现代药理研究表明黄皮具有神经保护、抗菌、保肝等多种作用[1]。本课题组前期研究从黄皮茎枝中分离得到多个具有显著神经保护作用的咔唑生物碱[2, 3], 因此, 为了近一步寻找生物活性较好的咔唑生物碱类成分, 对黄皮茎枝95%乙醇提取物的95%乙醇洗脱部位进行化学成分及生物活性研究, 以期丰富其物质基础研究、阐明其活性成分、促进黄皮资源的有效利用和开发。运用硅胶、HPD100、PRP512A大孔树脂及制备高效液相色谱等方法从中分离得到1个化合物, 并通过UV、IR、HR-ESI-MS、1D/2D NMR及ECD等方法鉴定为Claulamine F (1)。其中化合物1为新的咔唑生物碱类化合物。对化合物1进行肿瘤细胞毒活性测试, 发现其对人大细胞肺癌细胞H460、人肝癌细胞H7402、人结肠癌细胞HCT-8、人宫颈癌细胞HeLa以及人乳腺癌细胞MCF-7没有明显细胞毒活性(IC50 > 10 μmol)。另外还对其进行了抗菌活性测定, 遗憾的是, 该化合物对金葡菌(Staphylococcus aureus)、大肠埃希菌(Escherichia coli)和绿脓杆菌(Pseudomonas aeruginosa)未显示显著活性(IC50 > 10 μmol)。
结果与讨论化合物1白色无定形粉末(甲醇)。[α]D20 36.5 (c 0.02, MeOH)。HR-ESI-MS m/z: 364.151 55 [M+Na]+(计算值: 364.151 93), 确定分子式为C20H23O4N, 不饱和度为10。红外光谱显示其结构中存在羟基(3 353 cm-1)、双键(1 674 cm-1)、醚键(1 079 cm-1)等特征基团信号峰。
化合物1的1H NMR (500 MHz, DMSO-d6)显示, NH活泼氢信号δH 11.24 (1H, brs), 2个连氧甲基单峰信号δH 3.48 (3H, s, 6′-OCH3)、3.91 (3H, s, 1-OCH3), 低场区显示一组AA′BB′芳香氢信号[δH 8.06 (1H, d, J = 7.5 Hz, H-5)、7.12 (1H, t, J = 7.5 Hz, H-6)、7.36 (1H, t, J = 7.5 Hz, H-7)、7.46 (1H, d, J = 7.5 Hz, H-8)]和一个单峰芳香氢信号δH 7.74 (1H, s, H-4) (表1), 提示其结构内含有2个不同取代芳香环, 此外还显示2个连氧氢信号δH 3.75 (1H, dd, J = 11.5, 2.5 Hz, H-2′)、δH 5.69 (1H, s, H-6′)和与H-2′相互偶合的仲碳质子信号δH 2.98 (2H, dd, J = 12.5, 2.5 Hz, H-1′a)、δH 2.68 (1H, dd, J = 12.5, 11.5 Hz, H-1′b) (表 1)。以上信息提示化合物1属于咔唑生物碱结构骨架。
| 表 1 NMR data of compound 1.1H NMR (500 MHz), 13C NMR (125 MHz) in DMSO-d6, J in Hz |
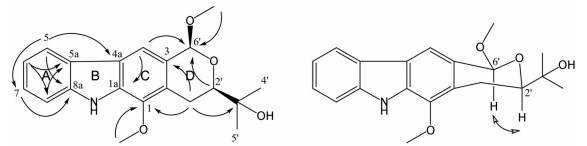
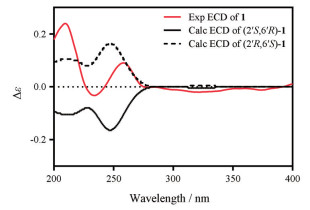
结合HSQC谱图, 完成对碳氢信号的准确归属(表 1)。13C NMR (125 MHz, DMSO-d6)给出了20个碳信号, 包括12个芳香碳信号、2个甲氧基碳信号、3个连氧碳信号和3个其余高场区碳信号。HMBC图谱显示H-5与C-4a、C-7 (δC 126.0)、C-8a (δC 140.6)相关, H-6与C-5a (δC 123.1)、C-8 (δC 111.6)相关, H-7与C-8a (δC 140.6)相关, H-8与C-5a (δC 123.1)相关, 提示A环无取代; H-4与C-1a (δC 132.6)相关, 1-OCH3与C-1 (δC 142.0)相关(图 1), 提示C环仅在2位无取代, 1-OCH3连接在C-1上, 这些特征信息构建了咔唑生物碱基本母核及取代情况。结合化合物1的不饱和度, 推断该化合物结构中应还含有另一个(D)环。HMBC谱显示H-4与C-6′相关, 表明C-6′连在咔唑母核的C-3位。从HMBC谱中可观察到H2-1′ (δH 2.98, dd, J = 12.5, 2.5 Hz; δH 2.68, dd, J = 12.5, 11.5 Hz)与C-1、C-3、C-3′相关, H3-4′、H3-5′与C-2′相关(图 1), 表明一个被还原的异戊烯基单位(C-1′到C-5′)连在了咔唑母核的C-2位。H-2′ (δH 3.75, dd, J = 11.5, 2.5 Hz)与C-6′远程相关, 结合C-2′ (δC 73.1)和缩酮碳C-6′ (δC 99.1)的化学位移, 表明C-2′与C-6′通过一个氧原子形成一个六元环。此外, 6′-OCH3与C-6′相关, 说明甲氧基位于C-6′位。因此, 化合物1的平面结构见图 1, 其相对构型是通过NOESY确定的。在NOESY图谱中, 可以观察到H-2′与H-6′的远程相关, 提示H-2′及H-6′处于同一平面的同侧。采用基于含时密度泛函理论(TD-DFT)[4-6], 运用Gaussian 09软件进行计算CD法, 2′R, 6′S-1的计算ECD曲线与化合物1的实验ECD曲线基本一致, 因此确定化合物1的绝对构型为2′R, 6′S (图 2)。通过以上分析最终可确定化合物1的结构(图 1), 命名为Claulamine F (1)。
|
Figure 1 Structure and key HMBC (left) and NOESY (right) correlations of compound 1 |
|
Figure 2 Experimental ECD spectra of 1 in MeOH and the calculated ECD spectra of 2′S, 6′R-1 and 2′R, 6′S-1 at the B3LYP/6-311+G(d, p) level |
紫外可见分光光度仪(JASCO V-650型); 旋光测定仪(JASCO P-2000型, 日本); 红外光谱仪(Nicolet impact 5700型傅里叶变换红外光谱仪); 核磁共振仪(BRUKER-500核磁共振仪, 以TMS信号作为参照); 质谱仪(Agilent 1100 series LC/MSD型); 高效液相色谱仪(Agilent 1100型高效液相色谱仪); 制备/半制备色谱柱(YMC-pack, ODS-A, 250 mm×20 mm); 100~200目硅胶, 硅胶H (青岛胜海化工厂); PRP-512A树脂(北京聚福树脂厂); 薄层硅胶板GF254 (青岛海洋化工厂); 分析纯试剂(北京化工厂); 色谱纯试剂(Dikma为美国Tedia公司生产; Fisher为美国Fisher公司生产)。
药材于2016年10月采自广西省柳州, 由柳州林业局工程师龙光日鉴定为芸香科(Rutaceae)黄皮属(Clausena)植物黄皮Clausena lansium (Lour.) Skeels的干燥茎枝。
1 提取与分离干燥的黄皮茎枝175 kg, 粉碎后用95%乙醇(1 400 L)回流提取2次, 每次2 h。减压回收溶剂后所得到的浸膏5.9 kg拌样于HPD100大孔树脂柱上, (1 000 mm×200 mm), 依次用水、30%乙醇、60%乙醇、80%乙醇、95%乙醇洗脱, 弃去水部分, 减压浓缩各个部分, 得30%乙醇部分(2.83 kg)、60%乙醇部分(1.18 kg)、80%乙醇部分(1.4 kg)和95%乙醇部分(0.6 kg)。95%乙醇部分(600 g)通过硅胶柱(100~200目)分离, 依次用石油醚-乙酸乙酯(20:1-9:1-4:1-1:1-0:1)梯度洗脱, 减压回收溶剂, 得到6个部分(Fr A-F)。Fr E部分(60 g)经PRP512A大孔树脂柱色谱, 依次用60%乙醇、75%乙醇、85%乙醇、95%乙醇梯度洗脱, 得到4个亚组分(Fr EP1~Fr EP4)。Fr EP3部分(10 g)通过硅胶H柱分离, 二氯甲烷-乙酸乙酯(20:1-9:1)梯度洗脱, 得到10个亚组分(Fr EP3.1~Fr EP3.10)。Fr EP3.2部分(276 mg)通过制备液相色谱(YMC, ODS-A, 200 mm×2 500 mm)分离, 以甲醇-水(75:25)等度洗脱, 得化合物1 (15 mg)。
2 结构鉴定化合物1 白色无定形粉末(MeOH)。[α]D20 36.5 (c 0.02, MeOH); UV (MeOH) λmax (log ε)/nm: 202 (1.86), 216 (1.96), 239 (2.05), 249 (1.97), 259 (1.82), 294 (1.57), 323 (1.02), 336 (0.96); ECD (MeOH) /nm: 209 (Δε 0.24), 234 (Δε -0.03), 258 (Δε 0.09); IR (microscope) νmax/cm-1: 3 353, 2 920, 2 851, 1 674, 1 199, 1 079; 1H和13C NMR数据见表 1; HR-ESI-MS m/z: 364.151 55 [M+Na]+ (calcd. for C20H23O4Na, 364.151 93)。
3 活性测定 3.1 细胞毒活性测定采用MTT法[7]对分离得到的化合物1进行了细胞毒活性试验, 所用的细胞株有人大细胞肺癌细胞H460、人肝癌细胞H7402、人结肠癌细胞HCT-8、人宫颈癌细胞HeLa以及人乳腺癌细胞MCF-7。结果显示化合物1对5种肿瘤细胞没有明显细胞毒活性(IC50 > 10 μmol·L-1)。
3.2 抗菌活性测定以万古霉素为阳性对照, 根据文献[8]的方法, 对化合物1进行3种菌株[金葡菌(Staphylococcus aureus)、大肠埃希菌(Escherichia coli)和绿脓杆菌(Pseudomonas aeruginosa)]的抗菌活性测定, 计算最低抑菌浓度(MIC)。结果表明, 该化合物对此3种菌株未显示显著活性(IC50 > 10 μmol·L-1)。
| [1] |
Huang L, Feng ZL, Wang YT, 等. Anticancer carbazole alkaloids and coumarins from Clausena plants: a review[J]. Chin J Nat Med, 2017, 15: 881-888. |
| [2] |
Du YQ, Liu H, Li CJ, et al. Bioactive carbazole alkaloids from the stems of Clausena lansium[J]. Fitoterapia, 2015, 103: 122-128. DOI:10.1016/j.fitote.2015.03.018 |
| [3] |
Liu H, Li CJ, Yang JZ, et al. Carbazole alkaloids from the stems of Clausena lansium[J]. J Nat Prod, 2012, 75: 677-682. DOI:10.1021/np200919a |
| [4] |
Software Sybyl, version X 2.0. Tripos Associates Inc.: St. Louis, MO, 2013.
|
| [5] |
Frisch MJ, Trucks GW, Schlegel HB, et al. Gaussian 09, Rev. C 01. Gaussian, Inc., Wallingford CT, 2009.
|
| [6] |
Stephens PJ, Harada N. ECD cotton effect approximated by the Gaussian curve and other methods[J]. Chirality, 2010, 22: 229-233. |
| [7] |
Mosmann T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays[J]. J Immunol Methods, 1983, 65: 55-63. DOI:10.1016/0022-1759(83)90303-4 |
| [8] |
Xu JQ. Studies on the Chemical Constituents and Biological Activities of the Stem of Homalium paniculiflorum (广南天料木茎化学成分及生物活性研究) [D]. Haikou: Hainan University, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10589-1013179769.htm
|
 2020, Vol. 55
2020, Vol. 55


