鹧鸪花(Trichilia connaroides)是楝科(Meliaceae)楝亚科鹧鸪花属(Trichilia)的一个种, 主要分布于中国广东、广西和云南等热带地区, 具有清热利咽、祛风湿等功效, 富含柠檬苦素柠檬苦素类三萜化合物[1, 2], 包括四环母核未开裂的柠檬苦素(cedrelones[3]等)、四环母核环开裂的柠檬苦素类化合物(prieurianins[4]等)、母核重排类化合物(mexicanolides[5]、phragmalins[6]、trijugins[7]等)。其中, trichilin类型柠檬苦素是一类主要来源于楝属和鹧鸪花属植物的四环母核完整的一类化合物, 该类化合物的结构特点是Me-19和Me-29通过氧桥相连, 与C-29形成半缩醛或缩醛, C-14和15位具有三元氧环或其衍生片段。该类化合物具有多样的生物活性, 例如细胞毒、抗炎、抗菌和昆虫拒食等活性, 截止2018年已有100余个trichilin类型柠檬苦素被报道。
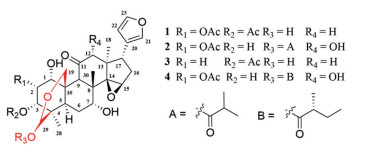
本课题组前期对鹧鸪花的茎木及皮和果实部位进行了系统的化学成分研究[7-11], 发现了大量结构新颖、类型丰富和活性显著的柠檬苦素类化合物如具有spiro [cyclopenta[b]furan-2, 1′-cyclopentan]罕见环系的spirotrichilins A and B[12], 具有对MCF-7/DOX细胞株逆转肿瘤多药耐药活性的trichiconnarones A and B[7]。为发现更多结构新颖和/或活性显著的柠檬苦素类化合物, 继续对鹧鸪花成熟果实进行研究。通过对采集于云南省西双版纳自治区的鹧鸪花成熟果实醇提物进行化学成分研究, 分离纯化得到4个trichilin类型柠檬苦素(1~4), 其中化合物1、2为新化合物。通过对人非小细胞肺癌细胞系A549和人宫颈癌细胞系HeLa等两种人源肿瘤细胞系的肿瘤细胞毒活性模型筛选, 发现新化合物1、2和已知化合物4在40 μmol·L-1浓度对宫颈癌细胞(HeLa)具有微弱的细胞毒活性, 抑制率分别为58%、55%和61%。
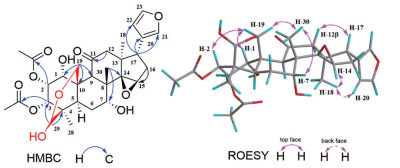
结果与讨论Trichisinlin G(1) 白色无定形粉末, 10%香草醛-浓硫酸显色呈蓝紫色。ESI-MS在正离子模式下给出分子离子峰m/z 592.2 [M+NH4]+, 在负离子模式下给出分子离子峰m/z 609.3 [M+Cl]-。HR-ESI-MS在正离子模式下给出的准分子离子峰为m/z 597.230 4 ([M+Na]+ (C30H38O11Na; calcd. 597.230 6);结合13C NMR谱图数据, 推测其分子式为C30H38O11, 计算其不饱和度为12。1H NMR图谱中出现3个单峰角甲基氢信号(δH 0.86、1.03、1.31)、两个乙酰基的单峰甲基氢信号(δH 2.00、2.13)、1个β取代的呋喃环上的3个低场区氢信号(δH 7.45、7.31、6.30) (表 1)。13C NMR中出现1个β取代呋喃环的4个碳信号(δC 123.4、139.7、110.5、142.9)、1个羰基碳信号(δC 213.3)、1个特征性的半缩醛碳信号(δC 95.2)、7个连氧碳信号。综合上述1D NMR信息归属并与trichisinlin E相应的数据进行对比[4], 推测化合物1为A/B/C/D环系完整Me-19和Me-29形成半缩醛结构的trichilin型柠檬苦素衍生物。仔细分析其1D NMR图谱, 发现化合物1是一对化合物, 比例为5:2 (高场单峰甲基积分比δH 1.06: δH1.04), 推测1是一对C-29的差向异构体, 进而确定1是具有C-19和C-29氧桥的四环柠檬苦素。由于化合物中含氧程度较高, 为确定羟基或者是乙酰基的取代位置, 通过1D NMR结合HMBC谱图来确定其连接方式和平面结构。1H NMR中低场区域出现了3个特征性的次甲基[(δH 4.18 (d, J = 5.0 Hz, H-1)、δH 5.51 (d, J = 5.0 Hz, H-3)、δH 5.86 (t, J = 5.0 Hz, H-2)], 根据化学位移大于5.0 ppm的两个氢的峰型分别为双重峰和三重峰, 推测乙酰基的取代位置有两种情况: C-1和C-2; C-2和C-3。HMBC谱图中H-3 (δH 5.51, d, J = 5.0 Hz)与C-4 (δC 41.6)相关, 因此, 确定C-2和C-3上的羟基被乙酰化。13C NMR谱图中出现了三元氧环的两个特征碳信号(δC 72.4、57.4), 并且Me-18 (δH 1.31)与C-14 (δC 72.4)出现HMBC相关, 表明三元氧环位于C-14和C-15, 而H2-12 (δH 2.40)与羰基碳(δC 213.3)的HMBC相关信号则说明羰基是位于C-11。综上所述, 化合物1的平面结构得以确定(图 1)。ROESY谱图中H-19与H-1、H-2和H3-30相关, H3-30与H-7相关。因此确定OH-1、OH-2和OH-7均为α构型, H-12β与H-17相关, H-14与Me-18相关, 因此表明呋喃环处于D环的α朝向, 三元氧环为β朝向。如图 2所示, 化合物1的平面结构和相对构型被确定。
| 表 1 1H (500 MHz) and 13C (125 MHz) NMR data of 1-2 in CD3OD (J in Hz) |
|
Figure 1 Structures of compounds 1-4 |
|
Figure 2 Key HMBC and ROESY correlations of compound 1 |
Trichisinlin H (2) 白色无定形粉末, 10%香草醛-浓硫酸显色呈蓝紫色。ESI-MS在正离子模式下给出分子离子峰m/z 636.2 [M+NH4]+, 在负离子模式下给出分子离子峰m/z 653.3 [M+Cl]-。HR-ESI-MS正离子模式给出的准分子离子峰为m/z 641.256 2 ([M+Na]+ (C32H42O12Na; calcd. 641.256 8);结合13C NMR中出现的32个碳原子信号, 推测其分子式为C32H42O12, 计算其不饱和度为12。对比化合物2与1的1D NMR图谱, 两者都有3个单峰的角甲基信号(δH 1.06、1.26、0.84)、1个特征性的半缩醛氢信号(δH 4.86)、1个半缩醛碳信号(δC 96.7)、一对特征性的偕耦次甲基氢[δH 4.06 (d, J = 11.5 Hz); δH 3.90 (d, J = 11.5 Hz)]和一个三元氧环信号, 推测化合物2和1为同一类碳骨架的柠檬苦素。化合物2与化合物1的最大区别是化合物不存在互变现象, 因此, 推断化合物C-29位置为半缩醛结构。通过H-29与C-1'的HMBC关键相关信号确定异丁酰基的取代位置为C-29。另外根据在δH 5.75出现了1个双峰信号, 在δH 4.42和4.04出现了两组双峰信号, 推测乙酰基的取代位置为C-2 (δC 70.8), 这一推断通过HMBC谱中OAc与C-2的相关信号得以确认。因此, 确定了化合物2的平面结构(图 1)。ROESY谱图中H-12与H-17明显相关, 确定H-12为β构型, 其相对应的OH-12为α构型。同时H-29与H-6出现明显的相关信号, 确定H-29与H-6处于桥环的同侧, 为endo构型。最终确定化合物2的结构如图 1所示。
化合物3和化合物4通过对比质谱、核磁共振氢谱和碳谱的方式确定其分别为3α-deacetylamoorastatin和mesendanins K。
实验部分Bruker Avance AVIII-500型核磁共振波谱仪(德国布鲁克公司); Agilent 6529 Q-TOF高分辨质谱仪(美国安捷伦公司); JASCO P-1020旋光仪(日本JASCO公司); Agilent 1260高效液相色谱仪(美国安捷伦公司)配备一根C18色谱柱(5 μm, 25 mm×4.6 mm, 美国安捷伦公司); 岛津LC-6A半制备高效液相色谱仪(日本岛津公司)配备一根C18色谱柱(10 μm, 25 mm×20 mm, 日本岛津); 柱色谱硅胶(200~300目) (青岛海洋化工厂); 薄层色谱硅胶(GF254) (青岛海洋化工厂); Sephadex LH-20 (25~100 μm; YMC; 日本); 氘代甲醇; 甲醇、乙腈、二氯甲烷等其他试剂为分析纯(江苏汉邦有限公司)。
鹧鸪花(Trichilia connaroides (Wight et Arn.) Bentv)果实约5.0 kg, 于2013年6月采自云南西双版纳, 样品由张顺成研究员采集并鉴定为鹧鸪花。凭证标本存放于中国药科大学天然药物化学教研室, 编号AA201308。
1 提取分离干燥粉碎后的鹧鸪花果实5.0 kg, 用95%工业乙醇回流提取3次(4 h、4 h和3 h), 合并提取液, 将回收液减压浓缩至无醇味, 得总浸膏500.5 g。将总浸膏混悬于2.0 L温水中, 先用石油醚脱脂, 然后用乙酸乙酯萃取, 获得乙酸乙酯部位浸膏150.5 g。
乙酸乙酯部位粗浸膏(150.5 g)用硅胶柱色谱, 以二氯甲烷/甲醇(100:0→0:1, v/v)梯度洗脱, 得到5个部分(Fr. A~E), 在分离过程中, 主要通过高效液相的保留时间、薄层板的Rf值和显色行为来判断化合物的类型以指导柠檬苦素类化合物的分离纯化。其中, B段(二氯甲烷-甲醇10:1洗脱部位, 10.5 g)综合运用硅胶柱色谱、ODS、凝胶Sephadex LH-20柱色谱、中压和制备HPLC等方法精细分离。通过以常压硅胶柱色谱(流动相:二氯甲烷-甲醇)和中压反相柱色谱(流动相:甲醇-水或乙腈-水)进行富集和分离, 最后, 通过半制备型HPLC (UV双波长检测器: 210 nm和230 nm, 流动相:甲醇-水; 65:35, v/v, 1 mL·min-1)共分离得到了4个化合物: 1 (3 mg)、2 (15 mg)、3 (30 mg)和4 (50 mg)。
2 结构鉴定化合物1 白色无定形粉末, UV λmax 209 nm; [α] +36 (c 0.1, MeOH); IR 3 446, 2 921, 1 640, 1 383, 1 265, 1 058, 874, 735 cm-1; ESI-MS m/z 592.2 [M+NH4]+, 609.3 [M+Cl]-。1H NMR (CD3OD, 500 MHz)和13C NMR (CD3OD, 125 MHz)谱图数据见表 1, HR-ESI-MS m/z 597.230 4 [M+Na]+ C30H38O11Na (calcd. 597.230 6)。
化合物2 白色无定形粉末, UV λmax 209 nm; [α] +50 (c 0.1, MeOH); IR 3 440, 2 919, 2 850, 1 691, 1 642, 1 383, 1 266, 1 153, 1 081, 1 032, 872, 788, 604 cm-1; ESI-MS m/z 636.2 [M+NH4]+, 653.3 [M+Cl]-; 1H NMR (CD3OD, 500 MHz)和13C NMR (CD3OD, 125 MHz)谱图数据见表 1, HR-ESI-MS m/z 641.256 2 [M+Na]+ C32H42O12Na (calcd. 641.256 8)。
化合物3 白色无定形粉末, ESI-MS显示m/z 534.2 [M+NH4]+, 551.2 [M+Cl]-; 1H NMR (CD3OD, 500 MHz) δH 7.44 (s, H-23), 7.26 (s, H-21), 6.24 (s, H-22), 5.75 (t, J = 4.0 Hz, H-2), 5.23 (d, J = 5.0 Hz. H-3), 4.85 (s, H-29), 4.67 (s, H-9), 4.39 (s, H-19), 4.05 (t, J = 5.0 Hz, H-2), 3.72 (s, H-15), 3.62 (t, J = 2.5 Hz, H-7), 2.08 (s, 3-OAc), 1.30 (s, Me-30), 1.04 (s, Me-18), 0.86 (s, Me-28); 13C NMR (CD3OD, 125 MHz) δC 215.1 (C-11), 172.8 (3-OAc), 144.3 (C-23), 141.1 (C-21), 124.9 (C-20), 111.9 (C-22), 97.2 (C-29), 66.0 (C-19), 58.8 (C-15)。上述波谱数据与文献报道基本一致, 因此化合物3被鉴定为3α-deacetylamoorastatin[13]。
化合物4 白色无定形粉末, ESI-MS显示m/z 650.2 [M+NH4]+, 667.3 [M+Cl]-, 1H NMR (CD3OD, 500 MHz) δH 7.35 (s, H-23), 7.29 (s, H-21), 6.51 (s, H-22), 5.81 (s, H-29), 5.75 (t, J = 4.0 Hz, H-2), 4.68 (s, H-9), 3.94 (s, H-15), 3.78 (s, H-7), 1.22 (s, Me-30), 1.18 (d, J = 7.0 Hz, Me-4′), 1.09 (s, Me-18), 0.98 (s, Me-28), 0.94 (t, J = 7.0 Hz, Me-5′); 13C NMR (CD3OD, 125 MHz) δC 213.6 (C-11), 175.4 (C-1′), 170.8 (2-OAc), 141.7 (C-23), 140.6 (C-21), 124.0 (C-20), 112.5 (C-22), 94.5 (C-29), 78.6 (C-12), 64.1 (C-19), 58.3 (C-15)。上述波谱数据与文献报道基本一致, 因此化合物4被鉴定为mesendanins K[14]。
3 生物活性通过SRP法测定化合物1~4对人体来源肿瘤细胞毒活性, 测试细胞株为人宫颈癌细胞系HeLa和人非小细胞肺癌细胞系A549。实验过程将培养的A549和HeLa肿瘤细胞铺96孔板, 培养24 h后, 加药(浓度40 μmol·L-1, 3复孔, 紫杉醇为阳性对照), 孵育48 h后, 基于SRB法利用酶标仪测量化合物细胞毒活性。实验结果显示新化合物1、2和已知化合物4在浓度40 μmol·L-1时对宫颈癌细胞(HeLa)具有微弱的细胞毒活性, 抑制率分别为58%、55%和61%。
本文还通过测试trichilin-type柠檬苦素抑制LPS诱导的小鼠单核巨噬细胞(RAW 264.7)释放一氧化氮(NO)的能力来评价其抗炎活性。但是, 4个化合物在浓度40 μmol·L-1时均对小鼠单核巨噬细胞显示有细胞毒性。
| [1] |
Zhang YY, Xu H. Recent progress in the chemistry and biology of limonoids[J]. RSC Adv, 2017, 7: 35191-35220. DOI:10.1039/C7RA04715K |
| [2] |
Tan QG, Luo XD. Meliaceous limonoids: chemistry and biological activities[J]. Chem Rev, 2011, 111: 7437-7522. DOI:10.1021/cr9004023 |
| [3] |
Wang GC, Yu JH, Shen Y, et al. Limonoids and triterpenoids as 11beta-HSD1 inhibitors from Walsura robusta[J]. J Nat Prod, 2016, 79: 899-906. DOI:10.1021/acs.jnatprod.5b00952 |
| [4] |
Liu SB, Mei WL, Chen HQ, et al. Limonoids from the roots of Trichilia sinensis and their cytotoxicities[J]. Arch Pharm Res, 2018, 41: 1170-1177. DOI:10.1007/s12272-017-0915-0 |
| [5] |
Wang GC, Fan YY, Shyaula SL, et al. Triconoids A-D, four limonoids possess two rearranged carbon skeletons from Trichilia connaroides[J]. Org Lett, 2017, 19: 2182-2185. DOI:10.1021/acs.orglett.7b00873 |
| [6] |
Liu SB, Chen HQ, Guo ZK, et al. Phragmalin-type limonoids from the roots of Trichilia sinensis[J]. RSC Adv, 2017, 7: 28994-29003. DOI:10.1039/C7RA01785E |
| [7] |
An FL, Sun DM, Wang RZ, et al. Trijugin- and mexicanolide-type limonoids from the fruits of Heynea trijuga that reverse multidrug resistance in MCF-7/DOX cells[J]. Phytochemistry, 2018, 151: 42-49. DOI:10.1016/j.phytochem.2018.04.004 |
| [8] |
An FL, Sun DM, Wang XB, et al. Trichiconlides C-F, four new limonoids with 1, 2-seco phragmalin-type carbon skeleton from the fruits of Trichilia connaroides[J]. Fitoterapia, 2018, 125: 72-77. DOI:10.1016/j.fitote.2017.12.023 |
| [9] |
An FL, Luo J, Wang XB, et al. Trichiconlides A and B: two novel limonoids from the fruits of Trichilia connaroides[J]. Org Biomol Chem, 2016, 14: 1231-1235. DOI:10.1039/C5OB02300A |
| [10] |
Wang HY, Wang JS, Shan SM, et al. Chemical constituents from Trichilia connaroides and their nitric oxide production and alpha-glucosidase inhibitory activities[J]. Planta Med, 2013, 79: 1767-1774. DOI:10.1055/s-0033-1351045 |
| [11] |
Wang HY, Wang JS, Zhang Y, et al. Inhibitory effect of four triterpenoids from Trichilia connaroides on nitric oxide production in lipopolysaccharide-stimulated RAW264.7 cells[J]. Chem Pharm Bull, 2013, 61: 1075-1080. DOI:10.1248/cpb.c13-00286 |
| [12] |
An FL, Luo J, Li RJ, et al. Spirotrichilins A and B: two rearranged spirocyclic limonoids from Trichilia connaroides[J]. Org Lett, 2016, 18: 1924-1927. DOI:10.1021/acs.orglett.6b00738 |
| [13] |
Vardamides JC, Dongo E, Nkengfack AE, et al. Diterpenoid and limonoids from the stem of Pterorhachis zenkeri[J]. Fitoterapia, 2001, 72: 386-393. DOI:10.1016/S0367-326X(00)00341-5 |
| [14] |
Yuan CM, Zhang Y, Tang GH, et al. Cytotoxic limonoids from Melia azedarach[J]. Planta Med, 2013, 79: 163-168. |
 2020, Vol. 55
2020, Vol. 55


